Method Article
Raziometrici calcio Imaging di singoli neuroni nel comportarsi Caenorhabditis Elegans
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo descrive l'uso di codificato geneticamente Ca2 + reporter per registrare le modifiche attività neurale in comportarsi vermi di Caenorhabditis elegans .
Abstract
È diventato sempre più chiaro che attività circuito neurale nel comportarsi animali differisce sostanzialmente da quello visto in animali anestetizzati o immobilizzati. Altamente sensibile, codificato geneticamente reporter fluorescenti di Ca2 + hanno rivoluzionato la registrazione della cella e attività sinaptica con approcci ottici non invasiva negli animali si comporta. Quando combinato con genetica e tecniche di optogenetica, i meccanismi molecolari che modulano l'attività cellulare e circuito durante stati possono essere identificati un comportamento diverso.
Qui descriviamo i metodi per raziometrici Ca2 + imaging di singoli neuroni nel comportarsi liberamente vermi di Caenorhabditis elegans . Dimostriamo una tecnica di montaggio semplice che delicatamente vermi di sovrapposizioni che cresce su un agar di Nematode crescita Media (NGM) standard si bloccano con un vetrino coprioggetti, permettendo gli animali essere registrate al alta risoluzione durante la piena libertà di movimento e di comportamento. Con questa tecnica, usiamo il sensibile Ca2 + reporter GCaMP5 per registrare le modifiche in intracellulare Ca2 + in neuroni serotoninergici ermafrodita specifico (HSNs) mentre guidano il comportamento di deposizione delle uova. Da cheesprimono mCherry, Ca2 +-proteina fluorescente insensibile, rintracciare la posizione di HSN all'interno ~ 1 µm e corretta per le fluttuazioni in fluorescenza causata da cambiamenti nella messa a fuoco o movimento. Campo chiaro simultanea, a raggi infrarossi imaging permette per la registrazione del comportamento e tracciabilità degli animali utilizzando un tavolino motorizzato. Integrando queste tecniche microscopiche e flussi di dati, possiamo registrare l'attività di Ca2 + nel circuito di deposizione delle uova di c. elegans Man mano che passa tra Stati di comportamento inattivo e attivo oltre decine di minuti.
Introduzione
Un obiettivo centrale delle neuroscienze è quello di capire come i neuroni comunicano in circuiti di comportamento animale in auto. I circuiti neurali integrano una gamma di diversi segnali sensoriali al fine di modificare l'attività del circuito, quindi Guida cambiamenti comportamentali necessarie agli animali per rispondere ai loro ambienti. Il nematode c. elegans, ha un sistema nervoso semplice con 302 neuroni cui connessioni sinaptiche sono stati completamente mappata1. Inoltre, i geni che codificano per proteine coinvolte nella neurotrasmissione sono altamente conservati tra c. elegans e mammiferi2. Nonostante la semplicità anatomica del suo sistema nervoso, viene visualizzato un complesso repertorio di comportamenti conservati fornendo una piattaforma fertile per capire come i neuroni regolano comportamento3.
C. elegans è favorevole all'applicazione di una vasta gamma di approcci quali manipolazione genetica, l'ablazione laser delle cellule, tecniche elettrofisiologiche, come pure in vivo optical imaging4,5. Recenti studi hanno prodotto mappe dettagliate del neurotrasmettitore principale sistemi in c. elegans , tra cui il colinergico e GABAergici reti neuronali di segnalazione. Questi studi, insieme con gli studi in corso per mappare l'espressione dei recettori accoppiati a proteine G tutto neuronali posizionare questo modello in una posizione unica per sfruttare strutturali altamente dettagliate e mappe di connettività neuronale funzionale per comprendere appieno come questi segnale di diversi neurotrasmettitori attraverso diversi recettori e tempistiche per diversi aspetti di unità di comportamento animale.
Al fine di studiare i modelli dinamici attività neuronale in qualsiasi sistema, prerequisito essenziale è quello di sviluppare metodologie robusti per registrare attività in singoli neuroni o intero circuiti durante i comportamenti. Particolarmente importante è la disponibilità di tali approcci ottici per visualizzare attività presinaptica che guida la fusione delle vescicole sinaptiche. Veloce e altamente sensibile reporter fluorescenti di intracellulare Ca2 +, insieme con la crescente disponibilità di fotorivelatori sensibili, hanno rivoluzionato la registrazione della cella e attività sinaptica in animali svegli, viventi durante il comportamento. Perché un importante risultato dell'attività elettrica sinaptica è di regolare i canali del Ca2 + , i cambiamenti in intracellulare di Ca2 + sono probabilmente per segnalare fedelmente le modifiche relativamente al comportamento rilevante nell'attività delle cellule.
In questo studio, presentiamo un metodo per eseguire raziometrici Ca2 + imaging in neuroni serotoninergici HSN motore che promuovono il comportamento di deposizione delle uova in c. elegans6,7. Questo approccio si basa su precedenti tentativi di visualizzare Ca2 + attività in c. elegans e il circuito di deposizione delle uova durante il comportamento5,8,9,10,11 . Il metodo consente di correlare simultaneamente i cambiamenti osservati nell'attività cellulare/circuito con eventi di deposizione delle uova, nonché cambiamenti nello stato dell'apparato locomotore degli animali. Anche se usiamo questo approccio per studiare l'attività in vermi adulti, lavoro inedito dal nostro laboratorio viene illustrato che questo approccio può essere esteso agli animali giovanili presso il quarto stadio larvale (L4) pure. È probabile che l'attività di altri neuroni di c. elegans che funzionano nei circuiti distinti e comportamenti dovrebbe essere allo stesso modo accessibile con questa tecnica. Altro ha sviluppato recentemente veloce Ca2 + indicatori con non sovrapposte spettri di emissione12,13,14,15,16, optogenetica strumenti17 e geneticamente codificato indicatori ottici di membrana tensione18, dovrebbe permetterci di eseguire indagini penetrante 'all-optical' su come i cambiamenti nell'attività del circuito neurale guidare stati di comportamento distinto.
Protocollo
1. ceppi, cultura Media e montaggio degli animali
- Crescere di c. elegans worms a 20 ° C su piastre agar Nematode crescita medio (NGM) 60 mm standard seminati con OP50 Escherichia coli batterica cibo19.
- Preparare due plasmidi per ogni promotore cellula-specifico di interesse: uno, espressione di GCaMP5 di registrazione intracellulare Ca2 +e il secondo, espressione di mCherry per consentire raziometrici quantificazione dei cambiamenti di fluorescenza di GCaMP5 di guida di guida e semplificare la misura e trovare oggetti.
Nota: GCaMP5:mCherry raziometrico imaging corregge le fluttuazioni in fluorescenza GCaMP5 che derivano da cambiamenti nel movimento di messa a fuoco e animale, non reali cambiamenti in intracellulare di Ca2 +. - Iniettare GCaMP5 - e mCherry-esprimendo plasmidi con il plasmide di marker visibile salvataggio pL15EK gonadi di LX1832 lite-1(ce314), lin-15(n765ts) X animali mutanti e recuperare non-Muv lin-15(+) animali esprimendo GCaMP5 e mCherry da un transgene alta-copia20,21,22. Utilizzare lo sfondo mutante lite-1 per ridurre l'evitare luce blu comportamento23,24.
- Integrare i transgeni ai cromosomi di mosaicismo di ridurre e semplificare la generazione di ceppi mutanti composto25.
Nota: Il ceppo di LX2004 descritto qui trasporta un transgene alta-copia integrato che esprime GCaMP5 e mCherry in HSNs dal promotore nlp-3 (Vedi Tabella materiali)26,27, 28 , 29. il promotore di PNL-3 è stato trovato per unità forte espressione nel HSNs di fine L4 e animali adulti senza causare difetti significativi nello sviluppo di HSN o comportamento di deposizione delle uova rispetto ad altri promotori testato (e.g.,tph-1, EGL-6e unc-86). Questo ceppo e altri che esprimono GCaMP5 e mCherry in neuroni di motore cavo ventrale (VC), muscoli vulval e cellule neuroendocrine uv1 sono disponibili dal centro di genetica di Caenorhabditis e dettagli della loro costruzione sono state descritte 27. - Applicare OP50 prendere cibo batterico da una piastra di agar NGM seminato alla parte inferiore di un verme di platino e utilizzarlo per trasferire ~ 20 animali L4 LX2004 tardi che esprimono GCaMP5 e mCherry in HSNs dal promotore nlp-3 . Assicurarsi che la vulva in via di sviluppo venga visualizzato in un microscopio stereoscopico come una macchia chiara scura circondata da una mezzaluna bianca. Incubare gli animali a 20 ° C per 24-40 h.
- Dopo l'incubazione, applicare OP50 il prelievo e trasferimento ~ 3 dei vermi ad una piastra del NGM non teste di serie, lasciando una piccola quantità di cibo dietro per i vermi a nutrirsi durante la formazione immagine. Garantire cibo a sufficienza, come troppo poco cibo batterico incoraggerà i vermi a vagare lontano dal centro della piastra, mentre troppo cibo aumenterà la fluorescenza di fondo e causare ipossia.
- Utilizzare una spatola piatta arrotondata per tagliare una ~ 20 x 20 mm pezzo dalla piastra che trasportano i vermi e trasferire il pezzo a faccia in giù al centro di un vetrino coprioggetto pulito 24 mm x 60 mm #1.5 (Figura 1). Avviare l'applicazione da un lato per evitare bolle sia intrappolato sotto il vetrino coprioggetto e capaci di interferire con la formazione immagine. Applicare un vetrino coprioggetti di 22 x 22 mm #1 nella parte superiore del blocco per ridurre l'evaporazione e attaccare.
2. hardware e installazione di strumentazione
- Posizionare la messa in scena, transgenici vermi sul palco di un microscopio invertito con ≥ 0,7 apertura numerica piano-Apochromat 20 x fase di x-y di oggettiva, motorizzato controllabile con un joystick, un immagine splitter e fluorescenza filtri per GCaMP5 simultanea e mCherry eccitazione ed emissione, telecamere per campo chiaro di fluorescenza e infrarossi imaging e un sistema di illuminazione Light Emitting Diode (LED) triggerable (Figura 2A).
Nota: Un divisore di fascio 80/20 invia 80% del segnale di immagine per la fotocamera di fluorescenza e il 20% alla fotocamera campo chiaro. Può essere utilizzato anche un microscopio dritto, ma il pezzo NGM dovrebbe essere collocato tra un vetrino e il coprioggetto grande in questo caso.- Utilizzare gli oculari del binocolo per selezionare un verme per l'imaging. Quando un animale è selezionato, far scorrere il filtro a infrarossi al posto sopra il condensatore.
- Trigger di transistor-transistor logic (TTL)
- Collegare il cavo coassiale da ciascuna delle tre linee di uscita trigger TTL della fotocamera di fluorescenza. Collegare l'uscita prima all'ingresso BNC #3 sistema di illuminazione del LED.
- Collegare l'uscita seconda a una scheda di 'banana' BNC con verde e marroni fili dal connettore 8-pin GPIO in esecuzione a GPIO input #3 (pin 4) e massa (pin 5) della telecamera a raggi infrarossi, rispettivamente.
- Collegare l'uscita terza a una scheda di 'banana' BNC con ponticelli in esecuzione all'ingresso digitale #8 e terra nel dispositivo di acquisizione digitale (Figura 2B).
- Dispositivo di acquisizione digitale (DAQ)
- Collegare la scheda microcontroller DAQ (Vedi Tabella materiali) al PC tramite un cavo USB. Aggiornare il firmware con lo standard Firmata protocollo (Vedi Tabella materiali) e configurare la porta USB per comunicare a 57600 baud.
- LED
- Eseguire il software LED Controller (Vedi Tabella materiali). Commutazione del tipo di Trigger da 'Continuo a 'Gestita' e selezionare il canale Trigger 3' per entrambi i LED 470 e 590 nm.
- Accendere ed entrare LED di potenza per ogni LED (ad es., set di 470 nm LED al 20% e il LED 590 nm al 40%).
- Eseguire la comunicazione seriale-fase script 'XY-fase-finale' nel Bonsai (Vedi Tabella materiali)30. Fare clic sul nodo 'CsvWriter' grigio e selezionare una cartella per salvare il registrato X e Y della fase informazioni (Figura 3). Premere la freccia verde nella barra degli strumenti per inizializzare il DAQ.
Nota: Lo script partirà la posizione X e Y di fase la registrazione quando la fotocamera di fluorescenza Invia un segnale TTL. Questo script genera quattro colonne di dati: telaio numero X posizione (µm), posizione Y (µm) e l'intervallo tra i fotogrammi (s). - Nella fotocamera a infrarossi software di registrazione (Vedi Tabella materiali) in 'Modalità Video personalizzate,' selezionare "Mode 1" (2 x 2 binning; 1.024 x 1.024 pixel), e "Pixel formato Raw 8". Sotto ' Trigger / strobo ', impostare la riga di input trigger (GPIO) su "3", la polarità su "Alta", la 'modalità' per "14". Attivare o disattivare 'Abilita' per interrompere l'acquisizione di telaio fino a quando non viene ricevuto un segnale di trigger TTL.
- Lasciando la finestra aperta, fare clic sul pulsante "Record" rosso sulla barra di visualizzazione fotocamera principale. Selezionare la cartella per sequenze di immagini da salvare. Selezionare la modalità di registrazione 'Buffered' e 'Immagini' di salvare in formato JPEG. Fare clic su "Start Recording" per inizializzare l'acquisizione.
- Splitter di fotocamera e l'immagine di fluorescenza
Nota: GCaMP5 e mCherry canali di fluorescenza devono essere raccolti contemporaneamente per garantire la registrazione di immagine corretta per quantificazione raziometrici. Un'immagine splitter permette l'acquisizione di due canali della fluorescenza GCaMP5 e mCherry su un sensore.- Nella scheda 'Capture' del software di acquisizione immagine (Vedi Tabella materiali), tempo di esposizione impostato a 10 ms, binning a 4x e la profondità dell'immagine a 16 bit. Selezionare una sottomatrice di fotocamera centrato di 512 pixel di larghezza per 256 pixel di altezza. Fare clic su 'Visualizza uscita Trigger opzioni' e impostare tutti i trigger per 'Positivo'.
Nota: Il DAQ occasionalmente può mancare TTL trigger se sono 10 ms o meno. - Assicurarsi che 'Trigger 1' e 'Trigger 2' sono impostate su 'Esposizione', mentre 'Trigger 3' è impostata su 'Programmabile' con un 'periodo' di 25 ms. sotto la scheda 'Sequenza', selezionare 'Time Lapse' con un 'campo Delay1' di 50 ms per raccogliere immagini a 20 Hz. Selezionare 'Salva da Buffer temporaneo."
- Nella scheda 'Capture' del software di acquisizione immagine (Vedi Tabella materiali), tempo di esposizione impostato a 10 ms, binning a 4x e la profondità dell'immagine a 16 bit. Selezionare una sottomatrice di fotocamera centrato di 512 pixel di larghezza per 256 pixel di altezza. Fare clic su 'Visualizza uscita Trigger opzioni' e impostare tutti i trigger per 'Positivo'.
- PMT guadagno e intensità del laser durante la formazione immagine confocal canale tre
- Impostare il guadagno PMT quindi la fluorescenza di fondo è ad un livello appena superiore al minimo (livello di nero). Potenzia 561 nm laser (verde) fino a un singolo pixel di 12 bit o 16 bit saturo è osservato al capolinea presinaptico nel canale mCherry.
- Regolare l'intensità di laser (blu) 488 nm affinché GCaMP5 fluorescenza è appena visibile al capolinea presinaptico sopra priorità bassa. Questa impostazione bassa impedisce la saturazione dei pixel GCaMP5 quando la fluorescenza aumenta in risposta alla forte2 + transitori di Ca. Aprire il foro stenopeico confocale tutto il modo per massimizzare la luce cattura.
3. raziometrici Ca2 + Imaging e registrazione del comportamento
- Sotto la scheda 'Sequenza' del software di acquisizione di fluorescenza, fare clic su "Start" per iniziare la registrazione. Traccia il worm con il joystick, mantenendo le celle e le sinapsi di interesse nel fuoco e nel centro del campo visivo (FOV). Fare clic sul pulsante 'Statistiche' nella finestra istogramma per visualizzare le statistiche di pixel di ogni canale.
- Regolare la potenza del LED per garantire una fluorescenza massima singolo pixel mCherry al terminale presinaptico di ≥ 8.000 conteggi (~ 4.000 fotoelettroni), dando un ~ 12-bit gamma dinamica sopra priorità bassa (~ 100 fotoelettroni). GCaMP5 segnali al capolinea presinaptico durante il riposo (basso) Ca2 + dovrebbe essere di circa ~ 2.500 conta - appena visibile sopra priorità bassa.
- Registrare fino a raggiunta uno stato attivo di deposizione delle uova; in genere questo problema si verifica ogni 20-30 min in un verme di selvaggio-tipo7. Salvare un sottoinsieme di 10 min (12.001 fotogrammi), 6.000 fotogrammi prima e dopo il primo evento di deposizione delle uova (telaio 6.001). Essere sicuri di mantenere lo stesso subset di immagini di campo chiaro del worm comportamento e punti temporali di posizione stadio XY, o la sincronizzazione precisa dei flussi di dati andranno persa.
- Utilizzare il plugin BioFormats e ImageJ (vedere Tabella materiali) per convertire sequenze di immagini in formato immagine Cytometry Standard (ICS) in modo che può essere importato nel software raziometrici quantificazione.
4. segmentazione e analisi quantitativa delle immagini
- Importare sequenze di immagini nel software raziometrici quantificazione (Vedi Tabella materiali). Fare clic su 'Auto contrasto' nel menu 'Strumenti' e regolare il contrasto di ogni canale per stabilire appropriato nero (~ 1.800) e bianco livelli (10.000). Selezionare 'Cambia colori...' nel menu strumenti per confermare che mCherry e GCaMP5 canale colore assegnazioni sono corrette (Figura 4A - C).
- Fare clic con il pulsante destro della serie temporale nella scheda «Sequenza» e impostarlo su 20 frame/s e 1,25 µm/pixel.
- Selezionare 'Ratio' dal menu 'Strumenti' e selezionare "GCaMP5" per "Canale A" e "mCherry" per 'Canale B'. Fare clic su "Calcola" accanto a 'Soglia' per sottrarre il background di ogni sequenza di immagini. Selezionare "Applica un arcobaleno LUT al canale di rapporto".
Nota: Per una registrazione con un rapporto medio basale di 0,3 (basso Ca2 +) e un rapporto massimo di 2-3 (alta Ca2 +), una tabella di ricerca adatto sarebbe da 0 (blu) a 1 (rosso). - Generare un canale di intensità modulata rapporto utilizzando il canale di mCherry (Figura 4D). Il canale di intensità modulata rapporto è un'immagine di milioni di colori, dove il colore del rapporto viene mappato nella luminosità del canale mCherry.
- Sotto la scheda 'Misure', è possibile creare un protocollo oggetto di ricerca trascinando lo strumento 'Trovare oggetti utilizzando intensità' nel riquadro 'Protocollo'. Fare clic su 'cog' per impostare la finestra di mCherry i valori di intensità e trovare gli oggetti.
- Selezionare i valori di intensità ≥ 2 deviazioni standard (SD) sopra priorità bassa (ad esempio, il limite inferiore di ~ 2.500, limite massimo di 65.535). Assicurarsi che il terminale presinaptico viene rilevato e che 'Aggiorna automaticamente la feedback' è selezionata dal menu di misurazioni.
Nota: Il software può anche identificare gli oggetti da loro deviazione standard da sfondo utilizzando un protocollo correlato 'SD intensità.' Tuttavia, se un oggetto particolarmente luminoso entra il FOV, può cambiare drasticamente l'intensità media durante quei punti temporali, che interessano il cut-off intensità utilizzato per trovare il HSN. Questa variabilità non si verificherà se i valori di intensità prima vengono utilizzati per trovare oggetti.
- Selezionare i valori di intensità ≥ 2 deviazioni standard (SD) sopra priorità bassa (ad esempio, il limite inferiore di ~ 2.500, limite massimo di 65.535). Assicurarsi che il terminale presinaptico viene rilevato e che 'Aggiorna automaticamente la feedback' è selezionata dal menu di misurazioni.
- Aggiungere ulteriori filtri indirizzano solo il canale mCherry (dimensioni, intensità massima, ecc.), se necessario escludere oggetti indesiderati come testa, coda e intestino fluorescenza. Selezionare 'Rendere elemento di misura' dal menu di misure e scegliere 'Tutti i punti temporali.'
Nota: Questo verrà eseguito il protocollo, tutte le misurazioni di scrittura in un file di valori separati da virgola (CSV) che deve essere esportato utilizzando il comando "Esporta" nel menu File. - Aprire il file exported.csv e copiare Timepoint, Area (µm2), media (rapporto di canale), centroide X (µm) e dati centroide Y (µm) in un nuovo foglio. Esportazione file CSV senza intestazioni di colonna. Il software di quantizzazione raziometrici può classificare una cella di interesse come uno o più oggetti al timepoint.
- Per ricombinare questi oggetti, utilizzare uno script personalizzato 'AnalzyeGCaMP_2017.m'.
Nota: Lo script identifica Ca2 + (ratio) picchi nei dati e salva il file CSV dei loro punti temporali, ampiezze di picco e picco larghezze. Viene inoltre generato il file postscript per le tracce di crudo e con annotazioni del rapporto. Con queste informazioni, Ca2 + transitoria ampiezza e intervallo Inter-transitoria deve essere determinate.
- Per ricombinare questi oggetti, utilizzare uno script personalizzato 'AnalzyeGCaMP_2017.m'.
- Aggiungere l'output X e Y valori centroide da ogni oggetto di fluorescenza per i valori X e Y registrati dallo script XY-fase da Bonsai. Utilizzare la posizione netta di XY per generare una traccia di locomozione di verme e calcolare lo spostamento delle cellule e la velocità che accompagnano il comportamento differente stati31.
- Importare le immagini registrate campo chiaro in ImageJ come uno stack virtuale. Annotare gli eventi di deposizione delle uova e altri comportamenti. Confrontare i tempi di questi eventi per Ca2 + cime dalla traccia del rapporto.
Risultati
La tecnica di montaggio semplice descritta qui (Figura 1) provoca modifiche minime all'ambiente cultura di L4 e adulti di c. elegans , consentendo la registrazione a comportarsi animali attraverso un vetrino coprioggetti (Figura 4) ad alta risoluzione. Sincronizzazione di sorgenti luminose a LED, controller di fase e fotocamera esposizioni permette per l'acquisizione di dati da più flussi 20 immagini/s per fino a 1 h. intermedio ingrandimento (x 20) con obiettivi di apertura numerica elevata (0,7-0,8) offre buona risoluzione spaziale della regione sinaptica nel circuito del comportamento-deposizione delle uova, anche con 4 x 4 pixel binning (1,25 µm/pixel). Acquisizione simultanea di segnali di fluorescenza GCaMP5 e mCherry (Figura 4A, B) viene utilizzato per generare un canale di pixel rapporto che compensa le variazioni di movimento degli animali e messa a fuoco (Figura 4D). Il capolinea presinaptico HSN è grande come molti corpi delle cellule neuronali in c. eleganse cambiamenti nella presinaptica HSN Ca2 + possono essere chiaramente visibili. Il grande FOV della telecamera a raggi infrarossi brightfield consente al worm di tenere traccia manualmente durante la registrazione (Figura 4E). Per ogni animale, cambiamenti in intracellulare di Ca2 + possono essere correlate con comportamenti evidenti nel campo chiaro imaging tra cui rilascio delluovo e cambiamenti nella locomozione (Figura 4E).
Quantificazione di HSN Ca2 + e velocità conferma che vermi cambiano loro locomozione come transizione a comportamento di deposizione delle uova. Ci sono differenze significative nella velocità di verme prima, durante e dopo lo stato attivo di deposizione delle uova (Figura 5A). Questo non è causato da rumore intrinseco per l'imaging o sistema di rilevamento. Lo zoom in un unico evento di deposizione delle uova, osserviamo un forte cambiamento in GCaMP5 fluorescenza (ΔF/F) prima dell'evento di deposizione delle uova mentre mCherry fluorescenza è relativamente invariato (Figura 5B). Misurato cambiamenti nel rapporto GCaMP5:mCherry (ΔR/R) mostrano chiaramente un HSN Ca2 + transitoria ~ 4 prima s del rilascio delluovo (Figura 5B). Coincidente con la contrazione del muscolo vulval, un chiaro rallentamento della locomozione verme si verifica che termina con l'uovo di rilascio. Risultati precedenti hanno dimostrato che i neuroni di motore VC colinergici, che sono innervati dalla HSNs, mostrano picchi di attività durante le contrazioni muscolari vulval forte e durante uovo rilascio 8,10,27. Inoltre abbiamo indicato che optogenetica attivazione dei neuroni VC spinge un immediato rallentamento della locomozione, suggerendo che i neuroni di VC possono essere attivati dalla contrazione del muscolo vulval, rallentando così la locomozione fino a ricevere feedback di rilascio delluovo27 .
L'imaging e monitoraggio sistema descritto permette la visualizzazione dell'organizzazione spaziale del comportamento di deposizione delle uova (Figura 5C). Come precedentemente illustrato, vermi immettere sostenute esecuzioni di locomozione avanti appena prima lo stato attivo32. Vermi trascorrono la maggior parte del loro tempo foraggiamento sui batteri al centro del blocco agar. Prima dell'entrata in stato attivo, vermi muoversi lontano dal cibo, che è coincida con la comparsa di infrequenti dinamiche HSN Ca2 + . Attività HSN quindi transizioni in cottura di scoppio, con diversi ravvicinate HSN Ca2 + transienti che sostenere eventi di deposizione delle uova. I vermi poi spesso girare intorno, riprendere la locomozione in avanti e depongono le uova nel cammino verso la loro posizione di partenza vicino i batteri OP50. Presumiamo che possono influenzare cambiamenti locali O2 e/o la concentrazione di CO2 dove i vermi decidano per deporre uova33,34.
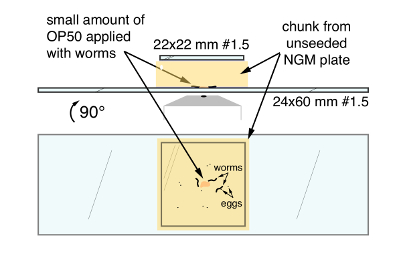
Figura 1. C. elegans tecnica per imaging ad alta risoluzione di deposizione delle uova circuito attività e comportamento del montaggio. Superiore, il montaggio finale dal lato. Fondo, il Monte finale come visti attraverso la parte inferiore del coprivetrino grande. Le frecce indicano OP50 batterico cibo, c. elegans worms e uova, inserita tra il pezzo di agar NGM e la lamella di grandi dimensioni 24 x 60 mm. Clicca qui per visualizzare una versione più grande di questa figura.
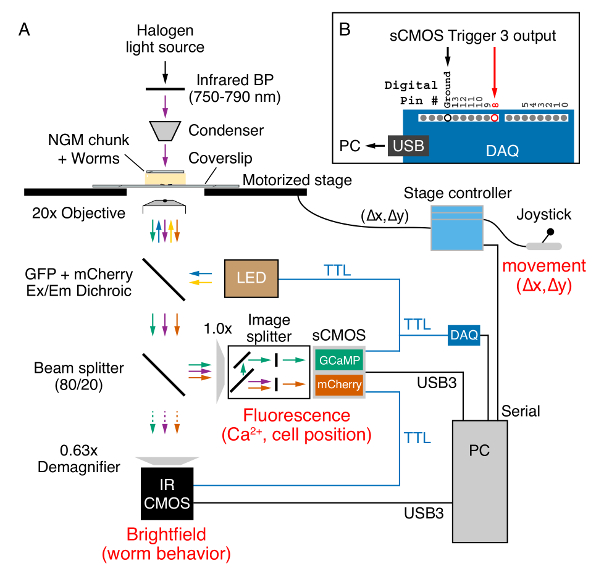
Figura 2 . Widefield raziometrici Ca2 + imaging e comportamento di registrazione su un microscopio a epifluorescenza invertito. (A) posizione di verme e il comportamento viene acquisito in campo chiaro tramite un 20x (0,8 NA) obiettivo piano-Apochromat utilizzando luce infrarossa (750-790 nm) (frecce viola) emessa da una lampada alogena attraverso il pezzo NGM. Un joystick e tavolino motorizzato controller viene utilizzato per mantenere il verme nel campo visivo durante la registrazione. Posizione di fase (Δx, Δy) viene inviata al PC tramite la porta seriale. GCaMP5 e mCherry proteine espresse nel verme sono eccitate con 470 nm (frecce blu) e 590 nm (frecce gialle) diodi emettitori di luce (LED). Emessa GCaMP5 (frecce verdi) e fluorescenza mCherry (frecce arancioni) insieme con la luce infrarossa passa attraverso uno specchio dicroico multi-banda (Vedi Tabella materiali). Un divisore di fascio 80/20 Invia 20% della luce attraverso un demagnifer x 0.63 per cattura su una fotocamera CMOS di infrarosso sensibili (freccia viola). Il restante 80% della luce viene inviato attraverso la porta laterale del microscopio di un'immagine splitter che separa il GCaMP5 e fluorescenza mCherry sulla metà di una macchina fotografica sCMOS separate durante la rimozione campo chiaro infrarosso luce. Dati da entrambe le fotocamere sono trasferiti ad un PC tramite cavi USB3. Le porte del grilletto dalla fotocamera sCMOS fluorescenza (blu) vengono utilizzate per inviare + 5V TTL innesca il sistema di illuminazione LED, macchina fotografica di CMOS di campo chiaro a infrarossi e il dispositivo di acquisizione digitale (DAQ). (B) Trigger 3 uscita segnali TTL sono rilevati da DAQ al pin digitale #8 e inviati al PC tramite una connessione USB. Questi ingressi digitali innescano un ' dove XY' comando seriale da uno script di software Bonsai (XY-fase finale) che legge la posizione per ogni immagine di fluorescenza/infrarosso GCaMP5/mCherry catturato in scena X e Y. Clicca qui per visualizzare una versione più grande di questa figura.
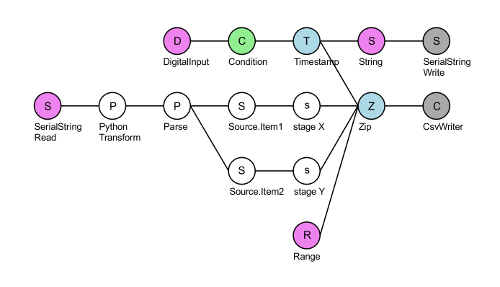
Figura 3 : Layout dello script Bonsai comunicazione seriale-stadio XY-fase finale. La parte superiore DigitalInput nodo (rosa) legge trigger TTL entrano in pin #8 del DAQ. Per ogni tensione TTL positivo (verde), il DAQ rende un timestamp (blu) e scrive una stringa 'Dove XY?' (rosa) al controller di fase tramite la porta seriale (grigio). Il nodo di SerialStringRead (rosa) legge che x e Y coordinare la risposta dal controller di fase. Questa stringa viene quindi convertita in micron e separata in fase di X e Y coordinate. Infine, questi quattro flussi vengono combinati utilizzando un nodo zip (blu) e viene scritto un file di quattro column.csv: un numero di fotogrammi dei segnali TTL ricevuti (nodo di gamma, rosa), le coordinate X e Y e l'intervallo tra successive punti temporali (in genere ~ 50 ms quando registrazione a 20 Hz). Clicca qui per visualizzare una versione più grande di questa figura.
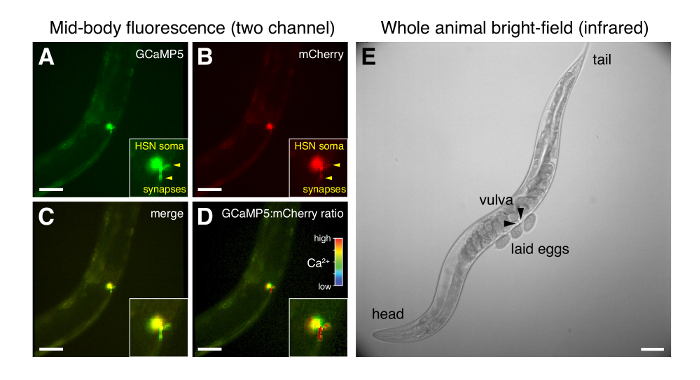
Figura 4 : Micrografie rappresentativi di HSN fluorescenza e animale intero campo chiaro durante la deposizione delle uova comportamento. (A–D) Raziometrici simultanea formazione immagine di fluorescenza GCaMP5 e mCherry in HSNs appena prima del rilascio delluovo. Termini presinaptici HSN sono indicate con le frecce. (C) Unione di GCaMP5 e mCherry fluorescenza. (D) GCaMP5:mCherry Intensity-modulated rapporto; un alto rapporto (rosso) indica alta intracellulare Ca2 + al terminale presinaptico. (E) immagine di campo chiaro del verme intero solo dopo che le uova sono state deposte. Le frecce indicano le metà anteriore e posteriore della vulva da cui le uova vengono deposte. Barra della scala per tutte le immagini è 50 µm. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5 : Registrazione di velocità di HSN Ca2 + e locomozione durante la deposizione delle uova comportamento. (A) tracce di cambiamenti di rapporto di GCaMP5:mCherry in risposta a intracellulare Ca2 + transitori (ΔR/R; rosso) e la velocità del verme istantanea (µm/s; blu). Eventi di deposizione delle uova sono indicati da frecce. (B) tracce di fluorescenza HSN GCaMP5 (verde, ΔF/F), mCherry fluorescenza (rosso; ΔF/F), GCaMP5:mCherry rapporto di fluorescenza (nero; ΔR/R) e vite senza fine velocità (blu) intorno al momento del rilascio di uovo. (C) l'organizzazione spaziale dei comportamenti di deposizione delle uova e locomozione durante l'intera registrazione di 10 min. La pista di vite senza fine è stata ottenuta dalle informazioni di fase XY che è stato aggiunto nella posizione di baricentro di HSN ottenuti dalla registrazione fluorescenza mCherry. Sono indicati i tempi di transienti HSN (cerchi rossi), eventi di deposizione delle uova (frecce nere) e inizio e fine della registrazione (diamanti verdi e blu). Barra della scala è di 1 mm. per favore clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Transgeni:
Perché espressione di mCherry è stata migliorata attraverso l'inserimento di codone-ottimizzazione e introne (e più disponibile GCaMP giornalisti non hanno), iniettare ~ 4 volte la quantità di plasmide GCaMP5-esprimendo per assicurare livelli comparabili di fluorescenza GCaMP5 durante forte Ca 2 + transitori. Salvataggio della mutazione lin-15(n765ts) consente il facile recupero di animali transgenici con effetti minimi sulla deposizione delle uova e altri comportamenti35. Transgeni dovrebbero essere integrati per garantire espressione uniforme e condizioni tra diversi animali25di imaging. Dovrebbe funzionare anche indicatori selezionabili compreso resistenza antibiotica36,37 e salvataggio di armi letali termosensibile38 , ma, poiché gli animali non transgenici sono morti, conferma di integrazione del transgene e l'omozigosi è più difficile rispetto ai marcatori che presentano un fenotipo visibile25. Marcatori dominanti che interferire con normale locomozione e diminuiscono il fitness, quali rol-6(dm), dovrebbero essere evitato39. Imaging in lite-1 sfondo mutante è essenziale per ridurre la luce blu fuga risposte durante imaging23,40,41. Ulteriore mutazione del gur-3, che agisce in parallelo lite-1, può ridurre ulteriormente le residua comportamento e cambiamenti fisiologici causati da luce blu42. Convenientemente, gur-3, lite-1e lin-15 sono tutti situati nella metà destra del cromosoma X, che dovrebbe semplificare la costruzione di nuovi ceppi per Ca2 + imaging e optogenetica esperimenti.
Poiché i tempi di esposizione sono brevi e vengono raccolte le immagini a 20 Hz, segnali GCaMP5 e mCherry devono essere brillanti. La spiegazione più probabile per rumoroso Ca2 + le registrazioni è dim fluorescenza causata dall'espressione debole reporter. Promotori dovrebbero anche essere ragionevolmente specifici per la regione essere imaged. Perché il corpo cellulare HSN e sinapsi sui muscoli vulval sono al centro del corpo, espressione aggiuntiva dal promotore nlp-3 in testa e in coda è in genere di fuori del campo visivo e può essere escluso tramite filtri aggiuntivi nella Software di quantizzazione raziometrici. Per garantire che osservato cambiamenti nel risultato di fluorescenza di GCaMP5 da modifiche effettive in intracellulare di Ca2 +, controllo transgeni che esprimono GFP invece di GCaMP5 devono essere preparato in modo indipendente e analizzato26. Più recenti Ca2 + reporter con differenti colori, cinetica e2 + sensibilità Ca hanno ampliato la scelta di strumenti disponibili di imaging, ma ogni nuovo reporter devono essere convalidati utilizzando il Ca2 +-variante fluorescente insensibile14 ,16.
Media:
Piastre NGM per imaging devono essere preparati con agar di alta qualità. Agar di qualità inferiore non si dissolvono completamente all'autoclave, lasciando piccole particelle che disperdono luce durante imaging e aumentando la fluorescenza di fondo. Agarosio per biologia molecolare può essere utilizzato invece, ma l'importo aggiunto dovrebbe essere ridotta per mantenere la fermezza piastra equivalente.
Confronti con altri metodi di montaggio:
Precedenti approcci all'attività di immagine nel circuito del comportamento di deposizione delle uova sono utilizzati vermi immobilizzati con colla ad un pad di agarosio. Sotto queste condizioni, il circuito attività ed il comportamento di deposizione delle uova non è favorite senza una riduzione in terreni di coltura osmolarità8,10,44,45. La prova recente suggerisce che numerosi comportamenti di vite senza fine sono modulati dallo stato di locomozione, sollevando dubbi circa il rapporto di attività delle cellule osservati negli animali immobilizzati a quello visto nel comportarsi liberamente gli animali. Abbiamo recentemente dimostrato che attività di deposizione delle uova circuito è gradualmente in modo imprevisto con locomozione26,27. Allo stesso modo, compartimenti Ca2 + segnalazione nell'Interneurone RIA integra attività dai neuroni sensoriali e testa motore neuroni durante il foraggiamento movimenti46. Comportamento di defecazione è accompagnato anche da un cambiamento preciso e stereotipato di locomozione che permette gli animali ad allontanarsi dal loro posto di foraggiamento prima di espellere rifiuti47. Insieme, questi risultati suggeriscono che brevi registrazioni di attività di circuito da immobilizzato animali possono essere fondamentalmente diverse da quelli ottenuti a comportarsi liberamente gli animali.
Nonostante sia direttamente sotto un vetrino coprioggetti, comportamento del verme ricorda molto quello visto su piastre standard NGM. Le uova deposte andrà avanti a covare, e la piccola quantità di cibo depositato permette le larve L1 a crescere in adulti (dati non mostrati). La dimensione del blocco grande agar consente lo scambio di gas ragionevole e resiste alla disidratazione, anche se troppo cibo aumenterà la fluorescenza di fondo. Mentre questo metodo funziona meglio per gli adulti, la tecnica utilizzabile anche per animali di immagine di L4. Tuttavia, lo spessore dello strato acquoso tra il pezzo e il coprioggetto è tale che più piccole larve hanno difficoltà strisciando e spesso possono rimanere intrappolate sulla scia di un adulto commovente.
Una limitazione di questa tecnica di montaggio è che la stimolazione meccanica o chimica diretta a precise regioni del corpo è difficile. Recenti sviluppi nelle tecniche di illuminazione con motivi consentono l'eccitazione separata di testa o di coda-espresso microbiche opsine con illuminazione separata e rilevamento della fluorescenza di GCaMP/mCherry nel midbody48,49. Di conseguenza, è possibile superare questo problema utilizzando approcci optogenetica.
Confronti con altri Ca 2 + Approcci di imaging:
Questo metodo funziona molto bene per la registrazione delle modifiche in citoplasmico Ca2 + da singolo, risolte le cellule e le loro regioni sinaptiche. Formazione immagine in tempo reale, volumetrica dei neuroni nella testa recentemente è stata realizzata utilizzando la posizione dei nuclei delle cellule per l'identificazione delle cellule e per quantificare i cambiamenti nel calcio adrenocorticale50,51,52. Il rapporto tra nucleare e sinaptica Ca2 + rimane poco chiaro. I nostri dati suggeriscono che il più cospicuo HSN intracellulare di Ca2 + modifiche alla termini presinaptici lontano il soma della cellula (Figura 4). Termini presinaptiche del HSN e i neuroni di VC sono incorporati nei muscoli vulval postsinaptica26. Non è chiaro se ci sarebbe sufficiente risoluzione nella dimensione Z anche con filatura disco o tecniche di foglio leggero di attribuire presinaptici Ca2 + segnali a celle specifiche senza dipendere in qualche modo somatica del calcio per l'identificazione delle cellule . Utilizzando le tecniche descritte qui, ogni 10 min, due canali di registrazione con 12.001 immagini TIFF di 256x256 pixel a 16 bit è ~ 4 GB. Il rapporto modulato e intensità canali doppia rispetto alla dimensione file di ~ 8 GB. Un tipico esperimento registrazione 10 animali da ciascuno dei due genotipi (wild-type e sperimentali) genera quasi 150 GB di dati primari e richiede 20 h per raccogliere e analizzare. Analisi volumetrica con 10 fette Z al timepoint richiederebbe un ordine di grandezza più dati e tempo analitico, spiegando perché così pochi tali studi sono stati completati.
Hardware:
Registriamo e analizzare sequenze di immagini su workstation biprocessore con alte prestazioni schede grafiche (ad es., gaming), 64 GB di RAM, e ad alte prestazioni Solid state drives (Vedi Tabella materiali). Dati devono essere memorizzati in rete matrice ridondante di dischi indipendenti (RAID) e il backup nel cloud presso un centro di dati off-site.
Si consiglia di utilizzare ad alta potenza collimato LED per l'eccitazione di fluorescenza pulsata sopra ad alogenuri metallici o fonti di luce a base di mercurio. Sono disponibili diversi sistemi di LED multi-colore commercialmente disponibili. Mentre alcuni di questi sistemi a LED hanno un costo iniziale più elevato, hanno una lunga durata (> 20.000 h), può contemporaneamente eccitare fluorofori diversi quattro o più e offrono un controllo temporale preciso utilizzando un seriale e/o interfaccia TTL con bassa latenza (10-300 µs passare tempo). Innescando assicura che il campione è illuminato solo quando in realtà sono stati raccolti. Generalmente utilizziamo un'esposizione di 10 ms ogni 50 ms (20% aliquota di dazio). Questo riduce la fototossicità e sfocatura in movimento durante la cattura delle immagini, come precedentemente segnalato43.
Usiamo sCMOS telecamere per la loro velocità e una grande matrice di pixel piccolo, sensibile. Una EM-CCD telecamera è un'alternativa più costosa, ma 'fioritura' effetti possono causare catturati fotoelettroni fuoriuscita in pixel adiacenti. Nuovo retro-illuminato sCMOS fotocamere hanno fotosensibilità simili di EM-CCD a costi significativamente ridotti. Indipendentemente da ciò quale sensore è utilizzato, i canali GCaMP5 e mCherry devono essere ottenuti simultaneamente. Acquisizione sequenziale in vermi in movimento porterà a mal registrati immagini inadatti per la quantificazione raziometrici. Formazione immagine doppio canale può essere realizzata su una singola macchina fotografica dopo la scissione di canali utilizzando un'immagine splitter (Figura 2) o due fotocamere identiche. La gamma dinamica di immagini a 16 bit è suggerita sopra immagini di 8 bit per la quantificazione accurata raziometrici. Per le immagini di campo chiaro del comportamento di verme, catturiamo usando una macchina fotografica di 1pollice 4.1 MP vicino infrarosso USB3 per catturare grandi sequenze di immagine a 8 bit 1.024 x 1.024 binned 2x2 dopo compressione JPEG. Il FOV più grande disponibile sui modelli più recenti di microscopio permette un verme adulto possano essere visualizzati a 20x dopo 0.63 x demagnification con solo lieve vignettatura (Figura 4E).
Si consiglia di utilizzare i segnali di tensione standard TTL per sincronizzare l'illuminazione e la cattura di fotogrammi. A causa di latenze potenziali in programmi software diversi, si consiglia di utenti configurare la fotocamera di fluorescenza con uscite trigger come master con uscite TTL guida tutti gli altri dispositivi. In questo modo, informazioni sulla posizione di campo chiaro e fase verranno raccolti per ogni misura di Ca2 + .
Fessura - o risonante microscopi confocali punto-scansione trovati tipicamente in Servizi confocale in comune anche dare prestazioni eccellenti durante raziometrici Ca2 + imaging. Tali strumenti possono essere utilizzati per catturare due o più canali di fluorescenza insieme a campo chiaro24. In questo caso, il foro stenopeico confocale deve essere aperto e il suo diametro massimo, e un rilevatore spettrale dovrebbe essere usato per separare segnali infrarossi campo chiaro, mCherry e GCaMP5. Questo massimizza la luce raccolta da una spessa (~ 20 µm) fetta consentendo comunque il rifiuto di fluorescenza di out-of-focus. L'unico lato negativo è il FOV più piccolo e più restrizioni per personalizzazione hardware e software.
Software:
Maggior parte dei produttori della nave e installare le loro macchine fotografiche e microscopi con software proprietario, inclusa la configurazione di innescare ingressi e uscite. Possono variare le caratteristiche e le prestazioni di questo software durante la registrazione. Perché vermi in rapido movimento può essere difficile tenere traccia, formato immagine durante la registrazione deve essere liscia e stabile a 20 Hz. Per migliorare le prestazioni, sequenze di immagini possono essere temporaneamente salvati in RAM con sottoinsiemi comportamentale pertinenti salvati al termine dell'esperimento. Questi due canali immagine sequenza file possono essere convertiti nel formato immagine Cytometry Standard aperto (ICS) per l'importazione nel software raziometrici quantificazione. OME-TIFF è un formato open source immagine più recente, anche se diverse installazioni possono essere Impossibile salvare sequenze di immagini TIFF superiori a 4 GB.
Una caratteristica fondamentale della pipeline quantificazione è la generazione della scanalatura del rapporto e quindi una procedura di segmentazione non distorta immagine utilizzando mCherry fluorescenza per trovare celle di interesse. Da ogni oggetto trovato, significa che la dimensione dell'oggetto, posizione baricentro XY e il minimo, e vengono calcolati i valori di intensità di fluorescenza massima per ogni canale (compreso il canale di rapporto). Insieme, questi valori vengono utilizzati per quantificare i cambiamenti in intracellulare Ca2 + a ogni timepoint nella registrazione. Misure oggetto per ogni timepoint poi vengono esportate come file CSV per analisi successive.
Una limitazione importante del protocollo descritto qui è la dipendenza lo spostamento dei dati in forme diverse attraverso un patchwork di prodotti software. Un'ulteriore irritazione è che alcuni dei software è open source e gratuito, mentre gli altri sono chiusi, costosi e aggiornato in modo non uniforme. Un importante miglioramento sarebbe usare o sviluppare un pezzo di software (idealmente open source) che fornisce livelli di prestazioni e facilità d'uso dall'acquisizione all'analisi simili. Come notato sopra, analisi raziometrici raddoppia la dimensione del file e il tempo necessario per completare un esperimento. Generazione di driver di fotocamera che può essere integrato in quadri personalizzabili dall'utente come Bonsai avrebbe permesso immagini e altri flussi di dati devono essere raccolti e analizzati in tempo reale, in modo significativo miglioramento velocità effettiva.
Prospettive future:
Mentre si traccia in genere verme movimenti manualmente, rilevamento del centroide verme rilevato nelle registrazioni a infrarossi o scuro-campo chiaro dovrebbe consentire per ulteriori nodi che forniscono circuito chiuso regolazione della posizione di fase e automatizzato di elaborazione di immagini rilevamento (Figura 3 e dati non mostrati). La maggior parte delle registrazioni fluorescenza ottenuto con questo metodo è scuro e privo di dati biologicamente interessanti. Elaborazione delle tecniche che delle colture di sequenze di immagini per gli oggetti rilevanti sul sensore o in tempo reale immagini di post-acquisizione avrebbe permesso per una maggiore risoluzione spaziale e di accelerare la pipeline di analisi di dati, in particolare se ulteriori Z-fette sono raccolti per ogni timepoint visualizzare attività all'interno di tutte le celle di pre- e postsinaptiche nel circuito.
Divulgazioni
Gli autori dichiarano che non interessi concorrenti presenti.
Riconoscimenti
Quest'opera è stata finanziata da una sovvenzione NINDS a KMC (R01 NS086932). LMN è stata sostenuta da una sovvenzione dal programma NIGMS IMSD (R25 GM076419). Ceppi utilizzati in questo studio centro di genetica, che è finanziato dall'ufficio di NIH di programmi di ricerca dell'infrastruttura (P40 OD010440) di c. elegans. Ringraziamo James Baker e Mason Klein per utili discussioni.
Materiali
| Name | Company | Catalog Number | Comments |
| C. elegans growth, cultivation, and mounting | |||
| Escherichia coli bacterial strain, OP50 | Caenorhabditis Genetic Center | OP50 | Food for C. elegans. Uracil auxotroph. E. coli B. Biosafety Level 1 |
| HSN GCaMP5+mCherry worm strain | Caenorhabditis Genetic Center | LX2004 | Integrated transgene using nlp-3 promoter to drive GCaMP5 and mCherry expression in HSN. Full genotype: vsIs183 [nlp-3p::GCaMP5::nlp-3 3'UTR + nlp-3p::mCherry::nlp-3 3'UTR + lin-15(+)], lite-1(ce314), lin-15(n765ts) X |
| lite-1(ce314), lin-15(n765ts) mutant strain for transgene preparation | author | LX1832 | Strain for recovery of high-copy transgenes after microinjection with pL15EK lin-15(n765ts) rescue plasmid. Also bears the linked lite-1(ce314) mutation which reduces blue-light sensitivity. Available from author by request |
| pL15EK lin-15a/b genomic rescue plasmid | author | pL15EK | Rescue plasmid for recovery of transgenic animals after injection into LX1832 lite-1(ce314), lin-15(n765ts) X strain. Available from author by request |
| pKMC299 plasmid | author | pKMC299 | Plasmid for expression of mCherry in the HSNs from the nlp-3 promoter. Has nlp-3 3' untranslated region |
| pKMC300 plasmid | author | pKMC300 | Plasmid for expression of GCaMP5 in the HSNs from the nlp-3 promoter. Has nlp-3 3' untranslated region |
| Potassium Phosphate Monobasic | Sigma | P8281 | For preparation of NGM plates |
| Potassium Phosphate Dibasic | Sigma | P5655 | For preparation of NGM plates |
| Magnesium Sulfate Heptahydrate | Amresco | 0662 | For preparation of NGM plates |
| Calcium Chloride Dihydrate | Alfa Aesar | 12312 | For preparation of NGM plates |
| Peptone | Becton Dickinson | 211820 | For preparation of NGM plates |
| Sodium Chloride | Amresco | 0241 | For preparation of NGM plates |
| Cholesterol | Alfa Aesar | A11470 | For preparation of NGM plates |
| Agar, Bacteriological Type A, Ultrapure | Affymetrix | 10906 | For preparation of NGM plates |
| 60 mm Petri dishes | VWR | 25384-164 | For preparation of NGM plates |
| 24 x 60 mm micro cover glasses, #1.5 | VWR | 48393-251 | Cover glass through which worms are imaged |
| 22 x 22 mm micro cover glasses, #1 | VWR | 48366-067 | Cover glass that covers the top of the agar chunk |
| Stereomicroscope with transmitted light base | Leica | M50 | Dissecting microscope for worm strain maintenance, staging, and mounting |
| Platinum iridium wire, (80:20), 0.2mm | ALFA AESAR | AA39526-BW | For worm transfer |
| Calcium imaging microscope | |||
| Anti-vibration air table | TMC | 63-544 | Micro-g' Lab Table 30" x 48" anti-vibration table with 4" CleanTop M6 on 25mm top |
| Inverted compound microscope | Zeiss | 431007-9902-000 | Axio Observer.Z1 inverted microscope |
| Sideport L80/R100 (3 position) | Zeiss | 425165-0000-000 | To divert 20% of output to brightfield (CMOS) camera, 80% to fluorescence (sCMOS) camera |
| Tilt Back Illumination Carrier | Zeiss | 423920-0000-000 | For infrared/behavior imaging |
| Lamphousing 12V/100W w/ Collector | Zeiss | 423000-9901-000 | For infrared/behavior imaging |
| Halogen lamp 12V/100W | Zeiss | 380059-1660-000 | For infrared/behavior imaging. White-light LEDs do not emit significant infrared light, so they will not allow brightfield imaging after the infrared bandpass filter |
| 32 mm Infrared bandpass filter (750-790 nm) for Halogen lamp | Zeiss | 447958-9000-000 | BP 750-790; DMR 32mm, for infrared illumination for brightfield and behavior |
| 6-filter Condenser Turret (LD 0.55 H/DIC/Ph), Motorized | Zeiss | 424244-0000-000 | For infrared/behavior imaging |
| Condenser & Shutter | Zeiss | 423921-0000-000 | For infrared/behavior imaging |
| Binocular eyepiece with phototube for infrared CMOS camera | Zeiss | 425536-0000-000 | For infrared/behavior imaging |
| Eyepiece 10x, 23mm | Zeiss | 444036-9000-000 | For worm localization on the agar chunk |
| C-Mount Adapter 2/3" 0.63x demagnifier | Zeiss | 426113-0000-000 | Mount for infrared CMOS camera |
| CMOS camera for infrared brightfield and behavior (1" sensor) | FLIR (formerly Point Grey Research) | GS3-U3-41C6NIR-C | Camera for brightfield imaging |
| USB 3.0 Host Controller Card | FLIR (formerly Point Grey Research) | ACC-01-1202 | Fresco FL1100, 4 Ports |
| 8 pins, 1m GPIO Cable, Hirose HR25 Circular Connector | FLIR (formerly Point Grey Research) | ACC-01-3000 | Cable for TTL triggering. The green wire connects to GPIO3 / Pin 4 and the brown wire connects to Ground / Pin 5 |
| Plan-Apochromat 20x/0.8 WD=0.55 M27 | Zeiss | 420650-9901-000 | Best combination of magnification, numerical aperture, and working distance |
| 6-cube Reflector Turret, Motorized | Zeiss | 424947-0000-000 | For fluorescence imaging |
| Fluorescence Light Train, Motorized | Zeiss | 423607-0000-000 | For fluorescence imaging |
| Fluorescence Shutter | Zeiss | 423625-0000-000 | For fluorescence imaging |
| GFP and mCherry dual excitation and emission filter cube (for microscope) | Zeiss | 489062-9901-000 | FL Filter Set 62 HE BFP+GFP+HcRed for fluorescence imaging |
| LED illumination system | Zeiss | 423052-9501-000 | Triggerable Colibri.2 LED system for fluorescent illumination |
| GFP LED module (470 nm) | Zeiss | 423052-9052-000 | Colibri.2 LED for GFP fluorescence excitation |
| mCherry LED module (590 nm) | Zeiss | 423052-9082-000 | Colibri.2 LED for mCherry fluorescence excitation |
| Iris stop slider for incident-light equipment | Zeiss | 000000-1062-360 | Field aperture iris to limit LED illumination to the camera field of view |
| C-Mount Adapter 1" 1.0x | Zeiss | 426114-0000-000 | Adapter for image-splitter and sCMOS fluorescence camera |
| Image splitter | Hamamatsu | A12801-01 | Gemini W-View, other image splitters may be used, but they may not be optimized for the large sensor size of the sCMOS cameras |
| GFP / mCherry dichroic mirror (image splitter) | Semrock | Di02-R594-25x36 | Splitting GCaMP5 from mCherry and infrared signals |
| GFP emission filter (image splitter) | Semrock | FF01-525/30-25 | Capturing GCaMP5 fluorescence |
| mCherry/ emission filter (image splitter) | Semrock | FF01-647/57-25 | This filter is necessary to exclude the infrared light used for brightfield imaging |
| sCMOS camera for fluorescence (1" sensor) | Hamamatsu | A12802-01 / C11440-22CU | Orca FLASH 4.0 V2. Newer models allow for separate image acquisition settings on separate halves of the sensor, allowing acquisition of two-channel images in combination with an image splitter |
| Motorized XY Stage | Märzhäuser | SCAN IM 130 x 100 | Stage movement; the XY resolution of this stage is 0.2µm per step |
| XY Stage controller with joystick | LUDL | MAC6000, XY joystick | Manual tracking of worms. MAC6000 controller should be connected to the PC through the serial (RS-232) port configured to 115200 baud |
| Digital Acquisition board (DAQ) | Arduino | Uno | Receiving TTL triggers from sCMOS camera. The Uno should be loaded with the standard Firmata package, and the computer USB port configured to 57600 baud |
| BNC Male to BNC Male Cable - 6 ft | Hosa Technology | HOBB6 | BNC connectors for TTL triggering |
| Gold-Plated BNC Male to SMA male coaxial cable (8.8") | uxcell | 608641773651 | To connect the fluorescence camera trigger outputs |
| BNC turn head adapter | Hantek | RRBNCTH21 | BNC to Banana Plug Adapter (4mm) |
| BNC female to female connector | Diageng | 20130530009 | Female to female BNC adapter to connect the BNC output from the camera to the Banana Plug |
| Solderless flexible breadboard jumper wires | Z&T | GK1212827 | To connect the BNC trigger outputs to the Arduiono DAQ. Male to male. |
| High performace workstation | HP | Z820 | Windows 7, 64GB RAM, Dual Xeon processor, solid state C: drive, serial (RS-232) port, multiple PCIe3 slots for ethernet connectivity, USB 3.0 cards, and additional solid state drives |
| M.2 Solid state drive | Samsung | MZ-V5P512BW | High-speed streaming and analysis of image data |
| M.2 Solid state drive adapter for workstations | Lycom | DT-120 | M.2 to PCIe 3.0 4-lane adapter |
| Network attached storage | Synology | DS-2415+ | Imaging data storage and analysis |
| Hard disk drives | Western Digital | WD80EFZX | RED 8 TB, 5400 RPM Class SATA 6 Gb/s 128MB Cache 3.5 Inch. Storage of imaging data (10 drives + 2 drive redundancy) |
| Software | |||
| Fluorescence Acquisition | Hamamatsu | HCImage DIA | Recording of two channel (GCaMP5 and mCherry) fluorescence image sequences at 20 fps |
| Brightfield Acquisition | FLIR (formerly Point Grey Research) | Flycapture | Recording of brightfield JPEG image sequences |
| Stage Serial Port Reader | Bonsai | https://bitbucket.org/horizongir/bonsai | Facilitates tracking of worms during behavior |
| LED controller software | Zeiss | Micro Toolbox Test 2011 | To set up the intensity and trigger inputs for the different LEDs in the Colibri.2 unit |
| ImageJ | NIH | https://imagej.net/Fiji/Downloads | Simple review of image sequences and formatting changes for import into Ratiometric Quantitation software |
| Excel | Microsoft | 2002984-001-000001 | For generating subsets of comma-separated value data from Volocity for MATLAB analysis |
| Peak Finding | MATLAB | R2017a | Script used for Ratio peak feature calculations |
| Ratiometric Quantitation | Perkin Elmer | Volocity 6.3 | Facilitates calculation of ratiometric image channels, image segmentation for object finding, and ratio measurement of found objects |
| Scripts | |||
| XY-stage-final.bonsai | Bonsai | TTL-triggered DAQ and stage position serial port reader | Records X and Y stage position (in microns) when the attached Arduino receives a positive TTL signal from sCMOS camera during frame exposure. Script writes a .csv file with four columns: frame number, X position (microns), Y position (microns), and the time elapsed between frames (typically ~50 msec when recording at 20 fps). X and Y stage position from this output (columns 2 and 3, respectively) are added to the X and Y centroid positions from the AnalyzeGCaMP_2017.m MATLAB script (columns 4 and 5, respectively), to give the final X and Y position of the fluorescent object for the recording. |
Riferimenti
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The structure of the nervous system of the nematode Caenorhabditis elegans. Phil Trans R. Soc. 314, 1-340 (1986).
- Bargmann, C. I. Neurobiology of the Caenorhabditis elegans genome. Science. 282, 2028-2033 (1998).
- Piggott, B. J., Liu, J., Feng, Z., Wescott, S. A., Xu, X. Z. S. The neural circuits and synaptic mechanisms underlying motor initiation in C. elegans. Cell. 147, 922-933 (2011).
- Chung, S. H., Sun, L., Gabel, C. V. In vivo neuronal calcium imaging in C. elegans. J. Vis. Exp. JoVE. , (2013).
- Kerr, R., et al. Optical imaging of calcium transients in neurons and pharyngeal muscle of C. elegans. Neuron. 26, 583-594 (2000).
- Desai, C., Garriga, G., McIntire, S. L., Horvitz, H. R. A genetic pathway for the development of the Caenorhabditis elegans HSN motor neurons. Nature. 336, 638-646 (1988).
- Waggoner, L. E., Zhou, G. T., Schafer, R. W., Schafer, W. R. Control of alternative behavioral states by serotonin in Caenorhabditis elegans. Neuron. 21, 203-214 (1998).
- Zhang, M., et al. A self-regulating feed-forward circuit controlling C. elegans egg-laying behavior. Curr. Biol. CB. 18, 1445-1455 (2008).
- Shyn, S. I., Kerr, R., Schafer, W. R. Serotonin and Go modulate functional states of neurons and muscles controlling C. elegans egg-laying behavior. Curr. Biol. CB. 13, 1910-1915 (2003).
- Zhang, M., Schafer, W. R., Breitling, R. A circuit model of the temporal pattern generator of Caenorhabditis egg-laying behavior. BMC Syst. Biol. 4, 81 (2010).
- Kerr, R. A., Schafer, W. R. Intracellular Ca2+ imaging in C. elegans. Methods Mol. Biol. Clifton NJ. 351, 253-264 (2006).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. J. Neurosci. Off. J. Soc. Neurosci. 32, 13819-13840 (2012).
- Dana, H., et al. Sensitive red protein calcium indicators for imaging neural activity. eLife. 5, (2016).
- Inoue, M., et al. Rational design of a high-affinity, fast, red calcium indicator R-CaMP2. Nat. Methods. 12, 64-70 (2015).
- Oheim, M., et al. New red-fluorescent calcium indicators for optogenetics, photoactivation and multi-color imaging. Biochim. Biophys. Acta. 1843, 2284-2306 (2014).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499, 295-300 (2013).
- Kim, C. K., Adhikari, A., Deisseroth, K. Integration of optogenetics with complementary methodologies in systems neuroscience. Nat. Rev. Neurosci. 18, 222-235 (2017).
- Storace, D., et al. Toward Better Genetically Encoded Sensors of Membrane Potential. Trends Neurosci. 39, 277-289 (2016).
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77, 71-94 (1974).
- Mello, C., Fire, A. DNA transformation. Methods Cell Biol. 48, 451-482 (1995).
- Berkowitz, L. A., Knight, A. L., Caldwell, G. A., Caldwell, K. A. Generation of stable transgenic C. elegans using microinjection. J. Vis. Exp. JoVE. , (2008).
- Clark, S. G., Lu, X., Horvitz, H. R. The Caenorhabditis elegans locus lin-15, a negative regulator of a tyrosine kinase signaling pathway, encodes two different proteins. Genetics. 137, 987-997 (1994).
- Edwards, S. L., et al. A novel molecular solution for ultraviolet light detection in Caenorhabditis elegans. PLoS Biol. 6, 198 (2008).
- Thapaliya, E. R., et al. Bioimaging with Macromolecular Probes Incorporating Multiple BODIPY Fluorophores. Bioconjug. Chem. 28, 1519-1528 (2017).
- Mariol, M. -. C., Walter, L., Bellemin, S., Gieseler, K. A rapid protocol for integrating extrachromosomal arrays with high transmission rate into the C. elegans genome. J. Vis. Exp. JoVE. , e50773 (2013).
- Collins, K. M., Koelle, M. R. Postsynaptic ERG Potassium Channels Limit Muscle Excitability to Allow Distinct Egg-Laying Behavior States in Caenorhabditis elegans. J. Neurosci. Off. J. Soc. Neurosci. 33, 761-775 (2013).
- Collins, K. M., et al. Activity of the C. elegans egg-laying behavior circuit is controlled by competing activation and feedback inhibition. eLife. 5, e21126 (2016).
- Li, P., Collins, K. M., Koelle, M. R., Shen, K. LIN-12/Notch signaling instructs postsynaptic muscle arm development by regulating UNC-40/DCC and MADD-2 in Caenorhabditis elegans. eLife. 2, 00378 (2013).
- Banerjee, N., Bhattacharya, R., Gorczyca, M., Collins, K. M., Francis, M. M. Local neuropeptide signaling modulates serotonergic transmission to shape the temporal organization of C. elegans egg-laying behavior. PLoS Genet. 13, 1006697 (2017).
- Lopes, G., et al. Bonsai: an event-based framework for processing and controlling data streams. Front. Neuroinformatics. 9, 7 (2015).
- Flavell, S. W., et al. Serotonin and the neuropeptide PDF initiate and extend opposing behavioral states in C. elegans. Cell. 154, 1023-1035 (2013).
- Hardaker, L. A., Singer, E., Kerr, R., Zhou, G., Schafer, W. R. Serotonin modulates locomotory behavior and coordinates egg-laying and movement in Caenorhabditis elegans. J. Neurobiol. 49, 303-313 (2001).
- Ringstad, N., Horvitz, H. R. FMRFamide neuropeptides and acetylcholine synergistically inhibit egg-laying by C. elegans. Nat. Neurosci. 11, 1168-1176 (2008).
- Hallem, E. A., et al. Receptor-type guanylate cyclase is required for carbon dioxide sensation by Caenorhabditis elegans. Proc. Natl. Acad. Sci. U. S. A. 108, 254-259 (2011).
- Tanis, J. E., Moresco, J. J., Lindquist, R. A., Koelle, M. R. Regulation of serotonin biosynthesis by the G proteins Galphao and Galphaq controls serotonin signaling in Caenorhabditis elegans. Genetics. 178, 157-169 (2008).
- Giordano-Santini, R., et al. An antibiotic selection marker for nematode transgenesis. Nat. Methods. 7, 721-723 (2010).
- Semple, J. I., Garcia-Verdugo, R., Lehner, B. Rapid selection of transgenic C. elegans using antibiotic resistance. Nat. Methods. 7, 725-727 (2010).
- Granato, M., Schnabel, H., Schnabel, R. pha-1, a selectable marker for gene transfer in C. elegans. Nucleic Acids Res. 22, 1762-1763 (1994).
- Mello, C. C., Kramer, J. M., Stinchcomb, D., Ambros, V. Efficient gene transfer in C.elegans: extrachromosomal maintenance and integration of transforming sequences. EMBO J. 10, 3959-3970 (1991).
- Gong, J., et al. The C. elegans Taste Receptor Homolog LITE-1 Is a Photoreceptor. Cell. 167, 1252-1263 (2016).
- Liu, J., et al. C. elegans phototransduction requires a G protein-dependent cGMP pathway and a taste receptor homolog. Nat. Neurosci. 13, 715-722 (2010).
- Bhatla, N., Horvitz, H. R. Light and hydrogen peroxide inhibit C. elegans Feeding through gustatory receptor orthologs and pharyngeal neurons. Neuron. 85, 804-818 (2015).
- Larsch, J., Ventimiglia, D., Bargmann, C. I., Albrecht, D. R. High-throughput imaging of neuronal activity in Caenorhabditis elegans. Proc. Natl. Acad. Sci. U. S. A. 110, 4266-4273 (2013).
- Zang, K. E., Ho, E., Ringstad, N. Inhibitory peptidergic modulation of C. elegans serotonin neurons is gated by T-type calcium channels. eLife. 6, (2017).
- Branicky, R., Miyazaki, H., Strange, K., Schafer, W. R. The voltage-gated anion channels encoded by clh-3 regulate egg laying in C. elegans by modulating motor neuron excitability. J. Neurosci. Off. J. Soc. Neurosci. 34, 764-775 (2014).
- Hendricks, M., Ha, H., Maffey, N., Zhang, Y. Compartmentalized calcium dynamics in a C. elegans interneuron encode head movement. Nature. 487, 99-103 (2012).
- Nagy, S., Huang, Y. -. C., Alkema, M. J., Biron, D. Caenorhabditis elegans exhibit a coupling between the defecation motor program and directed locomotion. Sci. Rep. 5, 17174 (2015).
- Leifer, A. M., Fang-Yen, C., Gershow, M., Alkema, M. J., Samuel, A. D. T. Optogenetic manipulation of neural activity in freely moving Caenorhabditis elegans. Nat. Methods. 8, 147-152 (2011).
- Stirman, J. N., et al. Real-time multimodal optical control of neurons and muscles in freely behaving Caenorhabditis elegans. Nat. Methods. 8, 153-158 (2011).
- Kato, S., et al. Global brain dynamics embed the motor command sequence of Caenorhabditis elegans. Cell. 163, 656-669 (2015).
- Nguyen, J. P., et al. Whole-brain calcium imaging with cellular resolution in freely behaving Caenorhabditis elegans. Proc. Natl. Acad. Sci. U. S. A. 113, 1074-1081 (2016).
- Toyoshima, Y., et al. Accurate Automatic Detection of Densely Distributed Cell Nuclei in 3D Space. PLOS Comput. Biol. 12, 1004970 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon