A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
النهج السلوكية لدراسة الإجهاد الفطري في Zebrafish
In This Article
Summary
تصف هذه المخطوطة طريقه بسيطه لقياس الإجهاد السلوكيا في البالغين المتعصبين. النهج يستفيد من النزعة الفطرية ان الزرد يفضل النصف السفلي من خزان عندما تكون في حاله المجهدة. ونحن أيضا وصف أساليب لاقتران الفحص مع علم الصيدلة.
Abstract
الاستجابة المناسبة للمؤثرات المجهدة ضرورية لبقاء الكائن الحي. وقد أجريت بحوث واسعه النطاق علي مجموعه واسعه من الامراض المرتبطة بالإجهاد والاضطرابات العقلية ، ولكن لا تزال هناك حاجه إلى مزيد من الدراسات في التنظيم الجيني والعصبي للإجهاد لتطوير العلاجات أفضل. يوفر الزيبرافيش نموذجا جينيا قويا للتحقيق في الأسس العصبية للإجهاد ، حيث توجد مجموعه كبيره من الخطوط المتحولة والمحورة وراثيا. وعلاوة علي ذلك ، يمكن بسهوله تطبيق الصيدلة علي zebrafish ، كما يمكن أضافه معظم الادويه مباشره إلى الماء. ونحن هنا وصف استخدام "اختبار دبابات الرواية" كوسيلة لدراسة الاستجابات الإجهاد الفطري في zebrafish ، وتبين كيف يمكن التحقق من صحة الادويه المحتملة مزيل القلق باستخدام الفحص. ويمكن بسهوله ان يقترن هذا الأسلوب مع خطوط الزرد إيواء الطفرات الجينية ، أو تلك التي تستخدم فيها النهج المحورة وراثيا للتلاعب الدوائر العصبية دقيقه. ويمكن أيضا ان تستخدم المقايسة في نماذج الأسماك الأخرى. وينبغي ان ييسر البروتوكول الموصوف معا اعتماد هذا الفحص البسيط علي المختبرات الأخرى.
Introduction
يتم تغيير الاستجابات الإجهاد السلوكية والفسيولوجية الدول الناتجة عن المحفزات الضارة أو المحتملة. يتم الحفاظ علي الاستجابات الإجهاد في جميع انحاء المملكة الحيوانية ، وهي حاسمه لبقاء الكائن الحي1. وقد توسعت عقود من البحوث إلى حد كبير معرفتنا لبعض أليات الوراثية والخلايا العصبية الكامنة وراء الدول الإجهاد. اليوم, مناطق الدماغ مثل اللوزة والمخطط2, والعوامل الوراثية مثل كورتيكوتروبين الإفراج عن هرمون (crh), والسكرية (gr) ومستقبلات القشرانيات ( السيد) وقد درست علي نطاق واسع3،4،5،6. علي الرغم من هذه النتائج الحاسمة ، لا يزال الكثير غير معروف عن التنظيم الوراثي والعصبي للإجهاد. وعلي هذا النحو ، يعاني العديد من الاضطرابات المرتبطة بالإجهاد من نقص التداوي.
الكائنات الحية النموذجية القابلة للتعديل وراثيا توفر أداه مفيده في دراسة التحكم الوراثي والعصبي للسلوك. نماذج الأسماك ، علي وجه الخصوص ، هي قويه للغاية: فهي كائنات صغيره مع مرات الجيل القصير ، واستخدامها في اعداد المختبر هو facile ، يتم تعديل الجينات بسهوله ، وباعتبارها فقاري ، فانها تشترك ليس فقط الوراثية ، ولكن أيضا التشريحية العصبية التماثل مع نظرائهم في الثدييات7,8. يمكن ان يقترن الاختبارات القياسية لقياس الإجهاد مع خطوط الزرد إيواء الطفرات الجينية ، أو تلك التي التلاعب في مجموعات فرعيه دقيقه الخلايا العصبية هو ممكن ، وأثار جينات واحده أو الخلايا العصبية المحددة يمكن تقييمها بسرعة وكفاءه.
سلوكيا, ويمكن وصف الاستجابات الإجهاد في الأسماك كفترات من فرط النشاط أو فترات طويلة من الخمول (أقرب إلى ' تجميد ')9, انخفاض الاستكشاف10, التنفس السريع, انخفاض المدخول الغذائي11, و مكان-تفضيل للأسفل من دبابة12. علي سبيل المثال ، عندما وضعت في خزان غير مالوف ، والكبار الزرد وغيرها من نماذج الأسماك الصغيرة تظهر تفضيل الاولي للنصف السفلي من الخزان ، ومع ذلك ، مع مرور الوقت ، تبدا الأسماك استكشاف نصفي العلوي والسفلي مع تردد شبه متساوية12. علاج البالغين المصابين بالمخدرات المعروفة للحد من القلق يسبب الأسماك لاستكشاف علي الفور النصف العلوي10,13. وعلي العكس من ذلك ، المخدرات التي تزيد من القلق تسبب الأسماك لإظهار تفضيل قوي للنصف السفلي من الخزان12،14،15. التالي ، انخفاض الاستكشاف وتفضيل النصف السفلي من الخزان هي مؤشرات بسيطه وموثوق بها من الإجهاد.
مثل معظم الفقاريات ، ويحرك الاستجابات الإجهاد في الأسماك عن طريق تفعيل محور طائي-الغدة النخامية بين الكلي (hpi ؛ مماثله لطائي-الغدة النخامية-الكظرية [HPA] محور في الثدييات)14,16. طائي الخلايا العصبية التعبير عن هرمون corticotropin الإفراج عن هرمون (CRH) اشاره إلى الغدة النخامية, الذي بدوره النشرات كظر الإفراج عن هرمون (ACTH). Acth ثم إشارات إلى الغدة الكلوية لإنتاج وإفراز الكورتيزول ، والتي لديها عدد من الأهداف المصب16، واحد منهم يجري ردود فعل سلبيه من الخلايا العصبية طائي المنتجة crh3،17، 18,19.
هنا ، ونحن وصف طريقه لتقييم الإجراءات السلوكية من الإجهاد الفطري. للسلوك ، ونحن التفاصيل البروتوكولات باستخدام رواية دبابات اختبار الغوص12،14. ثم نثبت ، علي سبيل المثال ، ان دواء مزيل القلق المعروف ، buspirone ، يقلل من التدابير السلوكية للإجهاد.
Access restricted. Please log in or start a trial to view this content.
Protocol
وقد تمت الموافقة علي هذا البروتوكول من قبل المؤسسة المؤسسية للعناية بالماشية واستخدام اللجنة فلوريدا الأطلسي جامعه.
1-الاعداد
- تعيين غرفه معزولة لاجراء الدراسات السلوكية ، أو إغلاق قسم من الغرفة بحيث تكون معزولة.
ملاحظه: يجب ان تكون الغرفة دون عائق وانخفاض حركه المرور لتجنب تعطيل السلوك الطبيعي للأسماك. - نقل المواد والمعدات التالية إلى الغرفة السلوكية: ' 1 ' كاميرا وعدسه ، ' 2 ' فلتر بالاشعه تحت الحمراء يمكن إرفاقه بالعدسة ، ' 3 ' حامل كاميرا ، ' 4 ' حاسوب مزود ببرمجيات لاقتناء الكاميرات ، ' 5 ' طاوله ثابته ومستقره لاجراء الفحص علي ، ' 6 ' أضواء الاشعه تحت الحمراء (أضواء IR ؛ 850 nm أو 940 nm) ، ' 7 ' الناشر الأكريليك الأبيض ، والذي هو أطول من طول خزان التسجيل (viii) 1.8 L خزان الفحص البلاستيكي شبه المنحرف (المشار اليه باسم "دبابة الرواية" ؛ واحد المستخدم هنا هو 12 × 18 بوصه) ، و (9) دلو من مياه نظام السمك.
ملاحظه: بالنسبة للدبابات الرواية ، يستخدم مختبرنا الاوعيه البلاستيكية المتاحة تجاريا ، والتي هي شبه منحرفة في الشكل. ابعاد الخزان هي تقريبا 6 في x 9 في (يتم توفير ابعاد مفصله في الشكل 1ا). لوحه الناشر التي نستخدمها هي أكبر قليلا من دبابات الرواية (12 في x 18 في). وقد أجريت تجارب دبابات الرواية مع الدبابات وجود اشكال مختلفه ، مثل تلك التي هي مستطيله أو تلك مع ابعاد شبه منحرف مختلفه20،21. وعاده ما يكون سلوك الأسماك مماثلا في جميع الصهاريج بغض القياس عن ابعادها: النسبة لجميع الحاويات ، تفضل الأسماك في البداية النصف السفلي ، ولكن مع مرور الوقت تبدا في استكشاف النصف العلوي بتردد أكبر. - قم بإرفاق فلتر الاشعه تحت الحمراء بعدسه الكاميرا. الأطوال الموجية لشرائط ضوء الاشعه تحت الحمراء تتراوح عاده من 850 نانومتر إلى 940 نانومتر. الفلتر هو فلتر تمرير طويل يقيد ضوء الأطوال الموجية التي تقل عن 720 نانومتر من الإرسال إلى الكاميرا.
- حدد المعلمات المناسبة لبرنامج الاستحواذ علي الكاميرا. بالنسبة لمعظم التسجيلات ، اضبط اكتساب الكاميرا علي معدل 30 اطارا في الثانية ، ومده التسجيل إلى 10 دقائق.
ملاحظه: قد تختلف هذه المعلمات استنادا إلى التجربة. علي سبيل المثال ، لدراسة التعود في خزان رواية22،23، قد تكون هناك حاجه تسجيلات أطول.
2. الاعداد
ملاحظه: تصف الخطوات التي يتضمنها هذا القسم اعداد فحص خزان الرواية. ويرد رسم تخطيطي للمنتج النهائي في الشكل 1باء.
- وضع خزان الرواية في منتصف الجدول.
- وضع أضواء الاشعه تحت الحمراء وراء الخزان ووضع ورقه الأكريليك الأبيض أو الشاشة الناشر في ما بين الخزان والصمام مصدر الضوء.
- وضع الناشر بحيث ينتشر الحد الأقصى الضوء القادمة من المصابيح ، وشده الضوء هو ما يكفي لتضيء دبابة الرواية. وكلما اقتربت اللوحة من مصدر الضوء ، ستكون الأضواء أكثر إشراقا ، ولكن كلما قلت انها ستنتشر. وعلي النقيض من ذلك ، فان وضع لوحه الناشر بعيدا عن مصدر الضوء سيقلل من شده الضوء ، ولكنه ينشر الضوء بشكل أفضل.
- ملء ما يقرب من ثلاثه أرباع دبابة الرواية مع المياه نظام السمك.
ملاحظه: يتم إنشاء نظام المياه باستخدام التناضح العكسي من مياه الصنبور ، تليها الجرعات مثل ان الموصليه يساوي 900 ± 100 μS ، ان الأس الهيدروجيني محايد (7.2) ، وان درجه الحرارة هي 27 ± 1 درجه مئوية. - ارفق الكاميرا بحامل الكاميرا وقم بتوصيل الكاميرا بالكمبيوتر. فتح برنامج الحصول علي الفيديو وضبط الكاميرا لمواجهه الجبهة من الخزان وضمان الدبابة الرواية بأكملها يمكن ان ينظر اليها وانه لا توجد مناطق حجب في الفيديو. ضبط الخزان وأضواء الاشعه تحت الحمراء بحيث ان هناك ما يكفي وحتى الاضاءه في جميع انحاء الخزان عندما لوحظ من خلال الكاميرا.
ملاحظه: قبل الشروع في التجارب ، يمكن ان يكون مفيدا في كثير من الأحيان لاجراء تشغيل تجريبي ، حيث يتم التقاط الفيديو لسمكه ويتم تنفيذ التتبع. سيضمن هذا الاعداد كافيه لتجريب السلوك.
3. رواية الاعداد اختبار دبابات
- اعداد كوب 250 mL معباه مسبقا مع المياه نظام السمك ، واثنين علي الأقل من الدبابات القابضة.
- في صباح الاختبار ، ونقل ما لا يقل عن 10 اختبار الزرد الكبار لاستخدامها لكل حاله تجريبية (الضوابط والبالغين التجريبية) من مرفق الأسماك في خزان عقد ، ونقلها إلى غرفه السلوك ، والسماح لهم للتكيف لمده واحده علي الأقل ساعه.
ملاحظه: يجب اجراء تحليل الطاقة قبل التجريب ، ولكن في ايدينا ، n = 10 عاده ما تكون كافيه للكشف عن الاهميه الاحصائيه. وعلاوة علي ذلك ، ينبغي ان تحتوي الصهاريج القابضة علي ما لا يزيد عن خمسه افراد لكل لتر من الماء. التاقلم من ساعة واحده كافيه كما أظهرت البالغين الزرد إلى روض في غضون 30 دقيقه من دبابة جديده22. أيضا ، تتاثر الإيقاعات السلوكية بعمليات الساعة البيولوجية ، التالي يجب اجراء نسخ متماثلة التجريبية القيام به في أيام مختلفه في غضون ساعات نفسها. نقوم عاده باجراء جميع التجارب بين الساعة 11:00 صباحا و 6:00 مساء. - تسميه الدبابات بحيث حاله أو النمط الجيني للحيوانات اعمي لمجرب.
ملاحظه: يمكن بسهوله ان تكون التجارب عمياء لمجرب عن طريق وضع العلامات علي الدبابات باستخدام نظام الحروف أو الأرقام (اي ان أحد الخزانات يسمي ' A ' ، واخر ' B ' ، وما إلى ذلك). ويقوم الطرف غير المشارك في التجارب بتسميه الدبابات بنظام من هذا القبيل ، ويخفي هويات المجرب حتى بعد اكتمال التحليل اللاحق. - باستخدام الشبكة ، ضع الشخص البالغ الواحد برفق في الدورق المملوء مسبقا من الخطوة 3.1. السماح للأسماك الكبار للتاقلم في الكاس لمده 10 دقيقه.
ملاحظه: تسجيل جنس البالغين ، لأنه قد يكون من المهم بعد التحليل للبحث عن الاختلافات بين الجنسين. - بعد التاقلم في الكاس ، وإدخال الأسماك في خزان الرواية (التي أنشئت في القسم 1) عن طريق سكب بلطف من الماء والكبار من الكاس.
- بعد إدخال الكبار في خزان الرواية ، بدء تسجيل الكاميرا ، والابتعاد عن الاعداد لمنع الاستغاثة اضافيه للأسماك.
- بعد الانتهاء من التسجيل ، وأزاله الفرد من دبابة الرواية ووضعها في خزان القابضة الجديدة.
ملاحظه: يجب استخدام خزان عقد مختلفه من واحد في الخطوة 3.2 لمنع تكرار الاختبار علي نفس الافراد. - كرر الخطوات 3.4 إلى 3.7 لكل شخص بالغ حتى يتم اختبار جميع الكائنات.
ملاحظه: بالاضافه إلى الظروف المسببة للعمي أو الأنماط الجينية ، عشوائي التجارب. استخدام مولد رقم عشوائي أو اي أداه تسمح للمرء ان عشوائي بين التجارب. وينبغي ان يتم ذلك قبل التجريب بحيث يتم تحديد كل محاكمه قبل بدء التجارب. - في نهاية جميع الاختبارات ، وأعاده الأسماك مره أخرى إلى مرفق الأسماك.
4. المعالجة المسبقة مع المخدرات
ملاحظه: الهدف من الخطوات التالية هو مقارنه سلوك الفرد قبل وبعد استخدام المخدرات. ويتحقق هذا المقارنة من خلال القيام أولا اختبار دبابة جديده كما هو الأمر في الخطوة 3.4 إلى 3.6 ، تليها العلاج المخدرات ، ومن ثم اختبار دبابة الرواية الثانية (الشكل 3ا).
- اعداد حل الأسهم من المخدرات ، بما في ذلك الضوابط الايجابيه والسلبية.
ملاحظه: إذا كان المخدرات قد استخدمت سابقا في الأدبيات, العثور علي جرعه العمل المناسبة واستخدام هذا. علي سبيل المثال ، ل بوسبيرون في النتائج التمثيلية ، ونحن جعل الحل الأسهم 100x واستخدام 0.05 mg/mL كتركيز النهائي ، كما هو موضح في الأدب13،20. إذا كانت الجرعة المقترحة غير معروفه ، يجب اجراء منحني استجابه الجرعة عن طريق فحص عده تركيزات. اعداد المزيد من الأكواب مع المخففات المسلسل من المخدرات. إذا كان الدواء غير قابل للذوبان في الماء, استخدام ثنائي ميثيل سولفوكسيد (DMSO) كمذيب. - تمييع المخدرات للتركيز العمل في 250 مل أكواب مع المياه النظام. علي سبيل المثال ، إذا تم اجراء حل 100x ، تمييع 1:100 في المياه النظام. اعداد الكاس مع نظام المياه فقط كعنصر تحكم.
ملاحظه: إذا تم استخدام DMSO كمذيب في الخطوة 3.1 ، استخدم حجم متساو من DMSO في الدورق التحكم. - بمساعده باحث آخر ، قناع هويات المخدرات والسيطرة علي الأكواب لضمان ان الفاحص هو اعمي لظروف العلاج حتى مرحله ما بعد التحليل.
ملاحظه: قد يتم استخدام نظام رقم أو حرف. - اجراء اختبار دبابة جديده باتباع الخطوات 3.1 إلى 3.6 للحصول علي استجابه الإجهاد السلوكية الاساسيه.
- بعد تسجيل خط الأساس ، واستخدام شبكه لأزاله فورا الأسماك الكبار من دبابة الرواية ووضعه في الكاس مداوي مع المخدرات أو المركبات ، كما هو موضح في الخطوة 4.2. السماح للبالغين بالبقاء في الكاس لمده 10 دقيقه.
ملاحظه: تاكد من ان الشبكة لا تلمس الماء في الأكواب لمنع التلوث المتبادل للادويه. ضمان الجرعة المناسبة والوقت الإداري اعتمادا علي المخدرات المستخدمة. قد لا يعمل وقت العلاج 10 دقيقه لجميع الادويه. - بعد العلاج ، واستخدام شبكه لأزاله الكبار من الكاس في الخطوة 4.5 ووضعه في كاس آخر مليئه المياه نظام جديد فقط. هذه هي فتره غسيل لتقليل المزيد من الجرعات خلال اختبار الدبابة الرواية الثانية. السماح للبالغين بالبقاء في الكاس يغسل لمده 10 دقيقه اضافيه.
ملاحظه: يجب استخدام شبكات منفصلة لكل حاله من حالات المخدرات لمنع اي علاج عبر غير المرغوب فيها مع المخدرات. قد يتم تخطي فتره الغسيل إذا رغب مجرب. - اجراء اختبار الغوص دبابات الرواية مره ثانيه عن طريق أزاله هذا البالغ من الكاس في الخطوة السابقة ، وضعه في دبابة جديده الرواية ، واتبع الخطوات 3.5 إلى 3.6.
- بعد اختبار دبابة الرواية الثانية ، وأزاله الفرد في خزان عقد منفصلة. صب المياه النظام بعيدا في خزان الرواية الثانية وملء مع المياه النظام الطازج للاختبار المقبل. هذه الخطوة يمنع التلوث المتبادل لأي دواء.
ملاحظه: اعتمادا علي نصف عمر المخدرات ، يجب ان يتم الأكواب الطازجة التي تحتوي علي المخدرات كل 3 ساعات. ل buspirone ، وجعل حلول جديده كل 3 ساعات. الاضافه إلى ذلك ، وبعد الملاحظة في الخطوة 3.8 ، ينبغي ان تكون التجارب عشوائية بين الضوابط والعلاجات الدوائية. - في نهاية جميع المحاكمات ، وأعاده الافراد العودة إلى مرفق الأسماك.
ملاحظه: اعتمادا علي نوع المخدرات المستخدمة ، وأثار هذه العلاجات علي الافراد يمكن ان تكون طويلة الأمد. لذلك ، لا تستخدم هؤلاء الافراد في تجارب أخرى.
5-تحليل الفيديو
- بعد كل التجارب ، تحميل ملفات الفيديو في تتبع البرمجيات المفضلة.
ملاحظه: نحن عاده استخدام برامج تتبع المتاحة تجاريا ، ولكن يمكن استخدام عده حزم البرامج المتاحة بحريه. قد تختلف خطوات تحقيق التتبع وفقا لحزمه البرامج المستخدمة. - باستخدام اطار لا يزال من الفيديو ، وتحديد الحدود وهميه حول ' 1 ' كامل الساحة دبابات الرواية التي تمتلئ بالماء ، والحدود حول ' 2 ' الثالث الأعلى ، ' 3 ' الثالث الأوسط ، و ' 4 ' الثلث السفلي من الخزان. استخدام هذه لتحديد الوقت الذي تنفق الأسماك في كل جزء من الدبابة الرواية.
- حساب الازاحه س-ص لكل اطار لكل الساحة المحددة في الخطوة 5.2.
- تحديد المناطق العلوية والوسطي والسفلي من الخزان. وينبغي ان تكون كل منطقه متشابهة في الحجم. طريقه مختصره لتحديد هذه المناطق هي لحساب طول الخزان في اتجاه y ، وتقسيم هذا بمقدار 3.
ملاحظه: الاختلافات في البروتوكول العام موجودة. علي سبيل المثال ، تستخدم بعض المختبرات نصفين بدلا من الثلثين14. - تحديد الوقت المستغرق في كل ساحة ، والمسافة ، والسرعة.
ملاحظه: ستقوم معظم حزم التعقب تلقائيا بحساب هذه للمستخدم. ومع ذلك ، إذا لم يكن برنامج التتبع ، يمكن حساب هذه بسهوله من قيم الازاحه س-ص. علي سبيل المثال ، يمكن تحديد المسافة باستخدام الصيغة: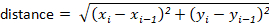
ويمكن تحديد السرعة بعد الصيغة: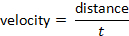
- كرر الخطوات 5.2 إلى 5.4 للحصول علي المسارات والقياسات لجميع التجارب.
ملاحظه: الاختلافات في هذا البروتوكول العام
6-اختبار الأوضاع الطبيعية
- قم باجراء الإحصائيات قبل المتابعة لحساب الاختلافات الاحصائيه. تحقق لمعرفه ما إذا كان يتم توزيع البيانات عاده باستخدام اختبار شابيرو-Wilk.
- إذا تم رفض الفرضية الفارغة التي يتم توزيع البيانات عاده (علي سبيل المثال ، لا تتبع البيانات توزيع Gaussian) ، قم باجراء كافة الاختبارات باستخدام الاختبارات غير الحدودية. وعلي العكس من ذلك ، إذا تم العثور علي البيانات لمتابعه توزيع عادي ، انتقل إلى استخدام الاختبارات الحدودية.
ملاحظه: نحن نستخدم البرمجيات المتاحة تجاريا لأداء الإحصاءات ؛ ومع ذلك ، يمكن أيضا استخدام لغة البرمجة R. يمكن اجراء تحليل شابيرو-ويلك باستخدام وظيفة الاختبار الخاصة ب R.
Access restricted. Please log in or start a trial to view this content.
النتائج
فحص الإجهاد في الزبرافيش
لفحص السلوك الإجهاد مع مرور الوقت في zebrafish البرية ، اختبرنا الأسماك الكبار من سلاله AB24 في اختبار دبابات الرواية. واخضع البالغون من الأبين للبروتوكول علي النحو الموصوف أعلاه. وباختصار ، أعطيت الأسماك فتره التاقلم 1-ح في خزان في ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
Zebrafish يحمل استجابه قويه الإجهاد في دبابة جديده
هنا ، ونحن وصف نهج سلوكي بسيط لفحص الاستجابات الإجهاد في zebrafish الكبار ، والتحقق من صحة النهج كمقياس بسيط من الإجهاد باستخدام علم الصيدلة.
اختبار دبابات الرواية هو اختبار يستخدم علي نطاق واسع لفحص الإجهاد الفطري في الزرد و...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ويعلن صاحبا البلاغ انهما لا يملكان مصالح متنافسة أو مالية.
Acknowledgements
وقد دعم هذا العمل بتمويل من مبادرة كوكب المشتري للعلوم الحياتية في جامعه فلوريدا اتلانتيك إلى ERD و ACK. وكان هذا العمل مدعوما أيضا بمنح R21NS105071 (منحت إلى ACK و ERD) و R15MH118625 (منحت إلى ERD) من المعاهد الوطنية للصحة.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Camera | We use Point Grey Grasshopper3 USB camera with lens from Edmund Optics. | ||
| Infrared filter | Edmund Optics | ||
| Video Acquisition Program | Use programs such as Virtualdub or FlyCapture because the acquisition framerate can be set. | ||
| Infrared LED lights | |||
| Assay tank | Aquaneering | Part number ZT180 | Size: M3 1.8 liter |
| Stand and clamp, or standard tripod for camera | |||
| 250mL beaker | |||
| Tracking software | We use Ethovision XT 13 from Noldus Information Technology | ||
| Buspirone chloride | Sigma-Aldrich | B7148 | |
| Randomized trial generator | We use the RANDBETWEEN function in Microsoft Excel |
References
- McEwen, B. S. Stress, adaptation, and disease. Allostasis and allostatic load. Annals of the New York Academy of Sciences. 840, 33-44 (1998).
- Tovote, P., Fadok, J. P., Lüthi, A. Neuronal circuits for fear and anxiety. Nature Reviews Neuroscience. 16 (6), 317-331 (2015).
- Facchinello, N., et al. Nr3c1 null mutant zebrafish are viable and reveal DNA-binding-independent activities of the glucocorticoid receptor. Scientific Reports. 7 (4371), (2017).
- Ziv, L., et al. An affective disorder in zebrafish with mutation of the glucocorticoid receptor. Molecular Psychiatry. , (2013).
- Grone, B. P., Maruska, K. P. Divergent evolution of two corticotropin-releasing hormone (CRH) genes in teleost fishes. Frontiers in Neuroscience. , (2015).
- Fuller, P. J., Lim-Tio, S. S., Brennan, F. E. Specificity in mineralocorticoid versus glucocorticoid action. Kidney International. , (2000).
- Zhdanova, I. V. Sleep and its regulation in zebrafish. Reviews in the Neurosciences. 22 (1), 27-36 (2011).
- Patton, E. E., Zon, L. I. The art and design of genetic screens: zebrafish. Nature Reviews Genetics. , (2001).
- Duboué, E. R. E. R., Hong, E., Eldred, K. C. K. C., Halpern, M. E. M. E. Left Habenular Activity Attenuates Fear Responses in Larval Zebrafish. Current Biology. 27 (14), 2154-2162 (2017).
- Facchin, L., Duboue, E. R., Halpern, M. E. Disruption of Epithalamic Left-Right Asymmetry Increases Anxiety in Zebrafish. Journal of Neuroscience. 35 (48), 15847-15859 (2015).
- Øverli, Ø, Sørensen, C., Nilsson, G. E. Behavioral indicators of stress-coping style in rainbow trout: Do males and females react differently to novelty. Physiology and Behavior. , (2006).
- Levin, E. D., Bencan, Z., Cerutti, D. T. Anxiolytic effects of nicotine in zebrafish. Physiology & behavior. 90 (1), 54-58 (2007).
- Bencan, Z., Sledge, D., Levin, E. D. Buspirone, chlordiazepoxide and diazepam effects in a zebrafish model of anxiety. Pharmacology Biochemistry and Behavior. 94 (1), 75-80 (2009).
- Cachat, J., et al. Measuring behavioral and endocrine responses to novelty stress in adult zebrafish. Nature Protocols. 5 (11), 1786-1799 (2010).
- Mathuru, A. S., et al. Chondroitin fragments are odorants that trigger fear behavior in fish. Current Biology. , (2012).
- Alsop, D., Vijayan, M. The zebrafish stress axis: Molecular fallout from the teleost-specific genome duplication event. General and Comparative Endocrinology. , (2009).
- Evans, A. N., Liu, Y., MacGregor, R., Huang, V., Aguilera, G. Regulation of Hypothalamic Corticotropin-Releasing Hormone Transcription by Elevated Glucocorticoids. Molecular Endocrinology. , (2013).
- Fenoglio, K. A., Brunson, K. L., Avishai-Eliner, S., Chen, Y., Baram, T. Z. Region-specific onset of handling-induced changes in corticotropin- releasing factor and glucocorticoid receptor expression. Endocrinology. , (2004).
- Liposits, Z., et al. Ultrastructural localization of glucocorticoid receptor (GR) in hypothalamic paraventricular neurons synthesizing corticotropin releasing factor (CRF). Histochemistry. , (1987).
- Facchin, L., Duboué, E. R., Halpern, M. E. Disruption of epithalamic left-right asymmetry increases anxiety in Zebrafish. Journal of Neuroscience. 35 (48), (2015).
- Chin, J. S., et al. Convergence on reduced stress behavior in the Mexican blind cavefish. Developmental Biology. , (2018).
- Wong, K., et al. Analyzing habituation responses to novelty in zebrafish (Danio rerio). Behavioural Brain Research. 208 (2), 450-457 (2010).
- Matsunaga, W., Watanabe, E. Habituation of medaka (Oryzias latipes) demonstrated by open-field testing. Behavioural Processes. 85 (2), 142-150 (2010).
- Walker, C. Chapter 3 Haploid Screens and Gamma-Ray Mutagenesis. Methods in Cell Biology. , (1998).
- Rihel, J., et al. Zebrafish behavioral profiling links drugs to biological targets and rest/wake regulation. Science. 327, New York, N.Y. 348-351 (2010).
- Peal, D. S., Peterson, R. T., Milan, D. Small molecule screening in zebrafish. Journal of Cardiovascular Translational Research. , (2010).
- Murphey, R., Zon, L. Small molecule screening in the zebrafish. Methods. 39 (3), 255-261 (2006).
- Gammans, R. E., et al. Use of buspirone in patients with generalized anxiety disorder and coexisting depressive symptoms. A meta-analysis of eight randomized, controlled studies. Neuropsychobiology. 25 (4), 193-201 (1992).
- Maaswinkel, H., Zhu, L., Weng, W. The immediate and the delayed effects of buspirone on zebrafish (Danio rerio) in an open field test: A 3-D approach. Behavioural Brain Research. , (2012).
- Gebauer, D. L., et al. Effects of anxiolytics in zebrafish: Similarities and differences between benzodiazepines, buspirone and ethanol. Pharmacology Biochemistry and Behavior. , (2011).
- Maximino, C., et al. Fingerprinting of psychoactive drugs in zebrafish anxiety-like behaviors. PLoS ONE. , (2014).
- Horváth, J., Barkóczi, B., Müller, G., Szegedi, V. Anxious and nonanxious mice show similar hippocampal sensory evoked oscillations under urethane anesthesia: Difference in the effect of buspirone. Neural Plasticity. , (2015).
- Costall, B., Kelly, M. E., Naylor, R. J., Onaivi, E. S. Actions of buspirone in a putative model of anxiety in the mouse. Pharm Pharmacol. 40 (7), 494-500 (1988).
- Barros, M., Mello, E. L., Huston, J. P., Tomaz, C. Behavioral effects of buspirone in the marmoset employing a predator confrontation test of fear and anxiety. Pharmacology Biochemistry and Behavior. , (2001).
- Heinen-Kay, J. L., et al. Predicting multifarious behavioural divergence in the wild. Animal Behaviour. 121, 3-10 (2016).
- Thompson, R. R. J., Paul, E. S., Radford, A. N., Purser, J., Mendl, M. Routine handling methods affect behaviour of three-spined sticklebacks in a novel test of anxiety. Behavioural Brain Research. 306, 26-35 (2016).
- Hamilton, T. J., et al. Establishing zebrafish as a model to study the anxiolytic effects of scopolamine. Scientific Reports. , (2017).
- York, R. A., Fernald, R. D. The Repeated Evolution of Behavior. Frontiers in Ecology and Evolution. 4, 143(2017).
- Jakka, N. M., Rao, T. G., Rao, J. V. Locomotor behavioral response of mosquitofish (Gambusia affinis) to subacute mercury stress monitored by video tracking system. Drug and Chemical Toxicology. , (2007).
- Hu, C. K., Brunet, A. The African turquoise killifish: A research organism to study vertebrate aging and diapause. Aging Cell. , (2018).
- Maximino, C., et al. Measuring anxiety in zebrafish: A critical review. Behavioural Brain Research. 214 (2), 157-171 (2010).
- Maximino, C., Marques de Brito, T., Dias, C. A. G., Gouveia, A., Morato, S. Scototaxis as anxiety-like behavior in fish. Nature protocols. 5 (2), 209-216 (2010).
- Godwin, J., Sawyer, S., Perrin, F., Oxendine, S., Kezios, Z. Adapting the Open Field Test to assess anxiety related behavior in zebrafish. Zebrafish Protocols for Neurobehavioral Research. , 181-189 (2012).
- Agetsuma, M., et al. The habenula is crucial for experience-dependent modification of fear responses in zebrafish. Nature Neuroscience. 13 (11), 1354-1356 (2010).
- Valente, A., Huang, K. H., Portugues, R., Engert, F. Ontogeny of classical and operant learning behaviors in zebrafish. Learning and Memory. , (2012).
- Baker, M. R., Goodman, A. C., Santo, J. B., Wong, R. Y. Repeatability and reliability of exploratory behavior in proactive and reactive zebrafish, Danio rerio. Scientific Reports. , (2018).
- Friedrich, R. W., Genoud, C., Wanner, A. A. Analyzing the structure and function of neuronal circuits in zebrafish. Frontiers in Neural Circuits. , 7(2013).
- Friedrich, R. W., Jacobson, G. A., Zhu, P. Circuit Neuroscience in Zebrafish. Current Biology. 20 (8), (2010).
- Marquart, G. D., et al. A 3D Searchable Database of Transgenic Zebrafish Gal4 and Cre Lines for Functional Neuroanatomy Studies. Frontiers in Neural Circuits. , (2015).
- Randlett, O., et al. Whole-brain activity mapping onto a zebrafish brain atlas. Nature Methods. 12 (11), 1039-1046 (2015).
- Gupta, T., et al. Morphometric analysis and neuroanatomical mapping of the zebrafish brain. Methods. 1046 (18), 30011-30012 (2018).
- Marquart, G. D., et al. High-precision registration between zebrafish brain atlases using symmetric diffeomorphic normalization. GigaScience. , (2017).
- Ronneberger, O., et al. ViBE-Z: A framework for 3D virtual colocalization analysis in zebrafish larval brains. Nature Methods. , (2012).
- Subedi, A., et al. Adoption of the Q transcriptional regulatory system for zebrafish transgenesis. Methods. 66 (3), 433-440 (2014).
- Scheer, N., Campos-Ortega, J. A. Use of the Gal4-UAS technique for targeted gene expression in the zebrafish. Mechanisms of Development. 80 (2), 153-158 (1999).
- Chatterjee, D., Tran, S., Shams, S., Gerlai, R. A Simple Method for Immunohistochemical Staining of Zebrafish Brain Sections for c-fos Protein Expression. Zebrafish. , (2015).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved