Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Verhaltensweisen für den Studierenz-Stress in Zebrafischen
In diesem Artikel
Zusammenfassung
Dieses Manuskript beschreibt eine einfache Methode, um Stress verhaltensverhaltensverhaltensverhaltensverhaltensverhaltensfrei bei erwachsenen Zebrafischen zu messen. Der Ansatz nutzt die angeborene Tendenz, dass Zebrafische die untere Hälfte eines Tanks bevorzugen, wenn sie sich in einem stressigen Zustand befinden. Wir beschreiben auch Methoden zur Kopplung des Assays mit der Pharmakologie.
Zusammenfassung
Eine angemessene Reaktion auf stressige Reize ist für das Überleben eines Organismus unerlässlich. Es wurden umfangreiche Untersuchungen zu einem breiten Spektrum von stressbedingten Erkrankungen und psychiatrischen Erkrankungen durchgeführt, dennoch sind weitere Studien zur genetischen und neuronalen Regulierung von Stress erforderlich, um bessere Therapeutika zu entwickeln. Der Zebrafisch stellt ein starkes genetisches Modell zur Untersuchung der neuronalen Untermauerungen von Stress dar, da es eine große Ansammlung von Mutanten und transgenen Linien gibt. Darüber hinaus kann die Pharmakologie leicht auf Zebrafische angewendet werden, da die meisten Medikamente direkt dem Wasser zugesetzt werden können. Wir beschreiben hier die Verwendung des "neuartigen Panzertests" als Methode, um angeborene Stressreaktionen bei Zebrafischen zu untersuchen, und zeigen, wie potenzielle Angstmedikamente mit dem Test validiert werden können. Die Methode kann leicht mit Zebrafischlinien gekoppelt werden, die genetische Mutationen beherbergen, oder solche, in denen transgene Ansätze zur Manipulation präziser neuronaler Schaltkreise verwendet werden. Der Test kann auch in anderen Fischmodellen verwendet werden. Gemeinsam sollte das beschriebene Protokoll die Annahme dieses einfachen Tests an andere Labore erleichtern.
Einleitung
Stressreaktionen sind veränderte Verhaltens-und physiologische Zustände, die aus potenziell schädlichen oder mitteldurchschnittlichen Reizen resultieren. Stressreaktionen werden im gesamten Tierreich konserviert und sind entscheidend für das Überleben eines Organismus1. Die jahrzehntelange Forschung hat unser Wissen über einige der genetischen und neuronalen Mechanismen, die den Stresszuständen zugrunde liegen, stark erweitert. Heute sind Bereiche des Gehirns wie die Amygdala und das Striatum2, und genetische Faktoren wie Corticotropin freisetzendes Hormon (Crh), und die Glukokortikoid (gr) und Mineralocortikod-Rezeptoren ( Mr) wurden ausgiebig untersucht 3,4,5, 6. Trotz dieser kritischen Befunde ist in Bezug auf die genetische und neuronale Regulierung von Stress noch viel unbekannt. Viele stressbedingte Störungen leiden daher unter einem Mangel an Therapeutika.
Gentechnisch veränderbare Modellorganismen bieten ein nützliches Werkzeug bei der Untersuchung der genetischen und neuronalen Verhaltenskontrolle. Vor allem Fischmodelle sind extrem leistungsfähig: Sie sind kleine Organismen mit kurzen Erzeugungszeiten, ihr Einsatz im Labor ist oberflächlich, ihre Genome leicht modifiziert, und als Wirbel teilen sie nicht nur genetische, sondern auch neuroanatomische Homologie mit ihren Säugetieren 7,8. Standard-Assays zur Messung von Stress können mit Zebrafischlinien gepaart werden, die genetische Mutationen beherbergen, oder solche, in denen Manipulationen präziser neuronaler Untergruppen möglich sind, und die Auswirkungen einzelner Gene oder definierter Neuronen können schnell und effizient beurteilt werden.
Verhaltenell können Stressreaktionen in Fischen als Perioden der Hyperaktivität oder längere Phasen der Inaktivität (ähnlich wie "Einfrieren") 9,reduzierte Erkundung10, schnelle Atmung, reduzierteNahrungsaufnahme 11 und eine Platzpräferenz für den Boden eines Tanks12. Wenn zum Beispiel erwachsene Zebrafische und andere kleine Fischmodelle in einen unbekannten Tank gelegt werden, zeigen sie eine anfängliche Vorliebe für die untere Hälfte des Tanks, doch im Laufe der Zeit beginnen die Fische mit der Erkundung der oberen und unteren Hälften mit nahezu gleicher Häufigkeit12. Die Behandlung von Erwachsenen mit Medikamenten bekannt, um Angstzustände zu reduzieren, führen dazu, dass Fische sofort die obere Hälfte10,13zu erforschen. Umgekehrt führen Medikamente, die die Angst erhöhen, dazu, dass Fische eine starke Vorliebe für die untere Hälfte des Tanks12,14,15zeigen. So sind reduzierte Explorationen und die Bevorzugung der unteren Hälfte des Tanks einfache und zuverlässige Indikatoren für Stress.
Wie die meisten Wirbeltiere werden auch bei Fischen die Stressreaktionen bei Fischen durch die Aktivierung der Hypothalamic-Pituitary-inter-renal-Achse (HPI; analog zur Hypothalamin-Pituitary-Adrenal-Achse bei Säugetieren)14,16angetrieben. Hypothalamische Neuronen, die das Hormon Corticotropin freisetzendes Hormon (CRH) an die Hypophyse ausdrücken, das wiederum adrenocorticotropische freisetzende Hormone (ACTH) freigibt. ACTH signalisiert dann an die Internierendrüse,Cortisol zu produzieren und zu trennen, das eine Reihe von nachgelagerten Zielen16hat, von denen eines negative Feedback der crhproduzierendenhypothalamischen Neuronen 3,17 ist, 18,19.
Hier beschreiben wir eine Methode zur Beurteilung von Verhaltensmaßnahmen von angeborenem Stress. Für das Verhalten werden die Protokolle mit dem neuartigen Panzertauchtest12,14detailliert beschrieben. Wir zeigen dann als Beispiel, dass ein bekanntes Angstmedikament, Buspirone, verhaltensbedingte Stressmaßnahmen reduziert.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Das Protokoll wurde von der Institutional Animal Care and Use Committeeat Florida Atlantic University genehmigt.
1. Vorbereitung
- Gestalten Sie einen isolierten Raum für Verhaltensstudien oder schließen Sie einen Teil eines Raumes, so dass er isoliert wird.
Achtung: Der Raum sollte ungestört sein und wenig Verkehr haben, um ein normales Verhalten der Fische zu vermeiden. - Verschieben Sie die folgenden Materialien und Geräte in den Verhaltenssaal: (i) eine Kamera und ein Objektiv, (ii) einen Infrarotfilter, der an der Linse befestigt werden kann, (iii) einen Kameraständer, (iv) einen Computer mit Kameraaufnahmesoftware, (v) einen festen und stabilen Tisch, um den Test durchzuführen. Auf, (vi) Infrarotlicht (IR-Leuchten; 850 nm oder 940 nm), (vii) ein weißer Acryldiffusor, der länger als die Länge des Aufnahmesägers (viii) 1,8 L trapezförmiger Kunststoff-Assay (genannt "neuartiger Tank") ist; der hier verwendete ist 12 x 18 Zoll) , und (ix) einen Eimer Fischsystem Wasser.
NOTE: Für den neuartigen Tank verwendet unser Labor handelsübliche Kunststoffgefäße, die trapezförmig sind. Die Abmessungen des Tanks sind ca. 6 in x 9 in (Detailmaße sind in Abbildung1A vorgesehen). Die von uns verwendete Diffusorplatte ist etwas größer als der neuartige Tank (12 in x 18 in). Neuartige Tankanzversuche wurden mit Tanks mit unterschiedlichen Formen durchgeführt, wie zum Beispiel solche, die rechteckig sind, oder solche mit unterschiedlichen Trapezmaßen20,21. In der Regel ist das Fischverhalten in allen Tanks ähnlich, unabhängig von ihren Abmessungen: Für alle Behälter bevorzugen Fische zunächst die untere Hälfte, aber im Laufe der Zeit beginnen Sie, die obere Hälfte mit größerer Frequenz zu erforschen. - Befestigen Sie den Infrarotfilter an der Kameralinse. Die Wellenlängen der Infrarotlichtstreifen liegen typischerweise zwischen 850 nm und 940 nm. Bei dem Filter handelt es sich um einen Langpassfilter, der das Licht von Wellenlängen von weniger als 720 nm von der Übertragung an die Kamera begrenzt.
- Wählen Sie die passenden Parameter für die Kameraaufnahmesoftware aus. Setzen Sie bei den meisten Aufnahmen die Kameraaufnahme auf 30 Bilder pro Sekunde und die Aufzeichnungsdauer auf 10-min.
Hinweis: Diese Parameter können je nach Experiment abweichen. Um zum Beispiel die Gewöhnung in einem neuartigen Tank22,23zu untersuchen, können längere Aufnahmen erforderlich sein.
2. Einrichtung
Hinweis: Die Schritte in diesem Abschnitt beschreiben die Einrichtung des neuartigen Panzeruntergehens. Ein Diagramm des Endprodukts ist in Abbildung 1B angegeben.
- Legen Sie den neuartigen Tank in die Mitte des Tisches.
- Positionieren Sie die Infrarotleuchten hinter dem Tank und platzieren Sie das weiße Acrylblech oder den Diffusorbildschirm zwischen Tank und LED-Lichtquelle.
- Platzieren Sie den Diffusor so, dass er das Licht der LEDs maximal ausbreitet und die Intensität des Lichts ausreicht, um den neuartigen Tank zu beleuchten. Je näher das Brett an der Lichtquelle ist, desto heller werden die Lichter, aber desto weniger wird es diffundieren. Im Gegensatz dazu wird die Abgabe der Diffusorplatte von der Lichtquelle die Lichtintensität reduzieren, das Licht aber besser ausbreiten.
- Füllen Sie etwa drei Viertel des neuartigen Tanks mit Fischsystem Wasser.
Hinweis: Das Systemwasser wird mit der Umkehrosmose des Leitungswassers erzeugt, gefolgt von der Dosierung, dass die Leitfähigkeit 900 ± 100 μS entspricht, dass der pH-Wert neutral ist (7,2) und die Temperatur 27 ± 1 ° C beträgt. - Befestigen Sie die Kamera am Kameraständer und verbinden Sie die Kamera mit dem Computer. Öffnen Sie die Videoaufnahmesoftware und passen Sie die Kamera an die Vorderseite des Tanks an und stellen Sie sicher, dass der gesamte neuartige Tank sichtbar ist und dass es keine verdeckten Bereiche im Video gibt. Stellen Sie den Tank und die Infrarotleuchten so ein, dass im gesamten Tank ausreichend und sogar Beleuchtung vorhanden ist, wenn sie durch die Kamera beobachtet werden.
Hinweis: Bevor Sie zu Experimenten übergehen, kann es oft sinnvoll sein, einen Probebetrieb durchzuführen, bei dem das Video eines Fisches aufgenommen und die Verfolgung durchgeführt wird. So wird sichergestellt, dass das Setup für das Experimentieren von Verhalten ausreicht.
3. Neuartige Tankprüfstelle
- Bereiten Sie einen 250-ML-Becher vor, der mit Fischsystem Wasser gefüllt ist, und mindestens zwei Haltebästen.
- Am Morgen des Tests, übertragen Sie mindestens 10 Test erwachsene Zebrafische für jeden experimentellen Zustand (Kontrollen und experimentelle Erwachsene) von der Fischanlage in einen Haltebecken, übertragen sie in den Verhaltensraum, und ermöglichen ihnen, für mindestens eine die Stunde.
Hinweis: Vor dem Experimentieren sollte eine Leistungsanalyse durchgeführt werden, doch in unseren Händen reicht in der Regel ein n = 10 aus, um statistische Bedeutung zu erkennen. Außerdem sollte der Haltebecken nicht mehr als fünf Personen pro Liter Wasser enthalten. Eine Akklimatisierung von einer Stunde reicht aus, da Zebrafisch-Erwachsene innerhalb von 30 Minuten nach einem neuen Becken22nachweislich gewohnheitsmäßig sind. Auch Verhaltensrhythmen werden durch zirkadische Prozesse beeinflusst, so dass experimentelle Replikate, die an verschiedenen Tagen durchgeführt werden, innerhalb der gleichen Stunden durchgeführt werden sollten. Wir führen in der Regel alle Experimente zwischen den Stunden von 11:00 Uhr und 6:00 Uhr durch. - Kennzeichnen Sie die Tanks so, dass der Zustand oder der Genotyp der Tiere blind für den Experimentator ist.
Hinweis: Experimente können leicht mit einem Buchstaben-oder Zahlensystem an den Experimentator geblendet werden (d.h. ein Tank wird mit "A", einem anderen "B" usw. versehen). Eine Gruppe, die nicht an den Experimenten beteiligt ist, kennzeichnet die Tanks mit einem solchen System und maskiert die Identitäten des Experimentators, bis die Nachanalyse abgeschlossen ist. - Mit einem Netz, sanft einen einzelnen Erwachsenen in den vorgefüllten Becher aus Schritt 3.1 legen. Lassen Sie den erwachsenen Fisch für 10 Minuten im Becher akklimatisieren.
Hinweis: Nehmen Sie das Geschlecht des Erwachsenen auf, da es nach der Analyse wichtig sein könnte, nach geschlechtsspezifischen Unterschieden zu suchen. - Nach der Akklimatisierung im Becher den Fisch in den neuartigen Tank (in Abschnitt 1 eingerichtet) einführen, indem Sie das Wasser sanft ausgießen und sich aus dem Becher erwachsen lassen.
- Nachdem Sie den Erwachsenen in den neuartigen Tank eingeführt haben, starten Sie die Kameraaufnahme und bewegen Sie sich vom Setup weg, um zusätzliche Not auf den Fisch zu vermeiden.
- Nachdem die Aufnahme beendet ist, entfernen Sie den Einzelner aus dem neuartigen Tank und legen Sie ihn in einen neuen Haltebehälter.
Hinweis: Ein anderer Haltebehälter als der in Schritt 3.2 sollte verwendet werden, um wiederholte Tests an denselben Personen zu verhindern. - Wiederholen Sie die Schritte 3.4 bis 3.7 für jeden Erwachsenen, bis alle Tiere getestet wurden.
NOTE: Neben blinden Bedingungen oder Genotypen randomisieren Versuche. Verwenden Sie einen Zufallszahlengenerator oder ein Werkzeug, das es erlaubt, zwischen den Versuchen zu randomisieren. Dies sollte vor dem Experimentieren geschehen, damit jede Studie vor Beginn der Experimente bestimmt wird. - Am Ende aller Tests, geben Sie die Fische zurück in die Fischanlage.
4. Vorbehandlung mit Medikamenten
Hinweis: Ziel der folgenden Schritte ist es, das Verhalten eines Individuums vor und nach dem Konsum von Drogen zu vergleichen. Dieser Vergleich wird erreicht, indem zunächst ein neuartiger Panzertest wie in Schritt 3.4 bis 3.6 durchgeführt wird, gefolgt von einer medikamentösen Behandlung und dann ein zweiter neuartiger Panzertest (Abbildung3 A).
- Bereiten Sie eine Bestandslösung des Medikaments vor, einschließlich positiver und negativer Kontrollen.
Hinweis: Wenn das Medikament zuvor in der Literatur verwendet wurde, finden Sie eine geeignete Arbeitsdosis und verwenden Sie diese. Zum Beispiel, für Buspirone in den repräsentativen Ergebnissen, machen wir eine 100x Bestandslösung und verwenden 0,05 mg/mL als Endkonzentration, wie inder Literatur 13,20beschrieben. Wenn eine empfohlene Dosis unbekannt ist, sollte eine Dosisreaktionskurve durchgeführt werden, indem mehrere Konzentrationen untersucht werden. Mehr Becher mit seriellen Verdünnungen von Drogen aufstellen Wenn das Medikament im Wasser nicht aufgelöst werden kann, verwenden Sie Dimethylsulfoxid (DMSO) als Lösungsmittel. - Verdünnen Sie die Medikamente auf die Konzentration in 250 ml Becher mit Systemwasser. Zum Beispiel, wenn eine 100x Lösung gemacht wurde, verdünnen 1:100 in Systemwasser. Stellen Sie einen Becher mit nur Systemwasser als Steuerung ein.
NOTE: Wenn DMSO in Schritt 3.1 als Lösungsmittel verwendet wurde, verwenden Sie ein gleichwertiges DMSO-Volumen im Steuerbecher. - Mit Hilfe eines anderen Forschers die Identitäten der Drogen-und Kontrollbecher maskieren, um sicherzustellen, dass der Tester bis zur Nachanalyse blind für die Behandlungsbedingungen ist.
Hinweis: Es kann ein Zahlen-oder Buchstabensystem verwendet werden. - Führen Sie einen neuartigen Panzertest durch, indem Sie die Schritte 3.1 bis 3.6 folgen, um eine grundlegende Verhaltensstress-Reaktion zu erhalten.
- Nach der Basisaufnahme benutzen Sie ein Netz, um den erwachsenen Fisch sofort aus dem neuartigen Tank zu entfernen und in den mit Drogen oder Fahrzeug dosierten Becher zu legen, wie in Schritt 4.2 beschrieben. Lassen Sie den Erwachsenen im Becher für 10 min bleiben.
Hinweis: Achten Sie darauf, dass das Netz das Wasser in den Bechern nicht berührt, um Kreuzkontamination von Medikamenten zu verhindern. Stellen Sie sicher, dass die Dosierung und die Verabreichungszeit je nach verwendetem Medikament ordnungsgemäß erfolgen. Eine 10-minütige Behandlungszeit kann nicht für alle Medikamente funktionieren. - Nach der Behandlung, verwenden Sie ein Netz, um den Erwachsenen aus dem Becher in Schritt 4.5 zu entfernen und legen Sie es in einem anderen Becher mit frischem System Wasser gefüllt. Dies ist die Auswaschphase, um die weitere Dosierung während des zweiten neuartigen Tanktests zu minimieren. Lassen Sie den Erwachsenen in der Waschbecher für weitere 10 Minuten bleiben.
Hinweis: Für jede Medikamentenbedingung sollten separate Netze verwendet werden, um eine unerwünschte Kreuzbehandlung mit Medikamenten zu verhindern. Die Auswaschfrist kann übersprungen werden, wenn der Experimentator dies wünscht. - Führen Sie den neuartigen Panzer-Tauchtest ein zweites Mal durch, indem Sie den Erwachsenen aus dem Becher in vorangem Schritt entfernen, legen Sie ihn in einen neuen neuartigen Tank, und folgen Sie den Schritten 3,5 bis 3.6.
- Nach dem zweiten neuartigen Panzertest den Einzeltäter in einen separaten Haltebehälter entfernen. Das Systemwasser in den zweiten neuartigen Tank gießen und für den nächsten Test mit Frisch-Systemwasser füllen. Dieser Schritt verhindert die Kreuzkontamination von Medikamenten.
Achtung: Je nach Halbwertszeit der Medikamente sollten alle 3 Stunden frische Becher mit Medikamenten hergestellt werden. Machen Sie für Buspirone alle 3 Stunden frische Lösungen. Darüber hinaus sollten die Studien nach der Notiz in Schritt 3.8 zwischen Kontrollen und Medikamenten-Behandlungen randomisiert werden. - Am Ende aller Versuche werden die Personen in die Fischanlage zurückgebracht.
NOTE: Je nach Art des verwendeten Medikaments können die Auswirkungen dieser Behandlungen auf den Einzelnen lang sein. Verwenden Sie diese Personen daher nicht in anderen Experimenten.
5. Videoanalyse
- Nach allen Versuchen, laden Sie Videodateien in die Tracking-Software der Wahl.
Hinweis: Wir verwenden in der Regel kommerziell erhältliche Tracking-Software, aber es können mehrere frei verfügbare Softwarepakete verwendet werden. Die Schritte zur Verfolgung können je nach verwendetem Softwarepaket unterschiedlich sein. - Mit einem stillen Rahmen aus dem Video definieren Sie imaginäre Grenzen um (i) die gesamte neuartige Panzerarena, die mit Wasser gefüllt ist, und Grenzen um (ii) das oberste Drittel, (iii) das mittlere Drittel und (iv) unteres Drittel des Tanks. Verwenden Sie diese, um die Zeit festzustellen, die die Fische in jedem Teil des neuartigen Tanks verbracht.
- Berechnen Sie x-y-Verdrängung pro Rahmen für jede in Schritt 5.2 definierte Arena.
- Definieren Sie die oberen, mittleren und unteren Bereiche des Tanks. Jede Region sollte ähnlich groß sein. Eine kurze Methode zur Bestimmung dieser Regionen ist es, die Länge des Tanks in der y-Richtung zu berechnen und diese durch 3 zu teilen.
Hinweis: Es gibt Varianten des allgemeinen Protokolls. So verwenden einige Labore Halves statt Drittel 14. - Bestimmen Sie die Zeit, die in jeder Arena verbracht wird, die Distanz und die Geschwindigkeit.
Hinweis: Die meisten Tracking-Pakete berechnen diese automatisch für den Benutzer. Wenn die Tracking-Software dies jedoch nicht tut, lassen sich diese leicht aus den x-y-Verdrängungswerten berechnen. Zum Beispiel kann die Distanz mit der Formel bestimmt werden: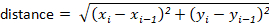
Und die Geschwindigkeit kann nach der Formel bestimmt werden: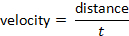
- Wiederholen Sie die Schritte 5.2 bis 5.4, um Spuren und Messungen für alle Versuche zu erwerben.
NOTE: Variationen zu diesem allgemeinen Protokoll
6. Test auf Normalität
- Führen Sie Statistiken an, bevor Sie statistische Unterschiede berechnen. Überprüfen Sie, ob die Daten normalerweise mit einem Shapiro-Wilk-Test verteilt werden.
- Wenn die Nullhypothese, dass die Daten normalerweise verteilt werden, abgelehnt wird (d.h. die Daten folgen nicht einer gaussischen Distribution), führen Sie alle Tests mit nicht-parametrischen Tests durch. Umgekehrt, wenn die Daten gefunden werden, um eine normale Verteilung zu folgen, gehen Sie mit parametrischen Tests.
Hinweis: Wir verwenden kommerziell verfügbare Software, um Statistiken durchzuführen; Aber auch die Programmiersprache R kann verwendet werden. Eine Shapiro-Wilk-Analyse kann mit der Funktion Shapiro.test von R durchgeführt werden.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Stress bei Zebrafischen untersucht
Um das Stressverhalten im Laufe der Zeit bei wilden Zebrafischen zu untersuchen, haben wir im neuartigen Tanktest erwachsene Fische aus der AD-Sorte24 getestet. Ab Erwachsene wurden dem Protokoll wie oben beschrieben unterzogen. Kurz gesagt, die Fische erhielten eine 1-h-Akklimatisierung in einem Tank im Verhaltensraum. Ein Einzelner wurde für 10-min in einen Becher gelegt und dann sanft in einen ungewohnten Tank (neu...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Zebrafische zeigen eine robuste Stressreaktion in einem neuartigen Tank
Hier beschreiben wir einen einfachen Verhaltensansatz zur Untersuchung von Stressreaktionen bei erwachsenen Zebrafischen und bestätigen den Ansatz als einfaches Maß für Stress mit Pharmakologie.
Der neuartige Panzertest ist ein weit verbreiteter Test zur Untersuchung angeborener Belastungen bei Zebrafischen und anderen Fischarten 12,14, 21, 35,<...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren erklären, dass sie keine konkurrierenden oder finanziellen Interessen haben.
Danksagungen
Diese Arbeit wurde durch die Förderung der Jupiter Life Science Initiative der Florida Atlantic University an ERD und ACK unterstützt. Unterstützt wurde diese Arbeit auch durch die Stipendien R21NS105071 (an ACK und ERD) und R15MH118625 (an ERD) von den National Institutes of Health.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Camera | We use Point Grey Grasshopper3 USB camera with lens from Edmund Optics. | ||
| Infrared filter | Edmund Optics | ||
| Video Acquisition Program | Use programs such as Virtualdub or FlyCapture because the acquisition framerate can be set. | ||
| Infrared LED lights | |||
| Assay tank | Aquaneering | Part number ZT180 | Size: M3 1.8 liter |
| Stand and clamp, or standard tripod for camera | |||
| 250mL beaker | |||
| Tracking software | We use Ethovision XT 13 from Noldus Information Technology | ||
| Buspirone chloride | Sigma-Aldrich | B7148 | |
| Randomized trial generator | We use the RANDBETWEEN function in Microsoft Excel |
Referenzen
- McEwen, B. S. Stress, adaptation, and disease. Allostasis and allostatic load. Annals of the New York Academy of Sciences. 840, 33-44 (1998).
- Tovote, P., Fadok, J. P., Lüthi, A. Neuronal circuits for fear and anxiety. Nature Reviews Neuroscience. 16 (6), 317-331 (2015).
- Facchinello, N., et al. Nr3c1 null mutant zebrafish are viable and reveal DNA-binding-independent activities of the glucocorticoid receptor. Scientific Reports. 7 (4371), (2017).
- Ziv, L., et al. An affective disorder in zebrafish with mutation of the glucocorticoid receptor. Molecular Psychiatry. , (2013).
- Grone, B. P., Maruska, K. P. Divergent evolution of two corticotropin-releasing hormone (CRH) genes in teleost fishes. Frontiers in Neuroscience. , (2015).
- Fuller, P. J., Lim-Tio, S. S., Brennan, F. E. Specificity in mineralocorticoid versus glucocorticoid action. Kidney International. , (2000).
- Zhdanova, I. V. Sleep and its regulation in zebrafish. Reviews in the Neurosciences. 22 (1), 27-36 (2011).
- Patton, E. E., Zon, L. I. The art and design of genetic screens: zebrafish. Nature Reviews Genetics. , (2001).
- Duboué, E. R. E. R., Hong, E., Eldred, K. C. K. C., Halpern, M. E. M. E. Left Habenular Activity Attenuates Fear Responses in Larval Zebrafish. Current Biology. 27 (14), 2154-2162 (2017).
- Facchin, L., Duboue, E. R., Halpern, M. E. Disruption of Epithalamic Left-Right Asymmetry Increases Anxiety in Zebrafish. Journal of Neuroscience. 35 (48), 15847-15859 (2015).
- Øverli, Ø, Sørensen, C., Nilsson, G. E. Behavioral indicators of stress-coping style in rainbow trout: Do males and females react differently to novelty. Physiology and Behavior. , (2006).
- Levin, E. D., Bencan, Z., Cerutti, D. T. Anxiolytic effects of nicotine in zebrafish. Physiology & behavior. 90 (1), 54-58 (2007).
- Bencan, Z., Sledge, D., Levin, E. D. Buspirone, chlordiazepoxide and diazepam effects in a zebrafish model of anxiety. Pharmacology Biochemistry and Behavior. 94 (1), 75-80 (2009).
- Cachat, J., et al. Measuring behavioral and endocrine responses to novelty stress in adult zebrafish. Nature Protocols. 5 (11), 1786-1799 (2010).
- Mathuru, A. S., et al. Chondroitin fragments are odorants that trigger fear behavior in fish. Current Biology. , (2012).
- Alsop, D., Vijayan, M. The zebrafish stress axis: Molecular fallout from the teleost-specific genome duplication event. General and Comparative Endocrinology. , (2009).
- Evans, A. N., Liu, Y., MacGregor, R., Huang, V., Aguilera, G. Regulation of Hypothalamic Corticotropin-Releasing Hormone Transcription by Elevated Glucocorticoids. Molecular Endocrinology. , (2013).
- Fenoglio, K. A., Brunson, K. L., Avishai-Eliner, S., Chen, Y., Baram, T. Z. Region-specific onset of handling-induced changes in corticotropin- releasing factor and glucocorticoid receptor expression. Endocrinology. , (2004).
- Liposits, Z., et al. Ultrastructural localization of glucocorticoid receptor (GR) in hypothalamic paraventricular neurons synthesizing corticotropin releasing factor (CRF). Histochemistry. , (1987).
- Facchin, L., Duboué, E. R., Halpern, M. E. Disruption of epithalamic left-right asymmetry increases anxiety in Zebrafish. Journal of Neuroscience. 35 (48), (2015).
- Chin, J. S., et al. Convergence on reduced stress behavior in the Mexican blind cavefish. Developmental Biology. , (2018).
- Wong, K., et al. Analyzing habituation responses to novelty in zebrafish (Danio rerio). Behavioural Brain Research. 208 (2), 450-457 (2010).
- Matsunaga, W., Watanabe, E. Habituation of medaka (Oryzias latipes) demonstrated by open-field testing. Behavioural Processes. 85 (2), 142-150 (2010).
- Walker, C. Chapter 3 Haploid Screens and Gamma-Ray Mutagenesis. Methods in Cell Biology. , (1998).
- Rihel, J., et al. Zebrafish behavioral profiling links drugs to biological targets and rest/wake regulation. Science. 327, New York, N.Y. 348-351 (2010).
- Peal, D. S., Peterson, R. T., Milan, D. Small molecule screening in zebrafish. Journal of Cardiovascular Translational Research. , (2010).
- Murphey, R., Zon, L. Small molecule screening in the zebrafish. Methods. 39 (3), 255-261 (2006).
- Gammans, R. E., et al. Use of buspirone in patients with generalized anxiety disorder and coexisting depressive symptoms. A meta-analysis of eight randomized, controlled studies. Neuropsychobiology. 25 (4), 193-201 (1992).
- Maaswinkel, H., Zhu, L., Weng, W. The immediate and the delayed effects of buspirone on zebrafish (Danio rerio) in an open field test: A 3-D approach. Behavioural Brain Research. , (2012).
- Gebauer, D. L., et al. Effects of anxiolytics in zebrafish: Similarities and differences between benzodiazepines, buspirone and ethanol. Pharmacology Biochemistry and Behavior. , (2011).
- Maximino, C., et al. Fingerprinting of psychoactive drugs in zebrafish anxiety-like behaviors. PLoS ONE. , (2014).
- Horváth, J., Barkóczi, B., Müller, G., Szegedi, V. Anxious and nonanxious mice show similar hippocampal sensory evoked oscillations under urethane anesthesia: Difference in the effect of buspirone. Neural Plasticity. , (2015).
- Costall, B., Kelly, M. E., Naylor, R. J., Onaivi, E. S. Actions of buspirone in a putative model of anxiety in the mouse. Pharm Pharmacol. 40 (7), 494-500 (1988).
- Barros, M., Mello, E. L., Huston, J. P., Tomaz, C. Behavioral effects of buspirone in the marmoset employing a predator confrontation test of fear and anxiety. Pharmacology Biochemistry and Behavior. , (2001).
- Heinen-Kay, J. L., et al. Predicting multifarious behavioural divergence in the wild. Animal Behaviour. 121, 3-10 (2016).
- Thompson, R. R. J., Paul, E. S., Radford, A. N., Purser, J., Mendl, M. Routine handling methods affect behaviour of three-spined sticklebacks in a novel test of anxiety. Behavioural Brain Research. 306, 26-35 (2016).
- Hamilton, T. J., et al. Establishing zebrafish as a model to study the anxiolytic effects of scopolamine. Scientific Reports. , (2017).
- York, R. A., Fernald, R. D. The Repeated Evolution of Behavior. Frontiers in Ecology and Evolution. 4, 143(2017).
- Jakka, N. M., Rao, T. G., Rao, J. V. Locomotor behavioral response of mosquitofish (Gambusia affinis) to subacute mercury stress monitored by video tracking system. Drug and Chemical Toxicology. , (2007).
- Hu, C. K., Brunet, A. The African turquoise killifish: A research organism to study vertebrate aging and diapause. Aging Cell. , (2018).
- Maximino, C., et al. Measuring anxiety in zebrafish: A critical review. Behavioural Brain Research. 214 (2), 157-171 (2010).
- Maximino, C., Marques de Brito, T., Dias, C. A. G., Gouveia, A., Morato, S. Scototaxis as anxiety-like behavior in fish. Nature protocols. 5 (2), 209-216 (2010).
- Godwin, J., Sawyer, S., Perrin, F., Oxendine, S., Kezios, Z. Adapting the Open Field Test to assess anxiety related behavior in zebrafish. Zebrafish Protocols for Neurobehavioral Research. , 181-189 (2012).
- Agetsuma, M., et al. The habenula is crucial for experience-dependent modification of fear responses in zebrafish. Nature Neuroscience. 13 (11), 1354-1356 (2010).
- Valente, A., Huang, K. H., Portugues, R., Engert, F. Ontogeny of classical and operant learning behaviors in zebrafish. Learning and Memory. , (2012).
- Baker, M. R., Goodman, A. C., Santo, J. B., Wong, R. Y. Repeatability and reliability of exploratory behavior in proactive and reactive zebrafish, Danio rerio. Scientific Reports. , (2018).
- Friedrich, R. W., Genoud, C., Wanner, A. A. Analyzing the structure and function of neuronal circuits in zebrafish. Frontiers in Neural Circuits. , 7(2013).
- Friedrich, R. W., Jacobson, G. A., Zhu, P. Circuit Neuroscience in Zebrafish. Current Biology. 20 (8), (2010).
- Marquart, G. D., et al. A 3D Searchable Database of Transgenic Zebrafish Gal4 and Cre Lines for Functional Neuroanatomy Studies. Frontiers in Neural Circuits. , (2015).
- Randlett, O., et al. Whole-brain activity mapping onto a zebrafish brain atlas. Nature Methods. 12 (11), 1039-1046 (2015).
- Gupta, T., et al. Morphometric analysis and neuroanatomical mapping of the zebrafish brain. Methods. 1046 (18), 30011-30012 (2018).
- Marquart, G. D., et al. High-precision registration between zebrafish brain atlases using symmetric diffeomorphic normalization. GigaScience. , (2017).
- Ronneberger, O., et al. ViBE-Z: A framework for 3D virtual colocalization analysis in zebrafish larval brains. Nature Methods. , (2012).
- Subedi, A., et al. Adoption of the Q transcriptional regulatory system for zebrafish transgenesis. Methods. 66 (3), 433-440 (2014).
- Scheer, N., Campos-Ortega, J. A. Use of the Gal4-UAS technique for targeted gene expression in the zebrafish. Mechanisms of Development. 80 (2), 153-158 (1999).
- Chatterjee, D., Tran, S., Shams, S., Gerlai, R. A Simple Method for Immunohistochemical Staining of Zebrafish Brain Sections for c-fos Protein Expression. Zebrafish. , (2015).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten