A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
حجم استبعاد الكروماتوغرافيا لتحليل الغشاء الخارجي البكتيري فيسيكلي التجانس
In This Article
Summary
الحويصلات البكتيرية تلعب أدوارا هامة في الإمراض ولها تطبيقات التكنولوجيا الحيوية الواعدة. عدم التجانس من الحويصلات يعقد التحليل والاستخدام; لذلك ، من الضروري استخدام طريقة بسيطة قابلة للاستنساخ لفصل أحجام مختلفة من الحويصلات. هنا، ونحن نثبت استخدام الكروماتوغرافيا استبعاد الحجم لفصل الحويصلات غير المتجانسة التي تنتجها Aggregatibacter actinomycetemcomitans.
Abstract
يتكون جدار الخلية من البكتيريا السلبية الغرام من غشاء داخلي (السيتوبلازمي) والخارجي (OM)، مفصولة طبقة بيبتيدوغليكان رقيقة. طوال النمو ، يمكن للغشاء الخارجي أن يبلل لتشكيل حويصلات الغشاء الخارجي الكروي (OMVs). وتشارك هذه OMVs في العديد من الوظائف الخلوية بما في ذلك تسليم البضائع إلى الخلايا المضيفة والتواصل مع الخلايا البكتيرية. وفي الآونة الأخيرة، بدأ استكشاف الإمكانات العلاجية لمركبات OMVs، بما في ذلك استخدامها كلقاحات ومركبات لإيصال الأدوية. على الرغم من أن OMVs مشتقة من OM ، فقد كان من دواعي التقدير منذ فترة طويلة أن شحنة الدهون والبروتين في OMV تختلف ، في كثير من الأحيان بشكل كبير ، عن تلك الخاصة ب OM. وفي الآونة الأخيرة، تم اكتشاف أدلة على أن البكتيريا يمكن أن تطلق أنواعا متعددة من OMVs، وتوجد أدلة على أن الحجم يمكن أن يؤثر على آلية امتصاصها من قبل الخلايا المضيفة. ومع ذلك، فإن الدراسات في هذا المجال محدودة بسبب الصعوبات في الفصل بكفاءة بين OMVs غير المتجانسة الحجم. وقد جرت العادة على استخدام أجهزة الطرد المركزي المتدرجة للكثافة لهذا الغرض؛ ومع ذلك، تستغرق هذه التقنية وقتا طويلا ويصعب توسيع نطاقها. من ناحية أخرى ، فإن اللونيات استبعاد الحجم (SEC) أقل تعقيدا وتفسح المجال للارتقاء المستقبلي الضروري للاستخدام العلاجي ل OMVs. هنا، ونحن نصف نهج لجنة الأوراق المالية والبورصة التي تمكن من فصل استنساخها من الحويصلات غير متجانسة الحجم، وذلك باستخدام كحالة اختبار، OMVs التي تنتجها Aggregatibacter actinomycetemcomitans، والتي تتراوح في القطر من أقل من 150 نانومتر إلى أكثر من 350 نانومتر. نحن نظهر فصل OMVs "كبيرة" (350 نانومتر) و "صغيرة" (<150 نانومتر) OMVs، التي تم التحقق منها من خلال تشتت الضوء الديناميكي (DLS). نوصي تقنيات قائمة على لجنة الأوراق المالية والبورصة على تقنيات المستندة إلى DGC لفصل الحويصلات غير متجانسة الحجم بسبب سهولة استخدامها، والاستنساخ (بما في ذلك المستخدم إلى المستخدم)، وإمكانية لتوسيع نطاق.
Introduction
البكتيريا السلبية الغرام إطلاق الحويصلات المستمدة من الغشاء الخارجي، ما يسمى الحويصلات الغشاء الخارجي (OMVs)، في جميع أنحاء النمو. هذه OMVs تلعب أدوارا هامة في الاتصالات بين الخلايا، سواء بين البكتيريا والمضيف وكذلك بين الخلايا البكتيرية، من خلال حمل عدد من الجزيئات الحيوية الهامة، بما في ذلك الحمض النووي / الحمض النووي الريبي، والبروتينات، والدهون، وpeptidoglycans1،2. على وجه الخصوص ، تم دراسة دور OMVs في الإمراض البكتيري على نطاق واسع بسبب تخصيبها في بعض عوامل الفوعة والسموم3و4و5و6و7و8و9و10و11.
وقد تم الإبلاغ عن OMVs لتتراوح في الحجم من 20 إلى 450 نانومتر، اعتمادا على البكتيريا الأم ومرحلة النمو، مع عدة أنواع من البكتيريا الإفراج عن OMVs غير متجانسة الحجم8،12،13،14،والتي تختلف أيضا في تكوين البروتين وآلية دخول الخلية المضيفة12. H. pylori صدر OMVs تتراوح في القطر من 20 إلى 450 نانومتر، مع OMVs أصغر تحتوي على تكوين البروتين أكثر تجانسا من OMVs أكبر. الأهم من ذلك، لوحظ أن اثنين من السكان من OMVs أن استيعابها من قبل الخلايا المضيفة عن طريق آليات مختلفة12. وبالإضافة إلى ذلك، أثبتنا أن Aggregatibacter actinomycetemcomitans تطلق مجموعة من OMVs صغيرة (<150 نانومتر) جنبا إلى جنب مع مجموعة كبيرة (>350 نانومتر) OMVs، مع OMVs تحتوي على كمية كبيرة من السم البروتين يفرز، leukotoxin (LtxA)15. في حين أن دور عدم التجانس OMV في العمليات الخلوية مهم بشكل واضح ، فإن الصعوبات التقنية في فصل وتحليل مجموعات متميزة من الحويصلات حدت من هذه الدراسات.
بالإضافة إلى أهميتها في الإمراض البكتيري ، تم اقتراح OMVs للاستخدام في عدد من التطبيقات الحيوية ، بما في ذلك اللقاحات ومركبات توصيل الأدوية16و17و18و19و20. لاستخدامها في هذه النهج، مطلوب إعداد نظيفة وموحدة من الحويصلات. وبالتالي، فإن أساليب الفصل الفعالة والفعالة ضرورية.
الأكثر شيوعا، كثافة التدرج الطرد المركزي (DGC) يستخدم لفصل مجموعات الحويكل غير متجانسة الحجم من الحطام الخلوي، بما في ذلك flagellae والبروتينات المفرزة21؛ كما تم الإبلاغ عن طريقة كنهج لفصل السكان الفرعي OMV غير متجانسة الحجم12،13،14. ومع ذلك، DGC تستغرق وقتا طويلا، غير فعالة، ومتغيرة للغاية من مستخدم إلى مستخدم22، وبالتالي، ليست مثالية لتوسيع نطاق. في المقابل، يمثل اللونيات استبعاد الحجم (SEC) نهجا قابلا للتطوير والكفاءة ومتسقا لتنقية OMVs21و23و24. لقد وجدنا أن طويلة (50 سم)، والجاذبية تدفق، عمود لجنة الأوراق المالية والبورصة، مليئة هلام الترشيح المتوسطة كافية لتنقية بكفاءة وفصل السكان الفرعيين من OMVs. على وجه التحديد، استخدمنا هذا النهج لفصل A. actinomycetemcomitans OMVs إلى مجموعات فرعية "كبيرة" و "صغيرة"، وكذلك لإزالة التلوث بالبروتين والحمض النووي. وقد تم الانتهاء من تنقية في أقل من 4 ساعة، وتم الفصل الكامل بين السكان الفرعيين OMV وإزالة الحطام.
Protocol
1. إعداد المخازن المؤقتة
- لإعداد العازلة غسل ELISA، إضافة 3.94 غرام تريس قاعدة، 8.77 غرام NaCl، و 1 غرام ألبوم مصل البقري (BSA) إلى 1 لتر من الماء deionized (DI). إضافة 500 ميكرولتر بوليسوربات-20. ضبط درجة الحموضة إلى 7.2 باستخدام HCl أو NaOH.
- لإعداد المخزن المؤقت للحجب، أضف 3.94 غرام من قاعدة Tris و8.77 g NaCl و10 g BSA. إضافة 500 ميكرولتر بوليسوربات-20 إلى 1 لتر من مياه DI. ضبط درجة الحموضة إلى 7.2 باستخدام HCl أو NaOH.
- لإعداد العازلة elution (PBS)، إضافة 8.01 غرام NaCl، 2.7 g KCl، 1.42 غنا 2HPO4،و 0.24 غرام KH2PO4 إلى 1 L DI المياه. ضبط درجة الحموضة إلى 7.4 باستخدام HCl أو NaOH.
ملاحظة: يمكن إجراء حل 10x من هذا المخزن المؤقت والتخفيف مع مياه DI حسب الحاجة.
2. إعداد عينة OMV
- تنمو A. actinomycetemcomitans الخلايا إلى المرحلة الأسية المتأخرة (الكثافة البصرية في 600 نانومتر من 0.7). بيليه الخلايا عن طريق الطرد المركزي مرتين في 10،000 × ز في 4 درجة مئوية لمدة 10 دقيقة. تصفية supernatant من خلال مرشح 0.45 ميكرومتر.
- ركز الناسخ الخالي من البكتيريا باستخدام مرشحات خفض الوزن الجزيئية 50 كيلودا. طارد فائق المحلول المركز عند 105,000 × غرام عند 4 درجات مئوية لمدة 30 دقيقة.
- إعادة إنفاق بيليه في برنامج تلفزيوني والطرد الفائق مرة أخرى (105،000 × ز في 4 درجة مئوية لمدة 30 دقيقة.) Resuspend بيليه في 2 مل من برنامج تلفزيوني.
3. التعبئة العمود S-1000
- مزيج زجاجة الأسهم من هلام الترشيح المتوسطة مع قضيب يحرك الزجاج وتصب في زجاجة الحجم اللازم لملء العمود، بالإضافة إلى ما يقرب من 50٪ الزائدة (حوالي 135 مل). دع هذه الخرزات تجلس حتى تستقر ، ثم تخلع السائل الزائد. Resuspend الخرز في العازلة elution ، بحيث الحل النهائي هو ما يقرب من 70 ٪ (من حيث الحجم) هلام ، 30 ٪ العازلة. ديغا الحل تحت فراغ.
- قم بتركيب العمود الزجاجي عموديا باستخدام حامل حلقة وملء مع العازلة elution لتبلل جدران العمود. استنزاف المخزن المؤقت حتى يكون هناك فقط حوالي 1 سم من المخزن المؤقت المتبقية في العمود.
- دون خلق فقاعات، الخرز ماصة بعناية في العمود، وملء العمود إلى الأعلى. متابعة استنزاف المخزن المؤقت الزائد خلال هذه العملية. تأكد من عدم السماح للخرز تسوية تماما قبل إضافة حبات إضافية إلى أعلى العمود. يجب أن تكون معبأة العمود إلى ارتفاع حوالي 2 سم تحت الجزء السفلي من خزان العمود.
4. تحميل العينة وجمع الكسور
- ديغا العازلة elution تحت فراغ. اغسل العمود بحجمين عموديين (180 مل) من المخزن المؤقت لل elution.
- السماح المخزن المؤقت المتبقية إلى إدخال العمود بالكامل. بمجرد أن يصل العازل إلى أعلى طبقة الجل ، قم بتنقية عينة 2 مل تحتوي على OMVs (بتركيز دهون من حوالي 100 - 200 نانومول / لتر) على سطح الخرز ، مع الحرص على عدم إزعاج أي من الخرز في الجزء العلوي من العمود. السماح للعينة لدخول كامل هلام، وهذا هو، عندما لا يبقى السائل فوق طبقة هلام.
- بعناية وببطء إضافة العازلة elution على رأس العمود هلام. لا تزعج الطبقة العليا من الجل ، لأن هذا سيسبب تخفيف العينة.
- ضع أنبوبا واحدا سعة 50 مل أسفل العمود وافتح العمود. جمع أول 20 مل من eluent. إضافة إضافية elution المخزن المؤقت إلى أعلى العمود، بعناية، حسب الحاجة لضمان العمود غير جاف أبدا.
- ضع سلسلة من أنابيب 1.5 مل تحت العمود. بدء تشغيل العمود وجمع سلسلة من عينات 1 مل في كل أنبوب. كما يتم جمع العينات، مواصلة إضافة elution المخزن المؤقت إلى أعلى العمود، حسب الضرورة. كرر حتى يتم جمع 96 كسرا. أوقف العمود.
ملاحظة: يجب تخزين العينات عند -20 درجة مئوية للتخزين طويل الأجل أو 4 درجات مئوية للتخزين قصير الأجل حتى إجراء مزيد من التحليل. - لتنظيف العمود، قم بتشغيل وحدة تخزين عمود واحد (90 مل) من 0.1 M NaOH من خلال العمود. تشغيل وحدتي تخزين عمود (180 مل) من المخزن المؤقت elution خلال العمود.
5. تحليل العينة
- لقياس تركيز الدهون في كل جزء، ماصة 50 ميكرولتر من كل جزء في بئر واحد من لوحة 96 جيدا. إلى كل بئر، أضف 2.5 ميكرولتر من صبغة الليبوفيلي. حضانة لمدة 15 s. قياس كثافة الفلورسينس على قارئ لوحة مع الطول الموجي الإثارة من 515 نانومتر وطول موجي انبعاث 640 نانومتر. لحساب جزء من جميع الدهون في كل عينة، مجموع كل من كثافة الانبعاثات وتقسيم كل كثافة الفردية على المجموع.
- لقياس تركيز بروتين معين، ماصة 100 ميكرولتر من كل جزء في بئر واحد من لوحة المناعة ELISA. حضانة عند 25 درجة مئوية لمدة 3 ساعة.
- واشجب العينات. إضافة 200 ميكرولتر من العازلة غسل ELISA إلى كل بئر وdecant. كرر أربع مرات لما مجموعه خمسة يغسل.
- إضافة 200 ميكرولتر من العازلة حجب إلى كل بئر واحتضان لمدة 1 ساعة في 25 درجة مئوية. (ديكانت)
- حضانة لوحات مع 100 ميكرولتر حجب العازلة بالإضافة إلى الأجسام المضادة الأولية (1:10،000 للأجسام المضادة النقية؛ 1:10 للأجسام المضادة غير المنقوطة) بين عشية وضحاها في 4 درجة مئوية. (ديكانت)
- إضافة 200 ميكرولتر من العازلة غسل ELISA إلى كل بئر وdecant. كرر أربع مرات لما مجموعه خمسة يغسل.
- أضف 100 ميكرولتر من عازل غسل ELISA بالإضافة إلى الأجسام المضادة الثانوية (1:30,000) لكل بئر. حضانة لمدة 1 ساعة في 25 درجة مئوية.
- إضافة 200 ميكرولتر من العازلة غسل ELISA إلى كل بئر وdecant. كرر أربع مرات لما مجموعه خمسة يغسل.
- إضافة 100 ميكرولتر من الحل 3,3',5,5'-tetramethylbenzidine (TMB) حل خطوة واحدة واحتضان لمدة 15-30 دقيقة أو حتى يتطور اللون الأزرق. إيقاف رد فعل TMB مع 50 ميكرولتر من حل التوقف.
- على قارئ لوحة، وقراءة امتصاص كل بئر على طول موجي من 450 نانومتر.
- لقياس تركيز البروتين الكلي، سجل الامتصاص عند طول موجي يبلغ 280 نانومتر (A280)من كل كسر، باستخدام مطياف الأشعة فوق البنفسجية.
يظهر تخطيطي للبروتوكول في الشكل 1.
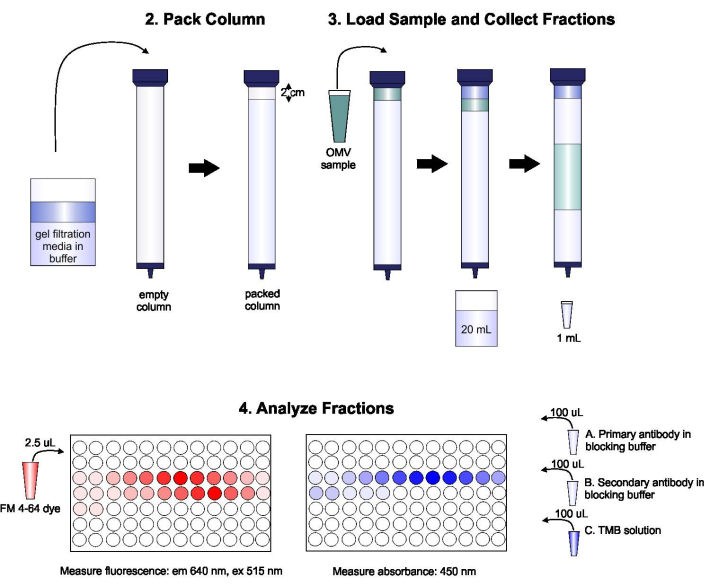
الشكل 1: تخطيطي لإجراءات لجنة الأوراق المالية والبورصة. ومعبأة العمود مع مزيل الغاز هلام الترشيح المتوسطة بعناية لتجنب الفقاعات والقطع، ثم غسلها مع اثنين من أحجام العمود من العازلة elution. بعد ذلك ، يتم إخراج العينة بعناية إلى الجزء العلوي من الجل ، دون تعطيل تعبئة الجل. يتم فتح العمود وتشغيله حتى تدخل العينة الجل بالكامل. عند هذه النقطة، يتم وضع المخزن المؤقت في أعلى العمود، ويتم تجميع أول 20 مل من eluate. بعد ذلك، يتم جمع سلسلة من كسور 1 مل. ثم يتم وضع هذه الكسور في لوحة من 96 بئرا أو 96 جيدا المناعي لوحة لتحليل محتوى الدهون والبروتين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
ويبين الشكل 2 النتائج التمثيلية لهذه الطريقة. OMVs التي تنتجها A. actinomycetemcomitans سلالة JP2 تم تنقيتها لأول مرة من الثقافة الفائقة باستخدام الطرد الفائق15. وجدنا سابقا أن هذه السلالة تنتج مجموعتين من OMVs، واحد مع أقطار حوالي 300 نانومتر وواحد مع أقطار حوالي 100 نانومتر...
Discussion
هنا ، قدمنا بروتوكولا للفصل البسيط والسريع والتكرار بين الخلايا الفرعية البكتيرية OMV. على الرغم من أن هذه التقنية مستقيمة نسبيا إلى الأمام، هناك بعض الخطوات التي يجب تنفيذها بعناية فائقة لضمان حدوث فصل فعال في العمود. أولا، من الضروري أن يتم تحميل الجل في العمود بعناية وببطء لتجنب فقاعات ?...
Disclosures
ولا يوجد لدى أصحاب البلاغ تضارب في المصالح يبلغون عنه.
Acknowledgements
تم تمويل هذا العمل من قبل المؤسسة الوطنية للعلوم (1554417) والمعاهد الوطنية للصحة (DE027769).
Materials
| Name | Company | Catalog Number | Comments |
| 1-Step Ultra TMB-ELISA | Thermo Scientific | 34028 | |
| Amicon 50 kDa filters | Millipore Sigma | UFC905024 | |
| Bovine Serum Albumin (BSA) | Fisher Scientific | BP9704-100 | |
| ELISA Immuno Plates | Thermo Scientific | 442404 | |
| FM 4-64 | Thermo Scientific | T13320 | 1.5 x 50 cm |
| Glass Econo-Column | BioRad | 7371552 | |
| Infinite 200 Pro Plate Reader | Tecan | ||
| Potassium Chloride (KCl) | Amresco (VWR) | 0395-500G | |
| Potassium Phosphate Monobasic Anhydrous (KH2PO4) | Amresco (VWR) | 0781-500G | |
| Sephacryl S-1000 Superfine | GE Healthcare | 17-0476-01 | |
| Sodium Chloride (NaCl) | Fisher Chemical | S271-3 | |
| Sodium Phosphate Dibasic Anhydrous (Na2HPO4) | Amresco (VWR) | 0404-500G | |
| Tris Base | VWR | 0497-1KG | |
| Tween(R) 20 | Acros Organics | 23336-2500 |
References
- Kuehn, M. J., Kesty, N. C. Bacterial outer membrane vesicles and the host-pathogen interaction. Genes and Development. 19, 2645-2655 (2005).
- Kulp, A., Kuehn, M. J. Biological functions and biogenesis of secreted bacterial outer membrane vesicles. Annual Reviews Microbiology. 64, 163-184 (2010).
- Kato, S., Kowashi, Y., Demuth, D. R. Outer membrane-like vesicles secreted by Actinobacillus actinomycetemcomitans are enriched in leukotoxin. Microbial Pathogenesis. 32 (1), 1-13 (2002).
- Nice, J. B., et al. Aggregatibacter actinomycetemcomitans leukotoxin is delivered to host cells in an LFA-1-independent manner when associated with outer membrane vesicles. Toxins. 10 (10), 414 (2018).
- Haurat, M. F., et al. Selective sorting of cargo proteins into bacterial membrane vesicles. Journal of Biological Chemistry. 286 (2), 1269-1276 (2011).
- Horstman, A. L., Kuehn, M. J. Enterotoxigenic Escherichia coli secretes active heat-labile enterotoxin via outer membrane vesicles. The Journal of Biological Chemistry. 275 (17), 12489-12496 (2000).
- Wai, S. N., et al. Vesicle-mediated export and assembly of pore-forming oligomers of the Enterobacterial ClyA cytotoxin. Cell. 115, 25-35 (2003).
- Balsalobre, C., et al. Release of the Type I secreted α-haemolysin via outer membrane vesicles from Escherichia coli. Molecular Microbiology. 59 (1), 99-112 (2006).
- Donato, G. M., et al. Delivery of Bordetella pertussis adenylate cyclase toxin to target cells via outer membrane vesicles. FEBS Letters. 586, 459-465 (2012).
- Kim, Y. R., et al. Outer membrane vesicles of Vibrio vulnificus deliver cytolysin-hemolysin VvhA into epithelial cells to induce cytotoxicity. Biochemical and Biophysical Research Communications. 399, 607-612 (2010).
- Maldonado, R., Wei, R., Kachlany, S. C., Kazi, M., Balashova, N. V. Cytotoxic effects of Kingella kingae outer membrane vesicles on human cells. Microbial Pathogenesis. 51 (1-2), 22-30 (2011).
- Turner, L., et al. Helicobacter pylori outer membrane vesicle size determines their mechanisms of host cell entry and protein content. Frontiers in Immunology. 9, 1466 (2018).
- Zavan, L., Bitto, N. J., Johnston, E. L., Greening, D. W., Kaparakis-Liaskos, M. Helicobacter pylori growth stage determines the size, protein composition, and preferential cargo packaging of outer membrane vesicles. Proteomics. 19 (1-2), 1800209 (2019).
- Rompikuntal, P. K., et al. Perinuclear localization of internalized outer membrane vesicles carrying active cytolethal distending toxin from Aggregatibacter actinomycetemcomitans. Infections and Immunity. 80 (1), 31-42 (2012).
- Nice, J. B., et al. Aggregatibacter actinomycetemcomitans leukotoxin is delivered to host cells in an LFA-1-independent manner when associated with outer membrane vesicles. Toxins. 10 (10), 414 (2018).
- Stevenson, T. C., et al. Immunization with outer membrane vesicles displaying conserved surface polysaccharide antigen elicits broadly antimicrobial antibodies. Proceedings of the National Academy of Sciences. 115 (14), 3106-3115 (2018).
- Gujrati, V., et al. Bioengineered bacterial outer membrane vesicles as cell-specific drug-delivery vehicles for cancer therapy. ACS Nano. 8 (2), 1525-1537 (2014).
- Huang, W., et al. Development of novel nanoantibiotics using an outer membrane vesicle-based drug efflux mechanism. Journal of Controlled Release. 317, 1-22 (2020).
- Chen, D. J., et al. Delivery of foreign antigens by engineered outer membrane vesicle vaccines. Proceedings of the National Academy of Sciences. 107 (7), 3099-3104 (2010).
- Chen, L., et al. Outer membrane vesicles displaying engineered glycotopes elicit protective antibodies. Proceedings of the National Academy of Sciences. 113 (26), 3609-3618 (2016).
- Singorenko, P. D., et al. Isolation of membrane vesicles from prokaryotes: A technical and biological comparison reveals heterogeneity. Journal of Extracellular Vesicles. 6 (1), 1324731 (2017).
- Zeringer, E., Barta, T., Li, M., Vlassov, A. V. Strategies for isolation of exosomes. Cold Spring Harbor Protocols. 2015 (4), 319-323 (2015).
- Benedikter, B. J., et al. Ultrafiltration combined with size exclusion chromatography efficiently isolates extracellular vesicles from cell culture media for compositional and functional studies. Science Reports. 7 (1), 15297 (2017).
- Mol, E. A., Goumans, M. J., Doevendans, P. A., Sluijter, J. P. G., Vader, P. Higher functionality of extracellular vesicles isolated using size-exclusion chromatography compared to ultracentrifugation. Nanomedicine. 13 (6), 2061-2065 (2017).
- Lally, E. T., Golub, E. E., Kieba, I. R. Identification and immunological characterization of the domain of Actinobacillus actinomycetemcomitans leukotoxin that determines its specificity for human target cells. Journal of Biological Chemistry. 269 (49), 31289-31295 (1994).
- Chang, E. H., Giaquinto, P., Huang, J., Balashova, N. V., Brown, A. C. Epigallocatechin gallate inhibits leukotoxin release by Aggregatibacter actinomycetemcomitans by promoting association with the bacterial membrane. Molecular Oral Microbiology. 35 (1), 29-39 (2020).
- Klimentová, J., Stulík, J. Methods of isolation and purification of outer membrane vesicles from gram-negative bacteria. Microbiological Research. 170, 1-9 (2015).
- Dauros Singorenko, P., et al. Isolation of membrane vesicles from prokaryotes: a technical and biological comparison reveals heterogeneity. Journal of Extracellular Vesicles. 6 (1), 1324731 (2017).
- Monguió-Tortajada, M., Gálvez-Montón, C., Bayes-Genis, A., Roura, S., Borràs, F. E. Extracellular vesicle isolation methods: rising impact of size-exclusion chromatography. Cellular and Molecular Life Sciences. 76 (12), 2369-2382 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved