Method Article
عزل واستزراع الخلايا الجذعية الوسيطة لنخاع العظم من الفك السفلي البشري
* These authors contributed equally
In This Article
Summary
يصف هذا البروتوكول إجراء فعالا لعزل واستزراع الخلايا الجذعية الوسيطة المشتقة من نخاع عظم الفك السفلي البشري باستخدام طريقة الالتصاق بنخاع العظم الكامل. تم تحديد الخلايا المستزرعة عن طريق فحوصات تكاثر الخلايا ، وقياس التدفق الخلوي ، وتحريض التمايز متعدد الأنالات.
Abstract
أظهرت الخلايا الجذعية الوسيطة البشرية (hMSCs) إمكانات كبيرة في تجديد العظام وتعديل المناعة وعلاج الأمراض المزمنة المقاومة للحرارة. تم العثور على أصول مختلفة للحصول على hMSCs مؤخرا ، بينما كان نخاع العظم لا يزال يعتبر المصدر الرئيسي. تتميز الخلايا الجذعية الجذعية المشتقة من نخاع العظام (BMSCs) من مواقع عظام المتبرعين المختلفة بخصائص مميزة بسبب العوامل البيئية الدقيقة. أظهرت الدراسات أن BMSCs من عظام الوجه والفكين قد يكون لها قدرات تكاثرية وعظمية أكبر من BMSCs من العظام الطويلة أو القمة الحرقفية. واعتبرت BMSCs للوجه والفكين أكثر ملاءمة للعلاج بالخلايا الجذعية في أنسجة الوجه والفكين. كان الفك السفلي ، وخاصة منطقة الرمال الصاعدة ذات النخاع الكافي ، موقعا ممكنا للمانحين لحصاد BMSCs. وصفت هذه الدراسة بروتوكولا لحصاد وعزل وزراعة الخلايا الجذعية الجذعية المشتقة من نخاع عظم الفك السفلي البشري (hmBMSCs). علاوة على ذلك ، تم إجراء التنميط المناعي ل hmBMSCs ، ومقايسات الانتشار ، والحث في المختبر للتمايز العظمي ، والشحمية ، والغضروفية لتحديد الخلايا المستنبتة. يمكن أن يساعد تطبيق هذا البروتوكول الباحثين في الحصول بنجاح على ما يكفي من hmBMSCs عالية الجودة ، وهو أمر ضروري لمزيد من الدراسات حول الوظيفة البيولوجية والتأثيرات البيئية الدقيقة والتطبيقات السريرية.
Introduction
الخلايا الجذعية الوسيطة البشرية (hMSCs) هي خلايا متعددة القدرات يمكن تمييزها إلى أنواع مختلفة من الخلايا ، مثل الخلايا العظمية والخلايا الشحمية والخلايا الغضروفية من سلالة الأديم المتوسط ، وخلايا الكبد ، وخلايا البنكرياس من سلالة الأديم الباطن ، والخلايا العصبية من سلالة الأديمالظاهر 1. وبالتالي ، أظهرت hMSCs إمكانات كبيرة في تجديد الأنسجة. علاوة على ذلك ، فإن hMSCs هي معدلات مناعية قوية يمكنها تنظيم البيئة المكروية في الأنسجة المضيفة وعلاج الأمراض المقاومة للحرارة المزمنةبشكل فعال 2. لذلك ، تم استخدام hMSCs على نطاق واسع في العلاج الخلوي للدراسات السريرية. وبالتالي ، من المهم الحصول على ما يكفي من hMSCs بجودة عالية بطريقة مريحة بنجاح.
منذ أن تم الإبلاغ عن الخلايا الجذعية الجذعية الجذعية لأول مرة في نخاع العظام ، تم العثور على العديد من مصادر الخلايا الجذعية الجذعية البديلة ، مثل الأنسجة الدهنية ، والسائل الزليلي ، والعضلات الهيكلية ، والسائل الأمنيوسي ، وبطانة الرحم ، وأنسجة الأسنان ، والحبل السري1،3. ومع ذلك ، يظل نخاع العظم هو المصدر الرئيسي ل hMSCs لمعظم الدراسات قبل السريرية والسريرية ، ويتم أخذ الخلايا الجذعية الجذعية المشتقة من نخاع العظام (BMSCs) كمعيار لمقارنة الخلايا الجذعية الجذعية من مصادرأخرى 4. لسنوات ، كانت القمة الحرقفية أو العظام الطويلة (الظنبوب وعظم الفخذ) هي المواقع التشريحية الأكثر شيوعا للحصول على نخاع العظم1،5. ومع ذلك ، فإن القمة الحرقفية أو العظام الطويلة لها أصول جنينية وأنماط نمو مختلفة مقارنة بعظام الوجه والفكين5،6. أثبتت العديد من الدراسات السريرية والمخبرية والتنموية أن BMSCs من أصول مختلفة أظهرت خصائص خاصة بالموقع ، وأن BMSCs المطعمة تحتفظ بخصائص الموقع المتبرع بعد الزرع في الموقع المتلقي5،6،7،8،9. من منظور الأصل التنموي ، تنشأ أنسجة الوجه والفكين ، مثل الفك العلوي ، والفك السفلي ، والعاج ، والعظام السنخية ، واللب ، وأربطة اللثة ، حصريا من خلايا القمة العصبية. في المقابل ، تتكون القمة الحرقفية والعظام الطويلة بواسطة الأديم المتوسط. بالإضافة إلى ذلك ، يتم إنشاء الفك السفلي عن طريق التعظم الغشائي ، بينما تخضع الهياكل العظمية المحورية والزائدية للتعظم الغضروفي. علاوة على ذلك ، بالمقارنة مع القمة الحرقفية والعظام الطويلة ، أظهرت بعض الدراسات السريرية أن hMSCs المشتقة من نخاع عظم الوجه والفكين لديها نشاط تكاثري خلوي أفضل وقدرة على التمايز6،8. لذلك ، من المتوقع أن تكون BMSCs من مناطق الوجه والفكين خيارا أفضل لتجديد أنسجة الوجه والفكين وعلاج الأمراض المقاومة للوجه والفكين المزمنة.
يتكون الفك السفلي من عظام قشرية سميكة من طبقتين مع نخاع عظمي إسفنجي بينهما حتى يتمكن من تحميل قوة المضغ. لذلك ، عادة ما يستخدم الفك السفلي ، وخاصة منطقة الرمال الصاعدة ، كموقع مانح للحصول على ترقيع عظمي ذاتي في جراحات الوجه والفكين10. وفي العمليات الجراحية مثل الفك السفلي السهمي والانقسام العظمي وقطع العظم وعملية تصغير زاوية الفك السفلي ، يجب إزالة أجزاء من الفك السفلي القشري والعظم الإسفنجي لتحقيق محيط وجه ممتع. يمكن أن تكون تلك العظام الإسفنجية المهملة موردا محتملا ل hMSCs. ومع ذلك ، وصفت بعض الدراسات المنشورة بروتوكول العزل السريع واستزراع الخلايا الجذعية الجذعية المشتقة من نخاع عظم الفك السفلي البشري (hmBMSCs).
تستخدم الدراسة الحالية طريقة معدلة للالتصاق بنخاع العظم الكامل لإدخال بروتوكول موثوق به وقابل للتكرار لعزل واستزراع hmBMSCs. وتم تحديد الخلايا الجذعية عن طريق التنميط المناعي لقياس التدفق الخلوي للخلايا الجذعية ، ومقايسات التكاثر ، وتحريض التمايز متعدد الأنساب قد يساعد تطبيق هذا الإجراء القياسي الباحثين في الحصول على الخلايا الجذعية الجذعية المشتقة من نخاع عظم الفك السفلي البشري عالية الجودة ، وهو أمر مهم في مزيد من الدراسات حول الوظيفة البيولوجية والتأثيرات البيئية الدقيقة والتطبيقات السريرية.
Protocol
تمت الموافقة على إجراء حصاد عينات عظام الفك السفلي البشري من قبل لجنة الأخلاقيات التابعة لكلية طب الأسنان ، الجامعة الطبية العسكرية الرابعة. اتبعت الدراسة المبادئ التوجيهية الأخلاقية لإعلان هلسنكي لعام 1975. تم إبلاغ جميع الجهات المانحة لهذه الدراسة بالمخاطر المحتملة وأهداف الدراسة. تراوحت أعمار المتبرعين بين 18-40 عاما ، ولم يكن هناك تحيز بين الجنسين. تم الحصول على موافقة خطية من جميع المشاركين من البشر.
1. التحضير للجراحة
- حدد المتبرع المناسب.
- حدد المرضى كمتبرعين يخططون للخضوع لعمليات جراحية مثل انتكاسة الفك السفلي بعد قطع عظم الراموس السهمي وعملية تجميل تصغير زاوية الفك السفلي.
- تحضير محلول الحفظ.
- استكمل 30 مل من محلول ملحي عازل للفوسفات (1x PBS) مع 1٪ بنسلين وستربتومايسين في أنبوب طرد مركزي معقم وخالي من الإنزيم سعة 50 مل في اليوم السابق للجراحة. قم بتخزينه في الثلاجة على حرارة 4 درجات مئوية.
- في يوم الجراحة ، ضع أنبوب الطرد المركزي مع محلول الحفظ في صندوق ثلج واحتفظ به في غرفة العمليات قبل ساعة واحدة من الجراحة.
- تعقيم الأدوات لعزل نخاع العظم في اليوم السابق للجراحة بما في ذلك المقص والملاقط والسكاكين عند ضغط 120 درجة مئوية وضغط 0.27 ميجا باسكال لمدة 20 دقيقة.
- تحضير وسط استزراع α-MEM عن طريق خلط الحد الأدنى من ألفا المتوسط الأساسي (α-MEM) مع 10٪ مصل بقري للجنين (FBS) و 1٪ بنسلين وستربتومايسين.
- قم بإعداد وسط تمايز العظم عن طريق خلط وسط استزراع α-MEM مع 50 ملي مولار من حمض الأسكوربيك ، و 10 ملي مولار β جلسرين فوسفات ، و 0.1 ملي مولار ديكساميثازون (انظر جدول المواد).
- تحضير وسط التمايز الشحمي A عن طريق خلط وسط استزراع α-MEM مع 1 ملي مولار ديكساميثازون ، 0.2 ملي مولار إندوميتاسين ، 10 ميكروغرام / مل من الأنسولين ، و 0.5 ملي مولار 3-إيزوبوتيل -1-ميثيل زانثين (IBMX) (انظر جدول المواد).
- تحضير وسط التمايز الشحمي B عن طريق خلط وسط زراعة α-MEM مع 10 ميكروغرام / مل من الأنسولين.
- قم بإعداد وسط التمايز الغضروفي عن طريق خلط وسط النسر المعدل من Dulbecco مع نسبة عالية من الجلوكوز (HG-DMEM) و 100 نانومتر من ديكساميثازون ، و 100 جم / مل من بيروفات الصوديوم ، و 25 مجم / مل من فيتامين C ، و 40 مجم / مل من البرولين ، و 10 نانوغرام / مل من TGF-β3 ، و 1٪ من ITS (انظر جدول المواد).
ملاحظة: يمكن تحضير وسط التمايز العظمي والشحمي والغضروفي داخليا ، كما هو مذكور أعلاه. ومع ذلك، استخدمت في هذه الدراسة مجموعات متوفرة تجاريا (انظر جدول المواد).
2. حصاد عينة عظم الفك السفلي البشري
- قبل الجراحة ، ادرس بعناية صور المسح المقطعي المحوسب ثلاثي الأبعاد وتخطيط المحاكاة الجراحية للمتبرعين (الشكل 1).
- حدد موقع الفك السفلي الذي يخطط المتبرع لإزالته في الجراحة وهو غني بالعظام الإسفنجية مع نخاع العظم كموقع متبرع.
- تطهير المريض ولفه قبل العملية.
- قم باستئصال موقع المتبرع المحدد للفك السفلي باستخدام شفرة العظم بالموجات فوق الصوتية (انظر جدول المواد) ، وتجنب إصابة العصب السنخي السفلي وضعف عظام المتبرع.
- ضع عينات عظم الفك السفلي في محلول الحفظ (الخطوة 1.2) في أسرع وقت ممكن.
- ضع محلول الحفظ مع عينات العظام في صندوق ثلج حتى يبدأ عزل الخلايا الجذعية الجذعية في المختبر.
ملاحظة: يجب البدء في عزل الخلايا الجذعية الجذعية في أقرب وقت ممكن بعد الحصاد للحفاظ على صلاحية الخلايا. إذا تعذر إجراء عزل الخلايا الجذعية الجذعية على الفور ، فيمكن تخزين محلول الحفظ مع عينات العظام في صندوق ثلج أو تبريده عند 4 درجات مئوية لمدة أقصاها ساعتين.
3. عزل وزراعة mBMSCs البشرية
- أخرج عينات العظام من محلول الحفظ واغمسها في 1x PBS مع 1٪ بنسلين وستربتومايسين لمدة 5 دقائق على مقعد نظيف من خزانة التدفق الصفيحي.
ملاحظة: تهدف هذه الخطوة إلى غسل الجلطة الدموية وسوائل الفم المتبقية والقضاء على الكائنات الحية الدقيقة لأن الفم ليس بيئة معقمة تماما. قبل عزل الخلايا وزراعتها ، اغسل اليدين وطهرها بالكحول وارتد قفازات وأقنعة معقمة يمكن التخلص منها. - نظف الأنسجة الرخوة الملتصقة ولطخة الدم على سطح العظام باستخدام شاش مبلل معقم.
- املأ طبق ثقافة معقم مقاس 6 سم ب 5 مل من وسط زراعة α-MEM.
- ضع العظم في طبق الثقافة المعقم وقطعه إلى قطع صغيرة (حوالي 2-3 مم3 حجم) بسكين معقم أو مقص.
ملاحظة: أمسك عينات العظام بالملاقط لتجنب قطع الإصبع. - استنشاق وسط ثقافة α-MEM في طبق الاستزراع باستخدام حقنة معقمة يمكن التخلص منها سعة 1 مل.
- أدخل إبرة المحقنة بوسط ثقافة α-MEM في عمق تجويف نخاع العظم لقطع عينة العظام الإسفنجية.
- اغسل نخاع العظم في طبق الثقافة باستخدام المحقنة من جميع جوانب قطع عينة العظام ، على الأقل 5-10 مرات لكل جانب.
- كرر الخطوات 3.5-3.7 حتى تتحول جميع قطع عينة العظام إلى اللون الأبيض النقي لضمان مسح أكبر قدر ممكن من نخاع العظم في وسط الزراعة.
ملاحظة: يجب التحكم في إجمالي وقت التشغيل للخطوات المذكورة أعلاه من 3.1 إلى 3.8 في غضون 30 دقيقة على الجليد. - قم بإزالة وتخلص من جميع قطع عينة العظام باستخدام الملقط. قم بإزالة الأجزاء الصغيرة الأخرى باستخدام مرشح خلية بحجم المسام 70 ميكرومتر.
- رج طبق المزرعة برفق لجعل الخلايا المتدفقة موزعة بالتساوي.
- ضع طبق المزرعة في حاضنة خلية وزرع الخلايا عند 37 درجة مئوية في جو مرطب بنسبة 5٪ ثاني أكسيدالكربون 2.
- في اليوم الثالث من الثقافة ، تحقق من مورفولوجيا الخلية وحالة نموها تحت المجهر الضوئي. إزالة نصف وسط الثقافة مع عدم وجود خلايا ملتصقة وجزء من الأنسجة; أضف 3 مل من وسط استزراع α-MEM الطازج.
- في اليوم الثقافي 7 ، قم بإزالة جميع وسط الاستزراع وأضف 5 مل من وسط الاستزراع الطازج α-MEM.
- بعد ذلك ، قم بتحديث وسيط ثقافة α-MEM كل 3 أيام.
- تحقق من مورفولوجيا الخلية ونموها كل يوم.
ملاحظة: عندما تصل مزارع الخلايا الأولية (P0) إلى 70٪ -80٪ من التقاء بعد 7-10 أيام من الثقافة ، قم بإجراء مرور الخلية.
4. مرور الخلية
- عند التقاء 70٪ -80٪ ، قم بإزالة كل وسط زراعة خلايا P0. اغسل طبق الثقافة برفق باستخدام 1x PBS مرتين لتنظيف وسط الثقافة المتبقي.
- أضف 1 مل من 0.25٪ تريبسين مع 0.02٪ EDTA إلى طبق المزرعة لهضم الخلايا. رج طبق المزرعة برفق للتأكد من توزيع التربسين بالتساوي. ضع طبق الثقافة على حرارة 37 درجة مئوية لمدة 3 دقائق.
- افحص الخلايا تحت المجهر. عندما تنقبض 70٪ -80٪ من الخلايا وتقريبها ، أضف 2 مل من وسط زراعة α-MEM لإيقاف التفاعل الهضمي.
- انفخ سطح الطبق برفق عدة مرات باستخدام ماصة لتفجير الخلايا.
- انقل تعليق الخلية إلى أنبوب طرد مركزي سعة 15 مل. جهاز الطرد المركزي لتعليق الخلية عند 200 × جم لمدة 5 دقائق في درجة حرارة الغرفة.
- تخلص من المادة الطافية وأعد تعليق الخلايا باستخدام وسط زراعة α-MEM. بذور P0 خلايا في قوارير الاستزراع (25 سم) للتمدد بنسبة تقسيم 1: 2. كانت خلايا المرور الأولى تسمى خلايا P1.
- عندما تصل خلايا P1 إلى التقاء 70٪ -80٪ ، كرر مرور الخلية باتباع الخطوات من 4.1-4.6. كانت خلايا الجيل الثاني تسمى خلايا P2.
- قم بتغيير نسبة تقسيم التمدد إلى 1: 3 بعد مرور خلية الجيل الثالث.
- استخدم خلايا P3 إلى P5 لإجراء تجارب تحديد الهوية.
5. تحليل قياس التدفق الخلوي
- استيعاب P3 إلى P5 MSCs باستخدام 0.25٪ تربسين مع 0.02٪ EDTA ، باتباع الخطوات 4.1-4.5.
- تخلص من المادة الطافية وأعد تعليق الخلايا في 1x PBS بتركيز 1 × 106 خلايا / مل.
- انقل الخلايا إلى أنابيب الطرد المركزي الدقيقة مع 100 ميكرولتر من تعليق الخلية لكل أنبوب.
- أضف الأجسام المضادة للإنسان أحادية النسيلة للفأر ذات العلامات المناعية إلى أنابيب الطرد المركزي الدقيقة.
ملاحظة: بالنسبة للدراسة الحالية ، تم استخدام الأجسام المضادة المترافقة ب Phycoerythrin (PE) ضد CD45 ، والأجسام المضادة المترافقة بالفلورسين - الأيزوثيوسيانات (FITC) ضد CD90 و CD34 و CD444،11 (انظر جدول المواد) ، وكانت تخفيفات الأجسام المضادة كلها 1: 100. يجب أن تتبع تخفيفات الأجسام المضادة تعليمات الشركة المصنعة. سيتم تقديم PBS كمراقبة. - احتضان الأجسام المضادة والتحكم في PBS في درجة حرارة الغرفة في الظلام لمدة 30 دقيقة.
- جهاز الطرد المركزي للأنابيب عند 800 × جم لمدة 5 دقائق في درجة حرارة الغرفة. تخلص من التعليق وأعد تعليق الخلايا في 0.5 مل من 1x PBS. كرر هذه الخطوة مرتين.
- قم بتحميل الأنابيب في مقياس التدفق الخلوي (انظر جدول المواد). احسب أرقام الخلايا المسماة بالفلورة باستخدام مقياس التدفق الخلوي بحد أدنى 10,000 حدث.
ملاحظة: من الأفضل بدء عملية تعداد خلايا مقياس التدفق الخلوي مباشرة بعد إجراء وضع العلامات على التألق المناعي. إذا لم يكن الأمر كذلك ، فيجب تثبيت الخلايا في 1٪ بارافورمالدهايد ، وتخزينها عند 4 درجات مئوية في الظلام ، وإنهاء العملية في غضون 24 ساعة.
6. فحص تكاثر الخلايا
- استخدم خلايا P3 لإجراء فحص تكاثر الخلايا. قم باستيعاب الخلايا الجذعية الجذعية P3 التي تحتوي على 0.25٪ من التربسين ، باتباع الخطوات 4.1-4.5.
- تخلص من المادة الطافية وأعد تعليق الخلايا باستخدام وسط زراعة α-MEM.
- احسب رقم الخلية باستخدام مقياس كثافة الدم ، وبذر الخلايا على ألواح ثقافة 96 بئرا بكثافة 3 × 103 خلايا لكل بئر ، بإجمالي 35 بئرا ، 5 آبار لكل يوم عد (في اليوم 1 ، 2 ، 3 ، 4 ، 5 ، 6 ، 7). قم بتحديث وسط ثقافة الخلايا كل 3 أيام.
- في كل يوم عد ، تخلص من وسط استزراع α-MEM من الآبار الخمسة المعينة ليوم عد معين ، ثم أضف 100 ميكرولتر من وسط الاستزراع و 10 ميكرولتر من محلول CCK-8 (انظر جدول المواد). احتضان عند 37 درجة مئوية لمدة 1 ساعة.
- ضع لوحات الاستزراع في مقياس الطيف الضوئي المجهري (انظر جدول المواد) وقم بقياس قيمة الكثافة الضوئية لخمسة آبار لكل يوم عد (إجمالي 7 أيام عد) بطول موجي يبلغ 450 نانومتر. استخدم خمسة آبار من وسط الثقافة بدون خلايا كفراغات.
- سجل قيمة الكثافة الضوئية لكل بئر ، واحسب متوسط القيمة والانحراف المعياري لخمسة آبار لكل يوم عد ، وارسم منحنى نمو الخلية5،12.
7. التمايز متعدد السلالات
- قم بإجراء تحريض التمايز العظمي باتباع الخطوات أدناه.
- استوعب خلايا P3 باستخدام التربسين باتباع الخطوات 4.1-4.5. بذر الخلايا بحجم 2 × 105 خلايا / سم2 في طبق من 6 آبار. أضف 2.5 مل من وسط ثقافة α-MEM لكل بئر.
- عندما تصل الخلايا إلى التقاء 60٪ -70٪ ، قم بتغيير وسط الثقافة إلى وسط تحريض العظم (الخطوة 1.5). ثم قم بتغيير وسيط الحث كل 3 أيام.
- افحص الخلايا تحت المجهر كل 3 أيام بعد التحريض. راقب مورفولوجيا الخلية وابحث عن عقد تمعدن واضحة.
- بعد 7 أيام من الحث ، قم بإجراء تلطيخ الفوسفاتيز القلوي (ALP) لتقييم تكلس الخلايا.
- استخدم 1x PBS لغسل الخلايا مرتين برفق. أضف 4٪ بارافورمالدهيد لتثبيت الخلايا في درجة حرارة الغرفة لمدة 30 دقيقة. ثم استخدم 1x PBS لغسل الخلايا مرتين.
- أضف محلول تلطيخ ALP (انظر جدول المواد) واحتضنه في درجة حرارة الغرفة لمدة 10 دقائق.
ملاحظة: يمكن لأنواع مختلفة من محلول تلطيخ ALP أن تلطخ الخلايا بألوان مختلفة ، مثل الرمادي الداكن والأحمر والأزرق. في هذا البروتوكول ، كانت الخلايا ملطخة باللون الأزرق. يمكن إطالة وقت الحضانة إذا لم يكن لون التلوين واضحا. قد تكون بعض مجموعات تلطيخ محلول ALP سامة. اقرأ التعليمات بعناية قبل الاستخدام ، وارتد القفازات والقناع أثناء التجربة ، واغسل يديك بعناية بعد الاستخدام. - اغسل الخلايا بالماء لوقف تفاعل تلطيخ ALP. لاحظ الحبيبات الزرقاء المصطبغة في الخلايا تحت المجهر الضوئي والتقط الصور. استخدم برنامج Image J لتحليل درجة التلوين كميا.
- قم بإجراء تلطيخ أحمر الأيزارين (انظر جدول المواد) لتقييم قدرة الخلايا على التمعدن.
ملاحظة: عادة ما يمكن رؤية تكوين عقد التمعدن الواضحة للخلايا المتمايزة بعد 21 يوما من الحث. - استخدم 1x PBS لغسل الخلايا مرتين برفق. ثم أضف 4٪ بارافورمالدهيد لتثبيت الخلايا في درجة حرارة الغرفة لمدة 30 دقيقة.
- اغسل الخلايا باستخدام 1x PBS مرتين ، وأضف محلول تلطيخ أحمر أليزارين 0.1٪ (انظر جدول المواد) واحتضنه لمدة 20 دقيقة. مرة أخرى ، اغسل الخلايا باستخدام 1x PBS مرتين.
- راقب العقيدات الحمراء بين الخلايا الثابتة تحت المجهر الضوئي ، مما يشير إلى رواسب الكالسيوم للتمايز العظمي للخلايا المستنبتة ، والتقط الصور.
- لتحديد كمية الأليزارين الأحمر ، أضف 10٪ من كلوريد سيتيل بيريدينيوم (CPC ، انظر جدول المواد) إلى الخلايا الملطخة باللون الأحمر للأيزارين واحتضانها في درجة حرارة الغرفة لمدة 30 دقيقة.
- استنشق 50 ميكرولتر من محلول CPC وقياس الكثافة الضوئية (OD) بطول موجي 540 نانومتر باستخدام مقياس الطيف الضوئي المجهري.
- إجراء تحريض التمايز الدهني.
- قم بزرع خلايا P3 في صفيحة من 6 آبار باستخدام الإجراء الموضح أعلاه (الخطوة 7.1).
- عندما تحصل الخلايا على التقاء 80٪ -90٪ ، قم بتغيير وسط الثقافة إلى وسط التمايز الدهني A (الخطوة 1.6).
- احتضان الخلايا بوسط التمايز الدهني A عند 37 درجة مئوية في جو مرطب بنسبة 5٪ ثاني أكسيد الكربون2 لمدة 3 أيام.
- قم بتغيير وسط الحث إلى وسط التمايز الدهني B (الخطوة 1.7) ، واحتضانه لمدة يوم واحد.
- قم بتغيير الوسط مرة أخرى إلى وسط التمايز الدهني A واحتضانه لمدة 3 أيام. ثم استبدلها بمتوسط B لمدة 1 يوم. كرر هذه الدورة 3-5 مرات حتى يمكن رؤية قطرات الدهون تحت المجهر.
ملاحظة: يمكن رؤية قطرات الدهون بعد حوالي 21 يوما من التحريض. - استخدام وسيط التمايز الشحمي B لزراعة الخلايا لمدة 7 أيام إضافية. بعد ذلك ، يمكن رؤية قطرات دهنية كبيرة ومستديرة تحت المجهر. قم بتحديث المتوسط B كل 3 أيام.
- قم بإزالة وسيط الحث واستخدم 1x PBS لغسل الخلايا برفق. ثم أضف 4٪ بارافورمالدهيد لتثبيت الخلايا في درجة حرارة الغرفة لمدة 10 دقائق.
- اغسل الخلايا ب 1x PBS مرتين ؛ بعد ذلك ، احتضان الخلايا بمحلول تلطيخ O أحمر زيتي (1 مل لكل بئر ، انظر جدول المواد) لمدة 15 دقيقة. مرة أخرى ، اغسل الخلايا باستخدام 1x PBS مرتين.
- ضع الخلايا تحت المجهر ، وراقب قطرات الدهون الحمراء لتقييم تكوين الدهون للخلايا المتمايزة.
- إجراء تحريض التمايز الغضروني.
- هضم ونقل خلايا P3 إلى أنبوب طرد مركزي سعة 15 مل بأرقام خلايا 5 × 105.
- جهاز الطرد المركزي للأنبوب عند 250 × جم لمدة 4 دقائق في درجة حرارة الغرفة. تخلص من المادة الطافية عن طريق صب المحلول العلوي بعناية.
- أضف 0.5 مل من وسط التمايز الغضروفي (الخطوة 1.8) في الأنبوب لإعادة تعليق الخلايا ، وقم بالطرد المركزي للأنبوب مرة أخرى عند 150 × جم لمدة 5 دقائق في درجة حرارة الغرفة. كرر هذه الخطوة مرتين.
- قم بفك غطاء أنبوب الطرد المركزي لتسهيل تبادل الهواء. ضع الأنبوب في الحاضنة وحفز الخلايا ب 0.5 مل من وسط التمايز الغضروفي عند 37 درجة مئوية في جو مرطب بنسبة 5٪ ثاني أكسيد الكربون2.
- حافظ على ثبات أنبوب الطرد المركزي دون إزالته أو هزه في غضون 24 أو 48 ساعة, حتى تبدأ الخلايا في التكوير. قم بتحريك الجزء السفلي من أنبوب الطرد المركزي لتعليق حبيبات الخلية في وسط التمايز (الخطوة 1.5).
- جدد وسط التمايز الغضروفي بماصة كل 3 أيام. تجنب شفط حبيبات الخلية.
- قم بتحفيز الخلايا لمدة 21 يوما على الأقل حتى تتراكم الحبيبات إلى قطر 2 مم.
- اغسل الحبيبات باستخدام 1x PBS ، وثبتها بنسبة 4٪ بارافورمالدهيد لمدة 30 دقيقة. بعد الجفاف وتضمين البارافين13 ، قم بتقسيم الحبيبات بسمك 3 ميكرومتر باستخدام ميكروتوم (انظر جدول المواد).
- ضع الأقسام على شرائح زجاجية. قم بتلطيخ الشرائح بمحلول ألسي الأزرق (انظر جدول المواد) لمدة ساعة واحدة عند 37 درجة مئوية. اغسل الشرائح الملطخة بالماء. ضع الشرائح تحت مجهر ضوئي والتقط صورا لعديدات السكاريد المخاطية الحمضية الملطخة باللون الأزرق التي تشير إلى أنسجة الغضاريف.
النتائج
تم جمع عينة عظم الفك السفلي بنجاح من المريض. والوقت من القطع بشفرة قطع العظم بالموجات فوق الصوتية إلى وضع جزء العظم في أنبوب الطرد المركزي حوالي 5 دقائق. لم تحدث أي من المضاعفات المحتملة في عملية الاستئصال وبعدها ، بما في ذلك تلف العصب السنخي السفلي أو جذر الأسنان ، والعدوى ، وتمزق الأوعية الدموية والنزيف ، وإصابة الغشاء المخاطي ، وكسر العظام العرضي ، وما إلى ذلك. تم استزراع hmBMSCs بنجاح ومرورها وتمييزها دون تلوث.
في هذه الدراسة ، شوهدت العديد من الخلايا الملتصقة تحت المجهر في اليوم الثالث بعد الثقافة الأولية. في اليوم السابع ، كانت معظم الخلايا الملتصقة مرتبطة بالفعل بطبق الثقافة. عادة ، وصلت الخلايا المستنبتة إلى 70٪ -80٪ من التقاء بعد 7-9 أيام من الثقافة الأولية. بعد المرور ، كان يعتقد عادة أن خلايا P3 هي خلايا MSCs منقاة ، والتي أظهرت مورفولوجيا على شكل مغزل ، وملتصقة بالبلاستيك ، وشبيهة بالخلايا الليفية (الشكل 2). وأجريت تجارب تحديد الهوية في خلايا P3 إلى P5. مقايسة تكاثر الخلايا ، زاد معدل نمو الخلايا بسرعة من اليوم الثالث للزراعة ، وتباطأ معدل الزيادة في اليوم 6 (الشكل 2).
وفقا للتعريف الذي قدمته الجمعية الدولية للعلاج الخلوي ، فإن الخلايا الجذعية الجذعية لها تعبير إيجابي وسلبي عن جزيئات سطحية معينة. في هذه الدراسة ، أظهر تحليل قياس التدفق الخلوي لخلايا الثقافة تعبيرا إيجابيا عن CD44 و CD90 وتعبيرا سلبيا عن CD45 و CD34 ، وهو ما يتوافق مع التعريف4،11 (الشكل 3). في تجارب القدرة على التمايز متعدد السلالات ، أظهرت الخلايا المستنبتة قدرة قوية على التمايز العظمي والشحمي والغضروفوني. بعد 7 أيام من تحريض العظم ، ظهر ترسب الكالسيوم خارج الخلية تحت المجهر. بعد 21 يوما من تحريض العظم ، أظهرت الخلايا المستنبتة عقد تمعدنية واضحة ، وتم تلطيخ العقد باللون الأحمر باللون الأحمر أليزارين (الشكل 4). بالنسبة لتكوين الشحم ، شوهدت الكثير من قطرات الدهون المستديرة المتراكمة الملطخة باللون الأحمر باللون الأحمر في السيتوبلازم بعد 21 يوما من الحث الشحمي (الشكل 4). بعد 21 يوما من تحريض التمايز الغضروفي ، يمكن تلطيخ شرائح حبيبات الخلية التي تظهر نسيجا شبيها بالغضروف مع ثغرة في الغضروف باللون الأزرق (الشكل 4).
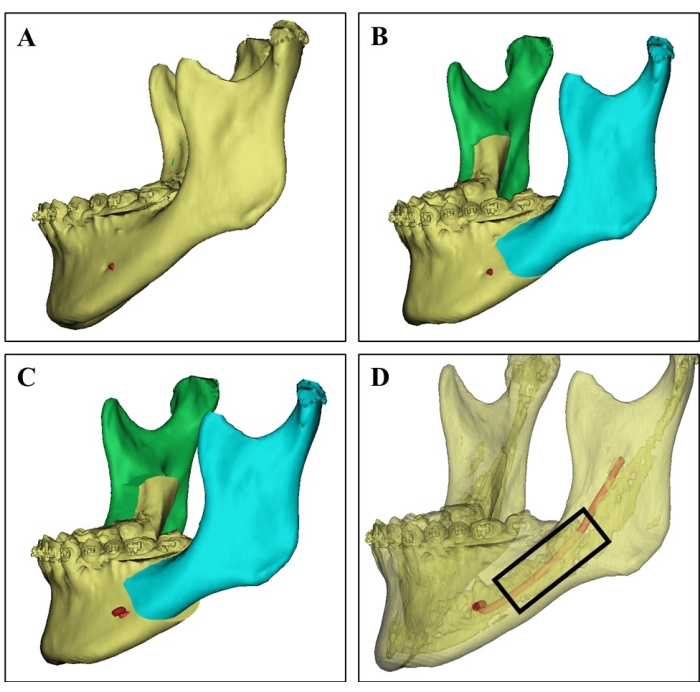
الشكل 1: اختيار موقع المتبرع على صورة التصوير المقطعي المحوسب ثلاثي الأبعاد. (أ) صورة التصوير المقطعي المحوسب ثلاثي الأبعاد للفك السفلي للمتبرع من مريضة تبلغ من العمر 21 عاما. (ب) المحاكاة الجراحية لبضع عظم الراموس السهمي الثنائي للفك السفلي. (ج) يظهر التخطيط الجراحي انتكاسة الفك السفلي المنقسم. (د) صورة التصوير المقطعي المحوسب ثلاثية الأبعاد تظهر العظم القشري (الجزء الشفاف) ، والعظم الإسفنجي الغني بنخاع العظام ، والعصب السنخي السفلي (الأحمر) بناء على قيم التصوير المقطعي المحوسب المختلفة ، والتي يمكن أن توجه الجراحين لتحديد موقع المتبرع وتجنب إصابة الأعصاب. تم حصاد رقائق العظام الكانسيلية من المنطقة في المستطيل الأسود. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
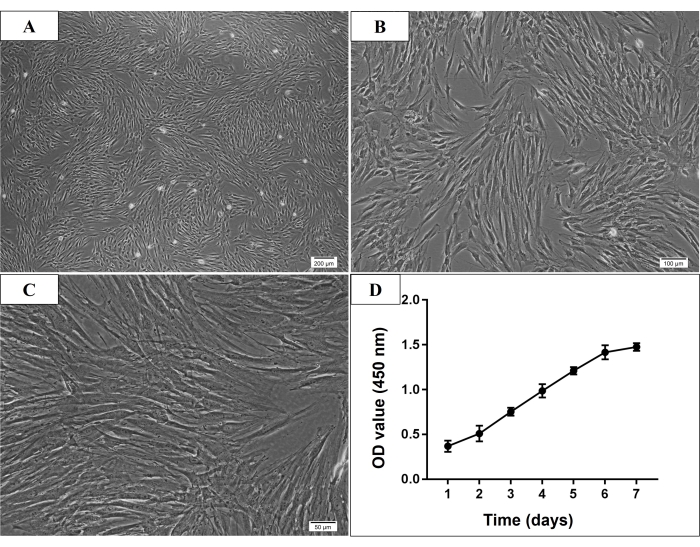
الشكل 2: التشكل المجهري ومنحنى النمو للخلايا الجذعية لنخاع العظم البشري المشتق من الفك السفلي P3 (hmBMSCs). (A-C) مورفولوجيا على شكل مغزل ، ملتصقة بالبلاستيك ، وشبيهة بالخلايا الليفية ل P3 hmBMSCs (شريط المقياس = 200 ميكرومتر ، 100 ميكرومتر ، 50 ميكرومتر ل A ، B ، C ، على التوالي). (د) أظهر منحنى نمو الخلية أن معدل نمو hmBMSCs زاد بسرعة من اليوم الثالث للزراعة وتباطأ معدل الزيادة في اليوم السادس من الاستزراع. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
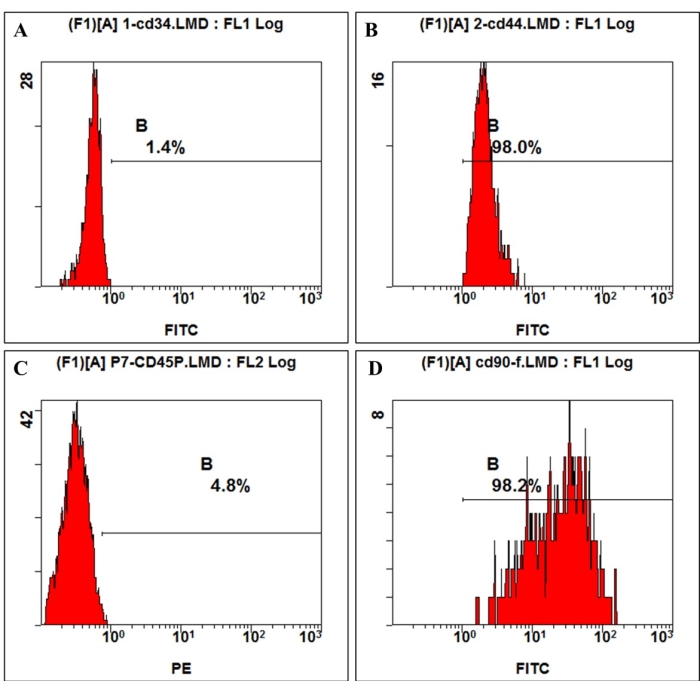
الشكل 3: تم الكشف عن تعبير مستضد سطح الخلية على hmBMSCs عن طريق قياس التدفق الخلوي. أظهر تحليل قياس التدفق الخلوي أن hmBMSCs كانت سلبية ل CD45 (A) و CD44 (C) ، وإيجابية ل CD44 (B) و CD90 (D). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
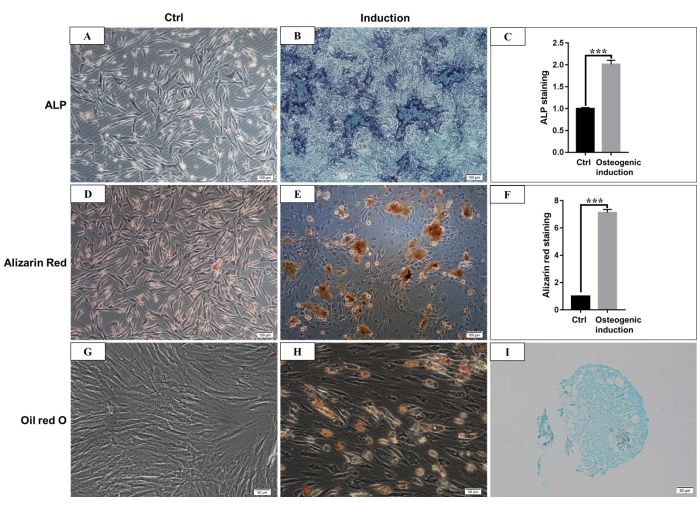
الشكل 4: التمايز العظمي والشحمي والغضروفي ل hmBMSCs. (أ) تلطيخ ALP ل hmBMSCs بعد 7 أيام من الثقافة دون تحريض التمايز العظمي (شريط المقياس = 100 ميكرومتر). (ب) تلطيخ ALP ل hmBMSCs بعد 7 أيام من تحريض التمايز العظمي (شريط المقياس = 100 ميكرومتر). (ج) النتائج الكمية للمنطقة الإيجابية لتلطيخ ALP (***P < 0.001). (د) تلطيخ أليزارين الأحمر ل hmBMSCs بدون تمايز العظم (شريط المقياس = 100 ميكرومتر). (ه) يمكن رؤية تكوين عقد تمعدن واضحة بعد 21 يوما من التمايز العظمي ل hmBMSCs ، ويمكن تلطيخها باللون الأحمر بتلطيخ أحمر أليزارين (شريط المقياس = 100 ميكرومتر). (F) النتائج الكمية للتلطيخ الأحمر للأيزارين (***P < 0.001). (ز) تلطيخ O باللون الأحمر الزيتي ل hmBMSCs بدون تمايز شحمي (شريط المقياس = 50 ميكرومتر) ؛ (ح) شوهدت قطرات دهنية مستديرة بعد 21 يوما من التمايز الدهني ل hmBMSCs ، وكانت قطرات الدهون ملطخة باللون الأحمر باللون الأحمر باللون الأحمر الزيتي (شريط المقياس = 50 ميكرومتر). (I) كان تلطيخ Alcian الأزرق إيجابيا بعد 21 يوما من تحريض التمايز الغضروفي (شريط المقياس = 50 ميكرومتر). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
في الآونة الأخيرة ، أظهر علاج hMSCs وعدا كبيرا في تجديد الأنسجة وعلاج العديد من الأمراض المقاومة للحرارة ، مثل أمراض الخلل المناعي أو أمراض الدم الجهازية أو السرطانات أو الصدمات ، في العديد من التجارب السريرية1،14،15،16،17. من بين المصادر المختلفة للخلايا الجذعية الجذعية ، يظل نخاع العظم المصدر الأكثر استخداما وسهولة الوصول إليه. استخدمنا رقائق العظام الإسفنجية للفك السفلي البشري لزراعة BMSCs بنجاح باستخدام طريقة الالتصاق بنخاع العظم بالكامل الموضحة في البروتوكول الحالي. حتى الآن ، هناك أربع طرق رئيسية لعزل الخلايا الجذعية من نخاع العظام ، بما في ذلك طريقة الالتصاق نخاع العظم بالكامل ، وطريقة الطرد المركزي المتدرج للكثافة ، وطريقة فرز الخلايا الفلورية ، وطريقة فرز الخلايا المنشطةمغناطيسيا 10. طريقة الالتصاق بنخاع العظم بالكامل بسيطة وسهلة التشغيل ورخيصة ويمكن أن تحصل على كميات كبيرة من الخلايا الملتصقة. ومع ذلك ، كان الحد من هذه الطريقة هو انخفاض نقاء BMSCs الأولية المزروعة ، والتي تم خلطها بالخلايا المكونة للدم والخلايا الليفية. بعد تحديث وسط زراعة الخلايا الأولية بانتظام ، تم التخلص من الخلايا المكونة للدم غير الملتصقة جنبا إلى جنب مع الوسط المهمل. أيضا ، يمكن إزالة الخلايا الليفية من خلال مرور الخلية ، وكانت خلايا P3 عبارة عن BMSCs عالية النقاء. لذلك لا يمكن استخدام خلايا P0 إلى P2 للعلاج الخلوي ، مما يعني أن هناك حاجة إلى وقت إضافي لتنقية الخلايا الجذعية. باستخدام فرز الخلايا الفلورية وفرز الخلايا المنشطة مغناطيسيا ، يمكن للمرء الحصول على المزيد من BMSCs المنقاة ، في حين أن الطريقتين باهظتان الثمن ، ويمكن أن يؤدي وقت الاختيار الطويل إلى إضعاف بقاء الخلية11. لإثبات أن الخلايا المستزرعة كانت الخلايا الجذعية الجذعية ، أشرنا إلى تعريف الخلايا الجذعية الوسيطة البشرية الذي اقترحته لجنة الخلايا الجذعية الوسيطة والأنسجة التابعة للجمعية الدولية للعلاج الخلوي ، والذي تضمن طابعا ملتصقا بالبلاستيك ، وتعبيرا إيجابيا وسلبيا عن أنماط ظاهرية معينة ، مثل CD45 و CD90 وما إلى ذلك ، والقدرة على تمايز متعددالسلالات 18.
في معظم الدراسات ، كانت عظم الفخذ والقمة الحرقفية هي المصادر الرئيسية لعضلات الدم العظمية ، مقارنة بعظام الوجه والفكين ، مثل الفك السفلي والفك العلوي9،16. ومع ذلك ، أظهرت النظرية المميزة الخاصة بالموقع ل hBMSCs في الدراسات الحديثة أن hBMSCs من عظام مختلفة لها شخصيات مختلفة في القدرة على التمايز ، والنشاط التكاثري ، وتكوين العظم ، والمناعة6،8. قد يكون الاختلاف الخاص بالموقع مرتبطا بأصول جنينية مختلفة ، والتكيف مع المتطلبات الوظيفية في كل موقع هيكلي ، والبيئة المكروية ، وإمدادات الأوعية الدموية المحلية ، والتأثيرات الهرمونية ، وما إلى ذلك. علاوة على ذلك ، أظهرت الدراسات أن العظم الحرقفي المطعمة أظهر فقدانا رأسيا أسرع من عظم الفك في غضون 6 أشهر بعد الكسب غير المشروع للعظم8. بخلاف ذلك ، وجدت الدراسات أن النشاط التكاثري للخلايا الجذعية الجذعية من نخاع الفك السفلي كان متفوقا على تلك الموجودة في النخاع الحرقفي5،8،19،20. ويعزى هذا الاختلاف في النشاط التكاثري إلى السمات التي تحتوي على كمية أكبر من إمدادات الدم ومعدل دوران العظام أسرع من الحرقفة5،6،8. كشفت الدراسات أيضا أن BMSCs من الفك السفلي عبرت عن مستوى أعلى من Runx-2 و OCN من تلك الموجودة في عظم الفخذ ، وكانت القدرة العظمية ل BMSCs من الفك السفلي مساوية أو أعلى من تلك الموجودة في عظم الفخذ والحرقفة5،19،21. كما وجد أن الالتزام بقدرة التيتانيوم ل hmBMSCs أقوى من BMSCs من عظم الفخذ ، مما يشير إلى أن hmBMSCs كانت أكثر ملاءمة لاستخدامها في زراعة الفم5. بالإضافة إلى ذلك ، وجدت دراسة سريرية استمرت 3 سنوات لإعادة بناء العيب السنخي أن العظم المتجدد للخلايا الجذعية الجذعية من لب الأسنان يتكون من عظم مضغوط بالكامل بكثافة مصفوفة أعلى ، في حين أن BMSCs التي جددت عظما إسفنجيا مشابها لهيكل العظام السنخية البشرية22. في الختام ، كانت hmBMSCs خلايا جذعية علاجية مثالية لتجديد الوجه والفكين والأمراض الأخرى بسبب نفس الأصل الجنيني وخصائصها الفائقة.
ومع ذلك ، فإن الفك السفلي يحتوي على نخاع عظم أقل من عظم الفخذ والحرقفة ، لذلك من المهم الحصول على ما يكفي من نخاع العظام و BMSCs من الفك السفلي للاستخدام السريري. يمكن للشفاطات الحرقفية البشرية الحصول على كميات كبيرة من نخاع العظام لعزل الخلايا الجذعية الجذعية الجذعية ، كما استخدم الباحثون شفاطات الفك السفلي للحصول على الخلايا الجذعية الجذعية ، في حين أن العائد الأولي للخلايا الجذعية الجذعية من شفاطات الفك السفلي كان أقل بثلاث مرات من النفط الحرقفي21. كانت هناك حاجة إلى شقوق إضافية لجمع ما يكفي من زخرفة نخاع الفك السفلي ، مما يضيف صدمة جراحية إضافية. علاوة على ذلك ، أظهرت الدراسات أن إمكانات تكاثر الخلايا الجذعية الجذعية من رقائق العظام السفلية قد تكون متفوقة على تلك الموجودة في نشفط نخاع الفك السفلي8،21. لذلك ، في هذه الدراسة ، تم استخدام رقائق العظام الإسفنجية الفك السفلي المهملة لعزل الخلايا الجذعية الجذعية الجذعية نظرا لأن كلا جانبي الفك السفلي قد تم تضمينهما في قطع عظم الكبر السهمي أو رأب تصغير زاوية الفك السفلي ، يمكننا الحصول على ما يكفي من نخاع الفك السفلي من المرضى دون أي ضرر إضافي. في الآونة الأخيرة ، تم استخدام التكنولوجيا بمساعدة الكمبيوتر على نطاق واسع في جراحة الفم والوجه والفكين لتحسين التأثير الجراحي وتقليل المضاعفاتالجراحية 23. لتجنب إصابة الفك السفلي والأعصاب أثناء حصاد نخاع العظم من الفك السفلي ، تم الحصول على صورة التصوير المقطعي المحوسب ثلاثي الأبعاد للفك السفلي للمتبرعين ، وتم تحليل التخطيط الجراحي للمتبرعين لتحديد مواقع المتبرعين وتنفيذ المحاكاة الجراحية في الدراسة ؛ وبالتالي ، لم تحدث أي من المضاعفات الجراحية. تم استخدام شفرة قطع العظم بالموجات فوق الصوتية ، وهي جهاز خاص بالأنسجة يسمح للجراحين بعمل قطع عظم دقيق مع حماية الأنسجة الرخوةالمجاورة 24 ، لتجنب إصابة الأنسجة الرخوة والحفاظ على نشاط نخاع العظم الذي تم الحصول عليه.
باختصار ، وصفت هذه الدراسة بروتوكولا موثوقا وبسيطا وآمنا ورخيصا لعزل واستزراع الخلايا الجذعية الجذعية للفك السفلي البشري المناسب ، والتي يمكن استخدامها في العلاجات الخلوية لأنسجة الأسنان والوجه والفكين.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
تم دعم الدراسة من قبل المؤسسة الوطنية للعلوم الطبيعية في الصين (رقم 81903249) وبرنامج البحوث الأساسية للعلوم الطبيعية في مقاطعة شنشي (رقم 2019JQ-701 ، رقم 2022JZ-50).
Materials
| Name | Company | Catalog Number | Comments |
| 4% Paraformaldehyde | PlantChemMed | PC-00005 | |
| Adipogenic differentiation medium | OriCell, Cyagen Biosciences | HUXMX-90031 | |
| Alcian blue solution | OriCell, Cyagen Biosciences | ALCB-10001 | |
| Alcohol | Macklin | e809056 | |
| Alizarin red staining solution | Solarbio | G1452 | |
| ALP staining solution | Beijing ComWin Biotech Co.,Ltd. | CW0051S | |
| Autoclave | ALP Co., Ltd., Japan | CL-40L | |
| CCK-8 solution | Yeasen Biotech Co., Ltd. | 40203ES80 | |
| Cell filter (70 μm pore size) | BD Biosciences | 352350 | |
| Cell incubator | Thermo Fisher Scientific | 41334177 | |
| Centrifuge | Eppendorf | 5805ZP761456 | |
| Centrifuge tube (50 mL, 15 mL) | Sangon Biotech | F600888-9001 | |
| Cetylpyridinium chloride | Aladdin | H108696 | |
| Chondrogenesis differentiation medium | OriCell, Cyagen Biosciences | HUXMX-90041 | |
| Clean bench/Laminar flow cabinet | BIOBASE | BBS-DDS00030 | |
| Culture dish (6 cm) | Thermo | 150462 | |
| Culture flasks (25 cm) | Thermo | 156367 | |
| Culture plates (96-well, 6-well) | Corning-Costar | 352350 | |
| Disposable sterile gloves and masks | Sangon Biotech | F516018-9001;F516038-9001 | |
| Disposable sterile syringe (1 mL) | Shaanxi longkangxin Medical Instrument Co., Ltd | 1.00009E+11 | |
| Dulbecco's modified Eagle's medium with high glucose (HG-DMEM) | Hyclone | SH30022.01B | |
| EDTA | Solarbio | E8040-500g | |
| Fetal bovine serum (FBS) | PlantChemMed | PC-00001 | |
| Flow cytometer | Beckman Coulter | EPICS XL | |
| Fluorescein-isothiocyanate (FITC)-conjugated mouse monoclonal anti-human antibody against CD34 | Biolegend | 343503 | |
| Fluorescein-isothiocyanate (FITC)-conjugated mouse monoclonal anti-human antibody against CD44 | Biolegend | 338804 | |
| Fluorescein-isothiocyanate (FITC)-conjugated mouse monoclonal anti-human antibody against CD90 | Biolegend | 328108 | |
| Hemocytometer | Koraba | 30119480698 | |
| Icebox | Sangon Biotech | F615002-0001 | |
| Image J software | National Institute of Mental Health | ||
| Light microscope | OLYMPUS | IX71-2L20944 | |
| Microcentrifuge tubes | Sangon Biotech | F601620-0010 | |
| Microplate spectrophotometer | BioTek-EPOCH | 259091 | |
| Microtome | Feica | 1003001 | |
| Mimics software | Materialise | ||
| Minimum essential medium alpha (α-MEM) | Hyclone | SH30265.01 | |
| Oil red O staining solution | Solarbio | G1261 | |
| Osteogenic differentiation medium | OriCell, Cyagen Biosciences | HUXMA-90021 | |
| Penicillin and streptomycin | PlantChemMed | PC-86115 | |
| Phosphate buffer saline (PBS) | PlantChemMed | PC-00003 | |
| Phycoerythrin (PE)-conjugated mouse monoclonal anti-human antibody against CD45 | Biolegend | 304008 | |
| Pipette | SORFA | 320511 | |
| ProPlan CMF 3.0 | Materialise | ||
| Scissors, tweezers and knives | Shanghai Jinzhong Surgical instrument Co., Ltd | ZJA030,YAA110,J11010 | |
| Sterile wet gauze | HENAN PIAOAN GROUP Co., Ltd | ||
| Trypsin | Gibco | 17075029 | |
| Ultrasonic osteotome blade | Stryker Instruments | 5450-815-107 |
References
- Ullah, I., Subbarao, R. B., Rho, G. J. Human mesenchymal stem cells - current trends and future prospective. Bioscience Reports. 35 (2), 1-8 (2015).
- Brown, C., et al. Mesenchymal stem cells: Cell therapy and regeneration potential. Journal of Tissue Engineering and Regenerative Medicine. 13 (9), 1738-1755 (2019).
- Trohatou, O., Maria, G. R. Mesenchymal stem/stromal cells in regenerative medicine: Past, present, and future. Cellular Reprogramming. 19 (4), 217-224 (2017).
- Heo, J. S., Choi, Y., Kim, H. S., Kim, H. O. Comparison of molecular profiles of human mesenchymal stem cells derived from bone marrow, umbilical cord blood, placenta and adipose tissue. International Journal of Molecular Medicine. 37 (1), 115-125 (2016).
- Li, C. J., Wang, F. F., Zhang, R., Qiao, P. Y., Liu, H. C. Comparison of proliferation and osteogenic differentiation potential of rat mandibular and femoral bone marrow mesenchymal stem cells in vitro. Stem Cells and Development. 29 (11), 728-736 (2020).
- Lloyd, B., et al. Similarities and differences between porcine mandibular and limb bone marrow mesenchymal stem cells. Archives of Oral Biology. 77 (5), 1-11 (2017).
- Yamaza, T., et al. Mouse mandible contains distinctive mesenchymal stem cells. Journal of Dental Research. 90 (3), 317-324 (2011).
- Akintoye, S. O., et al. Skeletal site-specific characterization of orofacial and iliac crest human bone marrow stromal cells in same individuals. Bone. 38 (6), 758-768 (2006).
- Mendi, A., Ulutürk, H., Ataç, M. S., Stem Yılmaz, D. cells for the oromaxillofacial area: Could they be a promising source for regeneration in dentistry. Advances in Experimental Medicine and Biology. 11 (44), 101-121 (2019).
- Hong, Y. Y., et al. Isolation and cultivation of mandibular bone marrow mesenchymal stem cells in rats. Journal of Visualized Experiments. (162), e61532 (2020).
- Chu, D. T., et al. An update on the progress of isolation, culture, storage, and clinical application of human bone marrow mesenchymal stem/stromal cells. International Journal of Molecular Sciences. 21 (3), 708 (2020).
- Yu, Y. J., et al. Activation of mesenchymal stem cells promotes new bone formation within dentigerous cyst. Stem Cell Research & Therapy. 11 (1), 476 (2020).
- Sadeghipour, A., Babaheidarian, P. Making formalin-fixed, paraffin embedded blocks. Methods in Molecular Biology. 1897, 253-268 (2019).
- Mathiasen, A. B., et al. marrow-derived mesenchymal stromal cell treatment in patients with ischaemic heart failure: final 4-year follow-up of the MSC-HF trial. European Journal of Heart Failure. 22 (5), 884-892 (2020).
- Maqsood, M., et al. Adult mesenchymal stem cells and their exosomes: Sources, characteristics, and application in regenerative medicine. Life Sciences. 01 (256), 118002 (2020).
- Reinders, M. J., et al. Autologous bone marrow-derived mesenchymal stromal cell therapy with early tacrolimus withdrawal: The randomized prospective, single-center, open-label TRITON study. American Journal of Transplantation: Official Journal of the American Society of Transplantation and the American Society of Transplant Surgeons. 21 (9), 3055-3065 (2021).
- Shi, H. Y., et al. marrow-derived mesenchymal stem cells promote Helicobacter pylori-associated gastric cancer progression by secreting thrombospondin-2. Cell Proliferation. 54 (10), 13114 (2021).
- Dominici, M., et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8 (4), 315-317 (2006).
- Aghaloo, T. L., et al. Osteogenic potential of mandibular vs. long-bone marrow stromal cells. Journal of Dental Research. 89 (11), 1293-1298 (2010).
- Dong, W. J., et al. Phenotypic characterization of craniofacial bone marrow stromal cells: unique properties of enhanced osteogenesis, cell recruitment, autophagy, and apoptosis resistance. Cell and Tissue Research. 358 (1), 165-175 (2014).
- Lee, B. K., Choi, S. J., Mack, D., Oh, S. H. Isolation of mesenchymal stem cells from the mandibular marrow aspirates. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontics. 112 (6), 86-93 (2011).
- Giuliani, A., et al. Three years after transplants in human mandibles, histological and in-line holotomography revealed that stem cells regenerated a compact rather than a spongy bone: biological and clinical implications. Stem Cells Translational Medicine. 2 (4), 316-324 (2013).
- Chen, Y. W., et al. Computer-assisted surgery in medical and dental applications. Expert Review of Medical Devices. 18 (7), 669-696 (2021).
- Gilles, R., Couvreur, T., Dammous, S. Ultrasonic orthognathic surgery: enhancements to established osteotomies. International Journal of Oral and Maxillofacial Surgery. 42 (8), 981-987 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved