Method Article
Aislamiento y cultivo de células madre mesenquimales de médula ósea de la mandíbula humana
* Estos autores han contribuido por igual
En este artículo
Resumen
El presente protocolo describe un procedimiento eficiente para el aislamiento y cultivo de células madre mesenquimales derivadas de la médula ósea mandibular humana utilizando el método de adherencia de la médula ósea completa. Las células cultivadas se identificaron mediante ensayos de proliferación celular, citometría de flujo e inducción de diferenciación multilinaje.
Resumen
Las células madre mesenquimales humanas (hMSC) han demostrado un gran potencial en la regeneración ósea, la modulación inmunitaria y el tratamiento de enfermedades crónicas refractarias. Recientemente, se han encontrado varios orígenes para obtener hMSCs, mientras que la médula ósea todavía se consideraba la fuente principal. Las MSC derivadas de la médula ósea (BMSC) de diferentes sitios óseos de donantes tienen características distintas debido a factores microambientales. Los estudios han demostrado que las BMSC del hueso maxilofacial pueden tener mayores capacidades proliferativas y osteogénicas que las BMSC de huesos largos o de la cresta ilíaca. Y las BMSC maxilofaciales se consideraron más adecuadas para la terapia con células madre en los tejidos maxilofaciales. La mandíbula, especialmente el área del ramal ascendente con suficiente médula, fue un sitio donante factible para la recolección de BMSC. En este estudio se describe un protocolo para la recolección, el aislamiento y el cultivo de MSC derivadas de la médula ósea mandibular humana (hmBMSC). Además, se realizó inmunofenotipado de hmBMSC, ensayos de proliferación e inducción in vitro de diferenciación osteogénica, adipogénica y condrogénica para identificar las células cultivadas. La aplicación de este protocolo puede ayudar a los investigadores a obtener con éxito suficientes hmBMSC de alta calidad, lo cual es necesario para estudios posteriores de la función biológica, los efectos microambientales y las aplicaciones clínicas.
Introducción
Las células madre mesenquimales humanas (hMSC) son células multipotentes que se pueden diferenciar en varios tipos de células, como osteocitos, adipocitos y condrocitos del linaje mesodérmico, hepatocitos y pancreocitos del linaje endodérmico y neurocitos del linaje ectodérmico1. Así, las hMSCs han demostrado un gran potencial en la regeneración de tejidos. Además, las hMSC son potentes inmunomoduladores que pueden regular el microambiente en los tejidos del huésped y tratar eficazmente las enfermedades crónicas refractarias2. Por lo tanto, las hMSC se han utilizado ampliamente en la terapia celular de estudios clínicos. En consecuencia, es importante obtener suficientes hMSC con alta calidad de una manera conveniente con éxito.
Desde que se notificaron por primera vez las hMSC en la médula ósea, se han encontrado muchas fuentes alternativas de MSCs, como el tejido adiposo, el líquido sinovial, el músculo esquelético, el líquido amniótico, el endometrio, los tejidos dentales y el cordón umbilical 1,3. Sin embargo, la médula ósea sigue siendo la principal fuente de hMSC para la mayoría de los estudios preclínicos y clínicos, y las MSC derivadas de la médula ósea (BMSC) se toman como estándar para comparar las MSC de otras fuentes4. Durante años, la cresta ilíaca o los huesos largos (la tibia y el fémur) han sido las localizaciones anatómicas más populares para la obtención de médula ósea 1,5. Sin embargo, la cresta ilíaca o los huesos largos tienen diferentes orígenes embrionarios y patrones de desarrollo en comparación con los huesos maxilofaciales 5,6. Muchos estudios clínicos, de laboratorio y de desarrollo demostraron que las BMSC de diferentes orígenes mostraron propiedades específicas del sitio, y las BMSC injertadas conservan las propiedades del sitio donante después de la implantación en el sitio receptor 5,6,7,8,9. Desde la perspectiva del origen del desarrollo, los tejidos maxilofaciales, como el maxilar, la mandíbula, la dentina, el hueso alveolar, la pulpa y el ligamento periodontal, surgen exclusivamente de las células de la cresta neural. Por el contrario, la cresta ilíaca y los huesos largos están formados por mesodermo. Además, las mandíbulas se crean por osificación intramembranosa, mientras que los esqueletos axiales y apendiculares sufren osificación endocondral. Además, en comparación con la cresta ilíaca y los huesos largos, algunos estudios clínicos han demostrado que las hMSC derivadas de la médula ósea maxilofacial tienen mejor actividad proliferativa celular y capacidad de diferenciación 6,8. Por lo tanto, se espera que las BMSC de las áreas maxilofaciales sean una mejor opción para la regeneración del tejido maxilofacial y el tratamiento de enfermedades crónicas maxilofaciales refractarias.
La mandíbula está compuesta por huesos corticales gruesos de dos capas con médula ósea esponjosa en el medio para que pueda cargar el poder de masticar. Por lo tanto, la mandíbula, especialmente el área del ramal ascendente, suele ser utilizada como sitio donante para la obtención de injertos óseos autólogos en cirugías craneomaxilofaciales10. Y en cirugías como la osteotomía de la rama dividida sagital mandibular y la plastia de reducción del ángulo mandibular, se deben extirpar partes de la corteza mandibular y el hueso esponjoso para lograr un contorno facial agradable. Esos huesos esponjosos desechados podrían ser un recurso potencial para las hMSC. Sin embargo, pocos estudios publicados describieron el protocolo para aislar rápidamente y cultivar MSCs derivadas de la médula ósea mandibular humana de alta calidad (hmBMSC).
El presente estudio utiliza un método modificado de adherencia a la médula ósea completa para introducir un protocolo fiable y reproducible para el aislamiento y cultivo de hmBMSCs. Y las células madre se identificaron mediante inmunofenotipado por citometría de flujo de MSC, ensayos de proliferación e inducción de diferenciación multilinaje. La aplicación de este procedimiento estándar puede ayudar a los investigadores a obtener MSC derivadas de la médula ósea mandibular humana de alta calidad, lo cual es importante en estudios posteriores sobre la función biológica, los efectos microambientales y las aplicaciones clínicas.
Protocolo
El procedimiento para la recolección de muestras de hueso mandibular humano fue aprobado por el Comité de Ética de la Escuela de Estomatología de la Cuarta Universidad Médica Militar. El estudio siguió las directrices éticas de la Declaración de Helsinki de 1975. Todos los donantes del presente estudio fueron informados de los posibles riesgos y de los objetivos del estudio. La edad de los donantes osciló entre los 18 y los 40 años, y no hubo sesgo de género. Se obtuvo el consentimiento por escrito de todos los participantes humanos.
1. Preparación de la cirugía
- Seleccione el donante adecuado.
- Seleccionar a los pacientes como donantes que planean someterse a cirugías como el retroceso mandibular después de la osteotomía de la rama dividida sagital y la plastia de reducción del ángulo mandibular.
- Prepara la solución de conservación.
- Complemente 30 mL de solución salina tampón fosfato (1x PBS) con penicilina al 1% y estreptomicina en un tubo centrífugo estéril y libre de enzimas de 50 mL el día antes de la cirugía. Guárdelo en el refrigerador a 4 °C.
- El día de la cirugía, coloque el tubo centrífugo con solución de conservación en una nevera y manténgalo en el quirófano 1 h antes de la cirugía.
- Esterilice los instrumentos para aislar la médula ósea el día antes de la cirugía, incluyendo tijeras, pinzas y cuchillos a 120 °C y 0,27 MPa de presión durante 20 min.
- Prepare el medio de cultivo α-MEM mezclando el medio esencial mínimo alfa (α-MEM) con un 10% de suero fetal bovino (FBS) y un 1% de penicilina y estreptomicina.
- Prepare un medio de diferenciación osteogénico mezclando α medio de cultivo de MEM con 50 mM de ácido ascórbico, 10 mM de fosfato de β-glicerol y 0,1 mM de dexametasona (consulte la tabla de materiales).
- Prepare el medio de diferenciación adipogénico A mezclando α medio de cultivo de MEM con 1 mM de dexametasona, 0,2 mM de indometacina, 10 μg/mL de insulina y 0,5 mM de 3-isobutil-1-metilxantina (IBMX) (ver Tabla de Materiales).
- Prepare el medio de diferenciación adipogénico B mezclando medio de cultivo α-MEM con 10 μg/mL de insulina.
- Prepare el medio de diferenciación condrogénico mezclando el medio de Eagle modificado de Dulbecco con glucosa alta (HG-DMEM) y 100 nM de dexametasona, 100 g/mL de piruvato de sodio, 25 mg/mL de vitamina C, 40 mg/mL de prolina, 10 ng/mL de TGF-β3 y 1% de ITS (ver Tabla de Materiales).
NOTA: El medio de diferenciación osteogénico, adipogénico y condrogénico se puede preparar internamente, como se mencionó anteriormente. Sin embargo, en el presente estudio se utilizaron kits disponibles comercialmente para el mismo (ver Tabla de Materiales).
2. Recolección de espécimen de hueso mandibular humano
- Antes de la cirugía, estudiar cuidadosamente las imágenes de tomografía computarizada tridimensional y la planificación de la simulación quirúrgica de los donantes (Figura 1).
- Seleccione el sitio mandibular que el donante planea extirpar en cirugía y que sea rico en hueso esponjoso con médula ósea como sitio donante.
- Desinfecte y cubra al paciente antes de operar.
- Resecar el sitio donante seleccionado de la mandíbula utilizando la cuchilla de osteótomo ultrasónico (ver Tabla de Materiales), evitando la lesión del nervio alveolar inferior y el deterioro óseo del donante.
- Coloque las muestras de hueso mandibular en la solución de conservación (paso 1.2) lo antes posible.
- Coloque la solución de conservación con muestras óseas en una nevera hasta que comience el aislamiento de las MSC en el laboratorio.
NOTA: El aislamiento de las MSC debe iniciarse lo antes posible después de la recolección para preservar la viabilidad de las células. Si el aislamiento de las MSC no puede realizarse inmediatamente, la solución de conservación con muestras óseas puede almacenarse en una nevera o refrigerarse a 4 °C durante un máximo de 2 h.
3. Aislamiento y cultivo de mBMSCs humanas
- Saque las muestras óseas de la solución de conservación y sumérjalas en 1x PBS con penicilina y estreptomicina al 1% durante 5 minutos en un banco limpio de la cabina de flujo laminar.
NOTA: Este paso tiene como objetivo lavar el coágulo de sangre y los fluidos orales residuales y eliminar aún más el microorganismo porque la boca no es un ambiente completamente estéril. Antes del aislamiento y cultivo celular, lávese y desinfecte las manos con alcohol y use guantes y mascarillas estériles desechables. - Limpie el tejido blando adherido y la mancha de sangre en la superficie ósea con una gasa húmeda estéril.
- Llene una placa de cultivo estéril de 6 cm con 5 mL de medio de cultivo α-MEM.
- Coloque el hueso en la placa de cultivo estéril y córtelo en trozos pequeños (casi 2-3 mm3 de volumen) con un cuchillo o tijera esterilizada.
NOTA: Sostenga los especímenes de hueso con pinzas para evitar un corte en el dedo. - Aspire el medio de cultivo α-MEM en la placa de cultivo con una jeringa estéril desechable de 1 mL.
- Inserte la aguja de la jeringa con medio de cultivo α-MEM profundamente en la cavidad de la médula ósea de las piezas de muestra ósea esponjosa.
- Enjuague la médula ósea en la placa de cultivo con la jeringa desde todos los lados de las piezas de la muestra ósea, al menos 5-10 veces por lado.
- Repita los pasos 3.5-3.7 hasta que todas las piezas de la muestra ósea se vuelvan de color blanco puro para asegurarse de que se enjuague la mayor cantidad de médula ósea en el medio de cultivo.
NOTA: El tiempo total de operación de los pasos anteriores de 3.1 a 3.8 debe controlarse dentro de los 30 minutos en hielo. - Retire y deseche todos los trozos de muestras de hueso con pinzas. Elimine otros fragmentos pequeños con un filtro celular con un tamaño de poro de 70 μm.
- Agite suavemente la placa de cultivo para que las células enrojecidas se distribuyan uniformemente.
- Coloque la placa de cultivo en una incubadora de células y cultive las células a 37 °C en una atmósfera humidificada de 5% de CO2.
- Al tercer día de cultivo, compruebe la morfología celular y el estado de crecimiento bajo un microscopio óptico. Extraer la mitad del medio de cultivo sin células adherentes y fragmentos de tejido; añadir 3 mL de medio de cultivo α-MEM fresco.
- En el día 7 de cultivo, retire todo el medio de cultivo y agregue 5 mL de medio de cultivo α-MEM fresco.
- A continuación, actualice el medio de cultivo α-MEM cada 3 días.
- Revise la morfología y el crecimiento de las células todos los días.
NOTA: Cuando los cultivos celulares primarios (P0) alcancen una confluencia del 70%-80% después de 7-10 días de cultivo, realice el paso celular.
4. Paso de la celda
- Al 70%-80% de confluencia, retire todo el medio de cultivo de las células P0. Lave la placa de cultivo suavemente con 1x PBS dos veces para limpiar el medio de cultivo residual.
- Añadir 1 mL de tripsina al 0,25% con EDTA al 0,02% a la placa de cultivo para digerir las células. Agite suavemente la placa de cultivo para asegurarse de que la tripsina se distribuya uniformemente. Colocar la placa de cultivo a 37 °C durante 3 min.
- Revise las células bajo el microscopio. Cuando el 70%-80% de las células se contraigan y redondeen, agregue 2 mL de medio de cultivo α-MEM para detener la reacción digestiva.
- Sople suavemente la superficie del plato varias veces con una pipeta para soplar las células.
- Transfiera la suspensión celular a un tubo de centrífuga de 15 mL. Centrifugar la suspensión celular a 200 x g durante 5 min a temperatura ambiente.
- Deseche el sobrenadante y vuelva a suspender las células con medio de cultivo α-MEM. Siembra de células P0 en matraces de cultivo (25 cm) para expansión con una relación de división de 1:2. Las primeras células de paso se llamaron células P1.
- Cuando las células P1 alcancen el 70%-80% de confluencia, repita el paso de la célula siguiendo los pasos de 4.1-4.6. Las células de segunda generación se denominaron células P2.
- Cambie la relación de división de la expansión a 1:3 después del paso de la celda de tercera generación.
- Utilice las células P3 a P5 para realizar experimentos de identificación.
5. Análisis de citometría de flujo
- Digiera las MSC P3 a P5 utilizando tripsina al 0,25 % con EDTA al 0,02 %, siguiendo los pasos 4.1-4.5.
- Deseche el sobrenadante y vuelva a suspender las células en 1x PBS a una concentración de 1 x 106 células/mL.
- Transfiera las células a tubos de microcentrífuga con 100 μL de la suspensión celular por tubo.
- Agregue anticuerpos monoclonales antihumanos de ratón inmunomarcados en los tubos de microcentrífuga.
NOTA: Para el presente estudio, se utilizaron anticuerpos conjugados con ficoeritrina (PE) contra CD45, anticuerpos conjugados con fluoresceína e isotiocianato (FITC) contra CD90, CD34 y CD44 4,11 (ver Tabla de Materiales), y las diluciones de los anticuerpos fueron todas 1:100. Las diluciones de anticuerpos deben seguir las instrucciones del fabricante. PBS servirá como control. - Incubar los anticuerpos y el control de PBS a temperatura ambiente en la oscuridad durante 30 min.
- Centrifugar los tubos a 800 x g durante 5 min a temperatura ambiente. Deseche la suspensión y vuelva a suspender las células en 0,5 mL de 1x PBS. Repita este paso dos veces.
- Cargue los tubos en el citómetro de flujo (consulte la tabla de materiales). Cuente los números de células marcadas con fluorescencia utilizando un citómetro de flujo con un mínimo de 10.000 eventos.
NOTA: Es mejor iniciar el proceso de recuento de células con citómetro de flujo inmediatamente después del procedimiento de marcaje de inmunofluorescencia. De lo contrario, las células deben fijarse en paraformaldehído al 1%, almacenarse a 4 °C en la oscuridad y finalizar el proceso dentro de las 24 horas.
6. Ensayo de proliferación celular
- Utilice células P3 para realizar el ensayo de proliferación celular. Digiera las MSC P3 con tripsina al 0,25%, siguiendo los pasos 4.1-4.5.
- Deseche el sobrenadante y vuelva a suspender las células con medio de cultivo α-MEM.
- Cuente el número de células con un hemocitómetro y siembre las células en placas de cultivo de 96 pocillos a una densidad de 3 x 103 celdas por pocillo, un total de 35 pocillos, 5 pocillos por cada día de conteo (en el día 1, 2, 3, 4, 5, 6, 7). Refresque el medio de cultivo de células cada 3 días.
- En cada día de conteo, deseche el medio de cultivo α-MEM de los cinco pocillos para el día de conteo y luego agregue 100 μL de medio de cultivo y 10 μL de solución CCK-8 (consulte la Tabla de materiales). Incubar a 37 °C durante 1 h.
- Coloque las placas de cultivo en un espectrofotómetro de microplacas (consulte la Tabla de materiales) y mida el valor de densidad óptica de cinco pocillos para cada día de conteo (un total de 7 días de conteo) a una longitud de onda de 450 nm. Utilice cinco pocillos del medio de cultivo sin células como blancos.
- Registre el valor de la densidad óptica de cada pocillo, calcule el valor promedio y la desviación estándar de cinco pocillos para cada día de conteo y trace la curva de crecimiento celular 5,12.
7. Diferenciación multilinaje
- Realice la inducción de la diferenciación osteogénica siguiendo los pasos que se indican a continuación.
- Digiera las células P3 con tripsina siguiendo los pasos 4.1-4.5. Siembre las celdas a 2 x 105 celdas/cm2 en una placa de 6 pocillos. Agregue 2.5 mL de medio de cultivo α-MEM por pocillo.
- Cuando las células alcancen el 60%-70% de confluencia, cambie el medio de cultivo por el medio de inducción osteogénico (paso 1.5). Luego, cambie el medio de inducción cada 3 días.
- Revise las células bajo un microscopio cada 3 días después de la inducción. Observe la morfología de la célula y busque nodos de mineralización obvios.
- Después de 7 días de inducción, realizar la tinción de fosfatasa alcalina (ALP) para evaluar la calcificación de las células.
- Use 1x PBS para lavar las celdas dos veces suavemente. Agregue un 4% de paraformaldehído para fijar las celdas a temperatura ambiente durante 30 minutos. Luego, use 1x PBS para lavar las celdas dos veces.
- Agregue la solución de tinción de ALP (consulte la Tabla de materiales) e incube a temperatura ambiente durante 10 minutos.
NOTA: Diferentes tipos de solución de tinción de ALP pueden teñir las células con diferentes colores, como gris oscuro, rojo y azul. En este protocolo, las células se tiñeron de azul. El tiempo de incubación puede prolongarse si el color de la mancha no es evidente. Algunos kits de tinción de solución de ALP pueden ser venenosos; Lea atentamente las instrucciones antes de usar, use guantes y una mascarilla durante el experimento y lávese las manos cuidadosamente después de usarlo. - Lave las células con agua para detener la reacción de tinción de ALP. Observe los gránulos pigmentados de azul en las células bajo un microscopio óptico y capture las fotos. Utilice el software Image J para analizar cuantitativamente el grado de tinción.
- Realizar tinción con rojo de alizarina (ver Tabla de Materiales) para evaluar la capacidad de mineralización de las células.
NOTA: La formación obvia de nodos de mineralización de las células diferenciadas generalmente se puede ver después de 21 días de inducción. - Use 1x PBS para lavar las celdas dos veces suavemente. A continuación, añade un 4% de paraformaldehído para fijar las células a temperatura ambiente durante 30 min.
- Lave las células con 1x PBS dos veces, agregue una solución de tinción de rojo de alizarina al 0,1% (consulte la tabla de materiales) e incube durante 20 minutos. Nuevamente, lave las celdas con 1x PBS dos veces.
- Observe los nódulos rojos entre las células fijas bajo un microscopio óptico, que indican depósitos de calcio de la diferenciación osteogénica de las células cultivadas, y capture las fotos.
- Para cuantificar la cantidad de rojo de alizarina, agregue cloruro de cetilpiridinio al 10% (CPC, consulte la Tabla de materiales) a las células teñidas con rojo de alizarina e incube a temperatura ambiente durante 30 minutos.
- Aspire 50 μL de la solución de CPC y mida la densidad óptica (OD) a una longitud de onda de 540 nm utilizando un espectrofotómetro de microplacas.
- Realizar la inducción de la diferenciación adipogénica.
- Siembre las células P3 en una placa de 6 pocillos utilizando el procedimiento descrito anteriormente (paso 7.1).
- Cuando las células obtengan una confluencia del 80%-90%, cambie el medio de cultivo por el medio de diferenciación adipogénico A (paso 1.6).
- Incubar las células con medio de diferenciación adipogénico A a 37 °C en una atmósfera humidificada de 5% CO2 durante 3 días.
- Cambie el medio de inducción a medio de diferenciación adipogénico B (paso 1.7) e incube durante 1 día.
- Cambie el medio de nuevo a medio de diferenciación adipogénico A e incube durante 3 días. Luego, reemplace con el medio B durante 1 día. Repita este ciclo de 3 a 5 veces hasta que se puedan ver las gotas de lípidos bajo el microscopio.
NOTA: Las gotas de lípidos se pueden ver aproximadamente 21 días después de la inducción. - Utilice el medio de diferenciación adipogénico B para cultivar las células durante 7 días adicionales; Luego, se pueden ver gotas de lípidos grandes y redondas bajo el microscopio. Refresque el medio B cada 3 días.
- Retire el medio de inducción y use 1x PBS para lavar las células suavemente. A continuación, añade un 4% de paraformaldehído para fijar las células a temperatura ambiente durante 10 min.
- Lave las celdas con 1x PBS dos veces; luego, incube las células con una solución de tinción de O rojo aceite (1 mL por pocillo, ver Tabla de Materiales) durante 15 min. Nuevamente, lave las celdas con 1x PBS dos veces.
- Coloque las células bajo un microscopio y observe las gotas de lípidos rojos para evaluar la adipogénesis de las células diferenciadas.
- Realizar la inducción de la diferenciación condrogénica.
- Digiera y transfiera las células P3 a un tubo de centrífuga de 15 ml con números de celda de 5 x 105.
- Centrifugar el tubo a 250 x g durante 4 min a temperatura ambiente. Deseche el sobrenadante decantando cuidadosamente la solución superior.
- Añadir 0,5 mL de medio de diferenciación condrogénico (paso 1,8) en el tubo para resuspender las células, y centrifugar el tubo de nuevo a 150 x g durante 5 min a temperatura ambiente. Repita este paso dos veces.
- Afloje la tapa del tubo de centrífuga para facilitar el intercambio de aire. Coloque el tubo en la incubadora e induzca las células con 0,5 mL de medio de diferenciación condrogénica a 37 °C en una atmósfera humidificada de 5% de CO2.
- Mantenga el tubo de centrífuga estable sin quitarlo ni agitarlo dentro de las 24 o 48 h, hasta que las celdas comiencen a peletizar. Agite la parte inferior del tubo de centrífuga para suspender el pellet de la célula en el medio de diferenciación (paso 1.5).
- Renueve el medio de diferenciación condrogénico con una pipeta cada 3 días. Evite aspirar la pelletización de la célula.
- Inducir las células al menos durante 21 días hasta que el pellet se acumule hasta un diámetro de 2 mm.
- Lave el pellet con 1x PBS y fíjelo con paraformaldehído al 4% durante 30 min. Después de la deshidratación y la inclusión de parafina13, seccione el pellet con un espesor de 3 μm con un micrótomo (ver Tabla de Materiales).
- Coloque las secciones en portaobjetos de vidrio. Teñir los portaobjetos con una solución de azul alcián (ver tabla de materiales) durante 1 h a 37 °C. Lave los portaobjetos manchados con agua. Coloque los portaobjetos bajo un microscopio óptico y capture fotos del mucopolisacárido ácido teñido de azul que indica tejidos cartilaginosos.
Resultados
Se recolectó con éxito una muestra de hueso mandibular del paciente. Y el tiempo desde el corte con la cuchilla de osteótomo ultrasónico hasta la colocación del fragmento óseo en el tubo de centrífuga es de unos 5 minutos. Ninguna de las posibles complicaciones ocurrió durante y después del procedimiento de resección, incluyendo daño del nervio alveolar inferior o de la raíz dental, infección, ruptura vascular y sangrado, lesión de la mucosa, fractura ósea accidental, etc. Las hmBMSC se cultivaron, pasaron y diferenciaron con éxito sin contaminación.
En el presente estudio, muchas células adheridas se observaron bajo el microscopio al tercer día después del cultivo inicial. Al séptimo día, la mayoría de las células adherentes ya estaban adheridas a la placa de cultivo. Normalmente, las células cultivadas alcanzaron un 70%-80% de confluencia después de 7-9 días de cultivo inicial. Después del paso, generalmente se pensaba que las células P3 eran MSC purificadas, que mostraban una morfología en forma de huso, adherente al plástico y similar a la de los fibroblastos (Figura 2). Y los experimentos de identificación se llevaron a cabo en células P3 a P5. En el ensayo de proliferación celular, la tasa de crecimiento de las células aumentó rápidamente a partir del tercer día de cultivo, y la tasa de aumento se ralentizó el día 6 (Figura 2).
De acuerdo con la definición dada por la Sociedad Internacional de Terapia Celular, las MSC tienen una expresión positiva y negativa de moléculas de superficie particulares. En este estudio, el análisis de citometría de flujo de las células en cultivo mostró expresión positiva de CD44, CD90 y negativa de CD45, CD34, lo que es consistente con la definición 4,11 (Figura 3). En los experimentos de capacidad de diferenciación multilinaje, las células cultivadas mostraron una fuerte capacidad de diferenciación osteogénica, adipogénica y condrogénica. Después de 7 días de inducción osteogénica, la deposición de calcio de la matriz extracelular emergió bajo el microscopio. Después de 21 días de inducción osteogénica, las células cultivadas mostraron nodos de mineralización evidentes, y los ganglios se tiñeron de rojo con tinción roja de alizarina (Figura 4). Para la adipogénesis, se observaron muchas gotas lipídicas redondas acumuladas teñidas de rojo por la tinción de Oil-red-O en el citoplasma después de 21 días de inducción adipogénica (Figura 4). Después de 21 días de inducción de la diferenciación condrogénica, los portaobjetos de los gránulos celulares que muestran tejido similar al cartílago con laguna cartilaginosa se pueden teñir de azul (Figura 4).
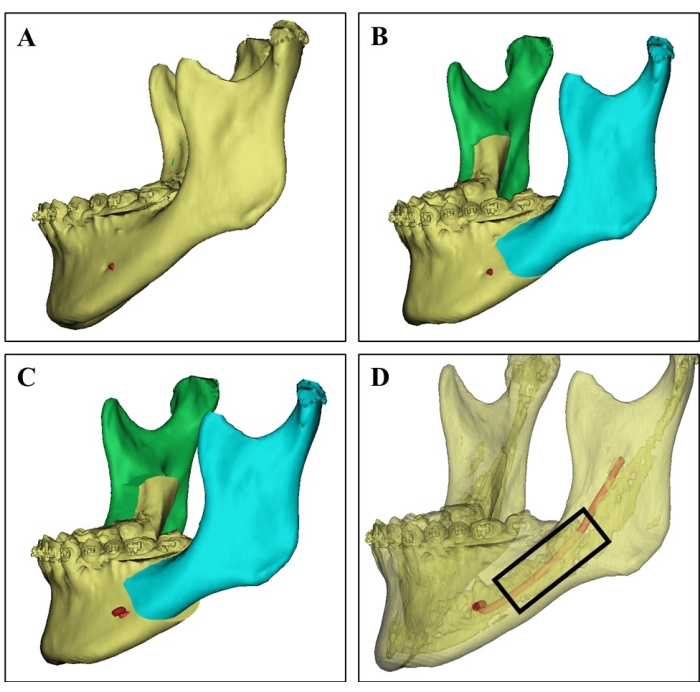
Figura 1: Selección del sitio donante en la imagen de TC 3D. (A) Imagen de TC 3D de la mandíbula del donante de una paciente femenina de 21 años. (B) Simulación quirúrgica de la osteotomía bilateral de la mandíbula con rama dividida sagital. (C) La planificación quirúrgica muestra el retroceso de una mandíbula dividida. (D) Imagen de TC 3D que muestra el hueso cortical (la parte translúcida), el hueso esponjoso rico en médula ósea y el nervio alveolar inferior (rojo) basado en diferentes valores de TC, que puede guiar a los cirujanos para seleccionar el sitio donante y evitar lesiones nerviosas. Se cosecharon astillas de hueso esponjosas de la región en el rectángulo negro. Haga clic aquí para ver una versión más grande de esta figura.
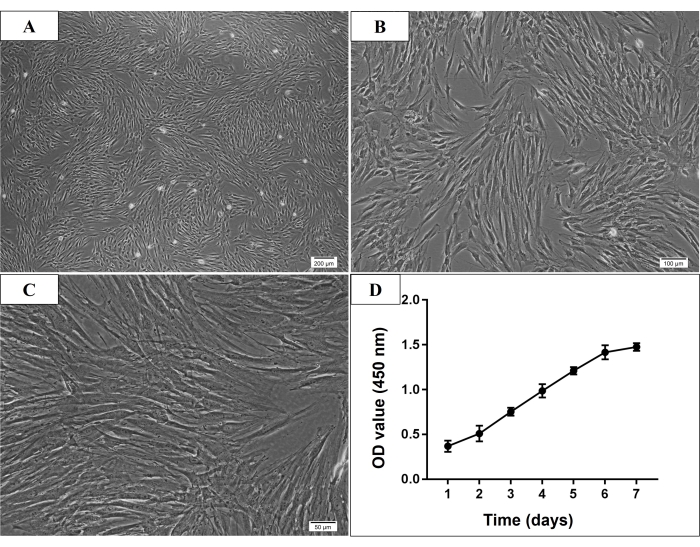
Figura 2: Morfología microscópica y curva de crecimiento de las células madre de médula ósea derivadas de la mandíbula humana P3 (hmBMSC). (A-C) Morfología en forma de huso, adherente al plástico y similar a un fibroblasto de las hmBMSC P3 (barra de escala = 200 μm, 100 μm, 50 μm para A, B, C, respectivamente). (D) La curva de crecimiento celular mostró que la tasa de crecimiento de las hmBMSC aumentó rápidamente a partir del tercer día de cultivo y la tasa de aumento se desaceleró en el sexto día de cultivo. Haga clic aquí para ver una versión más grande de esta figura.
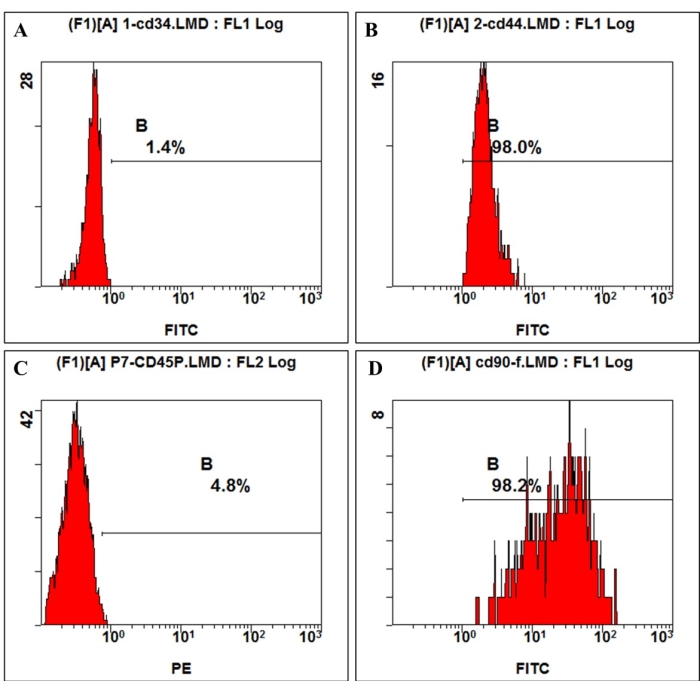
Figura 3: La expresión del antígeno de la superficie celular en las hmBMSC se detectó mediante citometría de flujo. El análisis de citometría de flujo mostró que las hmBMSC fueron negativas para CD45 (A) y CD44 (C), positivas para CD44 (B) y CD90 (D). Haga clic aquí para ver una versión más grande de esta figura.
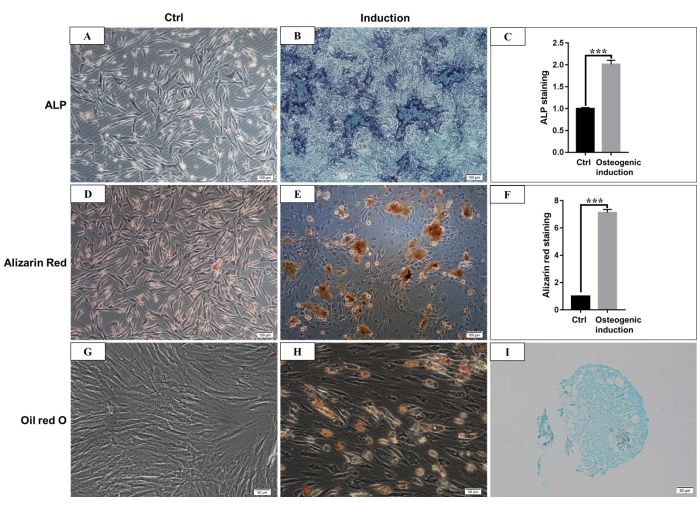
Figura 4: Diferenciación osteogénica, adipogénica y condrogénica de hmBMSC. (A) Tinción de ALP de hmBMSCs después de 7 días de cultivo sin inducción de diferenciación osteogénica (barra de escala = 100 μm). (B) Tinción de ALP de hmBMSCs después de 7 días de inducción de diferenciación osteogénica (barra de escala = 100 μm). (C) Resultados cuantitativos del área positiva de tinción de ALP (***P < 0,001). (D) Tinción con rojo de alizarina de hmBMSCs sin diferenciación osteogénica (barra de escala = 100 μm). (E) La formación de nodos de mineralización obvios se puede ver después de 21 días de diferenciación osteogénica de hmBMSC, y se puede teñir de rojo con tinción roja de alizarina (barra de escala = 100 μm). (F) Resultados cuantitativos de la tinción con rojo de alizarina (***P < 0,001). (G) Tinción de O rojo aceite de hmBMSCs sin diferenciación adipogénica (barra de escala = 50 μm); (H) Se observaron gotas lipídicas redondas después de 21 días de diferenciación adipogénica de hmBMSC, y las gotas de lípidos se tiñeron de rojo con tinción de O rojo aceite (barra de escala = 50 μm). (I) La tinción con azul alcián fue positiva después de 21 días de inducción de la diferenciación condrogénica (barra de escala = 50 μm). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Recientemente, la terapia con hMSCs ha demostrado ser muy prometedora en la regeneración de tejidos y en el tratamiento de muchas enfermedades refractarias, como enfermedades de disfunción inmune, enfermedades hematológicas sistémicas, cánceres o traumatismos, en numerosos ensayos clínicos 1,14,15,16,17. Entre las diversas fuentes de MSC, la médula ósea sigue siendo la fuente más utilizada y de fácil acceso. Utilizamos chips de hueso esponjoso mandibular humano para cultivar con éxito BMSC utilizando el método de adherencia de médula ósea completa descrito en el presente protocolo. Hasta la fecha, existen cuatro enfoques principales para aislar células madre de la médula ósea, incluido el método de adherencia a la médula ósea completa, el método de centrifugación en gradiente de densidad, el método de clasificación de células fluorescentes y el método de clasificación de células activadas magnéticamente10. El método de adherencia a toda la médula ósea es simple, fácil de operar, barato y puede obtener grandes cantidades de células adherentes. Sin embargo, la limitación de este método fue la baja pureza de las BMSC primarias cultivadas, que se mezclaron con células hematopoyéticas y fibroblastos. Después de refrescar regularmente el medio de cultivo de las células primarias, las células hematopoyéticas no adherentes se descartaron junto con el medio descartado. Además, los fibroblastos se pueden eliminar a través del paso celular, y las células P3 eran BMSC altamente purificadas. Por lo tanto, las células P0 a P2 no se pueden usar para la terapia celular, lo que significa que se necesitó tiempo adicional para purificar las células madre. Utilizando los métodos de clasificación de células fluorescentes y de clasificación de células activadas magnéticamente, se pueden obtener BMSC más purificadas, mientras que los dos métodos son caros y un tiempo de selección prolongado puede perjudicarla viabilidad de las células. Para demostrar que las células cultivadas eran MSCs, nos remitimos a la definición de MSCs humanas propuesta por el Comité de Células Madre Mesenquimales y Tisulares de la Sociedad Internacional de Terapia Celular, que incluía el carácter plástico adherente, la expresión positiva y negativa de ciertos fenotipos, como CD45, CD90, etc., y la capacidad de diferenciación multilinaje18.
En la mayoría de los estudios, los fémures y la cresta ilíaca fueron las principales fuentes de CMBM, en comparación con los huesos maxilofaciales, como la mandíbula y el maxilar 9,16. Sin embargo, la teoría de las características específicas del sitio de las hBMSCs en estudios recientes mostró que las hBMSCs de diferentes huesos tenían diferentes caracteres en la capacidad de diferenciación, la actividad proliferativa, la osteogénesis y la inmunidad 6,8. La diferencia site-specific puede estar relacionada con diferentes orígenes embriológicos, adaptación a las demandas funcionales de cada site esquelético, microambiente, aporte vascular local, efectos hormonales, etc. Además, los estudios demostraron que el hueso ilíaco injertado exhibió una pérdida vertical más rápida que el hueso maxilar dentro de los 6 meses posteriores al injerto óseo8. Por otro lado, los estudios han encontrado que la actividad proliferativa de las MSCs de la médula mandibular fue superior a la de la médula ilíaca 5,8,19,20. Y esta diferencia en la actividad proliferativa se atribuyó a los caracteres de que la mandíbula tenía más suministro de sangre y una tasa de recambio óseo más rápida que el ilion 5,6,8. Los estudios también revelaron que las BMSC de la mandíbula expresaron un nivel más alto de Runx-2 y OCN que las de los fémures, y la capacidad osteogénica de las BMSC de la mandíbula fue igual o mayor que las de los fémures y el ilion 5,19,21. También se encontró que la adherencia al titanio de las hmBMSCs era más fuerte que la de las BMSCs de los fémures, lo que sugiere que las hmBMSCs eran más apropiadas para ser utilizadas en implantología oral5. Además, un estudio clínico de 3 años para reconstruir el defecto alveolar encontró que el hueso regenerado de las MSC de la pulpa dental estaba compuesto por un hueso completamente compacto con una mayor densidad de matriz, mientras que las BMSC hm regeneraron hueso esponjoso similar a la estructura ósea alveolar humana normal22. En conclusión, las hmBMSCs fueron células madre terapéuticas ideales para la regeneración maxilofacial y otras enfermedades debido a su mismo origen embriológico y sus características superiores.
Sin embargo, la mandíbula tiene menos médula ósea que los fémures y el ilion, por lo que es importante obtener suficiente médula ósea y BMSC de la mandíbula para su uso clínico. Los aspirados ilíacos humanos pueden obtener grandes cantidades de médula ósea para aislar las MSCs. Los investigadores también utilizaron los aspirados mandibulares para obtener MSCs, mientras que el rendimiento inicial de las MSCs de los aspirados mandibulares fue tres veces menor que el de los aspirados ilíacos21. Se necesitaron incisiones adicionales para recolectar suficientes aspirados de médula mandibular, lo que agregó trauma quirúrgico adicional. Además, los estudios han demostrado que el potencial proliferativo de las MSCs de las astillas de hueso de la mandíbula puede ser superior al de los aspirados de médula mandicular 8,21. Por lo tanto, en este estudio, se utilizaron los fragmentos de hueso esponjoso de la mandíbula descartados para aislar las MSC. Debido a que ambos lados de la mandíbula se incluyeron en la osteotomía de rama dividida sagital o en la plastia de reducción del ángulo mandibular, podemos obtener suficiente médula mandibular de los pacientes sin ningún daño adicional. Recientemente, la tecnología asistida por ordenador ha sido ampliamente utilizada en cirugía oral y maxilofacial para mejorar el efecto quirúrgico y reducir las complicaciones quirúrgicas23. Para evitar lesiones de la mandíbula y el nervio durante la extracción de médula ósea de la mandíbula, se obtuvo la imagen TAC 3D de la mandíbula de los donantes, y se analizó la planificación quirúrgica de los donantes para decidir los sitios de los donantes e implementar la simulación quirúrgica en el estudio; Por lo tanto, no se produjo ninguna de las complicaciones quirúrgicas. La cuchilla ultrasónica de osteótomo, un dispositivo específico de tejido que permite a los cirujanos realizar osteotomías precisas mientras protegen el tejido blando adyacente24, también se utilizó para evitar lesiones de tejidos blandos y preservar la actividad de la médula ósea obtenida.
En resumen, este estudio describe un protocolo fiable, sencillo, seguro y barato para aislar y cultivar MSCs mandibulares humanas adecuadas, que pueden ser utilizadas en terapias celulares de tejidos dentales y maxilofaciales.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
El estudio contó con el apoyo de la Fundación Nacional de Ciencias Naturales de China (No.81903249) y el Programa de Investigación Básica de Ciencias Naturales de la provincia de Shaanxi (No.2019JQ-701, No.2022JZ-50).
Materiales
| Name | Company | Catalog Number | Comments |
| 4% Paraformaldehyde | PlantChemMed | PC-00005 | |
| Adipogenic differentiation medium | OriCell, Cyagen Biosciences | HUXMX-90031 | |
| Alcian blue solution | OriCell, Cyagen Biosciences | ALCB-10001 | |
| Alcohol | Macklin | e809056 | |
| Alizarin red staining solution | Solarbio | G1452 | |
| ALP staining solution | Beijing ComWin Biotech Co.,Ltd. | CW0051S | |
| Autoclave | ALP Co., Ltd., Japan | CL-40L | |
| CCK-8 solution | Yeasen Biotech Co., Ltd. | 40203ES80 | |
| Cell filter (70 μm pore size) | BD Biosciences | 352350 | |
| Cell incubator | Thermo Fisher Scientific | 41334177 | |
| Centrifuge | Eppendorf | 5805ZP761456 | |
| Centrifuge tube (50 mL, 15 mL) | Sangon Biotech | F600888-9001 | |
| Cetylpyridinium chloride | Aladdin | H108696 | |
| Chondrogenesis differentiation medium | OriCell, Cyagen Biosciences | HUXMX-90041 | |
| Clean bench/Laminar flow cabinet | BIOBASE | BBS-DDS00030 | |
| Culture dish (6 cm) | Thermo | 150462 | |
| Culture flasks (25 cm) | Thermo | 156367 | |
| Culture plates (96-well, 6-well) | Corning-Costar | 352350 | |
| Disposable sterile gloves and masks | Sangon Biotech | F516018-9001;F516038-9001 | |
| Disposable sterile syringe (1 mL) | Shaanxi longkangxin Medical Instrument Co., Ltd | 1.00009E+11 | |
| Dulbecco's modified Eagle's medium with high glucose (HG-DMEM) | Hyclone | SH30022.01B | |
| EDTA | Solarbio | E8040-500g | |
| Fetal bovine serum (FBS) | PlantChemMed | PC-00001 | |
| Flow cytometer | Beckman Coulter | EPICS XL | |
| Fluorescein-isothiocyanate (FITC)-conjugated mouse monoclonal anti-human antibody against CD34 | Biolegend | 343503 | |
| Fluorescein-isothiocyanate (FITC)-conjugated mouse monoclonal anti-human antibody against CD44 | Biolegend | 338804 | |
| Fluorescein-isothiocyanate (FITC)-conjugated mouse monoclonal anti-human antibody against CD90 | Biolegend | 328108 | |
| Hemocytometer | Koraba | 30119480698 | |
| Icebox | Sangon Biotech | F615002-0001 | |
| Image J software | National Institute of Mental Health | ||
| Light microscope | OLYMPUS | IX71-2L20944 | |
| Microcentrifuge tubes | Sangon Biotech | F601620-0010 | |
| Microplate spectrophotometer | BioTek-EPOCH | 259091 | |
| Microtome | Feica | 1003001 | |
| Mimics software | Materialise | ||
| Minimum essential medium alpha (α-MEM) | Hyclone | SH30265.01 | |
| Oil red O staining solution | Solarbio | G1261 | |
| Osteogenic differentiation medium | OriCell, Cyagen Biosciences | HUXMA-90021 | |
| Penicillin and streptomycin | PlantChemMed | PC-86115 | |
| Phosphate buffer saline (PBS) | PlantChemMed | PC-00003 | |
| Phycoerythrin (PE)-conjugated mouse monoclonal anti-human antibody against CD45 | Biolegend | 304008 | |
| Pipette | SORFA | 320511 | |
| ProPlan CMF 3.0 | Materialise | ||
| Scissors, tweezers and knives | Shanghai Jinzhong Surgical instrument Co., Ltd | ZJA030,YAA110,J11010 | |
| Sterile wet gauze | HENAN PIAOAN GROUP Co., Ltd | ||
| Trypsin | Gibco | 17075029 | |
| Ultrasonic osteotome blade | Stryker Instruments | 5450-815-107 |
Referencias
- Ullah, I., Subbarao, R. B., Rho, G. J. Human mesenchymal stem cells - current trends and future prospective. Bioscience Reports. 35 (2), 1-8 (2015).
- Brown, C., et al. Mesenchymal stem cells: Cell therapy and regeneration potential. Journal of Tissue Engineering and Regenerative Medicine. 13 (9), 1738-1755 (2019).
- Trohatou, O., Maria, G. R. Mesenchymal stem/stromal cells in regenerative medicine: Past, present, and future. Cellular Reprogramming. 19 (4), 217-224 (2017).
- Heo, J. S., Choi, Y., Kim, H. S., Kim, H. O. Comparison of molecular profiles of human mesenchymal stem cells derived from bone marrow, umbilical cord blood, placenta and adipose tissue. International Journal of Molecular Medicine. 37 (1), 115-125 (2016).
- Li, C. J., Wang, F. F., Zhang, R., Qiao, P. Y., Liu, H. C. Comparison of proliferation and osteogenic differentiation potential of rat mandibular and femoral bone marrow mesenchymal stem cells in vitro. Stem Cells and Development. 29 (11), 728-736 (2020).
- Lloyd, B., et al. Similarities and differences between porcine mandibular and limb bone marrow mesenchymal stem cells. Archives of Oral Biology. 77 (5), 1-11 (2017).
- Yamaza, T., et al. Mouse mandible contains distinctive mesenchymal stem cells. Journal of Dental Research. 90 (3), 317-324 (2011).
- Akintoye, S. O., et al. Skeletal site-specific characterization of orofacial and iliac crest human bone marrow stromal cells in same individuals. Bone. 38 (6), 758-768 (2006).
- Mendi, A., Ulutürk, H., Ataç, M. S., Stem Yılmaz, D. cells for the oromaxillofacial area: Could they be a promising source for regeneration in dentistry. Advances in Experimental Medicine and Biology. 11 (44), 101-121 (2019).
- Hong, Y. Y., et al. Isolation and cultivation of mandibular bone marrow mesenchymal stem cells in rats. Journal of Visualized Experiments. (162), e61532(2020).
- Chu, D. T., et al. An update on the progress of isolation, culture, storage, and clinical application of human bone marrow mesenchymal stem/stromal cells. International Journal of Molecular Sciences. 21 (3), 708(2020).
- Yu, Y. J., et al. Activation of mesenchymal stem cells promotes new bone formation within dentigerous cyst. Stem Cell Research & Therapy. 11 (1), 476(2020).
- Sadeghipour, A., Babaheidarian, P. Making formalin-fixed, paraffin embedded blocks. Methods in Molecular Biology. 1897, 253-268 (2019).
- Mathiasen, A. B., et al. marrow-derived mesenchymal stromal cell treatment in patients with ischaemic heart failure: final 4-year follow-up of the MSC-HF trial. European Journal of Heart Failure. 22 (5), 884-892 (2020).
- Maqsood, M., et al. Adult mesenchymal stem cells and their exosomes: Sources, characteristics, and application in regenerative medicine. Life Sciences. 01 (256), 118002(2020).
- Reinders, M. J., et al. Autologous bone marrow-derived mesenchymal stromal cell therapy with early tacrolimus withdrawal: The randomized prospective, single-center, open-label TRITON study. American Journal of Transplantation: Official Journal of the American Society of Transplantation and the American Society of Transplant Surgeons. 21 (9), 3055-3065 (2021).
- Shi, H. Y., et al. marrow-derived mesenchymal stem cells promote Helicobacter pylori-associated gastric cancer progression by secreting thrombospondin-2. Cell Proliferation. 54 (10), 13114(2021).
- Dominici, M., et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8 (4), 315-317 (2006).
- Aghaloo, T. L., et al. Osteogenic potential of mandibular vs. long-bone marrow stromal cells. Journal of Dental Research. 89 (11), 1293-1298 (2010).
- Dong, W. J., et al. Phenotypic characterization of craniofacial bone marrow stromal cells: unique properties of enhanced osteogenesis, cell recruitment, autophagy, and apoptosis resistance. Cell and Tissue Research. 358 (1), 165-175 (2014).
- Lee, B. K., Choi, S. J., Mack, D., Oh, S. H. Isolation of mesenchymal stem cells from the mandibular marrow aspirates. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontics. 112 (6), 86-93 (2011).
- Giuliani, A., et al. Three years after transplants in human mandibles, histological and in-line holotomography revealed that stem cells regenerated a compact rather than a spongy bone: biological and clinical implications. Stem Cells Translational Medicine. 2 (4), 316-324 (2013).
- Chen, Y. W., et al. Computer-assisted surgery in medical and dental applications. Expert Review of Medical Devices. 18 (7), 669-696 (2021).
- Gilles, R., Couvreur, T., Dammous, S. Ultrasonic orthognathic surgery: enhancements to established osteotomies. International Journal of Oral and Maxillofacial Surgery. 42 (8), 981-987 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados