A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحليل مورفولوجيا المستقيم العضوي (ROMA): اختبار تشخيصي في التليف الكيسي
In This Article
Summary
يصف هذا البروتوكول تحليل مورفولوجيا المستقيم العضوي (ROMA) ، وهو اختبار تشخيصي جديد للتليف الكيسي (CF). الخصائص المورفولوجية ، وهي الاستدارة (مؤشر الدائرية ، CI) ووجود التجويف (نسبة الشدة ، الأشعة تحت الحمراء) ، هي مقياس لوظيفة CFTR. أظهر تحليل 189 شخصا تمييزا تاما بين التليف الكيسي وغير التليف الكيسي.
Abstract
تشخيص التليف الكيسي (CF) ليس دائما مباشرا ، خاصة عندما يكون تركيز كلوريد العرق متوسطا و / أو يمكن تحديد أقل من طفرتين من CFTR المسببة للمرض. تم تضمين فحوصات CFTR الفسيولوجية (فرق جهد الأنف ، قياس التيار المعوي) في خوارزمية التشخيص ولكنها ليست دائما متاحة بسهولة أو مجدية (على سبيل المثال ، عند الرضع). عضويات المستقيم هي هياكل 3D التي تنمو من الخلايا الجذعية المعزولة من خبايا خزعة المستقيم عند زراعتها في ظل ظروف محددة. المواد العضوية من الموضوعات غير CF لها شكل دائري وتجويف مملوء بالسوائل ، حيث أن نقل الكلوريد بوساطة CFTR يدفع الماء إلى التجويف. لا تنتفخ المواد العضوية ذات وظيفة CFTR المعيبة ، وتحتفظ بشكل غير منتظم وليس لها تجويف مرئي. يتم تحديد الاختلافات في التشكل بين المواد العضوية CF وغير CF في "تحليل مورفولوجيا المستقيم العضوي" (ROMA) كاختبار فسيولوجي CFTR جديد. بالنسبة لفحص ROMA ، يتم طلاء المواد العضوية في 96 لوحة بئر ، ملطخة بالكالسين ، ويتم تصويرها في مجهر متحد البؤر. يتم قياس الاختلافات المورفولوجية باستخدام مؤشرين: يحدد مؤشر الدائرية (CI) استدارة الكائنات العضوية ، ونسبة الشدة (IR) هي مقياس لوجود تجويف مركزي. تحتوي المواد العضوية غير CF على CI مرتفع ومنخفض IR مقارنة بعضويات CF. ميزت مؤشرات ROMA تماما بين 167 شخصا مصابا بالتليف الكيسي من 22 شخصا بدون التليف الكيسي ، مما يجعل ROMA مقايسة CFTR الفسيولوجية الجذابة للمساعدة في تشخيص التليف الكيسي. يمكن إجراء خزعات المستقيم بشكل روتيني في جميع الأعمار في معظم المستشفيات ويمكن إرسال الأنسجة إلى مختبر مركزي لزراعة الأعضاء وروما. في المستقبل ، يمكن أيضا تطبيق ROMA لاختبار فعالية معدلات CFTR في المختبر. والهدف من هذا التقرير هو تقديم شرح كامل للأساليب المستخدمة في الروما، للسماح بتكرارها في مختبرات أخرى.
Introduction
التليف الكيسي (CF) هو مرض صبغي جسدي متنحي ناتج عن طفرات في جين منظم التوصيل عبر الغشاء CF (CFTR). بروتين CFTR عبارة عن قناة كلوريد وبيكربونات ، مما يضمن ترطيب العديد من الظهارة1. التليف الكيسي هو مرض عالي العبء ، يقصر العمر ، متعدد الأنظمة ، ويظهر في المقام الأول كمرض تنفسي ، ولكنه يؤثر أيضا على الجهاز الهضمي والبنكرياس والكبد والجهاز التناسلي2.
تؤدي طفرات CFTR المسببة للأمراض إلى انخفاض في كمية أو وظيفة CFTR ، مما يؤدي بدوره إلى جفاف المخاط. تم وصف أكثر من 2000 متغير في جين CFTR 3 ، منها 466 فقط تم توصيفها بدقة4.
يمكن إجراء تشخيص التليف الكيسي عندما يكون تركيز كلوريد العرق (SCC) أعلى من عتبة 60 مليمول / لتر أو عندما يتم تحديد طفرتين من CFTR المسببة للأمراض (وفقا لقاعدة بيانات CFTR2) 4,5. في الأشخاص الذين لديهم SCC مرتفع بشكل متوسط فقط (30-60 مليمول / لتر) ، والذي يحدث في حوالي 4٪ -5٪ من اختبارات العرق6 ، وطفرات CFTR ذات العواقب السريرية المتفاوتة أو غير المعروفة ، لا يمكن تأكيد التشخيص أو استبعاده ، حتى عندما يكون لديهم أعراض متوافقة مع التليف الكيسي أو اختبار فحص حديثي الولادة إيجابي. بالنسبة لهذه الحالات ، تم تضمين فحوصات CFTR الفسيولوجية للخط الثاني (فرق الجهد الأنفي (NPD) وقياسات التيار المعوي (ICM)) في خوارزمية التشخيص. هذه الاختبارات ليست متاحة بسهولة في معظم المراكز ولا يمكن إجراؤها في جميع الأعمار ، خاصة عند الرضع5.
العضويات الشرجية هي هياكل ثلاثية الأبعاد نمت من Lgr5 (+) الخلايا الجذعية المعوية البالغة من الخبايا المعوية التي تم الحصول عليها من خلال خزعة المستقيم7. يتم استخدام المواد العضوية بشكل متزايد في الأبحاث الطبية الحيوية ، مثل اختبار علاج المغير في CF8. يمكن الحصول على خزعة قابلة للحياة إما عن طريق الشفط أو خزعة الملقط ، وهو إجراء لا يسبب سوى الحد الأدنى من الانزعاج وهو آمن حتى عند الرضع ، مع معدلات مضاعفات منخفضة9. يتم إثراء الخبايا المعزولة من خزعات المستقيم في الخلايا الجذعية ، وفي ظل ظروف زراعة محددة ، يتم تنظيمها ذاتيا في عضويات مستقيمية. يتم تحديد مورفولوجيا هذه المواد العضوية من خلال التعبير عن وظيفة CFTR ، الموجودة في الغشاء القمي للخلايا الظهارية. يسمح CFTR الوظيفي للكلوريد والماء بدخول التجويف العضوي ، مما يؤدي إلى تورم المواد العضوية غير CF. لا تنتفخ عضويات CF وليس لها تجويف مرئي10,11.
يسمح تحليل مورفولوجيا المستقيم العضوي (ROMA) بالتمييز بين الكائنات العضوية CF وغير CF بناء على هذه الاختلافات في التشكل العضوي. المواد العضوية غير CF أكثر استدارة ولها تجويف مرئي ، في حين أن العكس صحيح بالنسبة للعضويات CF. لهذا الفحص ، يتم طلاء المواد العضوية الخاصة بالمريض في 32 بئرا من صفيحة 96 بئرا. بعد 1 يوم من النمو ، يتم تلطيخ المواد العضوية باللون الأخضر الكالسيين وتصويرها في مجهر متحد البؤر. تظهر المواد العضوية غير CF شكلا دائريا أكثر وجزءا مركزيا أقل فلورية ، حيث يحتوي التجويف على بقع سائلة وكالسيين خلايا فقط. يتم قياس هذه الاختلافات في التشكل باستخدام مؤشرين ROMA: مؤشر الدائرية (CI) يحدد استدارة المواد العضوية ، في حين أن نسبة الشدة (IR) هي مقياس لوجود أو عدم وجود تجويف مركزي. في هذا التقرير ، نصف بالتفصيل بروتوكول الحصول على هذه الفهارس التمييزية ، للسماح بتكرار التقنية.
Protocol
بالنسبة لجميع الإجراءات التي تنطوي على الأنسجة البشرية ، تم الحصول على موافقة لجنة الأخلاقيات Research UZ/KU Leuven (أبحاث EC). تم إجراء جميع الأبحاث بموافقة مستنيرة و / أو موافقة من الآباء والممثلين و / أو المرضى.
ملاحظة: يجب إجراء جميع الإجراءات التي تنطوي على خزعات المستقيم والمواد العضوية في تدفق رقائقي لحماية الباحث من أي خطر بيولوجي وتقليل مخاطر تلوث الثقافات. كما هو الحال بالنسبة لأي إجراء مختبري ، يجب على الباحثين في جميع الأوقات ارتداء معاطف المختبر والقفازات ونظارات السلامة للتلاعب بالعينات.
1. خزعة المستقيم ، وعزل الخلايا الجذعية البالغة من الخبايا ، والثقافة العضوية
- بالنسبة لهذا الجزء الأولي من البروتوكول ، بما في ذلك إنتاج الوسائط واستخدامها ، والثقافة العضوية ، والتقسيم ، والتوسع ، والتجميد للبنوك الحيوية ، اتبع البروتوكولين المنشورين سابقا 8,12.
- باختصار ، يجب اتخاذ الخطوات التالية:
- خذ ثلاث إلى أربع خزعات من المستقيم باستخدام ملقط أو جهاز شفط وقم بتجميعها في حاوية معقمة (على سبيل المثال ، أنبوب طرد مركزي دقيق سعة 1.5 مل) باستخدام وسيط Ad-DF +++ كما هو موضح في البروتوكول المذكور أعلاه.
- نقل الخزعات إلى مختبر مركزي على الجليد أو عند 4 درجات مئوية. النقل إلى مراكز أخرى ممكن ، ولا تتأثر الجودة بشكل كبير حتى عندما يستغرق النقل ما يصل إلى 48 ساعة. إذا كان من المتوقع أن يستغرق النقل أكثر من 6 ساعات ، فاستخدم أنبوبا مخروطيا سعة 15 مل مع 6 مل من وسيط Ad-DF +++ بدلا من أنبوب طرد مركزي دقيق سعة 1.5 مل.
- اغسل الخزعات في برنامج تلفزيوني بارد حتى يصبح الطافي واضحا لإزالة الحطام والأنسجة غير الظهارية مثل الأنسجة الدهنية.
- احتضان الخزعات باستخدام EDTA (التركيز النهائي 10 مللي متر) لفصل الخبايا. لوحة الخبايا في مصفوفة الغشاء القاعدي. أضف المضادات الحيوية واسعة الطيف (جنتاميسين 50 ميكروغرام / مل وفانكومايسين 50 ميكروغرام / مل) إلى الوسط في الأسبوع الأول من الزراعة لمنع التلوث البكتيري.
- عندما تتبرعم الخبايا وتغلق وتتكاثر ، قم بإجراء تقسيم ميكانيكي ، عادة بعد 7 أيام.
- تقسيم المواد العضوية الناتجة كل 7 أيام تقريبا. بهذه الطريقة ، قم بتوسيع الثقافة ، أو تجميد العينات الاحتياطية في البنك الحيوي ، أو استخدام المواد العضوية للمقايسات.
2. طلاء عضوي لروما (اليوم 1)
- تقسيم عضوي ميكانيكيا للطلاء
- اجمع المواد العضوية من ثلاثة آبار جيدة النمو من صفيحة مكونة من 24 بئرا عن طريق غسلها مرتين بوسط Ad-DF +++ البارد ، واجمعها في أنبوب طرد مركزي دقيق سعة 1.5 مل ، وقم بتقييمها تحت المجهر12.
- تأكد من أن الكائنات العضوية قابلة للحياة وذات جودة عالية ، والتي يمكن تحقيقها عادة بعد 5-7 أيام من النمو بعد تقسيمها مسبقا (الشكل 1).
- تقسيم المواد العضوية ميكانيكيا وفقا للبروتوكولالمذكور أعلاه 8,12. كرر حتى تصبح غالبية الكائنات العضوية ، كما تم تقييمها باستخدام مجهر برايت فيلد ، صغيرة بما يكفي مقارنة بالملاحظة الأولية.
- اجمع العضويات الأصغر ، والتي تتوافق عادة مع جمع حوالي 4/5 الجزء العلوي من محلول الوسط العضوي في أنبوب طرد مركزي دقيق جديد ، حيث تغرق الكائنات العضوية الكبيرة في قاع الأنبوب بسبب الجاذبية وتبقى المواد العضوية الصغيرة معلقة في الجزء العلوي من العمود المتوسط.
- جهاز طرد مركزي لعينة من المواد العضوية الأصغر عند 0.3 × 1000 جم لمدة 2 دقيقة وتخلص من الوسيط.
- تمييع بيليه من المواد العضوية الأصغر في 130 ميكرولتر من مصفوفة الغشاء القاعدي 40٪ -50٪ (مخففة بوسط Ad-DF +++12).
- أعد تعليق البئر باستخدام ماصة صغيرة سعة 200 ميكرولتر.
- صفيحة المواد العضوية في صفيحة من 96 بئرا
- باستخدام ماصة 20 ميكرولتر ، لوحة عضويات في 32 بئرا من لوحة 96 بئر تم تسخينها مسبقا. تأكد من أن كل بئر يحتوي على قطرة واحدة 4 ميكرولتر من محلول المصفوفة العضوية المنتج في الخطوة السابقة.
- تميل الكائنات العضوية في المحلول إلى تكوين حبيبات في أسفل الأنبوب بسبب الإزاحة السفلية المعتمدة على الجاذبية. لمنع ذلك وضمان طلاء موحد ، أعد تعليق محلول المصفوفة العضوية بانتظام باستخدام ماصة صغيرة سعة 200 ميكرولتر (على سبيل المثال ، في كل مرة بعد الطلاء من أربعة إلى ثمانية آبار).
- ضع كل قطرة في وسط البئر لمنع القطرة من الجري نحو حواف البئر ، مما يقلل من جودة الصورة لاحقا.
- استهدف حوالي 30 مادة عضوية لكل بئر (الحد الأدنى 15 ، الحد الأقصى 90) دون تداخل المواد العضوية.
- ضع في اعتبارك أنه يجب تحضين هذه المواد العضوية بين عشية وضحاها وستنمو قليلا خلال هذا الوقت ، وقد تبدأ في التداخل إذا كانت كثافة الطلاء عالية جدا.
- تحقق من كثافة الطلاء باستخدام مجهر برايت فيلد مع هدف تكبير 5x بعد طلاء أول بئر أو بئرين.
- إذا كانت كثافة الطلاء عالية جدا ، فقم بتخفيف محلول المصفوفة العضوية تدريجيا مع إضافة مصفوفة غشاء الطابق السفلي حتى يتم الوصول إلى كثافة الطلاء المطلوبة (الشكل 2).
- بعد الطلاء ، اضغط برفق على اللوحة على سطح مستو للتأكد من أن غالبية الكائنات العضوية في نفس المستوى البؤري.
- احتضان اللوحة
- احتضان لوحة 96 بئر عند 37 درجة مئوية و 5٪ CO2 خلال 8-10 دقائق للسماح بهلام مصفوفة الغشاء القاعدي.
- أضف 50 ميكرولتر من وسط القولون العضوي البشري +/+12 في كل بئر واحتضانه طوال الليل لمدة 16-24 ساعة.
- لا تضيف أي فورسكولين ولا معدلات CFTR ، لذلك تنمو المواد العضوية في ظل الظروف القاعدية.
3. التصوير العضوي باستخدام الفحص المجهري متحد البؤر (اليوم 2)
- وصمة عار المواد العضوية مع كالسيين الأخضر
- قم بإعداد محلول مخزون 1 مللي مول من الكالسيين الأخضر بإضافة 50 ميكرولتر من ثنائي ميثيل سلفوكسيد (DMSO) إلى قارورة واحدة تحتوي على 50 ميكروغرام من الكالسين الأخضر.
- قم بإعداد محلول عمل من الكالسيين الأخضر بإضافة 1.2 ميكرولتر من محلول المخزون إلى 200 ميكرولتر من Ad-DF +++ (تركيز 6 ميكرومتر).
- أضف 5 ميكرولتر من خليط الكالسيين هذا إلى كل بئر من صفيحة 96 بئرا التي تم فيها طلاء المواد العضوية (تركيز الكالسيين النهائي 0.6 ميكرومتر). لا تلمس وخلع قطرة المصفوفة داخل البئر عند تنفيذ هذه الخطوة.
- قم بتدوير اللوحة وإمالتها قليلا مع الغطاء عدة مرات لضمان التوزيع المتجانس للكالسيين الأخضر في البئر بالكامل.
- احتضان اللوحة مرة أخرى لمدة 15-30 دقيقة عند 37 درجة مئوية و 5٪ CO2 لضمان تلطيخ جميع المواد العضوية في الآبار.
- نقل اللوحة إلى المجهر متحد البؤر
- انقل اللوحة إلى المجهر متحد البؤر بمرحلة آلية وحاضنة متكاملة. تأكد من أن اللوحة مثبتة جيدا في حامل اللوحة.
- الحضانة عند 37 درجة مئوية و 5٪ CO2 اختيارية ولكنها ليست ضرورية ، نظرا لقصر مدة عملية التصوير (حوالي 10 دقائق).
- التركيز على المواد العضوية (الشكل 3)
- باستخدام المجهر متحد البؤر ، حدد الموضع الأمثل x / y والتركيز (موضع z) للعضويات في كل بئر يدويا ، واحفظ هذه المواضع في برنامج التصوير.
- أفضل تركيز ينطوي على تحديد أكثر حدة ممكنة من المواد العضوية وتصور أكبر جزء ممكن من انخفاض العضوية. إذا كان توزيع البقعة غير كاف ، كرر الخطوتين 3.1.4 و 3.1.5 (احتضان ، على سبيل المثال ، لمدة 5-10 دقائق إضافية).
- استخدم إعدادات تصوير الخلايا الحية مع انبعاث عند 488 نانومتر وإثارة عند 515 نانومتر (محدد لتصور مضان الكالسين) وهدف تكبير LD 5x.
- الحصول على صور عضوية للآبار ال 32 باستخدام المجهر متحد البؤر (الشكل 3 والشكل 4).
- التقط الصور بطريقة أحادية الاتجاه بدقة 1024 بكسل × 1024 بكسل (حجم البكسل 2.5 ميكرومتر × 2.5 ميكرومتر) وعمق 16 بت.
- اختر شدة الليزر والكسب الرئيسي للتصور الأمثل للاختلافات المورفولوجية بين المواد العضوية CF وغير CF (على سبيل المثال ، التمييز بين التجويف المركزي غير الملطخ المملوء بالماء (إن وجد) والحدود الخلوية الملطخة).
ملاحظة: لن يتم تحديد المواد العضوية بشكل صحيح عندما يكون الكسب الرئيسي وبالتالي إشارة التألق منخفضة جدا ؛ سيؤدي تعيين الكسب الرئيسي إلى ارتفاع كبير جدا في الحصول على صور ذات مواد عضوية ذات كثافة إشارة متجانسة عالية جدا ، مما يمنع تصوير الاختلافات المورفولوجية الأكثر دقة (الشكل 2). - احفظ صورة واحدة لكل بئر لجميع الآبار ال 32 بتنسيق المجهر وقم بتصديرها كملفات TIFF.
4. تحليل الصور (الشكل 5)
- قم بتحميل ملفات TIFF في برنامج تحليل الصور.
- قم بإجراء فحص الجودة الأول بناء على معايير الاستبعاد التي يحددها المشغل (الشكل 2): العديد من الهياكل أو الحطام المتمايز أو الميت ، وكثافة الطلاء غير الكافية ، والكثير جدا (على سبيل المثال ، المتداخلة) أو القليل جدا من المواد العضوية ، والتوزيع الفلوري غير الكافي (المواد العضوية غير محددة بوضوح ، إشارة الخلفية عالية جدا).
ملاحظة: يمكن أيضا تنفيذ هذه الخطوة قبل تصدير الصور كملفات TIFF في الخطوة 3.4. - إعداد الصور للتحليل
- أعد معايرة الصور ، بحيث يتوافق 1 بكسل مع 2.5 ميكرومتر × 2.5 ميكرومتر.
- إنشاء وفتح واحد بيانات الشبكة (. ND) لجميع الصور ال 32 لكل ثقافة عضوية ، مما يتيح التحليل المتزامن لجميع الصور ال 32 لكل موضوع.
- تحديد المواد العضوية
- تحديد الهياكل باستخدام عتبة كثافة أقل تبلغ 4,500 وعتبة عليا تبلغ 65,535 (إيقاف تشغيل الوظائف السلسة والنظيفة ؛ ملء الثقوب وظيفة على; وظيفة منفصلة في x3).
ملاحظة: يحدد هذا هياكل الفلورسنت ، مع فتحات التعبئة بما في ذلك التجويف في الهيكل المحدد إن وجد.
- تحديد الهياكل باستخدام عتبة كثافة أقل تبلغ 4,500 وعتبة عليا تبلغ 65,535 (إيقاف تشغيل الوظائف السلسة والنظيفة ؛ ملء الثقوب وظيفة على; وظيفة منفصلة في x3).
- عد المواد العضوية
- حدد جميع الهياكل ≥40 ميكرومتر.
- انقر على تحديث قياس ND زر (في كل مرة تكون هناك حاجة إلى قياس) ؛ سيتم ترقيم المواد العضوية المعدودة.
ملاحظة: هذا يساوي العدد الإجمالي للكائنات العضوية في الآبار ال 32 ، بينما يتم استبعاد الحطام الصغير ، مثل الخلايا الميتة.
- قياس الكثافة والدائرية لحساب المؤشرات
- حدد جميع الهياكل ≥60 ميكرومتر والعد.
ملاحظة: هذا يحسب المواد العضوية كبيرة بما يكفي لإظهار مورفولوجيا نموذجية إما CF أو غير CF. المواد العضوية >40 ميكرومتر و <60 ميكرومتر صغيرة وكثيفة ، سواء في غير CF أو في CF. - قم بإزالة جميع الهياكل التي تلامس حدود الصورة. افعل ذلك لإزالة الكائنات العضوية غير المرئية تماما ، حيث لا يمكن تحديد مورفولوجيتها بدقة.
- تآكل 1 بكسل (= 2.5 ميكرومتر) من حدود كل هيكل ≥60 ميكرومتر. هذا يزيل هالة مضان الكالسيين المنتشر المحيط بالمواد العضوية.
- قياس متوسط شدة كل هيكل. بهذه الطريقة ، يتم قياس متوسط مضان المواد العضوية.
- حدد جميع الهياكل ≥60 ميكرومتر مرة أخرى وقم بإزالة جميع الهياكل التي تلامس الحدود.
- تآكل 10 بكسل (= 25 ميكرومتر) من حدود كل هيكل ≥60 ميكرومتر.
ملاحظة: في المواد العضوية غير CF ، يؤدي هذا إلى تآكل الحدود الخلوية ويترك التجويف فقط. في عضويات CF ، يؤدي هذا إلى تآكل الجزء الخارجي من العضو العضوي ، والذي له نفس التألق تقريبا مثل الجزء الداخلي المتبقي. - قم بقياس متوسط شدة كل هيكل متآكل. بهذه الطريقة ، يتم قياس متوسط مضان الجزء المركزي من المواد العضوية.
- قياس دائرية كل هيكل. هذا يتوافق مع متوسط دائرية المواد العضوية.
- حدد جميع الهياكل ≥60 ميكرومتر والعد.
- قم بإجراء فحص الجودة الثاني: معايير الاستبعاد التي يحددها البرنامج. استبعد مجموعة الصور عندما يكون أقل من 50٪ من المواد العضوية (المعرفة على أنها هياكل ≥40 ميكرومتر) ≥60 ميكرومتر ، حيث يجب أن تكون المواد العضوية الكافية كبيرة بما يكفي لإظهار مورفولوجيا نموذجية إما ل CF أو غير CF. استبعد أيضا عند وجود <500 أو >3000 مادة عضوية (تعرف بأنها هياكل ≥40 ميكرومتر) في الآبار ال 32.
5. قياس المؤشرات في برنامج التصوير (الشكل 6)
- قياس مؤشر الدائرية (CI).
ملاحظة: هذا يتوافق مع متوسط الدائرية المقاسة في الخطوة 4.6 ، وهو متوسط الدائرية لجميع المواد العضوية في جميع الآبار ال 32. يحدد CI استدارة المواد العضوية ، والتي تعرف بأنها ، وهي أقل في CF منها في المواد العضوية غير CF
، وهي أقل في CF منها في المواد العضوية غير CF - قياس نسبة الشدة (IR)
- احسب الأشعة تحت الحمراء بقسمة متوسط قياس الشدة بعد تآكل 25 ميكرومتر من حد كل بنية ≥60 ميكرومتر على متوسط قياس الشدة بعد تآكل 2.5 ميكرومتر من حدود كل بنية ≥60 ميكرومتر.
ملاحظة: يقيس الأشعة تحت الحمراء وجود أو عدم وجود تجويف مركزي. الأشعة تحت الحمراء تساوي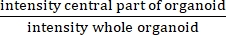 ، وهي أعلى في التليف الكيسي منها في المواد العضوية غير CF.
، وهي أعلى في التليف الكيسي منها في المواد العضوية غير CF.
- احسب الأشعة تحت الحمراء بقسمة متوسط قياس الشدة بعد تآكل 25 ميكرومتر من حد كل بنية ≥60 ميكرومتر على متوسط قياس الشدة بعد تآكل 2.5 ميكرومتر من حدود كل بنية ≥60 ميكرومتر.
- تبسيط عملية التحليل
- قم بإعداد ورقة عمل قياسية باستخدام برنامج جداول البيانات لحساب هذه المؤشرات تلقائيا عند نسخ البيانات (الشكل 7).
- لحساب IR:
- خذ قياس الشدة بعد تآكل 2.5 ميكرومتر من حدود كل هيكل ≥60 ميكرومتر. استخدم المتوسط الحسابي (المقام).
- خذ قياس الشدة بعد تآكل 25 ميكرومتر من حدود كل هيكل ≥60 ميكرومتر. استخدم المتوسط للحساب (البسط).
- لحساب CI ، خذ دائرية جميع المواد العضوية في جميع الآبار. المتوسط يتوافق مع CI.
ملاحظة: عند الحاجة إلى تحليل دفعات كبيرة من الصور، يمكن أن تكون عملية تحليل الصور كما هو موضح في القسم 4 شبه آلية، بدءا من ملفات ND المعايرة وتشغيل ماكرو مع دمج جميع الخطوات.
النتائج
تم جمع المواد العضوية من 212 شخصا خلال الزيارات السريرية الروتينية. لم تحدث أي أحداث سلبية أثناء أو بعد إجراء خزعة المستقيم. تم تصوير الكائنات العضوية من قبل أحد الباحثين الذين أعموا عن خصائص الموضوع مثل النمط الجيني والمعلومات السريرية. بسبب الصور منخفضة الجودة ، تم استبعاد 23 موضوعا. يمكن ?...
Discussion
نحن نقدم بروتوكولا مفصلا لتحليل مورفولوجيا المستقيم العضوي (ROMA). قام المؤشران المحسوبان باستخدام ROMA و IR و CI ، بتمييز الكائنات العضوية عن الأشخاص المصابين بالتليف الكيسي عن أولئك الذين لا يعانون من التليف الكيسي بدقة تامة. وبالتالي يمكن أن تعمل ROMA كاختبار CFTR فسيولوجي جديد مكمل ل SCC والاختبا...
Disclosures
تم تمويل هذه الدراسة من قبل جمعية مرضى التليف الكيسي البلجيكي "Mucovereniging / Association Muco" ، ومنحة البحث من الجمعية البلجيكية لطب الأطفال BVK-SBP 2019 ، ومنحة من صندوق UZ Leuven للبحوث الطبية الحيوية الانتقالية. يعلن المؤلفون عدم وجود تضارب في المصالح.
Acknowledgements
نشكر المرضى وأولياء الأمور الذين شاركوا في هذه الدراسة. نشكر عبيدة بيبي على كل أعمال الزراعة مع الكائنات العضوية. نشكر إلس إيرتجيرتس ، وكارولين برونيل ، وكلير كولارد ، وليليان كوليجنون ، ومونيك ديلفوس ، وأنجا ديلبورت ، وناتالي فيارتس ، وسيسيل لامبريمونت ، ولوت نيوبورج ، وناتالي بيترز ، وآن رامان ، وبيم سانسن ، وهيلدا ستيفنز ، وماريان شولت ، وإلس فان رانسبيك ، وكريستل فان دي براندي ، وجريت فان دن إيندي ، ومارلين فاندركيركين ، وإنجي فان ديك ، وأودري فاجنر ، ومونيكا واسكيفيتش ، وبرنارد ويندريكس على الدعم اللوجستي. كما نشكر Mucovereniging / Association Muco ، وتحديدا ستيفان جوريس والدكتور جان فانليوي ، على دعمهم وتمويلهم. نشكر جميع المتعاونين من مشروع Organoid البلجيكي: هيدويج بوبولي (CHR Citadelle ، لييج ، بلجيكا) ، ليندا بولانجر (مستشفيات جامعة لوفين ، بلجيكا) ، جورج كازيمير (HUDERF ، بروكسل ، بلجيكا) ، بنديكت دي ماير (مستشفى جامعة غنت ، بلجيكا) ، Elke De Wachter (مستشفى جامعة بروكسل ، بلجيكا) ، داني دي لوز (مستشفى جامعة غنت ، بلجيكا) ، إيزابيل إتيان (CHU Erasme ، بروكسل ، بلجيكا) ، لورانس هانسينس (HUDERF ، بروكسل) ، كريستيان نوب (CHU Erasme ، بروكسل ، بلجيكا) ، مونيك ليكين (مستشفى جامعة أنتويرب ، بلجيكا) ، فيكي نوي (مستشفى GZA St. Vincentius في أنتويرب) ، ديرك ستايسن (مستشفى GZA St. Vincentius في أنتويرب) ، ستيفاني فان بيرفليت (مستشفى جامعة غنت ، بلجيكا) ، إيفا فان برايكل (مستشفى جامعة غنت ، بلجيكا) ، كيم فان هورنبيك (مستشفى جامعة أنتويرب ، بلجيكا) ، إيف فاندرهيلست (مستشفى جامعة بروكسل ، بلجيكا) ، Stijn Verhulst (مستشفى جامعة أنتويرب ، بلجيكا)، ستيفاني فينكن (مستشفى جامعة بروكسل، بلجيكا).
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tubes | Sorenson | 17040 | |
| 15 mL conical tubes | VWR | 525-0605 | |
| 24 well plates | Corning | 3526 | |
| 96 well plates | Greiner | 655101 | |
| Brightfield microscope | Zeiss | Axiovert 40C | |
| Centrifuge | Eppendorf | 5702 | |
| CO2 incubator | Binder | CB160 | |
| Computer | Hewlett-Packard | Z240 | |
| Confocal microscope | Zeiss | LSM 800 | |
| Laminar flow hood | Thermo Fisher | 51025413 | |
| Material for organoid culture as detailed in previous protocol10 | |||
| Micropipettes (20, 200, and 1000 µL) | Eppendorf | 3123000039, 3123000055, 3123000063 | |
| Microsoft Excel | Microsoft | Microsoft Excel 2019 MSO 64-bit | Spreadsheet software |
| NIS-Elements Advanced Research Analysis Imaging Software | Nikon | v.5.02.00 | Imaging software |
| Pipette tips (20, 200, and 1000 µL) | Greiner | 774288, 775353, 750288 | |
| Zeiss Zen Blue software | Zeiss | v2.6 | Imaging software |
References
- Riordan, J. R., et al. Identification of the cystic fibrosis gene: Cloning and characterization of complementary DNA. Science. 245 (4922), 1066-1073 (1989).
- Castellani, C., et al. ECFS best practice guidelines: the 2018 revision. Journal of Cystic Fibrosis. 17 (2), 153-178 (2018).
- . CFTR2 Available from: https://www.cftr2.org/ (2022)
- Farrell, P. M., et al. Diagnosis of cystic fibrosis: Consensus guidelines from the cystic fibrosis foundation. The Journal of Pediatrics. 181, 4-15 (2017).
- Vermeulen, F., Lebecque, P., De Boeck, K., Leal, T. Biological variability of the sweat chloride in diagnostic sweat tests: A retrospective analysis. Journal of Cystic Fibrosis: Official Journal of the European Cystic Fibrosis Society. 16 (1), 30-35 (2017).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Boj, S. F., et al. Forskolin-induced swelling in intestinal organoids: An in vitro assay for assessing drug response in cystic fibrosis patients. Journal of Visualized Experiments: JoVE. (120), e55159 (2017).
- Friedmacher, F., Puri, P. Rectal suction biopsy for the diagnosis of Hirschsprung's disease: a systematic review of diagnostic accuracy and complications. Pediatric Surgery International. 31 (9), 821-830 (2015).
- Dekkers, J. F., et al. A functional CFTR assay using primary cystic fibrosis intestinal organoids. Nature Medicine. 19 (7), 939-945 (2013).
- Dekkers, J. F., et al. Characterizing responses to CFTR-modulating drugs using rectal organoids derived from subjects with cystic fibrosis. Science Translational Medicine. 8 (344), (2016).
- Vonk, A. M., et al. Protocol for application, standardization and validation of the forskolin-induced swelling assay in cystic fibrosis human colon organoids. STAR Protocols. 1 (1), 100019 (2020).
- Cuyx, S., et al. Rectal organoid morphology analysis (ROMA) as a promising diagnostic tool in cystic fibrosis. Thorax. 76 (11), 1146-1149 (2021).
- Wilschanski, M., et al. Mutations in the cystic fibrosis transmembrane regulator gene and in vivo transepithelial potentials. American Journal of Respiratory and Critical Care Medicine. 174 (7), 787-794 (2006).
- Derichs, N., et al. Intestinal current measurement for diagnostic classification of patients with questionable cystic fibrosis: validation and reference data. Thorax. 65 (7), 594-599 (2010).
- Ramalho, A. S., et al. Correction of CFTR function in intestinal organoids to guide treatment of Cystic Fibrosis. European Respiratory Journal. 57, 1902426 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved