Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Análisis de morfología organoide rectal (ROMA): un ensayo de diagnóstico en fibrosis quística
En este artículo
Resumen
Este protocolo describe el análisis de morfología organoide rectal (ROMA), un nuevo ensayo diagnóstico para la fibrosis quística (FQ). Las características morfológicas, a saber, la redondez (índice de circularidad, IC) y la presencia de un lumen (relación de intensidad, IR), son una medida de la función CFTR. El análisis de 189 sujetos mostró una discriminación perfecta entre FQ y no FQ.
Resumen
El diagnóstico de la fibrosis quística (FQ) no siempre es sencillo, especialmente cuando la concentración de cloruro en el sudor es intermedia y / o se pueden identificar menos de dos mutaciones CFTR causantes de la enfermedad. Los ensayos fisiológicos CFTR (diferencia de potencial nasal, medición de corriente intestinal) se han incluido en el algoritmo de diagnóstico, pero no siempre están disponibles o son factibles (p. ej., en lactantes). Los organoides rectales son estructuras 3D que crecen a partir de células madre aisladas de criptas de una biopsia rectal cuando se cultivan en condiciones específicas. Los organoides de sujetos sin FQ tienen una forma redonda y una luz llena de líquido, ya que el transporte de cloruro mediado por CFTR conduce el agua hacia el lumen. Los organoides con función CFTR defectuosa no se hinchan, conservando una forma irregular y sin luz visible. Las diferencias en la morfología entre los organoides CF y no CF se cuantifican en el 'Rectal Organoid Morphology Analysis' (ROMA) como un nuevo ensayo fisiológico CFTR. Para el ensayo ROMA, los organoides se colocan en placas de 96 pocillos, se tiñen con calceína y se obtienen imágenes en un microscopio confocal. Las diferencias morfológicas se cuantifican utilizando dos índices: el índice de circularidad (IC) cuantifica la redondez de los organoides, y la relación de intensidad (IR) es una medida de la presencia de un lumen central. Los organoides sin FQ tienen un IC alto y un IR bajo en comparación con los organoides de FQ. Los índices ROMA discriminaron perfectamente a 167 sujetos con FQ de 22 sujetos sin FQ, lo que hace de ROMA un ensayo fisiológico CFTR atractivo para ayudar en el diagnóstico de FQ. Las biopsias rectales se pueden realizar rutinariamente a todas las edades en la mayoría de los hospitales y el tejido se puede enviar a un laboratorio central para cultivo de organoides y ROMA. En el futuro, ROMA también podría aplicarse para probar la eficacia de los moduladores CFTR in vitro. El objetivo del presente informe es explicar plenamente los métodos utilizados para la ROMA, a fin de permitir la replicación en otros laboratorios.
Introducción
La fibrosis quística (FQ) es una enfermedad autosómica recesiva causada por mutaciones en el gen regulador de la conductancia transmembrana de la FQ (CFTR). La proteína CFTR es un canal de cloruro y bicarbonato, asegurando la hidratación de varios epitelios1. La FQ es una enfermedad multisistémica de alta carga, que acorta la vida, que se manifiesta principalmente como una enfermedad respiratoria, pero que también afecta al tracto gastrointestinal, el páncreas, el hígado y el tracto reproductivo2.
Las mutaciones CFTR causantes de la enfermedad conducen a una disminución en la cantidad o función de CFTR, lo que a su vez causa deshidratación del moco. Se han descrito más de 2.000 variantes en el gen CFTR 3, de las cuales sólo 466 han sido ampliamente caracterizadas4.
Se puede hacer un diagnóstico de FQ cuando la concentración de cloruro en sudor (CCE) está por encima del umbral de 60 mmol / L o cuando se identifican dos mutaciones CFTR causantes de la enfermedad (según la base de datos CFTR2) 4,5. En sujetos con SCC sólo moderadamente elevado (30-60 mmol/L), que ocurre en alrededor del 4%-5% de las pruebas de sudor6, y mutaciones CFTR de consecuencia clínica variable o desconocida, el diagnóstico no puede ser confirmado ni descartado, incluso cuando tienen síntomas compatibles con FQ o una prueba de cribado neonatal positiva. Para estos casos, se han incluido en el algoritmo de diagnóstico ensayos fisiológicos de segunda línea CFTR (diferencia de potencial nasal [NPD] y mediciones de corriente intestinal [MCI]). Estas pruebas no están fácilmente disponibles en la mayoría de los centros ni son factibles en todas las edades, especialmente en bebés5.
Los organoides rectales son estructuras 3D cultivadas a partir de células madre intestinales adultas Lgr5(+) de criptas intestinales obtenidas mediante biopsia rectal7. Los organoides se utilizan cada vez más en la investigación biomédica, como el tratamiento con moduladores de prueba en CF8. Una biopsia viable puede obtenerse por succión o biopsia con fórceps, un procedimiento que causa solo molestias mínimas y es seguro incluso en bebés, con bajas tasas de complicaciones9. Las criptas aisladas de las biopsias rectales están enriquecidas en células madre y, en condiciones de cultivo específicas, se autoorganizan en organoides rectales. La morfología de estos organoides está determinada por la expresión y función de CFTR, situado en la membrana apical de las células epiteliales. El CFTR funcional permite que el cloruro y el agua entren en la luz del organoide, induciendo así la hinchazón de los organoides no CF. Los organoides de FQ no se hinchan y no tienen luz visible10,11.
El análisis morfológico de organoides rectales (ROMA) permite la discriminación entre organoides CF y no CF en función de estas diferencias en la morfología de los organoides. Los organoides sin FQ son más redondos y tienen una luz visible, mientras que lo contrario es cierto para los organoides de FQ. Para este ensayo, los organoides específicos del paciente se colocan en 32 pocillos de una placa de 96 pocillos. Después de 1 día de crecimiento, los organoides se tiñen con verde calceína y se obtienen imágenes en un microscopio confocal. Los organoides no CF muestran una forma más circular y una parte central menos fluorescente, ya que la luz contiene líquido y la calceína tiñe solo las células. Estas diferencias en la morfología se cuantifican utilizando dos índices ROMA: el índice de circularidad (IC) cuantifica la redondez de los organoides, mientras que la relación de intensidad (IR) es una medida de la presencia o ausencia de un lumen central. En este informe, describimos en detalle el protocolo para obtener estos índices discriminativos, para permitir la replicación de la técnica.
Protocolo
Para todos los procedimientos con tejido humano, se obtuvo la aprobación del Comité de Ética de Investigación UZ/KU Leuven (investigación de la CE). Todas las investigaciones se realizaron con el consentimiento informado y/o el consentimiento de los padres, representantes y/o pacientes.
NOTA: Todos los procedimientos que involucren biopsias rectales y organoides deben realizarse en un flujo laminar para proteger al investigador de cualquier peligro biológico y minimizar el riesgo de contaminación de los cultivos. En cuanto a cualquier procedimiento de laboratorio, los investigadores deben usar en todo momento batas de laboratorio, guantes y gafas de seguridad para manipular las muestras.
1. Biopsia rectal, aislamiento de células madre adultas de criptas y cultivo de organoides
- Para esta parte inicial del protocolo, que incluye la producción y el uso de medios, el cultivo de organoides, la división, la expansión y la congelación para biobancos, siga los dos protocolos publicados anteriormente 8,12.
- En resumen, se deben tomar las siguientes medidas:
- Tome de tres a cuatro biopsias rectales con un fórceps o dispositivo de succión y recójalas en un recipiente estéril (por ejemplo, tubo de microcentrífuga de 1,5 ml) con el medio Ad-DF+++ como se describe en el protocolo mencionado anteriormente.
- Transporte las biopsias a un laboratorio central sobre hielo o a 4 °C. El transporte a otros centros es posible, y la calidad no se ve afectada significativamente incluso cuando el transporte tarda hasta 48 h. Si se espera que el transporte dure más de 6 h, utilice un tubo cónico de 15 ml con 6 ml de medio Ad-DF+++ en lugar de un tubo de microcentrífuga de 1,5 ml.
- Lave las biopsias en PBS frío hasta que el sobrenadante esté claro para eliminar los desechos y los tejidos no epiteliales, como el tejido graso.
- Incubar las biopsias con EDTA (concentración final 10 mM) para separar las criptas. Coloque las criptas en una matriz de membrana basal. Agregue antibióticos de amplio espectro (gentamicina 50 μg/ml y vancomicina 50 μg/ml) al medio en la primera semana de cultivo para prevenir la contaminación bacteriana.
- Cuando las criptas hayan brotado y estén cerradas y proliferadas, realice una división mecánica, generalmente después de 7 días.
- Dividir los organoides resultantes aproximadamente cada 7 días. De esta manera, amplíe el cultivo, congele muestras de respaldo en un biobanco o use los organoides para ensayos.
2. Organoides para ROMA (día 1)
- Dividir mecánicamente los organoides para el recubrimiento
- Recoja organoides de tres pocillos bien cultivados de una placa de 24 pocillos lavándolos dos veces con medio Ad-DF+++ frío, recójalos en un tubo de microcentrífuga de 1,5 ml y evalúelos bajo el microscopio12.
- Asegúrese de que los organoides sean viables y de alta calidad, lo que generalmente se puede lograr después de 5-7 días de crecimiento después de haber sido divididos previamente (Figura 1).
- Dividir mecánicamente los organoides según el protocolo antes mencionado 8,12. Repita hasta que la mayoría de los organoides, evaluados con el microscopio de campo claro, sean lo suficientemente pequeños en comparación con la observación inicial.
- Recoja los organoides más pequeños, generalmente correspondientes a la colección de aproximadamente los 4/5 superiores de la solución organoide-medio en un nuevo tubo de microcentrífuga, ya que los organoides grandes se hunden hasta el fondo del tubo debido a la gravedad y los organoides pequeños permanecen suspendidos en la parte superior de la columna mediana.
- Centrifugar la muestra de organoides más pequeños a 0,3 x 1000 g durante 2 min y desechar el medio.
- Diluir el pellet de organoides más pequeños en 130 μL de matriz de membrana basal al 40%-50% (diluido con Ad-DF+++ medio12).
- Resuspender bien con una micropipeta de 200 μL.
- Placa de los organoides en una placa de 96 pocillos
- Usando una pipeta de 20 μL, organoides en placa en 32 pocillos de una placa precalentada de 96 pocillos. Asegúrese de que cada pocillo contenga una gota de 4 μL de la solución de matriz organoide producida en el paso anterior.
- Los organoides en la solución tienden a formar una bolita en el fondo del tubo debido al desplazamiento hacia abajo dependiente de la gravedad. Para evitar esto y asegurar un recubrimiento uniforme, resuspenda regularmente la solución de matriz organoide utilizando una micropipeta de 200 μL (por ejemplo, cada vez después de chapar de cuatro a ocho pocillos).
- Coloque cada gota en el centro del pozo para evitar que la gota corra hacia los bordes del pozo, lo que reduciría la calidad de la imagen más adelante.
- Apunte a alrededor de 30 organoides por pocillo (mínimo 15, máximo 90) sin organoides superpuestos.
- Tenga en cuenta que estos organoides tendrán que incubarse durante la noche y crecerán ligeramente durante este tiempo, y podrían comenzar a superponerse si la densidad de recubrimiento es demasiado alta.
- Verifique la densidad del recubrimiento con un microscopio de campo claro con un objetivo de aumento de 5x después de revestir los primeros uno o dos pocillos.
- Si la densidad de recubrimiento es demasiado alta, diluya la solución de matriz organoide paso a paso con la adición de la matriz de membrana basal hasta que se alcance la densidad de recubrimiento deseada (Figura 2).
- Después del chapado, golpee suavemente la placa sobre una superficie plana para asegurarse de que la mayoría de los organoides estén en el mismo plano focal.
- Incubar el plato
- Incubar la placa de 96 pocillos a 37 °C y 5% deCO2 durante 8-10 min para permitir la gelificación de la matriz de la membrana basal.
- Añadir 50 μL de medio organoide de colon humano +/+12 en cada pocillo e incubar durante la noche durante 16-24 h.
- No agregue forskoline ni moduladores CFTR, por lo que los organoides crecen en condiciones basales.
3. Imágenes organoides mediante microscopía confocal (día 2)
- Manchar los organoides con verde calceína
- Preparar una solución madre de 1 mM de verde de calceína añadiendo 50 μL de dimetilsulfóxido (DMSO) a un vial que contenga 50 μg de verde de calceína.
- Preparar una solución de trabajo de verde de calceína añadiendo 1,2 μL de la solución madre a 200 μL de Ad-DF+++ (concentración 6 μM).
- Añadir 5 μL de esta mezcla de calceína a cada pocillo de la placa de 96 pocillos en la que se colocaron los organoides (concentración final de calceína 0,6 μM). No toque y disloque la matriz de caída dentro del pozo al realizar este paso.
- Gire e incline ligeramente la placa con la tapa puesta varias veces para garantizar una distribución homogénea del verde calceína en todo el pozo.
- Incubar la placa de nuevo durante 15-30 min a 37 °C y 5% deCO2 para asegurar la tinción de todos los organoides en los pocillos.
- Transfiera la placa al microscopio confocal
- Transfiera la placa al microscopio confocal con una etapa automatizada y una incubadora integrada. Asegúrese de que la placa esté bien fijada en el soporte de la placa.
- La incubación a 37 °C y 5% deCO2 es opcional pero no necesaria, dada la corta duración (unos 10 minutos) del proceso de obtención de imágenes.
- Enfoque en los organoides (Figura 3)
- Usando el microscopio confocal, determine la posición x/y óptima y el enfoque (posición z) de los organoides en cada pocillo manualmente, y guarde estas posiciones en el software de imágenes.
- El mejor enfoque implica la delineación más nítida posible de los organoides y la visualización de la mayor parte posible de la caída del organoide. Si la distribución de la mancha no es adecuada, repita los pasos 3.1.4 y 3.1.5 (incubar, por ejemplo, durante 5-10 minutos adicionales).
- Utilice ajustes de imágenes de células vivas con emisión a 488 nm y excitación a 515 nm (específico para la visualización de la fluorescencia de calceína) y un objetivo de aumento de 5x LD.
- Adquirir imágenes organoides de los 32 pocillos con el microscopio confocal (Figura 3 y Figura 4).
- Toma imágenes de forma unidireccional con una resolución de 1024 píxeles x 1024 píxeles (tamaño de píxel 2,5 μm x 2,5 μm) y profundidad de 16 bits.
- Elija la intensidad del láser y la ganancia maestra para una visualización óptima de las diferencias morfológicas entre los organoides CF y no CF (por ejemplo, discriminación entre un lumen central no teñido lleno de agua (si está presente) y un borde celular teñido).
NOTA: Los organoides no se delinearán correctamente cuando la ganancia maestra y, por lo tanto, la señal de fluorescencia sean demasiado bajas; Establecer la ganancia maestra demasiado alta dará como resultado imágenes con organoides con una intensidad de señal homogénea muy alta, evitando la obtención de imágenes de diferencias morfológicas más sutiles (Figura 2). - Guarde una imagen por pocillo para los 32 pocillos en formato de microscopio y expórtelos como archivos TIFF.
4. Análisis de imágenes (Figura 5)
- Cargue los archivos TIFF en el software de análisis de imágenes.
- Realice el primer control de calidad basado en los criterios de exclusión determinados por el operador (Figura 2): muchas estructuras o escombros diferenciados o muertos, densidad de recubrimiento inadecuada, demasiados (por ejemplo, superpuestos) o muy pocos organoides, y distribución inadecuada de fluorescencia (organoides no claramente delineados, señal de fondo demasiado alta).
NOTA: Este paso también se puede realizar antes de exportar imágenes como archivos TIFF en el paso 3.4. - Preparar imágenes para el análisis
- Recalibre las imágenes, de modo que 1 píxel corresponda a 2,5 μm x 2,5 μm.
- Cree y abra un Datos de red (. ND) de las 32 imágenes para cada cultivo de organoide, lo que permite el análisis simultáneo de las 32 imágenes por sujeto.
- Delinear los organoides
- Delinee las estructuras utilizando un umbral de intensidad inferior de 4.500 y un umbral superior de 65.535 (funciones lisas y limpias desactivadas ; Función de relleno de agujeros activada; Función separada en x3).
NOTA: Esto delinea estructuras fluorescentes, con orificios de relleno que incluyen el lumen en la estructura delineada si está presente.
- Delinee las estructuras utilizando un umbral de intensidad inferior de 4.500 y un umbral superior de 65.535 (funciones lisas y limpias desactivadas ; Función de relleno de agujeros activada; Función separada en x3).
- Cuenta los organoides
- Seleccione todas las estructuras ≥40 μm.
- Haga clic en el botón Actualizar medición ND (cada vez que se necesite una medición); Los organoides contados serán numerados.
NOTA: Esto equivale al número total de organoides en los 32 pozos, mientras que se excluyen los desechos pequeños, como las células muertas.
- Medir intensidad y circularidad para el cálculo de los índices
- Seleccione todas las estructuras ≥60 μm y continúe.
NOTA: Esto cuenta los organoides lo suficientemente grandes como para mostrar la morfología típica de la FQ o no CF. Los organoides >40 μm y <60 μm son pequeños y densos, tanto en la FQ como en la FQ. - Retire todas las estructuras que toquen los bordes de la imagen. Haga esto para eliminar los organoides que no son completamente visibles, ya que su morfología no se puede cuantificar con precisión.
- Erosionar 1 píxel (= 2,5 μm) desde el borde de cada estructura de ≥60 μm. Esto elimina el halo de fluorescencia de calceína difusa que rodea los organoides.
- Mide la intensidad media de cada estructura. De esta manera, se mide la fluorescencia media de los organoides.
- Seleccione todas las estructuras ≥60 μm de nuevo y elimine todas las estructuras que toquen los bordes.
- Erosionar 10 píxeles (= 25 μm) del borde de cada estructura de ≥60 μm.
NOTA: En los organoides sin FQ, esto erosiona el borde celular y deja solo el lumen. En los organoides CF, esto erosiona la parte externa del organoide, que tiene aproximadamente la misma fluorescencia que la parte interna que queda. - Mide la intensidad media de cada estructura erosionada. De esta manera, se mide la fluorescencia media de la parte central de los organoides.
- Mide la circularidad de cada estructura. Esto corresponde a la circularidad media de los organoides.
- Seleccione todas las estructuras ≥60 μm y continúe.
- Realice el segundo control de calidad: criterios de exclusión determinados por el software. Excluir el conjunto de imágenes cuando menos del 50% de los organoides (definidos como estructuras ≥40 μm) son ≥60 μm, ya que suficientes organoides deben ser lo suficientemente grandes como para mostrar la morfología típica de CF o no CF. También se excluye cuando <500 o >3.000 organoides (definidos como estructuras ≥40 μm) están presentes en los 32 pozos.
5. Mida los índices en el software de imágenes (Figura 6)
- Medir el índice de circularidad (IC).
NOTA: Esto corresponde a la circularidad media medida en el paso 4.6, que es la circularidad media de todos los organoides en los 32 pocillos. IC cuantifica la redondez de los organoides, definida como , que es menor en CF que en organoides no CF
, que es menor en CF que en organoides no CF - Medir la relación de intensidad (IR)
- Calcular el IR dividiendo la media de la medición de intensidad después de erosionar 25 μm desde el borde de cada estructura de ≥60 μm por la media de la medición de intensidad después de erosionar 2,5 μm desde el borde de cada estructura de ≥60 μm.
NOTA: IR mide la presencia o ausencia de un lumen central. IR es igual a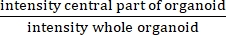 , y es mayor en CF que en organoides sin CF.
, y es mayor en CF que en organoides sin CF.
- Calcular el IR dividiendo la media de la medición de intensidad después de erosionar 25 μm desde el borde de cada estructura de ≥60 μm por la media de la medición de intensidad después de erosionar 2,5 μm desde el borde de cada estructura de ≥60 μm.
- Simplifique el proceso de análisis
- Prepare una hoja de trabajo estándar utilizando un software de hoja de cálculo para calcular automáticamente estos índices al copiar los datos (Figura 7).
- Para calcular el IR:
- Tome la medida de intensidad después de erosionar 2,5 μm desde el borde de cada estructura de ≥60 μm. Utilice la media para el cálculo (denominador).
- Tome la medida de intensidad después de erosionar 25 μm desde el borde de cada estructura de ≥60 μm. Utilice la media para el cálculo (numerador).
- Para calcular el IC, tome la circularidad de todos los organoides en todos los pocillos. La media corresponde al IC.
NOTA: Cuando se requiere el análisis de grandes lotes de imágenes, el proceso de análisis de imágenes descrito en la sección 4 puede ser semiautomatizado, a partir de los archivos ND calibrados y ejecutando una macro con todos los pasos combinados.
Resultados
Se recolectaron organoides de 212 sujetos durante las visitas clínicas de rutina. No se produjeron eventos adversos durante o después del procedimiento de biopsia rectal. Los organoides fueron fotografiados por un investigador cegado a las características del sujeto, como el genotipo y la información clínica. Debido a las imágenes de baja calidad, 23 sujetos fueron excluidos. En la Figura 2 se pueden ver ejemplos de cultivos de organoides exitosos y fallidos y adquisición de imágenes...
Discusión
Proporcionamos un protocolo detallado para el análisis morfológico de organoides rectales (ROMA). Los dos índices calculados con ROMA, IR e IC, distinguieron organoides de sujetos con FQ de aquellos sin FQ con perfecta precisión. ROMA podría funcionar como un nuevo ensayo fisiológico CFTR complementario al SCC y otras pruebas actualmente disponibles13,14,15.
El protocolo depende del uso de organ...
Divulgaciones
Este estudio fue financiado por la asociación belga de pacientes con FQ "Mucovereniging / Association Muco", la beca de investigación de la Sociedad Belga de Pediatría BVK-SBP 2019 y una subvención del Fondo UZ Leuven para la Investigación Biomédica Traslacional. Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
Agradecemos a los pacientes y padres que participaron en este estudio. Agradecemos a Abida Bibi por todo el trabajo de cultivo con los organoides. Agradecemos a Els Aertgeerts, Karolien Bruneel, Claire Collard, Liliane Collignon, Monique Delfosse, Anja Delporte, Nathalie Feyaerts, Cécile Lambremont, Lut Nieuwborg, Nathalie Peeters, Ann Raman, Pim Sansen, Hilde Stevens, Marianne Schulte, Els Van Ransbeeck, Christel Van de Brande, Greet Van den Eynde, Marleen Vanderkerken, Inge Van Dijck, Audrey Wagener, Monika Waskiewicz y Bernard Wenderickx por su apoyo logístico. También agradecemos a Mucovereniging/Association Muco, y específicamente a Stefan Joris y al Dr. Jan Vanleeuwe, por su apoyo y financiación. Agradecemos a todos los colaboradores del Proyecto Organoide Belga: Hedwige Boboli (CHR Citadelle, Lieja, Bélgica), Linda Boulanger (Hospitales Universitarios de Lovaina, Bélgica), Georges Casimir (HUDERF, Bruselas, Bélgica), Benedicte De Meyere (Hospital Universitario de Gante, Bélgica), Elke De Wachter (Hospital Universitario de Bruselas, Bélgica), Danny De Looze (Hospital Universitario de Gante, Bélgica), Isabelle Etienne (CHU Erasme, Bruselas, Bélgica), Laurence Hanssens (HUDERF, Bruselas), Christiane Knoop (CHU Erasme, Bruselas, Bélgica), Monique Lequesne (Hospital Universitario de Amberes, Bélgica), Vicky Nowé (GZA St. Vincentius Hospital Antwerp), Dirk Staessen (GZA St. Vincentius Hospital Antwerp), Stephanie Van Biervliet (Hospital Universitario de Gante, Bélgica), Eva Van Braeckel (Hospital Universitario de Gante, Bélgica), Kim Van Hoorenbeeck (Hospital Universitario de Amberes, Bélgica), Eef Vanderhelst (Hospital Universitario de Bruselas, Bélgica), Stijn Verhulst (Hospital Universitario de Amberes, Bélgica), Stefanie Vincken (Hospital Universitario de Bruselas, Bélgica).
Materiales
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tubes | Sorenson | 17040 | |
| 15 mL conical tubes | VWR | 525-0605 | |
| 24 well plates | Corning | 3526 | |
| 96 well plates | Greiner | 655101 | |
| Brightfield microscope | Zeiss | Axiovert 40C | |
| Centrifuge | Eppendorf | 5702 | |
| CO2 incubator | Binder | CB160 | |
| Computer | Hewlett-Packard | Z240 | |
| Confocal microscope | Zeiss | LSM 800 | |
| Laminar flow hood | Thermo Fisher | 51025413 | |
| Material for organoid culture as detailed in previous protocol10 | |||
| Micropipettes (20, 200, and 1000 µL) | Eppendorf | 3123000039, 3123000055, 3123000063 | |
| Microsoft Excel | Microsoft | Microsoft Excel 2019 MSO 64-bit | Spreadsheet software |
| NIS-Elements Advanced Research Analysis Imaging Software | Nikon | v.5.02.00 | Imaging software |
| Pipette tips (20, 200, and 1000 µL) | Greiner | 774288, 775353, 750288 | |
| Zeiss Zen Blue software | Zeiss | v2.6 | Imaging software |
Referencias
- Riordan, J. R., et al. Identification of the cystic fibrosis gene: Cloning and characterization of complementary DNA. Science. 245 (4922), 1066-1073 (1989).
- Castellani, C., et al. ECFS best practice guidelines: the 2018 revision. Journal of Cystic Fibrosis. 17 (2), 153-178 (2018).
- . CFTR2 Available from: https://www.cftr2.org/ (2022)
- Farrell, P. M., et al. Diagnosis of cystic fibrosis: Consensus guidelines from the cystic fibrosis foundation. The Journal of Pediatrics. 181, 4-15 (2017).
- Vermeulen, F., Lebecque, P., De Boeck, K., Leal, T. Biological variability of the sweat chloride in diagnostic sweat tests: A retrospective analysis. Journal of Cystic Fibrosis: Official Journal of the European Cystic Fibrosis Society. 16 (1), 30-35 (2017).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Boj, S. F., et al. Forskolin-induced swelling in intestinal organoids: An in vitro assay for assessing drug response in cystic fibrosis patients. Journal of Visualized Experiments: JoVE. (120), e55159 (2017).
- Friedmacher, F., Puri, P. Rectal suction biopsy for the diagnosis of Hirschsprung's disease: a systematic review of diagnostic accuracy and complications. Pediatric Surgery International. 31 (9), 821-830 (2015).
- Dekkers, J. F., et al. A functional CFTR assay using primary cystic fibrosis intestinal organoids. Nature Medicine. 19 (7), 939-945 (2013).
- Dekkers, J. F., et al. Characterizing responses to CFTR-modulating drugs using rectal organoids derived from subjects with cystic fibrosis. Science Translational Medicine. 8 (344), (2016).
- Vonk, A. M., et al. Protocol for application, standardization and validation of the forskolin-induced swelling assay in cystic fibrosis human colon organoids. STAR Protocols. 1 (1), 100019 (2020).
- Cuyx, S., et al. Rectal organoid morphology analysis (ROMA) as a promising diagnostic tool in cystic fibrosis. Thorax. 76 (11), 1146-1149 (2021).
- Wilschanski, M., et al. Mutations in the cystic fibrosis transmembrane regulator gene and in vivo transepithelial potentials. American Journal of Respiratory and Critical Care Medicine. 174 (7), 787-794 (2006).
- Derichs, N., et al. Intestinal current measurement for diagnostic classification of patients with questionable cystic fibrosis: validation and reference data. Thorax. 65 (7), 594-599 (2010).
- Ramalho, A. S., et al. Correction of CFTR function in intestinal organoids to guide treatment of Cystic Fibrosis. European Respiratory Journal. 57, 1902426 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados