Method Article
جيم ايليجانس تشريح الغدد التناسلية وتجميد الكراك للتألق المناعي وتلطيخ DAPI
* These authors contributed equally
In This Article
Summary
هذه طريقة شائعة الاستخدام لتشريح الغدد التناسلية C. elegans متبوعة بصدع التجميد ، والذي ينتج عينات من الخط الجرثومي للتألق المناعي عن طريق تلطيخ الأجسام المضادة ، أو لتلطيخ DAPI البسيط لتصور الحمض النووي. كان هذا البروتوكول ناجحا للطلاب الجامعيين في مختبر الأبحاث وفي تجربة بحثية جامعية قائمة على الدورة التدريبية.
Abstract
يعد الخط الجرثومي C. elegans نموذجا ممتازا لدراسة الانقسام الاختزالي ، ويرجع ذلك جزئيا إلى سهولة إجراء التحليلات الخلوية على الحيوانات التي تم تشريحها. تحافظ مستحضرات التركيب الكاملة على بنية النوى الاختزالية ، والأهم من ذلك ، أن كل ذراع غدد تناسلية تحتوي على جميع مراحل الانقسام الاختزالي ، منظمة في تقدم زمني مكاني يجعل من السهل تحديد النوى في مراحل مختلفة. تمتلك الخنثى البالغة ذراعين للغدد التناسلية، كل منهما منظم كأنبوب مغلق مع خلايا جذعية جرثومية متكاثرة في الطرف المغلق البعيد وبويضات خلوية في الطرف المفتوح القريب، والتي تنضم إلى المركز عند الرحم. يطلق التشريح أحد ذراعي المناسل أو كليهما من تجويف الجسم، مما يسمح بتصور الانقسام الميوزي بأكمله. هنا ، يتم تقديم بروتوكول مشترك للتألق المناعي ضد البروتين محل الاهتمام ، يليه تلطيخ DAPI لتمييز جميع الكروموسومات. يجمد الشباب في ليفاميزول ويتم تشريحهم بسرعة باستخدام إبرتين حقنة. بعد قذف الخط الجرثومي ، يتم تثبيت العينة قبل الخضوع لصدع التجميد في النيتروجين السائل ، مما يساعد على اختراق البشرة والأنسجة الأخرى. يمكن بعد ذلك تجفيف العينة في الإيثانول ، وإعادة ترطيبها ، وتحضينها بأجسام مضادة أولية وثانوية. يضاف DAPI إلى العينة في وسط التركيب ، مما يسمح بتصور موثوق للحمض النووي ويجعل من السهل العثور على الحيوانات لتصويرها تحت المجهر الفلوري. يتم اعتماد هذه التقنية بسهولة من قبل أولئك المطلعين على التعامل مع C. elegans بعد قضاء بضع ساعات في ممارسة طريقة التشريح نفسها. تم تدريس هذا البروتوكول لطلاب المدارس الثانوية والطلاب الجامعيين الذين يعملون في مختبر أبحاث وتم دمجه في تجربة بحثية جامعية قائمة على الدورة التدريبية في كلية الفنون الحرة.
Introduction
الانقسام الميوزي هو الانقسام الخلوي المتخصص المستخدم لتكوين الجاميتات (البويضات والحيوانات المنوية / حبوب اللقاح) في جميع الكائنات الحية التي تتكاثر جنسيا 1,2. إعادة التركيب المتقاطع هو التبادل المتبادل للحمض النووي بين الكروموسومات المتماثلة. إنه ضروري للانقسام الاختزالي ، حيث يوفر مصدرا مهما للتنوع الجيني ويعزز استقرار الجينوم عبر الأجيال. الكروموسومات التي تفشل في تكوين تقاطع واحد على الأقل أثناء الانقسام الاختزالي ستنفصل بشكل عشوائي ، مما قد يؤدي إلى عدم انفصال الكروموسوم ، مما يخلق الأمشاج ذات العدد غير الصحيح من الكروموسومات - وهي حالة عادة ما تكون قاتلة للذرية الناتجة3. أثناء الانقسام الاختزالي ، يتم تحفيز عمليات الانتقال بواسطة فواصل الحمض النووي المزدوجة المبرمجة4. سيتم إصلاح مجموعة فرعية من هذه الفواصل كعمليات انتقال توفر روابط فيزيائية للحمض النووي ، تسمى chiasmata ، والتي تساعد في توجيه الكروموسومات المتماثلة استعدادا لانقسام الخلية5. يتم الحفاظ على مراحل الانقسام الميوزي بشكل كبير عبر جميع حقيقيات النوى ، ويسمح تشكيلها الكروموسومي بالتعرف عليها بسهولة.
كمفهوم أساسي في علم الأحياء ، الانقسام الميوزي هو موضوع يواجهه الطلاب عدة مرات في دورات علم الأحياء المختلفة. غالبا ما يتم تعريفهم بآليات فصل الكروموسومات الاختزالية في المدرسة الثانوية ، بينما تركز الدورات على مستوى الكلية على بيولوجيا الخلية للفصل والتأثير الجيني لإعادة التركيب المتقاطع. ومع ذلك ، فإن الانقسام الاختزالي هو مفهوم صعب للغاية للعديد من الطلاب1. يمكن أن يؤدي الفشل في فهم العلاقة بين الجينات والحمض النووي والكروموسومات والانقسام الاختزالي إلى توليد مفاهيم خاطئة للطلاب وفجوات في الفهم تعيق الفهم الكامل للوراثة الجينية 6,7. تتمثل إحدى طرق تحسين فهم الطلاب للموضوعات المجردة في توفير أنشطة عملية ملموسة. على سبيل المثال ، عند تدريس الانقسام الاختزالي ، يمكن للمدرسين الاختيار من بين الأنشطة التي تحاكي التحليل الجزيئي8 ، أو نماذج 3D التي تسمح للطلاب بمعالجة الجزيئات9 ، أو لعب الأدوار حيث يقوم الطلاب أنفسهم بتمثيل الكوريغرافيا الجزيئية1. يعد دمج الأبحاث ذات النتائج غير المعروفة طريقة فعالة بشكل خاص لتحسين فهم الطلاب. تعرف هذه الممارسة باسم تجربة البحث الجامعية القائمة على الدورة التدريبية (CURE) ولها فائدة إضافية تتمثل في تعزيز مواقف الطلاب ووكالتهم ، خاصة بالنسبة لأولئك الذين ينتمون إلى مجموعات لا تزال ممثلة تمثيلا ناقصا في STEM10,11. دودة الديدان الخيطية Caenorhabditis elegans قابلة بشكل خاص للدراسات الصفية للسلوك والخصوبة والتهجينات الجينية ، وهي نموذج فعال لتعريف الطلاب بالبحوث البيولوجية12.
C. elegans يجعل كائن نموذجي قوي لبيولوجيا الخلية من خلال الجمع بين علم الوراثة الجزيئية والتحليل الخلوي البسيط. كما أنها مناسبة بشكل خاص للاستخدام في فصل علم الأحياء 13،14،15. إنها سهلة واقتصادية للحفاظ عليها في المختبر ، وتنتج مئات النسل كل 3 أيام ، سواء في درجة حرارة الغرفة القياسية أو عند 20 درجة مئوية ، وهي درجة حرارة الحضانة الأكثر شيوعا. الأهم من ذلك ، يمكن تجميدها كمخزون من الجلسرين وحفظها في مجمد -80 درجة مئوية ، مما يعني أن أي أخطاء في التربية يرتكبها الباحثون المبتدئون يمكن تصحيحها بسهولة16. علاوة على ذلك ، يسمح الجينوم المشروح جيدا بالتقنيات الجينية الأمامية والعكسية17,18 ، مما يسمح باستخدام C. elegans لمعالجة الأسئلة البيولوجية التي تتراوح من الجزيئية إلى التطورية. أخيرا ، أنشأ باحثو C. elegans مجتمعا داعما غالبا ما يكون على استعداد لتقديم المساعدة والمشورة للعلماء الناشئين19. وقد أدت هذه المزايا إلى دمج C. elegans في عدد من CUREs في أنواع مختلفة من المؤسسات12،19،20،21،22،23.
بالإضافة إلى فوائده للبحث والتدريس ، أصبح C. elegans نموذجا شائعا لدراسات الانقسام الاختزالي وتطور الخط الجرثومي24،25،26. يبسط الوضوح البصري لهذه الحيوانات النهج الخلوية27 ، وفي البالغين ، تمثل الغدد التناسلية ما يقرب من نصف الحيوان ، مما يوفر مئات الخلايا الاختزالية للدراسة. في الغدد التناسلية ، يتم ترتيب نوى الخط الجرثومي الميوتي مثل خط التجميع (الشكل 1) ؛ يحدث التضاعف الانقسامي عند الطرف البعيد للغدد التناسلية، حيث تتقدم النوى خلال المراحل الاختزالية أثناء هجرتها نحو الطرف القريب من المناسل، حيث تخرج الأجنة المخصبة من الفرج. نظرا لأن التنظيم المكاني النمطي يمثل أيضا تقدما زمنيا من خلال الانقسام الميوزي ، يمكن تحديد المراحل المختلفة بسهولة بناء على تنظيمها الكروموسومي وموقعها في الغدد التناسلية. وأخيرا، فإن العمليات التي تعطل الانقسام الاختزالي وتسبب اختلال الصيغة الصبغية تخلق أنماطا ظاهرية يسهل توصيفها، حتى بالنسبة للمبتدئين: العقم، أو الفتك الجنيني، أو ارتفاع نسبة الذكور (النمط الظاهري له)28.
هذا بروتوكول بسيط لتصور الكروموسومات الاختزالية في C. elegans. يتم إجراء التركيب والتشريح والتثبيت وتلطيخ الأجسام المضادة على نفس شريحة المجهر ، مما يبسط البروتوكول ويسمح باستعادة العينات شبه المثالية. تعمل هذه الطريقة مع تلطيخ DAPI البسيط لتصور الكروموسومات ويمكن استخدامها في التألق المناعي لتصور توطين البروتينات في الغدد التناسلية. يقوم الطلاب بتشريح الغدد التناسلية باستخدام مجاهر التشريح الأساسية ، وتوليد مستحضرات كاملة لتصور الحمض النووي أو التألق المناعي ، وتصويرها على مجهر فلوري مركب. تم تدريس هذا البروتوكول لطلاب المدارس الثانوية والطلاب الجامعيين الذين يعملون في مختبر أبحاث C. elegans وتم دمجه في CURE في كلية الفنون الحرة12. على الرغم من أن CURE كان حجم الفصل صغيرا نسبيا ، إلا أن هذا البروتوكول سيكون قابلا للفصول في مجموعة من المؤسسات بسبب التكلفة المنخفضة نسبيا لسلالات الديدان والكواشف. سيكون المدربون محدودين فقط بعدد مجاهر التشريح المتاحة للاستخدام. كان التنفيذ السابق يضم طلابا يعملون في مجموعات من ثلاثة أشخاص لمشاركة مجهر واحد واستغرق أكثر من ثلاث جلسات مدتها 90 دقيقة: الأولى لممارسة التشريح ، والثانية لتنفيذ التشريح وتلطيخ DAPI ، والثالثة لتصوير الشرائح على مجهر مضان واسع المجال. توفر المشاركة في الأبحاث الجامعية العديد من الفوائد للطلاب11,29 ، الأكاديمية والشخصية. يسمح تضمين البحث في الدورات التدريبية عبر CUREs للطلاب بالمشاركة في البحث خلال وقت الفصل العادي11،30،31 ، مما يجعل التعرض لهذه الفوائد أكثر سهولة وإنصافا.
Protocol
1. تربية C. ايليجانس
ملاحظة: انظر بروتوكول صيانة C. elegans 16 و Elgin et al.32 لمزيد من التفاصيل. يمكن الحصول على سلالات C. elegans بسهولة من مركز Caenorhabditis Genetics Center (https://cgc.umn.edu) ويتم شحنها عبر البريد العادي إلى أي مكان في الولايات المتحدة. تبلغ تكلفة كل سلالة 10 دولارات ، ويدفع كل مختبر / مستخدم رسوما سنوية قدرها 30 دولارا.
- باستخدام تقنية معقمة ، قم بإعداد صفائح أجار متوسطة نمو الديدان الخيطية 6 سم (ألواح أجار NGM).
ملاحظة: يمكن تخزين الأطباق المصبوبة رأسا على عقب في أكمامها البلاستيكية الأصلية أو حاويات محكمة الإغلاق عند 4 درجات مئوية لعدة أشهر.- لصنع ألواح أجار NGM ، أضف 3 جم من كلوريد الصوديوم ، و 2.5 جم من ببتون باكتو ، و 20 جم من أجار NGM ، و ddH2O إلى 1 لتر (~ 975 مل). الأوتوكلاف الوسائط باستخدام دورة سائلة تثبت عند 121 درجة مئوية لمدة 20 دقيقة. اتركه يبرد إلى 55 درجة مئوية ، وباستخدام تقنية معقمة ، أضف 1 مل من الكوليسترول ، و 0.5 مل من 1 M CaCl2 ، و 1 مل من 1 M MgSO4 ، و 25 مل من 1 M من محلول فوسفات البوتاسيوم (الرقم الهيدروجيني 6).
ملاحظة: لعمل 1 M عازلة فوسفات البوتاسيوم ، امزج 108.3 جم من KH 2 PO 4 (أحاديالقاعدة) و 35.6 جم من K2HPO4 (ثنائي القاعدة) ؛ إذا لزم الأمر ، اضبط الرقم الهيدروجيني على 6 باستخدام KOH. أضف ddH2O حتى 1 لتر (عادة ~ 900 مل) والأوتوكلاف لمدة 40 دقيقة عند 121 درجة مئوية. 1 لتر من NGM يصنع حوالي 100 لوحة تحتوي على 10 مل لكل منها.
- لصنع ألواح أجار NGM ، أضف 3 جم من كلوريد الصوديوم ، و 2.5 جم من ببتون باكتو ، و 20 جم من أجار NGM ، و ddH2O إلى 1 لتر (~ 975 مل). الأوتوكلاف الوسائط باستخدام دورة سائلة تثبت عند 121 درجة مئوية لمدة 20 دقيقة. اتركه يبرد إلى 55 درجة مئوية ، وباستخدام تقنية معقمة ، أضف 1 مل من الكوليسترول ، و 0.5 مل من 1 M CaCl2 ، و 1 مل من 1 M MgSO4 ، و 25 مل من 1 M من محلول فوسفات البوتاسيوم (الرقم الهيدروجيني 6).
- باستخدام ماصة مصلية أو نقل ، حدد الألواح بثلاث قطرات من الثقافات البكتيرية E.coli OP50 (~ 150 ميكرولتر). حاول أن تكتشف في وسط اللوحة وتجنب وضع بقع قريبة جدا من حواف اللوحة ؛ هذا سوف يثني الحيوانات عن الزحف على جوانب الألواح والتجفيف.
- بمجرد أن يجف العشب البكتيري ، قم بتخزين الألواح المرقطة رأسا على عقب في درجة حرارة الغرفة (RT) لمدة تصل إلى 2 أسابيع. سيسمح اكتشاف الألواح قبل 1-2 أيام على الأقل من الاستخدام للمروج البكتيرية بالنمو بشكل أكثر سمكا ودعم كثافة أعلى من الحيوانات.
ملاحظة: لإعداد الثقافات البكتيرية OP50 ، يمكن طلب OP50 من مركز علم الوراثة Caenorhabditis. يتم وضع بكتيريا OP50 من مخزون الجلسرين على لوحة LB لضمان مستعمرات مفردة ويتم الاحتفاظ بها عند 4 درجات مئوية لمدة 4-6 أسابيع. تزرع المزارع البكتيرية OP50 في LB بين عشية وضحاها عند 37 درجة مئوية من مستعمرة واحدة - لا حاجة إلى الاهتزاز. لتحضير وسائط LB ، أضف 10 جم من التربتون ، و 10 جم من كلوريد الصوديوم ، و 5 جم من مستخلص الخميرة ، و 950 مل من ddH 2 O ،واضبط الرقم الهيدروجيني على 7 مع 10 N NaOH واضبط الحجم النهائي على 1 L مع ddH2O. القسمة إلى كميات 100 مل والأوتوكلاف لمدة 20 دقيقة عند 121 درجة مئوية. - لإنشاء مخزون عامل لكل سلالة ، اختر ثلاثة خنثى من المرحلة L4 على صفيحة NGM مرقطة. قم بتخزين الأطباق في درجة حرارة 15-25 درجة مئوية. حالة الاستزراع القياسية هي 20 درجة مئوية. إذا لم يكن الوصول إلى الحاضنات التي يتم التحكم في درجة حرارتها متاحا ، فحافظ على الثقافات على سطح الطاولة في RT.
ملاحظة: يمكن تنظيم الخنثى L4 بسهولة من حيث الحجم (أصغر من البالغين) ووجود نصف دائرة مميزة في منتصف الطريق عبر أجسامهم (الفرج النامي). عند 20 درجة مئوية ، ستصل الحيوانات إلى المرحلة L4 بعد 34-46 ساعة من الفقس (أي حوالي 40-52 ساعة بعد وضع الأجنة). انظر Corsi et al.14 لمزيد من التفاصيل حول توقيت مراحل النمو.- تحويل الثقافات إلى درجات حرارة مختلفة للتحكم في معدل التطور. ستنمو الحيوانات بشكل أسرع في درجات حرارة أعلى وأبطأ في درجات حرارة منخفضة. ستبدأ في أن تصبح معقمة عند درجات حرارة أعلى من 25 درجة مئوية.
ملاحظة: بعض الأنماط الجينية الطافرة حساسة لدرجة الحرارة وستعرض أنماطا ظاهرية مختلفة اعتمادا على درجة حرارة الاستزراع.
- تحويل الثقافات إلى درجات حرارة مختلفة للتحكم في معدل التطور. ستنمو الحيوانات بشكل أسرع في درجات حرارة أعلى وأبطأ في درجات حرارة منخفضة. ستبدأ في أن تصبح معقمة عند درجات حرارة أعلى من 25 درجة مئوية.
- حافظ على مخزون العمل عن طريق قطف ثلاثة خنثى L4 إلى صفيحة NGM مرقطة جديدة كل 4 أيام. سيضمن القيام بذلك وجود سكان ثابتين يتمتعون بتغذية جيدة مع مجموعة واسعة من مراحل النمو.
2. تشريح الغدد التناسلية
- جمع البالغين المطابقين للعمر: قبل 12-24 ساعة من التشريح ، اختر خنثى L4-stage إلى صفيحة NGM مرقطة جديدة - تنمو هذه لتصبح شبابا في اليوم التالي ، وهو مثالي للتشريح. يعتمد عدد الخنثى في المرحلة L4 على التحليل الخلوي الذي يتم إجراؤه ؛ عادة ، يتم تشريح 10-20 خنثى لكل شريحة ، مع اثنين إلى أربعة شرائح ولدت لكل حالة.
ملاحظة: يتم بثق الغدد التناسلية بكفاءة أكبر في الحيوانات التي تتغذى جيدا. تأكد من اختيار خنثى L4 من المخزونات العاملة التي لم يتم تجويعها (أي لا يزال لديها عشب بكتيري مرئي موجود على اللوحة). تميل الحيوانات الجائعة إلى الخضوع لسحب الغدد التناسلية غير المكتمل ، مما يجعل من الصعب تصورها.- في حالة تقييم المراحل اللاحقة من الانقسام الاختزالي ، مثل التحريك العضلي ، قم بتشريح كبار السن (48 ساعة بعد L4) لأنهم يتراكمون المزيد من نوى مرحلة التحريك ، مما يبسط التحليل. ومع ذلك ، يجب على الباحثين ملاحظة احتمال أن تكون بعض الآثار ناجمة عن تقدم عمر الأم.
- الاستعداد للتشريح.
- تحضير M9: أضف 3 جم من KH 2 PO 4 (أحادي القاعدة) ، 6 جم من Na 2 HPO4 (ثنائي القاعدة) ، 5 جم من كلوريد الصوديوم ، وأضف ddH2O إلى 100 مل. الأوتوكلاف الحل لمدة 20 دقيقة عند 121 درجة مئوية ، واتركه يبرد ، ثم أضف 1 مل من 1 M MgSO4 باستخدام تقنية معقمة.
- تحضير المخزن المؤقت للتشريح: امزج 1 ميكرولتر من 10٪ توين 20 ، 12 ميكرولتر من 100 مللي متر ليفاميزول ، 10 ميكرولتر من 10x M9 ، و 77 ميكرولتر من ddH2O.
ملاحظة: يتم تضمين Tween 20 في المخزن المؤقت للتشريح لتقليل التوتر السطحي وزيادة نفاذية أغشية الأنسجة. - تحضير محلول الإصلاح (2٪ PFA [100 ميكرولتر]): امزج 12.5 ميكرولتر من 16٪ بارافورمالدهيد (PFA) ، و 10 ميكرولتر من 10x M9 ، و 77.5 ميكرولتر من ddH2O ؛ تأكد من استخدام أمبولة جديدة من PFA (مفتوحة لمدة لا تزيد عن 2 أسابيع).
تنبيه: PFA مادة كيميائية خطرة ، ويجب تحضير محلول التثبيت في غطاء الدخان. - إعداد طريقة التجميد - النيتروجين السائل أسهل في الإدارة ، ولكن إذا لزم الأمر ، يمكن استخدام كتلة الألومنيوم فوق الثلج الجاف.
- طريقة النيتروجين السائل: ضع دورقا بلاستيكيا أو جرة كوبلين بلاستيكية في صندوق من البوليسترين. املأ الدورق بالنيتروجين السائل (الفائض في وعاء البوليسترين جيد). اضبط الملقط في مكان قريب. من الناحية المثالية ، يجب أن تكون الدورق ضيقة بما يكفي لمنع شرائح المجهر من السقوط تماما يجب أن تكون الشرائح الأفقية مائلة ويسهل الإمساك بها باستخدام الملقط.
ملاحظة: من المهم استخدام الحاويات البلاستيكية عند العمل مع النيتروجين السائل بدلا من الزجاج لتجنب التحطم بسبب التبريد السريع. - طريقة الثلج الجاف:
- ضع كتلة ألمنيوم مسطحة على ثلج جاف في وعاء من البوليسترين أو دلو ثلج مستطيل. من الأسهل تجميد الشرائح إذا كان الجزء العلوي من الكتلة أعلى الجزء العلوي من الحاوية.
- عند ارتداء القفازات ، اضغط برفق على كتلة الألمنيوم لضمان ملامسة جيدة للثلج الجاف وتسريع عملية التبريد (قد يطلق صراخا عندما يبرد المعدن بسرعة). ضع شفرة حلاقة في مكان قريب.
- اترك كتلة الألمنيوم على الثلج الجاف لمدة 30 دقيقة على الأقل قبل توقف التجمد للسماح بالتبريد الكامل ، وهو أمر ضروري للتجميد السريع.
ملاحظة: من الناحية المثالية ، يجب استخدام كتل صلبة من الثلج الجاف ، مما يساعد السطح على البقاء مستويا. إذا لزم الأمر, يمكن وضع كتلة الألومنيوم على كريات الثلج الجاف, ولكن يجب توخي الحذر لضمان بقاء السطح مستويا. - سيجمع سطح كتلة الألمنيوم الصقيع ، مما قد يمنع الاتصال الوثيق بين الشرائح والكتلة. استخدم شفرة الحلاقة لكشط الصقيع عن السطح ، وإخلاء منطقة لكل شريحة. سيساعد تغطية حاوية البوليسترين بغطاء على منع تراكم الصقيع المفرط.
- طريقة النيتروجين السائل: ضع دورقا بلاستيكيا أو جرة كوبلين بلاستيكية في صندوق من البوليسترين. املأ الدورق بالنيتروجين السائل (الفائض في وعاء البوليسترين جيد). اضبط الملقط في مكان قريب. من الناحية المثالية ، يجب أن تكون الدورق ضيقة بما يكفي لمنع شرائح المجهر من السقوط تماما يجب أن تكون الشرائح الأفقية مائلة ويسهل الإمساك بها باستخدام الملقط.
- املأ جرة كوبلين ب ~ 40 مل من الإيثانول بنسبة 95٪.
- املأ ثلاثة برطمانات كوبلين ب ~ 40 مل من PBS-T.
ملاحظة: لصنع PBS-T ، امزج 100 مل من 10x PBS ، و 5 مل من Triton X-100 ، و 2 مل من 0.5 M EDTA (الرقم الهيدروجيني 8). أضف 873 مل من ddH2O. رج العبوة بقوة لحل Triton X-100. لعمل 10x PBS ، امزج 25.6 جم من Na 2 HPO 4 · 7H 2 O ، و80 جم من كلوريد الصوديوم ، و 2 جم من KCl ، و 2 جم من KH2PO4. أضف ddH2O لرفع مستوى الصوت إلى 1 لتر. الأوتوكلاف لمدة 40 دقيقة عند 121 درجة مئوية. يتم تضمين المنظف Triton X-100 في مخزن الغسيل PBS-T لتقليل التوتر السطحي وتعزيز الاحتفاظ بالحيوانات المثبتة بالكامل على الشريحة.
- تشريح الحيوانات على غطاء زجاجي مقاس 18 مم × 18 مم. هذه الخطوة حساسة للوقت بسبب تبخر المخزن المؤقت للتشريح. يجب أن يستغرق الأمر أقل من 5 دقائق لإنهاء التشريح.
ملاحظة: يستخدم ليفاميزول لشل حركة الحيوانات لتسهيل تشريحها ، لكن تركها في ليفاميزول لفترة طويلة جدا سيؤدي إلى ضعف قذف الغدد التناسلية. من الأسهل تقليل عدد الحيوانات التي يتم تشريحها لكل شريحة من أجل التوافق مع الإطار الزمني البالغ 5 دقائق.- ضع شريحة تثبيت على مسرح مجهر التشريح - يتم استخدام شريحة التثبيت لتحريك غطاء الغطاء بسهولة أكبر ، ويمكن إعادة استخدامها إلى أجل غير مسمى (الشكل 2 أ ، الصورة اليسرى).
- ضع غطاء الغطاء أعلى شريحة التثبيت وماصة 4 ميكرولتر من محلول التشريح في وسط قسيمة الغطاء. حرك شريحة الضغط إلى جانب واحد من المسرح لتحرير العرض.
- اختيار 10-20 خنثى في قطرة من محلول تشريح. اختر ما يكفي من الحيوانات لتصوير ~ 10 لكل شريحة ، ولكن ليس كثيرا بحيث لا يمكن تشريحها في غضون 5 دقائق.
- تشريح الحيوانات باستخدام إبرتين حقنة ، واحدة لكل يد (الشكل 2 أ).
- اعبر نقاط الإبر لعمل شكل X واستخدم الجزء السفلي من X لتثبيت شخص بالغ على سطح قسيمة الغطاء.
ملاحظة: قد يتطلب الأمر ممارسة لاكتشاف أفضل طريقة لحمل كل إبرة من حيث الزاوية والدوران. ابدأ بإمساك الإبر مع توجيه شطبها (الحافة المائلة) لأسفل. انظر المناقشة للحصول على اقتراحات حول التعلم الأول للتشريح في حجم أكبر (الشكل 2D). - ضع شكل X خلف البلعوم مباشرة ، حوالي 1/5 من طول جسم الشاب البالغ ، أو أسفل الجزء الشفاف من الرأس مباشرة (الشكل 2 أ ، الرسم البياني الأيمن).
- قطع رأس الحيوان بحركة مقصية واحدة (مثل تقطيع الطعام بسكين وشوكة). سيؤدي البثق الجيد إلى إطلاق ذراع واحدة من الغدد التناسلية (أو في بعض الأحيان كلا الذراعين) بالكامل من تجويف الجسم ، جنبا إلى جنب مع أحد نصفي القناة الهضمية أو كليهما (الشكل 2 ب ، الصورة اليسرى). ستظهر القناة الهضمية أغمق وذات عرض موحد ، بينما ستظهر الغدد التناسلية واضحة بطرف مدبب بعيد.
- يجب قطع كل مرة واحدة فقط ؛ إذا لم تنبثق الغدد التناسلية بعد إجراء القطع ، فما عليك سوى الانتقال إلى الحيوان التالي. يقلل القطع الأول بشكل كبير من الضغط الهيدروستاتيكي في الجسم ، مما يجعل أي تخفيضات أخرى من غير المرجح أن تؤدي إلى بثق أفضل. يمكن رؤية البثق غير المكتمل أو الضعيف بسهولة أثناء التصوير ويمكن تجاهله (الشكل 2 ب ، الصورة اليمنى).
ملاحظة: لا تحاول فصل الغدد التناسلية عن الذبيحة ، فالقيام بذلك عادة ما يؤدي إلى تمزيق الأنسجة والحد من عدد المراحل الاختزالية التي يمكن تحليلها.
- يجب قطع كل مرة واحدة فقط ؛ إذا لم تنبثق الغدد التناسلية بعد إجراء القطع ، فما عليك سوى الانتقال إلى الحيوان التالي. يقلل القطع الأول بشكل كبير من الضغط الهيدروستاتيكي في الجسم ، مما يجعل أي تخفيضات أخرى من غير المرجح أن تؤدي إلى بثق أفضل. يمكن رؤية البثق غير المكتمل أو الضعيف بسهولة أثناء التصوير ويمكن تجاهله (الشكل 2 ب ، الصورة اليمنى).
- كرر تشريح الحيوانات المتبقية على قسيمة الغطاء.
- اعبر نقاط الإبر لعمل شكل X واستخدم الجزء السفلي من X لتثبيت شخص بالغ على سطح قسيمة الغطاء.
- إصلاح العينة مع الفورمالديهايد.
- العمل برفق ، ماصة 4 ميكرولتر من حل الإصلاح على غطاء قريب جدا من قطرة مع الحيوانات. من الناحية المثالية ، تكون القطرات قريبة بما يكفي للدمج ؛ تجنب السحب مباشرة في قطرة التشريح وإزاحة الجثث المشرحة.
- ثبت الغطاء على شريحة التثبيت باستخدام إصبع واحد. من ناحية أخرى ، حرك الغطاء برفق عدة مرات لخلط القطرات. تركيز الإصلاح النهائي هو 0.8٪ PFA.
- أمسك شريحة موجبة الشحنة من الجانب الأمامي لأسفل ، استخدمها لالتقاط غطاء الغطاء في وسط الشريحة. المس قطرة العينة برفق ، وسوف يلتقط التوتر السطحي للقطرة قسيمة الغطاء.
ملاحظة: تحتوي الشرائح المشحونة إيجابيا على طلاء إلكتروستاتيكي يساعد الأنسجة على الالتصاق بالسطح لمنع فقدان العينة.- إذا رغبت في ذلك ، ضع غطاء الغطاء قطريا ، بحيث تتدلى زاوية واحدة من الحافة العلوية أو السفلية للشريحة بمقدار 1 مم. سيؤدي ترك الجزء المتدلي إلى تسهيل كسر الغطاء بعد التجميد (الشكل 2 ج).
- اضبط الشريحة على المقعد وقم بإصلاحها لمدة 5 دقائق بالضبط في RT. خلال هذا الوقت ، قم بتسمية الشريحة بقلم رصاص.
ملاحظة: من الشائع الإفراط في إصلاح العينات ، والتي يمكن اكتشافها عن طريق استبعاد الأجسام المضادة من النوى أو حتى جميع الأنسجة. بالإضافة إلى ذلك ، بعض الأجسام المضادة حساسة بشكل خاص للفورمالديهايد. في هذه الحالات ، قلل من وقت التثبيت ، أو قلل التركيز النهائي للفورمالديهايد المستخدم.
- تجميد الكراك
- مباشرة بعد الإصلاح ، قم بتجميد الشرائح.
- في حالة استخدام النيتروجين السائل: أمسك الحافة المصنفة للشريحة بملاقط وقم بخفضها برفق إلى نيتروجين سائل. حرر الشريحة بحيث تميل على جانب الدورق ، وتغطي الجانب المنزلق لأعلى. يتم تجميد الشرائح في غضون 10 ثوان (بمجرد توقف السائل عن الغليان).
- في حالة استخدام الثلج الجاف: اكشط الصقيع من سطح كتلة الألومنيوم باستخدام ماكينة حلاقة. أمسك الحافة الموسومة للشريحة بإحكام وضعها على السطح الذي تم تطهيره ، مع تطبيق بعض الضغط لأسفل لضمان التلامس الكامل مع الكتلة. يجب أن يكون الغطاء بالكامل على سطح الكتلة. يحدث التجميد في غضون 10 ثوان ويمكن تأكيده بصريا حيث تتحول العينة الموجودة أسفل الغطاء إلى جليد.
- لكلتا الطريقتين ، اترك الشرائح لمدة 5 دقائق على الأقل لتجميدها بالكامل.
ملاحظة: بمجرد التجميد ، يمكن ترك الشرائح في النيتروجين السائل أو على الكتلة لمدة 15-20 دقيقة ، طالما ظلت مجمدة. يسمح ذلك بجمع شرائح متعددة في هذه المرحلة قبل المتابعة إلى خطوة التكسير.
- العمل بسرعة ، وكسر غطاء الانزلاق من العينة. هذه الخطوة حساسة للوقت. قم بإزالة الغطاء واغمر الشريحة في الإيثانول قبل أن تبدأ العينة في الذوبان.
- قم بإزالة الشريحة المجمدة (باستخدام ملاقط النيتروجين السائل).
- أمسك الحافة القصيرة المسماة بالشريحة بإحكام وثبت حافة طويلة واحدة على المقعد.
- من ناحية أخرى ، أمسك ماكينة الحلاقة بإحكام ، وحرك حافة ماكينة الحلاقة لأسفل الشريحة لنفض الغبار عن الغطاء وبعيدا عن العينة. تكون هذه الخطوة أسهل قليلا إذا تم وضع غطاء الغطاء مع نتوء زاوية (الشكل 2C).
- مباشرة بعد الإصلاح ، قم بتجميد الشرائح.
- ضع الشريحة على الفور في جرة كوبلين تحتوي على 95٪ إيثانول في RT. اترك الشرائح في الإيثانول لمدة 5 دقائق على الأقل.
ملاحظة: يمكن ترك الشرائح في الإيثانول لفترة من الوقت - وهذا يسمح بجمع شرائح متعددة في هذه الخطوة قبل الشروع في الغسيل. يمكن أيضا تخزين الشرائح في هذه الخطوة لعدة أيام. في حالة التخزين ، انقل جرة كوبلين من الشرائح في الإيثانول إلى -20 درجة مئوية. - اغسل الشرائح في PBS-T ثلاث مرات لمدة 5 دقائق لكل منها في RT. استخدم PBS-T الطازج لكل غسلة.
- في حالة تلطيخ الأجسام المضادة ، انتقل إلى الخطوة 3 (تلطيخ الأجسام المضادة). إذا تم تلطيخها فقط باستخدام DAPI لتصور الكروموسومات ، فانتقل إلى الخطوة 4 (التركيب والتصوير).
3. تلطيخ الأجسام المضادة
- حضانة الأجسام المضادة الأولية
ملاحظة: عند وضع الظروف المناسبة للأجسام المضادة الجديدة ، من المهم تضمين الضوابط السلبية التالية للتحقق من خصوصية إشارة الفلورسنت: 1) شريحة تفتقر إلى جسم مضاد أولي ولها جسم مضاد ثانوي فقط ؛ 2) شريحة بها جسم مضاد أولي فقط تفتقر إلى جسم مضاد ثانوي. يجب أن ينتج عن كل من هذه الضوابط السلبية نقص كامل في الإشارة. إذا تم تحديد التألق على شريحة الأجسام المضادة الثانوية فقط ، فيجب زيادة تخفيف الجسم المضاد الثانوي أو استخدام ثانوي مختلف. إذا تم تحديد التألق على شريحة الأجسام المضادة الأولية فقط ، فمن المحتمل أن يكون ذلك بسبب التألق الذاتي أو الملوثات المحتملة الأخرى.- تمييع الجسم المضاد الأساسي في عازلة تخفيف الأجسام المضادة (50 ملغ من BSA + 50 ميكرولتر من 10 ٪ أزيد الصوديوم + 10 مل من PBS-T ) - إعداد ما يكفي من تخفيف الأجسام المضادة لاستخدام 20-30 ميكرولتر لكل شريحة.
- قم بإعداد غرفة رطبة: قم بتبطين الجزء السفلي من حاوية بلاستيكية بغطاء محكم الإغلاق بمناشف ورقية مبللة. ضع طبقة واحدة من ماصات باستور الزجاجية فوق المناشف الورقية. تخلق هذه الماصات سطحا يسمح للشرائح بالبقاء مستوية ويبقيها مرتفعة عن المناشف الورقية.
ملاحظة: بالنسبة للغرف الرطبة ، من الأفضل استخدام حاويات تخزين الطعام البلاستيكية ذات الأغطية المفاجئة ، مما يسهل فتح الحاوية وإغلاقها دون تعطيل الشرائح الموجودة بداخلها. ابحث عن واحدة طويلة بما يكفي لماصات باستور ولكن لها أيضا قاع مسطح نسبيا بدون مسافات بادئة للسماح للشرائح بالراحة أفقيا بالكامل. - قم بإزالة الشريحة من غسل PBS-T النهائي. اعمل بسرعة من هذه الخطوة إلى الأمام للحفاظ على العينة رطبة في جميع الأوقات وتجنب التبخر. إذا جفت العينة ، فسيتأثر تلطيخ الأجسام المضادة سلبا.
- جفف سطح الشريحة بالكامل باستخدام منديل مسح مطوي في مستطيل مضغوط. امسح الجزء الأمامي والخلفي من الشريحة ، ولكن اترك مساحة كبيرة حول العينة. توخ الحذر بشكل خاص عند تجفيف السطح بالقرب من العينة - تجنب الاقتراب كثيرا من العينة ، مما يترك مساحة بحجم غطاء الغطاء غير مجففة. ومع ذلك ، تأكد من أن محيط العينة جاف للخطوة التالية.
- ارسم دائرة حول العينة باستخدام قلم PAP كاره للماء. توخ الحذر لإحاطة منطقة العينة بأكملها ، ولكن تجنب تعطيل جثث الحيوانات المرئية على سطح الشريحة. انتظر ~ 5 ثوان للسماح للحاجز بالجفاف تماما.
ملاحظة: الحاجز الكارهة للماء ضروري لاحتواء محلول الأجسام المضادة الأساسي لأن سطح الشريحة قد تم طلاؤه ب PBS-T ، والذي يحتوي على منظف. يعمل قلم PAP بشكل أفضل على سطح منزلق جاف ، لذلك من المهم إنشاء محيط جاف حول العينة. ترك المنطقة الأقرب إلى العينة غير المجففة يحمي العينة خلال هذه الخطوة - اعمل بسرعة ، استخدم زاوية أو حافة منديل المسح المطوي لامتصاص السائل بعيدا عن العينة داخل الحاجز الكارهة للماء. احرص على تجنب تعطيل جثث الحيوانات.
- على الفور ماصة 20 ميكرولتر من محلول الأجسام المضادة الأساسي في الحلقة التي أنشأها الحاجز الكارهة للماء. احرص على ماصة بلطف وبزاوية لمنع تعطيل الجثث. تجنب السحب مباشرة على أي جثة.
- قم بإمالة الشريحة برفق للتأكد من تغطية السطح بالكامل داخل الحاجز الكارهة للماء بالمحلول.
ملاحظة: من الأفضل أن يكون محيط الحواجز الكارهة للماء محيطا داخليا يتراوح من 1-1.5 سم ، وهو مغطى بالكامل ب 20 ميكرولتر من محلول الأجسام المضادة. يعتمد عرض المحيط على كيفية توزيع الذبائح أثناء خطوة التجميد والكراك. قد تتطلب الحواجز الأوسع حجما أكبر من محلول الأجسام المضادة. إذا رغبت في ذلك ، يمكن وضع مربعات صغيرة من البارافيلم (مقطوعة بحجم غطاء 18 مم × 18 مم) برفق أعلى العينة. ستضمن مربعات الباراشيل أن محلول الأجسام المضادة يغطي العينة بأكملها وسيساعد أيضا في منع التبخر. - كرر الخطوات 3.1.3-3.1.8 لبقية الشرائح.
- انقل الشرائح بعناية إلى الغرفة الرطبة ، وتأكد من أن المحلول يظل موجودا داخل الحاجز الكارهة للماء وأن الشرائح تستريح بشكل مستو تماما.
- احتضان الشرائح طوال الليل في RT. اعتمادا على الجسم المضاد ، يمكن تقصير هذه الخطوة إلى 6 ساعات أو إجراؤها طوال الليل عند 4 درجات مئوية عن طريق الاحتفاظ بالغرفة الرطبة في غرفة باردة أو ثلاجة.
ملاحظة: عادة ما يكون استخدام غرفة رطبة وحواجز كارهة للماء كافيا لمنع تبخر محلول الأجسام المضادة ، حتى في حالات الحضانة الطويلة بين عشية وضحاها. ومع ذلك ، إذا ثبت أن التبخر يمثل مشكلة ، فيمكن وضع مربعات صغيرة من البارافيلم برفق على كل عينة ، مما سيساعد على منع التبخر. يمكن إزالتها في خطوة الغسيل الأولى: اغمر كل شريحة في جرة كوبلين مملوءة ب PBS-T (لا تحتوي على شرائح أخرى) ، واترك البارافيلم يطفو بعيدا عن العينة. قم بإزالة البارافيلم من جرة كوبلين قبل استخدام نفس البرطمان لإزالة البارافيلم من الشريحة التالية.
- اغسل الشرائح في برطمانات كوبلين تحتوي على ~ 40 مل من PBS-T ثلاث مرات لمدة 5 دقائق لكل منها في RT. استخدم PBS-T الطازج لكل غسلة.
- أثناء هذه الغسلات ، قم بتخفيف الجسم المضاد الثانوي في مخزن تخفيف الأجسام المضادة. تحضير ما يكفي من تخفيف الأجسام المضادة لاستخدام 20-30 ميكرولتر لكل شريحة. من الشائع استخدام الأجسام المضادة الثانوية المترافقة Alexa Fluor المخففة عند 1: 200.
- حضانة الأجسام المضادة الثانوية
- قم بإزالة الشريحة من غسل PBS-T النهائي. اعمل بسرعة من هذه الخطوة إلى الأمام للحفاظ على العينة رطبة في جميع الأوقات وتجنب التبخر.
- جفف الشريحة باستخدام منديل مسح مطوي. تجنب تجفيف المنطقة التي يحتويها الحاجز الكارهة للماء.
- اعمل بسرعة ، استخدم زاوية أو حافة منديل المسح المطوي لامتصاص السائل بعيدا عن العينة داخل الحاجز الكارهة للماء. احرص على تجنب تعطيل جثث الحيوانات.
- على الفور ماصة 20 ميكرولتر من محلول الأجسام المضادة الثانوي في الحلقة التي أنشأها الحاجز مسعور. احرص على الماصة برفق وبزاوية لمنع تعطيل الجثث.
- تجنب السحب مباشرة على أي جثة. تأكد من تغطية السطح بالكامل داخل الحاجز الكارهة للماء بالمحلول. قد تتطلب محيط الحاجز الأوسع حجما أكبر من محلول الأجسام المضادة. إذا رغبت في ذلك ، قم بتغطية العينة بمربع صغير من البارافيلم (انظر الملاحظة أدناه الخطوة 3.1.8).
- انقل الشريحة بعناية إلى الغرفة الرطبة ، وتأكد من بقاء المحلول داخل الحاجز الكارهة للماء وأن الشريحة تستريح بشكل مستو تماما. أعد تركيب غطاء الحجرة الرطبة لإبقاء الشريحة في الظلام.
- كرر الخطوات 3.3.1-3.3.6 لبقية الشرائح.
- احتضان في الظلام لمدة 4 ساعات في RT.
ملاحظة: اعتمادا على الجسم المضاد ، يمكن تقصير هذه الخطوة إلى 2 ساعة أو تمديدها إلى 6 ساعات. إذا لم تكن الغرفة الرطبة مظلمة ، ضعها في درج أو قم بتغطيتها بصندوق من الورق المقوى. بدلا من ذلك ، يمكن لف الغرفة الرطبة بورق الألمنيوم للحفاظ على الشرائح في الظلام.
- اغسل الشرائح في برطمانات كوبلين تحتوي على ~ 40 مل من PBS-T ثلاث مرات لمدة 5 دقائق لكل منها في RT. استخدم PBS-T الطازج لكل غسلة.
4. التركيب والتصوير
- استعد لتركيب العينة من خلال وجود وسيط تركيب + DAPI (2 ميكروغرام / مل) ، وأغطية زجاجية مقاس 18 مم × 18 مم ، وطلاء أظافر في متناول اليد.
- قم بإزالة الشريحة من الغسيل النهائي وجففها باستخدام منديل مسح مطوي. تجنب تجفيف المنطقة التي يحتويها الحاجز الكارهة للماء.
- باستخدام زاوية منديل المسح المطوي ، قم بإزالة السائل بعناية من العينة داخل الحاجز. قم بإزالة معظم السوائل في هذه الخطوة ، ولكن دون ترك الذبائح تجف تماما.
- العمل بسرعة ، أضف 8 ميكرولتر من وسيط التركيب إلى العينة. ماصة بلطف وبزاوية لمنع تعطيل الجثث. تجنب السحب مباشرة على الجثث.
- لا تزال تعمل بسرعة ، قم بخفض الغطاء الزجاجي بعناية على العينة.
- يمكن أن تعطل فقاعات الهواء التصوير وتؤدي إلى تدهور العينة. لتقليل فقاعات الهواء ، ضع حافة واحدة من غطاء الغطاء على الشريحة المجاورة للعينة ، بحيث يتم تثبيتها قطريا فوق العينة. يمكن أن يساعد في إراحة الحافة العلوية من غطاء الغطاء على قلم رصاص أو ملاقط. ثم قم بخفض الحافة العلوية لانزلاق الغطاء ببطء - تسمح هذه الحركة لوسيط التثبيت بإنشاء ختم سائل يتقدم من حافة واحدة إلى الحافة المقابلة.
- كرر الخطوات من 4.2 إلى 4.5 لبقية الشرائح.
- أغلق أغطية الأغطية بطلاء الأظافر. احرص على تجنب الضغط لأسفل على غطاء الغطاء (الذي سيسحق العينة) أو إزاحة الغطاء أفقيا (مما يؤدي إلى تشويه العينة).
- أضف نقطة صغيرة من طلاء الأظافر إلى كل ركن من أركان غطاء الغطاء (~ 1 مم). سيساعد ذلك في تثبيت الغطاء في مكانه. اترك النقاط تجف تماما.
- عندما تجف الزوايا تماما ، أغلق الحواف بطلاء الأظافر. تأكد من أن الملمع يملأ الفجوة بين غطاء الغطاء والشريحة تماما ، ولكن تجنب تغطية غطاء العينة كثيرا. من الأفضل الحفاظ على تداخل 1 مم على غطاء الغطاء. استخدمي فقط طلاء الأظافر بقدر الحاجة. تجنب استخدام الكثير أو وجود طلاء زائد ، والذي قد يستغرق وقتا طويلا حتى يجف ويتعرض لخطر إتلاف هدف المجهر.
ملاحظة: يفضل استخدام طلاء الأظافر الملون بدلا من الشفاف مما يسهل رؤية حدود الختم ويساعد على منع تصوير الحيوانات التي تقع تحت حدود طلاء الأظافر. - اترك طلاء الأظافر يجف تماما قبل التصوير. هذه الخطوة مهمة ، لأن طلاء الأظافر الرطب يمكن أن يلحق أضرارا بالغة بأهداف المجهر.
ملاحظة: يجب أن تبقى الشرائح في الظلام قدر الإمكان من الآن فصاعدا. استخدم صندوقا من الورق المقوى المسطح لتغطيتها أثناء جفافها على المقعد.
- قم بتخزين الشرائح في الظلام عند 4 درجات مئوية لمدة 1-2 أسابيع قبل التصوير. إذا لزم الأمر ، قم بتخزين الشرائح في -20 درجة مئوية لمدة أطول.
- الصورة باستخدام المجهر الضوئي المركب الفلوري القياسي.
- لكل شريحة ، أولا ، افحص العينة بأكملها عند 10x في قناة DAPI لتحديد الغدد التناسلية المبثوقة جيدا ولاحظ موضعها. بالنسبة لمعظم التطبيقات ، تجنب تصوير أي غدد تناسلية مقطوعة أو غير مكتملة أو مغطاة جزئيا بجزء آخر من الحيوان. بالنسبة لمعظم الحيوانات ، سيتم بثق ذراع الغدد التناسلية واحد فقط ومرئي بالكامل.
ملاحظة: قد يكون من المفيد التقاط صورة ذات تكبير أقل بمعدل 10x من الغدد التناسلية بأكملها في قناة DAPI لاستخدامها في التوجيه اللاحق أو تحديد موقع نوى معينة. - اعتمادا على التطبيق ، يمكن التقاط الصور بمعدل 40x أو 63x أو 100x. إذا كان سيتم التقاط الغدد التناسلية بأكملها ، فقم بإنشاء مونتاج بحدود متداخلة. أثناء التصوير ، تذكر أن الغدد التناسلية عبارة عن أنبوب مجوف ، مع نوى أكثر كثافة في الأعلى والأسفل.
- لكل شريحة ، أولا ، افحص العينة بأكملها عند 10x في قناة DAPI لتحديد الغدد التناسلية المبثوقة جيدا ولاحظ موضعها. بالنسبة لمعظم التطبيقات ، تجنب تصوير أي غدد تناسلية مقطوعة أو غير مكتملة أو مغطاة جزئيا بجزء آخر من الحيوان. بالنسبة لمعظم الحيوانات ، سيتم بثق ذراع الغدد التناسلية واحد فقط ومرئي بالكامل.
النتائج
يرتبط DAPI بقوة بالحمض النووي ، وتلطيخه قوي حتى في ظل مجموعة متنوعة من الظروف (الشكل 3 أ ، ب). يجب أن يكون موجودا في جميع النوى وبالتالي يقوم بتحكم إيجابي فعال لوجود أي نسيج دودي على الشريحة والقدرة على اكتشاف التألق على المجهر. يكون التلوين فعالا عندما يكون الجسم المضاد موجودا داخل النوى الاختزالية (الشكل 3 أ ، ب). على سبيل المثال ، يوضح الشكل 3A ، B نوى منتصف pachytene ملطخة ب DAPI وجسم مضاد يستهدف RAD-51 ، وهي علامة على فواصل الشريط المزدوج. KLE-2 هو أحد مكونات المكثفات ، وهو مركب بروتيني محفوظ للغاية يبني الكروموسومات استعدادا للانقسام والانقسام الاختزالي. تحتوي طفرات kle-2 / + على عيوب طفيفة في بنية الكروموسوم ، كما هو موضح في تلطيخ DAPI المضطرب قليلا وزيادة في عدد كسر الشريط المزدوج الذي ينعكس في العدد الأعلى من بؤر RAD-51 (الشكل 3 ب). من الأخطاء الشائعة في التألق المناعي ترك العينة في محلول الإصلاح لفترة طويلة جدا. يمكن أن يؤدي الإفراط في التثبيت إلى تلطيخ غير ناجح لأنه عادة ما يمنع الأجسام المضادة من الانتشار في النوى. يمكن تحديد هذا الخطأ عندما ينتشر الجسم المضاد في المناطق السيتوبلازمية في المناسل ، ولكن يبدو أنه مستبعد من النوى.
في الخط الجرثومي (الشكل 1) ، تتكاثر النوى انقساميا عند الطرف البعيد ، وتدخل الانقسام الميوزي خلال المنطقة الانتقالية ، وتتقدم عبر الباكيتين (الذي غالبا ما ينقسم إلى ثلاث مراحل متساوية بعدد من صفوف النوى) قبل دخول ثنائي بلوتين وأخيرا دياكينيسيس. يتم ترقيم البويضات في التحريك الذهني بناء على قربها من الحيوانات المنوية ، حيث تكون البويضة -1 هي الأكثر قربا من الحيوانات المنوية ، والخلية البيضية -2 هي البعيدة التالية ، وهكذا. تحتوي C. elegans على ستة كروموسومات ، والتي تظهر على شكل أشكال بيضاوية مدمجة في نوى التحريك الحادي. يمثل كل منها زوجا متماثلا من كروماتيدين شقيقين مرتبطين معا بواسطة chiasma ، وتسمى أيضا ثنائية التكافؤ (الشكل 3C). المسوخ ، مثل spo-11 ، التي تعطل تشكيل التقاطع سوف تفشل في تشكيل chiasmata. لذلك ، سيكون لنوى التحريك الديناميكي 12 جسما منفصلا من DAPI (تسمى أيضا أحادي التكافؤ) ، واحد لكل كروماتيد شقيق (الشكل 3D).
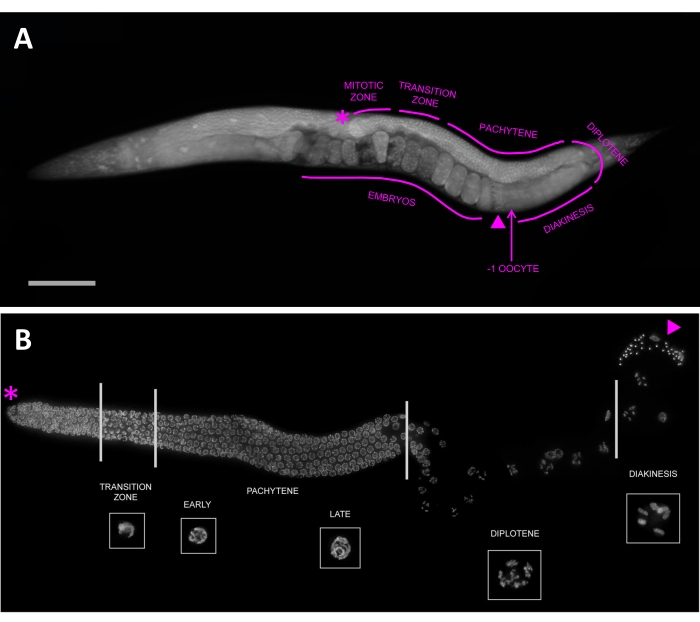
الشكل 1: تصطف نوى الخط الجرثومي بطريقة مكانية زمانية تمثل تقدمها خلال الانقسام الميوزي. (أ) خنثى بالغ كامل التركيب ملطخ ب DAPI. يتم تحديد مراحل الغدد التناسلية والانقسام الاختزالي ، من الطرف البعيد (النجمة) إلى المنطقة القريبة (البويضة -1 ، المشار إليها بسهم) ، والتي تحتوي على الحيوانات المنوية (المثلث). يمثل شريط المقياس 100 ميكرومتر. (ب) صورة مضان متوقعة لغدد خنثى تشريح ملطخة ب DAPI. يشار إلى المراحل الاختزالية ، مع ظهور نوى تمثيلية في أقحم (تظهر جميع الأجزاء الداخلية على أنها تتدرج مع بعضها البعض). يمكن تنظيم النوى بسهولة بناء على موقعها في الخط الجرثومي ومورفولوجيا الكروموسوم المميزة ، وتتقدم من المنطقة الانقسامية عند الطرف البعيد (النجمة) ، إلى المنطقة الانتقالية ، من خلال الباكيتين ، والديبلوتين ، والدياكينيسيس. تتميز الحيوانات المنوية بمثلث. تم تكييف هذا الرقم من Hillers et al. بموجب ترخيص CC BY 3.028. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 2: عرض توضيحي لإعداد التشريح . (أ) مرحلة المجهر أثناء التشريح. يتم تشريح الحيوانات في 4 ميكرولتر من محلول التشريح على غطاء يوضع على شريحة التثبيت ، والتي تستخدم لتحريك الغطاء إلى العرض. يوضح الرسم البياني وضع الإبرة المثالي. يتم الاحتفاظ بالإبر بحافة مشطوفة متجهة لأسفل ، متقاطعة فوق منطقة البلعوم. تظهر الأسهم الوردية حركة تشبه المقص للإبر. يظهر الخط الوردي المتقطع موقع القطع المثالي. (ب) صور لحيوانات تم تشريحها، مع مثال على قذف كامل وقذف غير كامل. يتم تصنيف أقسام الغدد التناسلية المبثوقة والشجاعة. (ج) صورة توضح خطوة التصدع المتجمد. يجب تثبيت الشريحة بإحكام بيد واحدة ، بحيث يكون جانب الغطاء متجها بعيدا عن الجسم. الحافة المقابلة مثبتة على مقاعد البدلاء. يجب أن تمسك الشفرة في اليد الأخرى. يشير السهم الوردي إلى اتجاه حركة ماكينة الحلاقة لنفض الغطاء عن الشريحة ، مع دوران طفيف بحيث ينزلق الغطاء بعيدا عن الجسم. لاحظ أنه تم وضع غطاء الغطاء بحيث تتدلى زاوية واحدة على الحافة الطويلة للشريحة. (د) صورة الإعداد لممارسة التشريح في طبق تلطيخ الأجنة الزجاجي. توضع الحيوانات في 50-200 ميكرولتر من محلول التشريح ، مما ينفي مشكلة التبخر ويطيل وقت التشريح. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
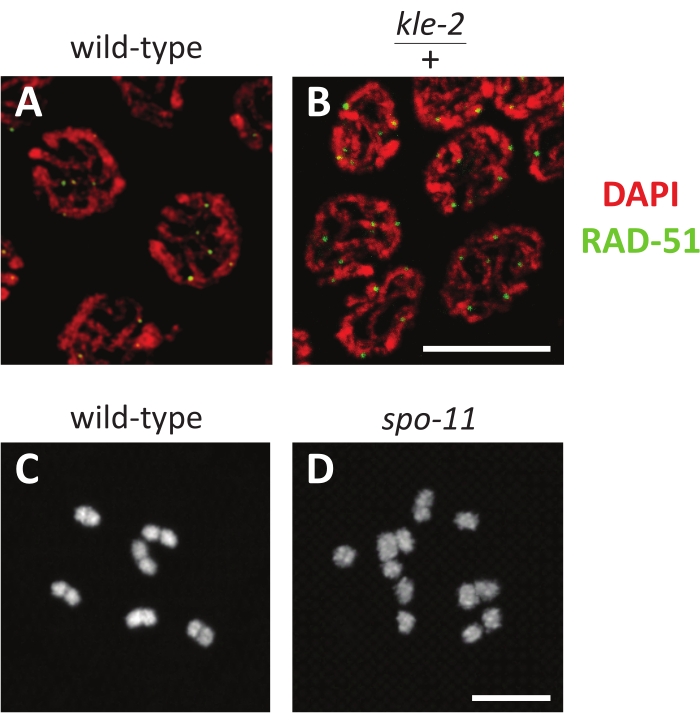
الشكل 3: نتائج التألق التمثيلي لنوى الخط الجرثومي . (أ ، ب) إسقاطات Z-stack لنوى pachytene المتأخرة الملطخة بالجسم المضاد RAD-51 (الأخضر) و DAPI (الأحمر) في (A) من النوع البري و (B) kle-2 / + متغاير الزيجوت. (ج، د) إسقاطات Z-stack لنواة واحدة من التحريك الديناميكي ملطخة ب DAPI في (C) من النوع البري (مع ستة أجسام تلطيخ DAPI) و (D) طفرات spo-11 (مع 12 جسم تلطيخ DAPI). تمثل قضبان المقياس 5 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
Discussion
يتطلب التكاثر الجنسي تكوين جاميتات أحادية الصيغة الصبغية، تنتج عن طريق الانقسام الخلوي المتخصص في الانقسام الميوزي. أصبحت C. elegans نموذجا شائعا للدراسة الخلوية للانقسام الاختزالي بسبب شفافيتها البصرية ، وتشريح الخط الجرثومي المريح ، وعلم الوراثة القوي28. يمكن الجمع بين التجارب العضوية البسيطة التي تقيم الخصوبة والفتك الجنيني مع علم الوراثة الجزيئي لمعالجة العديد من الأسئلة في المختبر أو الفصل الدراسي. على سبيل المثال، نظرا لأن عمليات الانتقال ضرورية لفصل الكروموسومات بشكل صحيح، فإن العمليات التي تعطل تكوينها أو حلها ستولد جاميتات اختلالية الصيغة الصبغية. في المقابل ، يؤدي اختلال الصيغة الصبغية إلى ذرية غير قابلة للحياة ، والتي يمكن تقييمها بسهولة عن طريق حساب النسل ، أو من خلال طريقة أكثر تعقيدا قليلا لتحديد الفتك الجنيني. من الناحية الخلوية ، سيؤثر نقص عمليات الانتقال على عدد الأجسام الملطخة ب DAPI التي لوحظت أثناء التحريك النفسي. إن متانة تلطيخ DAPI وسهولة التسجيل تجعل هذه تجربة مثالية لتعليم التقنيات الخلوية. يوفر التخطيط الزماني المكاني للنوى في الخط الجرثومي الخنثى لقطة لكل مرحلة من مراحل الانقسام الاختزالي في لحظة واحدة من الزمن. تستغرق النوى حوالي 54 ساعة للانتقال من النهاية الانقسامية البعيدة للخط الجرثومي إلى النهاية القريبة (على سبيل المثال ، انظر Jaramillo-Lambert et al.33 و Stamper et al.34 و Libuda et al.35). يسمح هذا التوقيت الراسخ للتقدم الاختزالي بوضع علامات مطاردة النبض أو تجارب إتلاف الحمض النووي.
نظرا لأن تلطيخ DAPI يعمل دائما تقريبا ، فإنه يعمل كعنصر تحكم تقني مفيد للفحص المجهري الفلوري (ويمكن أن يوفر الرضا لأخصائيي المجهر أثناء التدريب). يمكن أن يكون تلطيخ الأجسام المضادة أكثر تنوعا وهو مقياس جيد للتكاثر بين النسخ المتماثلة. قد يكون من الصعب إصلاح الغدد التناسلية C.elegans باستمرار ، حيث تتطلب هذه الخطوة توازنا بين الحفاظ على بنية الكروموسومات مع السماح أيضا بنشر ما يكفي من الأجسام المضادة. التثبيت مع الفورمالديهايد يحافظ بشكل أفضل على مورفولوجيا الكروموسومات ، وإعداد الفورمالديهايد الطازج من أمبولات بارافورمالدهيد قدم النتائج الأكثر قابلية للتكرار. من الممكن أيضا استخدام الفورمالديهايد المحضر من الفورمالين (37٪ فورمالديهايد مائي وميثانول). قد يلزم تحديد قوة التثبيت وتوقيته تجريبيا لكل جسم مضاد. تتضمن الطرق البديلة تخطي تثبيت الفورمالديهايد في الخطوة 2.4 ، وبعد التجميد ، الغمر في الإيثانول بنسبة 100٪ عند -20 درجة مئوية ، أو الغمر في الميثانول بنسبة 100٪ لمدة 10 دقائق متبوعا بالغمر في الأسيتون بنسبة 100٪ لمدة 10 دقائق عند -20 درجة مئوية. تسمح ظروف الإصلاح هذه باختراق أفضل للأجسام المضادة ولكنها ستؤثر سلبا على مورفولوجيا الأنسجة (ستبدو الكروموسومات منفوخة وأكثر انتفاخا).
التوقيت مهم جدا لخطوات التشريح والإصلاح الموضحة في الخطوة 2. نظرا لأن حجم محلول التشريح صغير جدا ، يمكن أن يؤثر التبخر على تركيز الإصلاح النهائي ، مما يؤدي إلى تلطيخ متغير للأجسام المضادة. يمكن لمعالج C. elegans ذو الخبرة إعداد شريحة في أقل من دقيقتين من البداية (الخطوة 2.3) لإصلاحها (الخطوة 2.4). العقبة التقنية الرئيسية هي القدرة على اختيار الحيوانات في قطرة محلول التشريح وتشريحها بسرعة. قد يكون من الأسهل تعلم كيفية التشريح بكميات أكبر. يبدأ المتدربون الجدد أولا بقطف الحيوانات في 50-200 ميكرولتر من محلول التشريح في طبق تلطيخ الأجنة الزجاجي (الشكل 2 د) ؛ يوفر السطح الأوسع مساحة أكبر للمناورة عند تحديد موضع الإبرة المثالي لسحب الغدد التناسلية الجيدة ، في حين أن الحجم الأكبر من السائل يجعل التبخر أقل مشكلة. بمجرد الراحة مع حركات التشريح ، يبدأ المتدربون في التشريح باستخدام 50 ميكرولتر فقط في الطبق ، ثم ينتقلون إلى التشريح في 20 ميكرولتر على شريحة. بمجرد التشريح على الشرائح ، يمكن للمتدربين البدء بسرعة في تقليل كمية المحلول حتى يصبحوا سريعين بما يكفي في العمل في 4 ميكرولتر لجعل التبخر ضئيلا.
إذا ظل توقيت التشريح يمثل مشكلة ، فيمكن للمتدربين تشريح 8 ميكرولتر من محلول التشريح خلال الخطوة 2.3. بعد ذلك ، خلال الخطوة 2.4 ، يمكنهم إضافة 8 ميكرولتر من محلول الإصلاح ، وسحب برفق للخلط جيدا (المراقبة عن كثب لضمان عدم تعطل الذبائح أو سحبها بعيدا) ، وإزالة 8 ميكرولتر من المحلول المختلط. سيؤدي هذا النهج البديل إلى نفس الحجم النهائي البالغ 8 ميكرولتر ونفس تركيز الإصلاح النهائي ؛ هذه الوحدة مهمة لضمان ملامسة الذبائح لكل من غطاء الغطاء وسطح الشريحة أثناء صدع التجميد في الخطوة 2.5. إذا ظل توقيت تحضير كل شريحة يمثل مشكلة حتى في أحجام التشريح الأكبر ، فقد تم وصف طريقة التعليق لبروتوكول التألق المناعي للخط الجرثومي بواسطة Gervaise و Arur26.
يتمثل القيد الرئيسي لاستخدام التألق المناعي لتصور البروتينات في الموقع في توافر الأجسام المضادة الأولية التي تستهدف بروتينا معينا مهما. ومع ذلك ، إذا تم تصميم نسخة موسومة من البروتين ، فيمكن تكييف هذا البروتوكول لتصور علامة البروتين. الأجسام المضادة التي تستهدف العلامات الشائعة ، مثل FLAG أو HA أو GFP ، متوفرة بشكل شائع. غالبا ما يمكن إخماد علامات الفلورسنت مثل GFP من خلال خطوات التثبيت ، لذلك يوصى باستخدام جسم مضاد أساسي يستهدف GFP ، بدلا من الاعتماد على إشارة التألق الأصلية نفسها. هناك قيد آخر لهذا البروتوكول وهو أنه يلتقط الخط الجرثومي في إطار زمني واحد (على الرغم من أن جميع مراحل تكوين البويضة سيتم تمثيلها داخل الخط الجرثومي). لذلك ، يمكن أن تفوت هذه التقنية التغييرات الديناميكية التي قد تحدث مع تقدم البويضة من خلال تكوين البويضة. ومع ذلك ، فقد تمت دراسة توقيت تكوين الأمشاج جيدا في C. elegans. في الشباب من النوع البري ، تستغرق البويضة حوالي 60 ساعة للتقدم من الطرف البعيد للخط الجرثومي (المنطقة الانقسامية) إلى التحريكالذهني 33. لذلك ، فإن مطاردة النبض أو التدخل المحدد مثل التشعيع متبوعا بدورة زمنية من شأنه أن يسمح بمراقبة التأثيرات في مراحل مختلفة من الانقسام الاختزالي.
في الختام ، يصف هذا البروتوكول تشريح الغدد التناسلية C. elegans متبوعا ب DAPI وتلطيخ الأجسام المضادة للفحص المجهري الفلوري. يستغرق التشريح والإصلاح (الخطوة 2) من 60 إلى 90 دقيقة ، اعتمادا على عدد الشرائح التي تم إنشاؤها. تلطيخ الأجسام المضادة (الخطوة 3) هو في الغالب عدم التدخل ويمكن أن تتراوح من 7 ساعات على الأقل إلى 1.5 يوم ، اعتمادا على أوقات حضانة الأجسام المضادة. يستغرق التركيب (الخطوات 4.1-4.7) حوالي 15 دقيقة. يمكن استخدام هذا النهج العام لتصور كروموسومات الخط الجرثومي والغدد التناسلية للدراسات الخلوية لأي بروتين في حالة وجود جسم مضاد أو كاشف علامة الفلورسنت. في أبسط أشكاله ، يمكن استخدام تلطيخ DAPI لنوى التحريك الديناميكي للكشف عن العوامل التي تؤثر على إعادة التركيب الاختزالي. عندما يقترن هذا النهج الخلوي بالتحليلات العضوية لعدد النسل ، وحدوث الذكور (النمط الظاهري له) ، والفتك الجنيني ، فإنه يوفر نقطة مقابلة أحادية الخلية للتحليلات القائمة على السكان.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه. المحتوى في هذه المخطوطة هو مسؤولية المؤلفين فقط. لا يمثل بالضرورة وجهات النظر الرسمية للمعاهد الوطنية للصحة أو المؤسسة الوطنية للعلوم.
Acknowledgements
تم دعم العمل في مختبر لي من قبل المعهد الوطني للعلوم الطبية العامة تحت رقم الجائزة 1R15GM144861 والمعهد الوطني للطفل والتنمية البشرية تحت رقم الجائزة 1R15HD104115 ، وكلاهما من المعاهد الوطنية للصحة. تم دعم DA من قبل برنامج علماء العلوم في كلية كينيدي للعلوم UML. تم دعم NW من خلال زمالة كلية UML Honors College وزمالة UMLSAMP (بتمويل من المؤسسة الوطنية للعلوم بموجب المنحة رقم HRD-1712771). نشكر A. Gartner على الأجسام المضادة RAD-51. تم توفير جميع سلالات C. elegans من قبل مركز Caenorhabditis Genetics Center ، الذي يموله مكتب برامج البنية التحتية البحثية التابع للمعاهد الوطنية للصحة تحت رقم الجائزة P40 OD010440.
Materials
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 488 Donkey Anti-Rabbit IgG Secondary Antibody | Molecular Probes | 711-545-152 | |
| Aluminum heating/cooling block | Millipore Sigma | Z743497 | |
| Bacto Peptone | Gibco | DF0118 17 0 | |
| Borosilicate Glass Pasteur Pipets, Disposable, 5.75 inches | Fisherbrand | 13 678 20B | Used to make worm picks |
| BSA, Bovine Serum Albumin | VWR | 97061 420 | |
| C. elegans wild type (ancestral) | Caenorhabditis Genetics Center | N2 (ancestral) | |
| C. elegans kle-2 (ok1151) mutants | Caenorhabditis Genetics Center | VC768 | The full genotype of this strain is: kle-2(ok1151) III/hT2 [bli-4(e937) let-?(q782) qIs48] (I;III). It has kle-2 balanced with a balancer chromosome marked with pharangeal GFP. Pick non-green animals to identify homozygous kle-2 mutants. |
| C. elegans spo-11 (me44) mutants | Caenorhabditis Genetics Center | TY4342 | The full genotype of this strains is: spo-11(me44) IV / nT1[qIs51] (IV:V). It has spo-11 balanced with a balancer chromosome marked with pharangeal GFP. Pick non-green animals to identify homozygous spo-11 mutants. |
| Calcium Chloride Anhydrous | VWR | 97062 590 | |
| Cholesterol | Sigma Aldrich | 501848300 | |
| DAPI | Life Technologies | D1306 | |
| EDTA, Disodium Dihydrate Salt | Apex Bioresearch Products | 20 147 | |
| Embryo Dish, glass, 30mm cavity | Electron Microscopy Services | 100492-980 | Used to practice dissecting; glass is preferred because dissected animals can stick to plastic |
| Escherichia coli | Caenorhabditis Genetics Center | OP50 | |
| Food storage container, plastic | various | n/a | Plastic containers with (1) relatively flat bottoms, to allow slides to rest level; (2) lids that are air-tight, but can still be easily removed without disturbing contents of container, and (3) are about 9 inches long by 6 inches wide are preferred |
| Glass Coplin Jar | DWK Life Sciences Wheaton | 08-813E | |
| Hydrophobic Barrier PAP Pen | ImmEdge | NC9545623 | |
| Kimwipes | Kimtech Science | 06 666A | |
| Levamisole Hydrochloride | Sigma Aldrich | L0380000 | |
| Magnesium Sulfate Anhydrous | Fisher Chemical | M65 500 | |
| Needles, Single-use, 25 G | BD PrecisionGlide | 14 821 13D | blue, 1 inch |
| NGM Agar, Granulated | Apex Bioresearch Products | 20 249NGM | |
| Parafilm | Bemis | 16 101 | |
| Paraformaldehyde (16% w/v) Aqueous Solution | Electron Microscopy Sciences | 50 980 487 | |
| PBS, Phosphate Buffered Saline (10x Solution) | Fisher BioReagents | BP399500 | |
| Petri Dishes, 60-mm | Tritech Research | NC9321999 | Non-vented, sharp edge |
| Platinum wire (90% platinum, 10% iridium) | Tritech Research | PT 9010 | Used to make worm picks |
| Potassium Chloride | Fisher | BP366-500 | |
| Potassium Phosphate Dibasic | VWR BDH Chemicals | BDH9266 500G | |
| Potassium Phosphate Monobasic | VWR BDH Chemicals | BDH9268 500G | |
| Premium Cover Glasses 18 mm x 18 mm | Fisherbrand | 12-548-AP | 0.13–0.17 mm thickness |
| Razor Blades, Single Edge | VWR | 55411 055 | |
| SlowFade Gold Antifade Mountant | Molecular Probes | S36937 | Alternatives: VectaShield Antifade Mounting Medium (Vector Laboratories, H-1000-10) or ProLong Diamond Antifade (Thermo Fisher Scientific, P36970). If using ProLong Diamond, no nail polish is required for sealing, but slides must cure for 24 hours before imaging. |
| Sodium Azide | Fisher BioReagents | BP922I 500 | |
| Sodium Chloride | Fisher Chemical | S271 500 | |
| Sodium Phosphate Dibasic Anhydrous | Sigma Aldrich | 7558 79 4 | |
| Sodium Phosphate Dibasic Heptahydrate | Sigma Aldrich | S9390 | |
| Styrofoam box | various | n/a | Approximate dimensions of interior: 12 inches long, 9 inches wide, 8 inches deep |
| Superfrost Plus Microscope Slides | Fisherbrand | 22 037 246 | |
| Triton X-100 | Fisher BioReagents | BP151 500 | |
| Tryptone | Apex Bioresearch Products | 20 251 | |
| Tween 20 | Fisher Chemical | BP337 500 | |
| Yeast Extract | Apex Bioresearch Products | 20 254 |
References
- Newman, D. L., Wright, L. K. Meiosis: A play in three acts, starring DNA sequence. CourseSource. 4, (2017).
- Ohkura, H. Meiosis: An overview of key differences from mitosis. Cold Spring Harbor Perspectives in Biology. 7 (5), 015859 (2015).
- Hassold, T., Hunt, P. To err (meiotically) is human: the genesis of human aneuploidy. Nature Reviews Genetics. 2 (4), 280-291 (2001).
- Keeney, S., Giroux, C. N., Kleckner, N. Meiosis-specific DNA double-strand breaks are catalyzed by Spo11, a member of a widely conserved protein family. Cell. 88 (3), 375-384 (1997).
- Rabitsch, K. P., et al. Kinetochore recruitment of two nucleolar proteins is required for homolog segregation in meiosis I. Developmental Cell. 4 (4), 535-548 (2003).
- Brown, C. R. Some misconceptions in meiosis shown by students responding to an advanced level practical examination question in biology. Journal of Biological Education. 24 (3), 182-186 (1990).
- Kalas, P., O'Neill, A., Pollock, C., Birol, G. Development of a meiosis concept inventory. CBE-Life Sciences Education. 12 (4), 655-664 (2013).
- McDonnel, L. M., Klenz, J. Teaching genetic linkage and recombination through mapping with molecular markers. CourseSource. 2, (2015).
- Wright, L. K., Cortez, P., Franzen, M. A., Newman, D. L. Teaching meiosis with the DNA triangle framework: A classroom activity that changes how students think about chromosomes. Biochemistry and Molecular Biology Education. 50 (1), 44-54 (2021).
- Shortlidge, E. E., Bangera, G., Brownell, S. E. Each to their own CURE: Faculty who teach course-based undergraduate research experiences report why you too should teach a CURE. Journal of Microbiology & Biology Education. 18 (2), 18 (2017).
- Auchincloss, L. C., et al. Assessment of course-based undergraduate research experiences: A meeting report. CBE-Life Sciences Education. 13 (1), 29-40 (2014).
- Lee, T. W., Carpenter, B. S., Birol, O., Katz, D. J., Schmeichel, K. L. The pipeline CURE: An iterative approach to introduce all students to research throughout a biology curriculum. CourseSource. 6, (2019).
- Lu, F. -. M., Eliceiri, K. W., Stewart, J., White, J. G. WormClassroom.org: an inquiry-rich educational web portal for research resources of Caenorhabditis elegans. CBE Life Sciences Education. 6 (2), 98-108 (2007).
- Corsi, A. K., Wightman, B., Chalfie, M. A Transparent window into biology: A primer on Caenorhabditis elegans. Genetics. 200 (2), 387-407 (2015).
- JoVE Science Education Database. Biology I: yeast, Drosophila and C. elegans. An Introduction to Caenorhabditis elegans. JoVE Science Education Database. , (2022).
- JoVE. Science Education Database. Biology I: yeast, Drosophila and C. elegans. C. elegans Maintenance. JoVE Science Education Database. , (2022).
- Lee, R. Web resources for C. elegans studies. WormBook. , (2005).
- JoVE. Science Education Database. Biology I: yeast, Drosophila and C. elegans. RNAi in C. elegans. JoVE Science Education Database. , (2022).
- Meneely, P. M., Dahlberg, C. L., Rose, J. K. Working with worms: Caenorhabditis elegans as a model organism. Current Protocols Essential Laboratory Techniques. 19 (1), 35 (2019).
- Lemons, M. L. An inquiry-based approach to study the synapse: Student-driven experiments using C. elegans. Journal of Undergraduate Neuroscience Education. 15 (1), 44-55 (2016).
- Kowalski, J. R., Hoops, G. C., Johnson, R. J. Implementation of a collaborative series of classroom-based undergraduate research experiences spanning chemical biology, biochemistry, and neurobiology. CBE-Life Sciences Education. 15 (4), 55 (2016).
- Mordacq, J., Drane, D., Swarat, S., Lo, S. Research and teaching: Development of course-based undergraduate research experiences using a design-based approach. Journal of College Science Teaching. 46 (4), (2017).
- Palmisano, N. J., et al. A laboratory module that explores RNA interference and codon optimization through fluorescence microscopy using Caenorhabditis elegans. bioRxiv. , 344069 (2021).
- Hillers, K. J., Villeneuve, A. M. Analysis of meiotic recombination in Caenorhabditis elegans. Meiosis. 557, 77-97 (2009).
- Phillips, C. M., McDonald, K. L., Dernburg, A. F. Cytological analysis of meiosis in Caenorhabditis elegans. Meiosis. 558, 171-195 (2009).
- Gervaise, A. L., Arur, S. Spatial and temporal analysis of active ERK in the C. elegans germline. Journal of Visualized Experiments. (117), e54901 (2016).
- Shakes, D. C., Miller, D. M., Nonet, M. L. Immunofluorescence microscopy. Methods in Cell Biology. 107, 35-66 (2012).
- Hillers, K. J., Jantsch, V., Martinez-Perez, E., Yanowitz, J. L. Meiosis. Wormbook. , (2017).
- Hunter, A. -. B., Seymour, E., Laursen, S., Thiry, H., Melton, G. . Undergraduate Research in the Sciences: Engaging Students in Real Science. , (2010).
- Wei, C. A., Woodin, T. Undergraduate research experiences in biology: Alternatives to the apprenticeship model. CBE-Life Sciences Education. 10 (2), 123-131 (2011).
- Elgin, S. C. R., et al. Insights from a convocation: Integrating discovery-based research into the undergraduate curriculum. CBE-Life Sciences Education. 15 (2), (2016).
- Stiernagle, T. Maintenance of C. Elegant. WormBook. , (2006).
- Jaramillo-Lambert, A., Ellefson, M., Villeneuve, A. M., Engebrecht, J. Differential timing of S phases, X chromosome replication, and meiotic prophase in the C. elegans germ line. Developmental Biology. 308 (1), 206-221 (2007).
- Stamper, E. L., et al. Identification of DSB-1, a protein required for initiation of meiotic recombination in Caenorhabditis elegans, illuminates a crossover assurance checkpoint. PLoS Genetics. 9 (8), 1003679 (2013).
- Libuda, D. E., Uzawa, S., Meyer, B. J., Villeneuve, A. M. Meiotic chromosome structures constrain and respond to designation of crossover sites. Nature. 502 (7473), 703-706 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved