Method Article
C. 엘레 간스 면역형광 및 DAPI 염색을 위한 생식선 해부 및 동결 균열
요약
이것은 항체 염색을 통해 면역형광을 위한 생식계열 샘플을 생성하거나 DNA를 시각화하기 위한 간단한 DAPI 염색을 위해 C. elegans 생식선 해부 후 동결 균열에 일반적으로 사용되는 방법입니다. 이 프로토콜은 연구실과 과정 기반 학부 연구 경험의 학부생에게 성공적이었습니다.
초록
C. elegans 생식계열은 부분적으로 해부된 동물에 대한 세포학적 분석을 쉽게 수행할 수 있기 때문에 감수 분열을 연구하기 위한 훌륭한 모델을 만듭니다. 전체 마운트 준비는 감수 분열 핵의 구조를 보존하며, 중요한 것은 각 생식선 팔이 감수 분열의 모든 단계를 포함하고 있으며, 시간적-공간적 진행으로 구성되어 있어 여러 단계에서 핵을 쉽게 식별할 수 있다는 것입니다. 성체 자웅동체는 두 개의 생식선 팔을 가지고 있으며, 각각은 원위 폐쇄 끝에 증식하는 생식선 줄기 세포와 자궁 중앙에 합류하는 근위 열린 끝에 세포화된 난모세포가 있는 닫힌 관으로 구성됩니다. 해부는 체강에서 한쪽 또는 양쪽 생식선 팔을 방출하여 감수 분열 전체를 시각화 할 수 있습니다. 여기에서는 관심 단백질에 대한 면역 형광에 대한 일반적인 프로토콜이 제시되고 모든 염색체를 표시하기위한 DAPI 염색이 이어집니다. 젊은 성인은 levamisole에 고정되어 있으며 두 개의 주사기 바늘을 사용하여 신속하게 해부됩니다. 생식계열 압출 후 액체 질소에서 동결 균열을 겪기 전에 샘플을 고정하여 큐티클 및 기타 조직을 투과시키는 데 도움이 됩니다. 그런 다음 샘플을 에탄올에서 탈수하고 재수화하고 1 차 및 2 차 항체와 함께 배양 할 수 있습니다. DAPI는 장착 매체의 샘플에 추가되어 DNA를 안정적으로 시각화하고 형광 현미경으로 이미지화할 동물을 쉽게 찾을 수 있습니다. 이 기술은 해부 방법 자체를 연습하는 데 몇 시간을 보낸 후 C. elegans를 다루는 데 익숙한 사람들이 쉽게 채택할 수 있습니다. 이 프로토콜은 연구실에서 일하는 고등학생 및 학부생에게 가르쳐졌으며 인문 대학의 코스 기반 학부 연구 경험에 통합되었습니다.
서문
감수 분열은 모든 성 생식 유기체 1,2에서 배우자 (난자 및 정자 / 꽃가루)를 만드는 데 사용되는 특수 세포 분열입니다. 교차 재조합은 상동 염색체 사이의 DNA의 상호 교환입니다. 감수 분열은 유전 적 다양성의 중요한 원천을 제공하고 세대를 거쳐 게놈 안정성을 촉진하는 데 필수적입니다. 감수 분열 동안 적어도 하나의 교차를 형성하지 못하는 염색체는 무작위로 분리되어 염색체가 분리되지 않아 잘못된 수의 염색체를 가진 배우자를 생성 할 수 있습니다 - 일반적으로 자손3에 치명적인 상태입니다. 감수 분열 동안, 교차는 프로그램 된 이중 가닥 DNA 파괴4에 의해 유도된다. 이러한 단절의 하위 집합은 세포 분열5를 준비하기 위해 상동 염색체의 방향을 지정하는 데 도움이 되는 교차점(chiasmata)이라고 하는 DNA의 물리적 연결을 제공하는 교차로 복구됩니다. 감수 분열 단계는 모든 진핵 생물에 걸쳐 고도로 보존되어 있으며 염색체 형태로 쉽게 식별 할 수 있습니다.
생물학의 기본 개념인 감수 분열은 학생들이 다양한 생물학 과정에서 여러 번 접하는 주제입니다. 그들은 종종 고등학교에서 감수 분열 염색체 분리의 역학에 소개되는 반면, 대학 수준의 과정은 분리의 세포 생물학과 교차 재조합의 유전 적 영향에 중점을 둡니다. 그러나 감수 분열은 많은 학생들에게 악명 높은 까다로운 개념입니다1. 유전자, DNA, 염색체 및 감수 분열 사이의 관계를 이해하지 못하면 유전 유전에 대한 완전한 이해를 방해하는 학생의 오해와 이해 격차가 발생할 수 있습니다 6,7. 추상적 인 주제에 대한 학생의 이해를 향상시키는 한 가지 방법은 구체적인 실습 활동을 제공하는 것입니다. 예를 들어, 감수 분열을 가르칠 때 강사는 분자 분석8을 모방하는 활동, 학생들이 분자를 조작할 수 있는 3D 모델9 또는 학생들이 직접 분자 안무1를 연기하는 역할극중에서 선택할 수 있습니다. 알려지지 않은 결과와 연구를 통합하는 것은 학생의 이해를 향상시키는 특히 효과적인 방법입니다. 이 관행은 코스 기반 학부 연구 경험(CURE)으로 알려져 있으며 특히 STEM10,11에서 과소 대표되는 그룹에 속한 학생들의 태도와 선택의지를 강화하는 추가 이점이 있습니다. 선충류 벌레 Caenorhabditis elegans는 행동, 생식력 및 유전 적 교배에 대한 교실 연구에 특히 적합하며 학생들에게 생물학적 연구를 소개하는 효과적인 모델입니다12.
C. elegans는 분자 유전학과 간단한 세포 학적 분석을 결합하여 세포 생물학을위한 강력한 모델 유기체를 만듭니다. 또한 생물학 교실 13,14,15에서 사용하기에 특히 적합합니다. 실험실에서 유지 관리가 쉽고 경제적이며 표준 실온 또는 가장 일반적인 배양 온도인 20°C에서 3일마다 수백 마리의 자손을 생산합니다. 중요한 것은 글리세롤 스톡으로 냉동하고 -80 ° C 냉동고에 보관할 수 있으므로 초보 연구원이 저지른 축산 실수를 쉽게 수정할 수 있습니다16. 또한 주석이 잘 달린 게놈은 정방향 및 역방향 유전 기술17,18을 허용하여 C. elegans를 사용하여 분자에서 진화에 이르는 생물학적 질문을 해결할 수 있습니다. 마지막으로, C. elegans 연구자들은 신진 과학자들에게 종종 도움과 조언을 기꺼이 제공하는 지원 커뮤니티를 만들었습니다19. 이러한 장점으로 인해 C. elegans는 다양한 유형의 기관 12,19,20,21,22,23에서 다수의 CURE에 통합되었습니다.
연구 및 교육에 대한 이점 외에도 C. elegans는 감수 분열 및 생식선 발달 연구에 널리 사용되는 모델이되었습니다24,25,26. 이 동물의 광학적 선명도는 세포학적 접근을 단순화하고27, 성인의 경우 생식선은 동물의 거의 절반을 차지하여 연구할 수백 개의 감수 분열 세포를 제공합니다. 생식선에서 감수 분열 생식선 핵은 조립 라인처럼 배열됩니다(그림 1). 유사분열 복제는 생식선의 말단부에서 발생하며, 핵은 수정란이 외음부에서 나오는 생식선의 근위부로 이동하면서 감수 분열 단계를 통해 진행됩니다. 고정 관념의 공간 조직은 또한 감수 분열을 통한 시간적 진행을 나타내기 때문에 염색체 조직과 생식선에서의 위치에 따라 다른 단계를 쉽게 식별 할 수 있습니다. 마지막으로, 감수 분열을 방해하고 이수성 (aneuploidy)을 유발하는 과정은 초보자에게도 특성화하기 쉬운 표현형을 만듭니다 : 불임, 배아 치사율 또는 남성의 높은 발병률 (He 표현형)28.
이것은 C. elegans에서 감수 분열 염색체를 시각화하기위한 간단한 프로토콜입니다. 장착, 해부, 고정 및 항체 염색이 모두 동일한 현미경 슬라이드에서 수행되므로 프로토콜이 간소화되고 거의 완벽한 샘플 회수가 가능합니다. 이 방법은 염색체를 시각화하는 간단한 DAPI 염색에 사용되며 생식선에서 단백질의 국소화를 시각화하기 위해 면역 형광법에 사용할 수 있습니다. 학생들은 기본 해부 현미경을 사용하여 생식선을 해부하고, DNA 또는 면역 형광의 시각화를 위한 전체 마운트 준비를 생성하고, 복합 형광 현미경으로 이미지화합니다. 이 프로토콜은 C. elegans 연구실에서 일하는 고등학생 및 학부생에게 가르쳐졌으며 인문 대학의 CURE에 통합되었습니다12. CURE는 상대적으로 작은 학급 규모를 가졌지 만,이 프로토콜은 웜 균주 및 시약의 상대적으로 저렴한 비용으로 인해 다양한 기관의 수업에 적합합니다. 강사는 사용할 수 있는 해부 현미경의 수에 의해서만 제한됩니다. 이전 구현에서는 학생들이 단일 현미경을 공유하기 위해 세 그룹으로 작업했으며 첫 번째는 해부 연습, 두 번째는 해부 및 DAPI 염색을 구현하고 세 번째는 광시야 형광 현미경으로 슬라이드를 이미지화하는 등 세 번의 90분 세션에 걸쳐 진행되었습니다. 학부 연구에 참여하면 학업 및 개인 학생11,29에게 많은 이점이 있습니다. CURE를 통해 코스에 연구를 포함하면 학생들이 정규 수업 시간 11,30,31 동안 연구에 참여할 수 있으므로 이러한 혜택에 대한 노출이 보다 접근가능하고 공평합니다.
프로토콜
1. C. 엘레 간스 축산
참고: 자세한 내용은 C. elegans 유지 관리 프로토콜16 및 Elgin et al.32를 참조하십시오. C. elegans 균주는 Caenorhabditis Genetics Center (https://cgc.umn.edu)에서 쉽게 얻을 수 있으며 일반 우편을 통해 미국의 모든 지역으로 배송됩니다. 각 균주의 비용은 $10이며 각 실험실/사용자는 $30의 연회비를 지불합니다.
- 멸균 기술을 사용하여 6cm 선충 성장 배지 한천 플레이트(NGM 한천 플레이트)를 준비합니다.
알림: 붓은 플레이트는 원래 플라스틱 슬리브 또는 밀폐 용기에 거꾸로 보관하여 4°C에서 몇 달 동안 보관할 수 있습니다.- NGM 한천 플레이트를 만들려면 1L(~975mL)에 NaCl 3g, 박토 펩톤 2.5g, NGM 한천 20g 및 ddH2O를 추가합니다. 121°C에서 20분 동안 유지되는 액체 사이클을 사용하여 매체를 오토클레이브합니다. 55°C로 냉각시키고, 멸균 기술을 사용하여, 1 mL의 콜레스테롤, 0.5 mL의 1 MCaCl2, 1 mL의 1 M MgSO4, 및 25 mL의 1 M 인산칼륨 완충액 (pH 6)을 첨가한다.
참고 : 1M 인산 칼륨 완충액을 만들려면 108.3g의 KH 2 PO 4 (일 염기성)와 35.6g의 K2HPO4 (이염기성)를 혼합하십시오. 필요한 경우 KOH를 사용하여 pH를 6으로 조정합니다. ddH2O를 최대 1 L (보통 ~ 900 mL)까지 첨가하고 121 ° C에서 40 분 동안 오토 클레이브합니다. 1 L의 NGM은 각각 10 mL를 포함하는 약 100 개의 플레이트를 만듭니다.
- NGM 한천 플레이트를 만들려면 1L(~975mL)에 NaCl 3g, 박토 펩톤 2.5g, NGM 한천 20g 및 ddH2O를 추가합니다. 121°C에서 20분 동안 유지되는 액체 사이클을 사용하여 매체를 오토클레이브합니다. 55°C로 냉각시키고, 멸균 기술을 사용하여, 1 mL의 콜레스테롤, 0.5 mL의 1 MCaCl2, 1 mL의 1 M MgSO4, 및 25 mL의 1 M 인산칼륨 완충액 (pH 6)을 첨가한다.
- 혈청학적 또는 전달 피펫을 사용하여 E.coli OP50 박테리아 배양액 3방울(~150μL)로 플레이트를 발견합니다. 플레이트 중앙에 지점을 놓고 플레이트 가장자리에 너무 가깝게 지점을 배치하지 마십시오. 이것은 동물들이 접시의 측면을 기어 올라가서 건조시키는 것을 막을 것입니다.
- 박테리아 잔디가 마르면 점박이 판을 실온 (RT)에서 최대 2 주 동안 거꾸로 보관하십시오. 사용하기 최소 1-2 일 전에 플레이트를 발견하면 박테리아 잔디가 더 두껍게 자라며 더 높은 밀도의 동물을 지원할 수 있습니다.
참고: OP50 박테리아 배양을 준비하기 위해 OP50은 Caenorhabditis Genetics Center에서 주문할 수 있습니다. OP50 박테리아는 단일 콜로니를 보장하기 위해 글리세롤 스톡에서 LB 플레이트로 줄무늬를 만들고 4-6주 동안 4°C에서 유지합니다. OP50 박테리아 배양은 단일 콜로니에서 LB에서 37°C의 밤새 성장하므로 흔들림이 필요하지 않습니다. LB 배지를 준비하려면 트립톤 10g, NaCl 10g, 효모 추출물 5g, ddH2O 950mL를 첨가하고 10N NaOH로 pH를 7로 조정하고 최종 부피를 ddH2O로 1L로 조정하여 100mL 양으로 분취하고121°C에서 20분 동안 오토클레이브합니다. - 각 균주에 대한 작업 스톡을 만들려면 점박이 NGM 플레이트에 3 개의 L4 단계 자웅 동체를 선택하십시오. 플레이트를 15-25 °C에서 보관하십시오. 표준 배양 조건은 20°C이다. 온도 제어 인큐베이터에 접근할 수 없는 경우 RT의 벤치 상단에 배양물을 유지하십시오.
알림: L4 단계 자웅동체는 크기(성인보다 작음)와 신체 중간에 뚜렷한 반원의 존재(발달 중인 외음부) 모두에 따라 쉽게 병기될 수 있습니다. 20 ° C에서 동물은 부화 후 34-46 시간 (배아가 놓인 후 약 40-52 시간)에 L4 단계에 도달합니다. 발달 단계의 시기에 대한 자세한 내용은 Corsi et al.14 를 참조하십시오.- 발달 속도를 제어하기 위해 배양 물을 다양한 온도로 이동하십시오. 동물은 더 높은 온도에서 더 빨리 성장하고 낮은 온도에서 더 느리게 자랍니다. 그들은 25 ° C 이상의 온도에서 멸균되기 시작할 것입니다.
참고: 일부 돌연변이 유전자형은 온도에 민감하며 배양 온도에 따라 다른 표현형을 표시합니다.
- 발달 속도를 제어하기 위해 배양 물을 다양한 온도로 이동하십시오. 동물은 더 높은 온도에서 더 빨리 성장하고 낮은 온도에서 더 느리게 자랍니다. 그들은 25 ° C 이상의 온도에서 멸균되기 시작할 것입니다.
- 4 일마다 새로운 발견 NGM 플레이트에 3 개의 L4 단계 자웅 동체를 선택하여 작업 재고를 유지하십시오. 그렇게하면 광범위한 발달 단계에서 지속적이고 잘 먹은 인구가 보장 될 것입니다.
2. 생식선 박리
- 연령에 맞는 성인 수집: 해부 12-24시간 전에 L4단계 자웅동체를 새로운 점박이 NGM 플레이트에 선택합니다 – 이들은 다음날 젊은 성인으로 자라며 해부에 이상적입니다. L4 단계 자웅 동체의 수는 수행되는 세포 학적 분석에 따라 다릅니다. 일반적으로 슬라이드 당 10-20 개의 자웅 동체가 해부되며 조건 당 2-4 개의 슬라이드가 생성됩니다.
알림: 생식선은 잘 먹은 동물에서 가장 효율적으로 압출됩니다. 굶어 죽지 않은 작업 주식에서 L4 자웅 동체를 선택하십시오 (즉, 접시에 여전히 눈에 보이는 박테리아 잔디가 있음). 굶주린 동물은 불완전한 생식선 압출을 겪는 경향이 있어 시각화하기 어렵습니다.- 이완증과 같은 감수 분열의 후기 단계를 평가하는 경우 노인 (L48 이후 48 시간)을 해부하면 더 많은 이완 단계 핵이 축적되어 분석이 단순화됩니다. 그러나 연구자들은 일부 영향이 고령으로 인해 발생할 수 있다는 가능성에 유의해야합니다.
- 해부를 준비하십시오.
- M9 준비 : KH2PO 4 (일 염기성) 3g, Na 2HPO4 (이염 염기성) 6g, NaCl 5g을 첨가하고 ddH2O를 100mL에첨가한다. 용액을 121°C에서 20분 동안 오토클레이브하고, 냉각시킨 다음, 멸균 기술을 사용하여 1 MMgSO4 1 mL를 첨가한다.
- 해부 완충액 준비: 10% 트윈 20 1μL, 100mM 레바미솔 12μL, 10x M9 10μL, ddH2O77μL를 혼합합니다.
참고: 트윈 20은 표면 장력을 줄이고 조직막을 추가로 투과시키기 위해 해부 완충액에 포함되어 있습니다. - 수정 용액 준비 (2 % PFA [100 μL]) : 12.5 μL의 16 % 파라 포름 알데히드 (PFA), 10 μL의 10x M9 및 77.5 μL의 ddH2O를 혼합합니다. PFA의 신선한 앰플 (2 주 이상 개봉)을 사용하십시오.
주의 : PFA는 유해 화학 물질이므로 흄 후드에 고정 용액을 준비해야합니다. - 냉동 방법 설정-액체 질소는 관리하기 쉽지만 필요한 경우 드라이 아이스 위에 알루미늄 블록을 사용할 수 있습니다.
- 액체 질소 방법 : 플라스틱 비커 또는 플라스틱 코플린 병을 폴리스티렌 상자에 넣으십시오. 비커에 액체 질소를 채 웁니다 (폴리스티렌 용기로 넘치면 괜찮습니다). 핀셋을 근처에 놓습니다. 이상적으로 비커는 현미경 슬라이드가 완전히 수평으로 떨어지지 않도록 충분히 좁아야 하며 슬라이드는 기울어져 있어야 하며 핀셋으로 쉽게 잡을 수 있어야 합니다.
알림: 급속 냉각으로 인한 파손을 방지하기 위해 유리가 아닌 액체 질소로 작업할 때 플라스틱 용기를 사용하는 것이 중요합니다. - 드라이 아이스 방법 :
- 폴리스티렌 용기 또는 직사각형 얼음 양동이에 드라이 아이스 위에 평평한 알루미늄 블록을 놓습니다. 블록의 상단이 컨테이너 상단 위에 있으면 슬라이드를 동결하는 것이 더 쉽습니다.
- 장갑을 끼고 알루미늄 블록을 부드럽게 눌러 드라이 아이스와 잘 접촉하고 냉각 과정을 서두르십시오 (금속이 빠르게 냉각됨에 따라 삐걱 거리는 소리가 날 수 있음). 면도날을 근처에 두십시오.
- 빠른 동결에 필요한 완전한 냉각을 허용하기 위해 동결 균열 정지 전에 최소 30분 동안 알루미늄 블록을 드라이아이스 위에 두십시오.
알림: 이상적으로는 표면이 수평을 유지하는 데 도움이 되는 단단한 드라이아이스 블록을 사용해야 합니다. 필요한 경우 알루미늄 블록을 드라이 아이스 펠릿 위에 놓을 수 있지만 표면이 수평을 유지하도록주의해야합니다. - 알루미늄 블록의 표면은 서리를 모아 슬라이드와 블록 사이의 밀착을 방지 할 수 있습니다. 면도날을 사용하여 표면에서 서리를 긁어 내고 각 슬라이드의 영역을 정리하십시오. 폴리스티렌 용기를 뚜껑으로 덮으면 과도한 서리 축적을 방지하는 데 도움이됩니다.
- 액체 질소 방법 : 플라스틱 비커 또는 플라스틱 코플린 병을 폴리스티렌 상자에 넣으십시오. 비커에 액체 질소를 채 웁니다 (폴리스티렌 용기로 넘치면 괜찮습니다). 핀셋을 근처에 놓습니다. 이상적으로 비커는 현미경 슬라이드가 완전히 수평으로 떨어지지 않도록 충분히 좁아야 하며 슬라이드는 기울어져 있어야 하며 핀셋으로 쉽게 잡을 수 있어야 합니다.
- 코플린 병에 ~40mL의 95% 에탄올을 채웁니다.
- 3개의 코플린 병에 ~40mL의 PBS-T를 채웁니다.
참고: PBS-T를 만들려면 10x PBS 100mL, 트리톤 X-100 5mL, 0.5M EDTA(pH 8) 2mL를 혼합합니다. 873mL의 ddH2O를 추가합니다. 트리톤 X-100을 녹이기 위해 세게 흔듭니다. 10x PBS를 만들기 위해, 25.6 g의 Na2HPO4·7H2O, 80 g의 NaCl, 2 g의 KCl 및 2 g의KH2PO4를 혼합한다. ddH2O를 추가하여 부피를 1 L까지 가져옵니다. 오토클레이브는 121°C에서 40분 동안 사용합니다. 세제 Triton X-100은 세척 버퍼 PBS-T에 포함되어 표면 장력을 줄이고 슬라이드에 장착된 동물의 유지력을 향상시킵니다.
- 18mm x 18mm 유리 커버 슬립에서 동물을 해부하십시오. 이 단계는 해부 완충액의 증발로 인해 시간에 민감합니다. 해부를 완료하는 데 5 분 미만이 소요됩니다.
알림: 레바미솔은 동물을 고정시켜 해부하기 쉽게 만드는 데 사용되지만 레바미솔에 너무 오래 두면 생식선 압출이 불량해집니다. 5 분 시간 프레임에 맞추기 위해 슬라이드 당 해부되는 동물의 수를 줄이는 것이 가장 쉽습니다.- 해부 현미경의 스테이지에 홀딩 슬라이드를 놓습니다 - 홀딩 슬라이드는 커버 슬립을보다 쉽게 이동하는 데 사용되며 무한정 재사용 할 수 있습니다 (그림 2A, 왼쪽 사진).
- 커버 슬립을 홀딩 슬라이드 위에 놓고 해부 용액 4μL를 커버 슬립 중앙에 피펫합니다. 고정 슬라이드를 스테이지의 한쪽으로 이동하여 시야를 확보합니다.
- 10-20 개의 자웅 동체를 해부 용액 방울에 넣으십시오. 슬라이드당 ~10마리를 이미지화할 수 있는 동물을 충분히 선택하되 5분 이내에 해부할 수 없을 정도로 많지는 않습니다.
- 각 손에 하나씩 두 개의 주사기 바늘을 사용하여 동물을 해부합니다(그림 2A).
- 바늘의 끝을 교차시켜 X 모양을 만들고 X의 바닥을 사용하여 성인을 커버 슬립 표면에 고정시킵니다.
알림: 각도와 회전 측면에서 각 바늘을 잡는 가장 좋은 방법을 찾으려면 연습이 필요할 수 있습니다. 경사 (기울어 진 가장자리)가 아래를 향하도록 바늘을 잡고 시작하십시오. 더 큰 볼륨으로 해부하는 첫 번째 학습에 대한 제안은 토론을 참조하십시오(그림 2D). - X자 모양을 인두 바로 뒤, 젊은 성인의 신체 길이의 약 1/5 또는 머리의 투명한 부분 바로 아래에 배치합니다(그림 2A, 오른쪽 다이어그램).
- 한 번의 가위 동작으로 동물을 참수하십시오 (예 : 나이프와 포크로 음식을 자르는 것). 좋은 압출은 생식선의 한쪽 팔 (또는 때로는 양쪽 팔)이 장의 한쪽 또는 양쪽 절반과 함께 체강에서 완전히 방출되는 결과를 낳습니다 (그림 2B, 왼쪽 이미지). 내장은 더 어둡고 균일 한 너비로 보이지만 생식선은 원위 테이퍼 진 팁으로 선명하게 보입니다.
- 각 동물은 한 번만 잘라야합니다. 절단 후 생식선이 돌출되지 않으면 다음 동물로 이동하십시오. 첫 번째 절단은 본체의 정수압을 크게 감소시켜 추가 절단이 더 나은 압출로 이어지지 않을 것입니다. 불완전하거나 불량한 압출은 이미징 중에 쉽게 볼 수 있으며 무시할 수 있습니다(그림 2B, 오른쪽 이미지).
참고: 시체에서 생식선을 분리하려고 시도하지 마십시오-그렇게 하면 일반적으로 조직이 찢어지고 분석할 수 있는 감수 분열 단계의 수가 제한됩니다.
- 각 동물은 한 번만 잘라야합니다. 절단 후 생식선이 돌출되지 않으면 다음 동물로 이동하십시오. 첫 번째 절단은 본체의 정수압을 크게 감소시켜 추가 절단이 더 나은 압출로 이어지지 않을 것입니다. 불완전하거나 불량한 압출은 이미징 중에 쉽게 볼 수 있으며 무시할 수 있습니다(그림 2B, 오른쪽 이미지).
- 커버 슬립에 남아있는 동물에 대해 해부를 반복하십시오.
- 바늘의 끝을 교차시켜 X 모양을 만들고 X의 바닥을 사용하여 성인을 커버 슬립 표면에 고정시킵니다.
- 포름 알데히드로 샘플을 고정하십시오.
- 부드럽게 작업하면서 커버슬립에 있는 픽스 용액 4μL를 동물과 함께 방울에 매우 가깝게 피펫합니다. 이상적으로는 방울이 병합하기에 충분히 가깝습니다. 해부 방울에 직접 피펫팅을 하고 해부된 시체를 옮기지 마십시오.
- 한 손가락을 사용하여 커버슬립을 고정 슬라이드에 고정합니다. 다른 손으로 커버 슬립을 부드럽게 몇 번 튕겨 방울을 섞습니다. 최종 수정 농도는 0.8% PFA입니다.
- 양전하를 띤 슬라이드를 앞면이 아래로 향하게 잡고 슬라이드 중앙에 있는 커버슬립을 들어 올리는 데 사용합니다. 샘플 방울을 부드럽게 만지면 방울의 표면 장력이 커버 슬립을 집어 올립니다.
알림: 양전하를 띤 슬라이드에는 정전기 코팅이있어 조직이 표면에 부착되어 샘플 손실을 방지합니다.- 원하는 경우 한쪽 모서리가 슬라이드의 상단 또는 하단 가장자리에서 1mm 정도 걸리도록 커버 슬립을 대각선으로 배치하십시오. 돌출부를 남겨두면 동결 후 커버슬립을 더 쉽게 깨뜨릴 수 있습니다(그림 2C).
- 슬라이드를 벤치에 놓고 RT에서 정확히 5분 동안 고정합니다. 이 시간 동안 연필로 슬라이드에 레이블을 지정합니다.
참고: 샘플을 과도하게 고정하는 것이 일반적이며, 이는 핵 또는 모든 조직에서 항체를 배제하여 검출할 수 있습니다. 또한 일부 항체는 포름 알데히드에 특히 민감합니다. 이러한 경우 고정 시간을 줄이거 나 사용 된 포름 알데히드의 최종 농도를 줄이십시오.
- 동결 균열
- 수정 직후 슬라이드를 고정하십시오.
- 액체 질소를 사용하는 경우: 핀셋으로 슬라이드의 레이블이 지정된 가장자리를 잡고 액체 질소로 부드럽게 내립니다. 슬라이드가 비커의 측면에 기대도록 슬라이드를 풀고 커버슬립 쪽이 위로 향하도록 합니다. 슬라이드는 10초 이내에 얼어붙습니다(액체가 끓지 않는 경우).
- 드라이 아이스를 사용하는 경우 : 면도기로 알루미늄 블록 표면에서 서리를 긁어냅니다. 슬라이드의 레이블이 지정된 가장자리를 단단히 잡고 깨끗한 표면에 놓고 블록과 완전히 접촉하도록 아래쪽으로 약간의 압력을 가합니다. 커버 슬립은 블록 표면에 완전히 있어야합니다. 동결은 10초 이내에 발생하며 커버슬립 아래의 샘플이 얼음으로 변할 때 육안으로 확인할 수 있습니다.
- 두 방법 모두 슬라이드가 완전히 얼 때까지 최소 5분 동안 그대로 두십시오.
알림: 일단 얼면 슬라이드는 동결 상태를 유지하는 한 액체 질소 또는 블록에 15-20분 동안 그대로 둘 수 있습니다. 이를 통해 크래킹 단계로 진행하기 전에이 단계에서 여러 슬라이드를 수집 할 수 있습니다.
- 신속하게 작업하여 샘플에서 커버 슬립을 깨십시오. 이 단계는 시간에 민감합니다. 샘플이 해동되기 전에 커버슬립을 제거하고 슬라이드를 에탄올에 담그십시오.
- 얼어 붙은 슬라이드를 제거하십시오 (액체 질소 용 핀셋 사용).
- 슬라이드의 레이블이 지정된 짧은 가장자리를 단단히 잡고 긴 가장자리 하나를 벤치에 고정합니다.
- 다른 손으로 면도기를 단단히 잡고 면도기의 가장자리를 슬라이드 아래로 밀어 덮개 슬립을 샘플에서 떼어냅니다. 이 단계는 커버슬립이 코너 돌출부와 함께 배치된 경우 약간 더 쉽습니다(그림 2C).
- 수정 직후 슬라이드를 고정하십시오.
- 즉시 슬라이드를 RT에서 95 % 에탄올이 들어있는 코플린 병에 넣으십시오. 슬라이드를 에탄올에 최소 5 분 동안 그대로 두십시오.
알림: 슬라이드는 잠시 동안 에탄올에 방치 될 수 있습니다.이 단계에서 여러 슬라이드를 수집하여 세척을 진행할 수 있습니다. 슬라이드는이 단계에서 며칠 동안 저장할 수도 있습니다. 보관하는 경우 에탄올에 슬라이드의 코플린 병을 -20 ° C로 옮깁니다. - 슬라이드를 PBS-T로 RT에서 각각 5분 동안 세 번 세척합니다. 각 세척에 대해 신선한 PBS-T를 사용하십시오.
- 항체로 염색하는 경우 3단계(항체 염색)로 진행합니다. 염색체를 시각화하기 위해 DAPI로만 염색하는 경우 4단계(장착 및 이미징)로 진행합니다.
3. 항체 염색
- 1차 항체 배양
참고: 새로운 항체에 대한 적절한 조건을 계산할 때 형광 신호의 특이성을 확인하기 위해 다음 음성 대조군을 포함하는 것이 중요합니다: 1) 1차 항체가 없고 2차 항체만 있는 슬라이드; 2) 2차 항체가 결여된 1차 항체만 있는 슬라이드. 이러한 각 음성 컨트롤은 완전한 신호 부족을 생성해야 합니다. 2차 항체 전용 슬라이드에서 형광이 확인되면 2차 항체 희석을 늘리거나 다른 2차 희석액을 사용해야 합니다. 1차 항체 전용 슬라이드에서 형광이 확인되면 자가형광 또는 기타 잠재적인 오염 물질 때문일 수 있습니다.- 1차 항체를 항체 희석 완충액(BSA 50mg + 10% 아지드화나트륨 50μL + PBS-T 10mL)에 희석하여 슬라이드당 20-30μL를 사용하기에 충분한 항체 희석액을 준비합니다.
- 습한 챔버 준비: 플라스틱 용기의 바닥에 밀폐된 뚜껑을 덮고 젖은 종이 타월을 깔아줍니다. 종이 타월 위에 유리 파스퇴르 피펫을 한 겹으로 놓습니다. 이 피펫은 슬라이드가 수평을 유지하고 종이 타월에서 높게 유지되도록 표면을 만듭니다.
알림: 습한 챔버의 경우 스냅 뚜껑이 있는 플라스틱 식품 보관 용기를 사용하는 것이 가장 좋으며, 이를 통해 내부의 슬라이드를 방해하지 않고 용기를 더 쉽게 열고 닫을 수 있습니다. 파스퇴르 피펫에 충분히 길지만 슬라이드가 완전히 수평으로 놓일 수 있도록 움푹 들어간 곳이 없는 비교적 평평한 바닥을 찾으십시오. - 최종 PBS-T 세척에서 슬라이드를 제거합니다. 이 단계부터 신속하게 작업하여 샘플을 항상 젖은 상태로 유지하고 증발을 방지하십시오. 샘플이 건조되면 항체 염색에 부정적인 영향을 미칩니다.
- 컴팩트 한 직사각형으로 접힌 닦는 티슈를 사용하여 슬라이드의 전체 표면을 건조시킵니다. 슬라이드의 앞면과 뒷면을 닦되 샘플 주위에 충분한 공간을 남겨 둡니다. 샘플 근처의 표면을 건조할 때 특히 주의하십시오 - 샘플에 너무 가까이 가지 않도록 하여 커버슬립 크기의 영역을 건조하지 마십시오. 그러나 다음 단계를 위해 시료의 둘레가 건조한지 확인하십시오.
- 소수성 PAP 펜을 사용하여 샘플 주위에 원을 그립니다. 전체 샘플 영역을 둘러싸도록 주의하되 슬라이드 표면에 보이는 동물 시체를 방해하지 마십시오. 장벽이 완전히 마를 때까지 ~5초 동안 기다립니다.
참고: 1차 항체 용액을 포함하려면 소수성 장벽이 필요한데, 이는 슬라이드 표면이 세제가 들어 있는 PBS-T로 코팅되었기 때문입니다. PAP 펜은 건조한 슬라이드 표면에서 가장 잘 작동하므로 샘플 주위에 건조한 둘레를 만드는 것이 중요합니다. 시료에 가장 가까운 영역을 건조되지 않은 상태로 두면 이 단계에서 시료를 보호할 수 있습니다. - 빠르게 작업하면서 접힌 닦는 조직의 모서리 또는 가장자리를 사용하여 소수성 장벽 내의 샘플에서 액체를 제거합니다. 동물 시체를 방해하지 않도록주의하십시오.
- 20 μL의 1차 항체 용액을 소수성 장벽에 의해 생성된 고리 내로 즉시 피펫합니다. 시체가 파손되지 않도록 부드럽게 비스듬히 피펫을 만드십시오. 시체에 직접 피펫팅을 하지 마십시오.
- 슬라이드를 부드럽게 기울여 소수성 장벽 내의 전체 표면이 용액으로 덮이도록 합니다.
참고: 소수성 장벽의 내부 둘레가 1-1.5cm이고 20μL의 항체 용액으로 완전히 덮인 것이 가장 좋습니다. 둘레 너비는 동결 균열 단계에서 시체가 어떻게 분포되는지에 따라 달라집니다. 더 넓은 장벽에는 더 많은 양의 항체 용액이 필요할 수 있습니다. 원하는 경우 작은 사각형의 파라필름(18mm x 18mm 커버슬립 크기로 절단)을 샘플 위에 부드럽게 놓을 수 있습니다. 파라필름 사각형은 항체 용액이 전체 샘플을 덮고 증발을 방지하는 데 도움이 됩니다. - 슬라이드의 나머지 부분에 대해 3.1.3-3.1.8단계를 반복합니다.
- 슬라이드를 습한 챔버로 조심스럽게 옮겨 용액이 소수성 장벽 내에 포함되어 있고 슬라이드가 완전히 수평으로 놓여 있는지 확인합니다.
- 슬라이드를 RT에서 밤새 배양한다. 항체에 따라, 이 단계는 6시간으로 단축되거나 습한 챔버를 차가운 방 또는 냉장고에 유지함으로써 4°C에서 밤새 수행될 수 있다.
참고: 습한 챔버와 소수성 장벽을 사용하면 일반적으로 긴 밤새 배양하는 경우에도 항체 용액의 증발을 방지하기에 충분합니다. 그러나 증발이 문제가 되는 것으로 판명되면 각 샘플에 작은 사각형의 파라필름을 부드럽게 배치하여 증발을 방지할 수 있습니다. 이들은 첫 번째 세척 단계에서 제거 할 수 있습니다 : PBS-T (다른 슬라이드는 포함하지 않음)로 채워진 Coplin 병에 각 슬라이드를 담그고 파라 필름이 샘플에서 멀리 떠 다니도록합니다. 동일한 용기를 사용하여 다음 슬라이드에서 파라필름을 제거하기 전에 Coplin 용기에서 파라필름을 제거합니다.
- ~40mL의 PBS-T가 들어 있는 코플린 병에 슬라이드를 RT에서 각각 5분 동안 세 번 세척합니다. 각 세척에 신선한 PBS-T를 사용하십시오.
- 이러한 세척 동안, 2차 항체를 항체 희석 완충액에 희석한다. 슬라이드당 20-30 μL를 사용할 수 있을 만큼 충분한 항체 희석액을 준비합니다. 1:200으로 희석된 Alexa Fluor 접합 2차 항체를 사용하는 것이 일반적입니다.
- 2차 항체 배양
- 최종 PBS-T 세척에서 슬라이드를 제거합니다. 이 단계부터 신속하게 작업하여 샘플을 항상 젖은 상태로 유지하고 증발을 방지하십시오.
- 접힌 닦는 티슈를 사용하여 슬라이드를 건조시킵니다. 소수성 장벽에 포함 된 부위를 건조시키지 마십시오.
- 빠르게 작업하면서 접힌 닦는 조직의 모서리 또는 가장자리를 사용하여 소수성 장벽 내의 샘플에서 액체를 제거합니다. 동물 시체를 방해하지 않도록주의하십시오.
- 2차 항체 용액 20 μL를 소수성 장벽에 의해 생성된 고리 내로 즉시 피펫한다. 시체가 파손되지 않도록 부드럽게 비스듬히 피펫을 사용하십시오.
- 시체에 직접 피펫팅을 하지 마십시오. 소수성 장벽 내의 전체 표면이 용액으로 덮여 있는지 확인하십시오. 더 넓은 장벽 둘레에는 더 많은 양의 항체 용액이 필요할 수 있습니다. 원하는 경우 샘플을 작은 사각형의 파라 필름으로 덮으십시오 (3.1.8 단계 아래 참고 사항 참조).
- 슬라이드를 습한 챔버로 조심스럽게 옮겨 용액이 소수성 장벽 내에 포함되어 있고 슬라이드가 완전히 수평으로 놓여 있는지 확인합니다. 슬라이드를 어두운 곳에 두기 위해 습한 챔버의 덮개를 교체하십시오.
- 슬라이드의 나머지 부분에 대해 3.3.1-3.3.6단계를 반복합니다.
- RT에서 4 시간 동안 어둠 속에서 배양하십시오.
참고: 항체에 따라 이 단계를 2시간으로 단축하거나 6시간으로 연장할 수 있습니다. 습한 챔버가 어둡지 않으면 서랍에 넣거나 골판지 상자로 덮으십시오. 또는 습한 챔버를 알루미늄 호일로 싸서 슬라이드를 어둠 속에 보관할 수 있습니다.
- ~40mL의 PBS-T가 들어 있는 코플린 병에 슬라이드를 RT에서 각각 5분 동안 세 번 세척합니다. 각 세척에 신선한 PBS-T를 사용하십시오.
4. 장착 및 이미징
- 장착 매체 + DAPI (2 μg / mL), 18mm x 18mm 유리 커버 슬립 및 매니큐어를 손이 닿는 곳에 두어 샘플 장착을 준비하십시오.
- 최종 세척에서 슬라이드를 제거하고 접힌 닦는 티슈를 사용하여 건조시킵니다. 소수성 장벽에 포함 된 부위를 건조시키지 마십시오.
- 접힌 닦는 티슈의 모서리를 사용하여 장벽 내부의 샘플에서 액체를 조심스럽게 제거합니다. 이 단계에서 대부분의 액체를 제거하되 시체가 완전히 마르지 않도록하십시오.
- 신속하게 작업하여 8μL의 장착 매체를 샘플에 추가합니다. 시체를 방해하지 않도록 부드럽게 비스듬히 피펫하십시오. 시체에 직접 피펫팅을 하지 마십시오.
- 여전히 빠르게 작업하면서 유리 커버 슬립을 샘플 위로 조심스럽게 내립니다.
- 기포는 이미징을 방해하고 샘플 분해로 이어질 수 있습니다. 기포를 최소화하려면 커버 슬립의 한쪽 가장자리를 샘플 옆의 슬라이드에 놓아 샘플 위의 대각선으로 유지되도록합니다. 커버 슬립의 높은 가장자리를 연필이나 핀셋에 올려 놓는 데 도움이 될 수 있습니다. 그런 다음 커버 슬립의 높은 가장자리를 천천히 아래로 내립니다.이 움직임은 장착 매체가 한쪽 가장자리에서 반대쪽 가장자리로 진행되는 액체 씰을 만들 수있게합니다.
- 슬라이드의 나머지 부분에 대해 4.2-4.5단계를 반복합니다.
- 커버 슬립을 매니큐어로 밀봉하십시오. 커버슬립을 누르거나(샘플이 부서짐) 커버슬립을 수평으로 제거(샘플이 번짐)하지 않도록 주의하십시오.
- 커버슬립의 각 모서리에 작은 매니큐어 점을 추가합니다(~1mm 너비). 커버슬립을 제자리에 고정하는 데 도움이 됩니다. 점이 완전히 마르도록 합니다.
- 모서리가 완전히 마르면 매니큐어로 가장자리를 밀봉하십시오. 광택제가 커버슬립과 슬라이드 사이의 틈을 완전히 채우는지 확인하되 커버슬립을 너무 많이 덮지 마십시오. 커버 슬립에 1mm 겹침을 유지하는 것이 가장 좋습니다. 필요한 만큼만 매니큐어를 사용하십시오. 건조하는 데 시간이 오래 걸리고 현미경 대물렌즈가 손상될 위험이 있는 너무 많이 사용하거나 과도하게 연마하지 마십시오.
참고: 투명 대신 컬러 매니큐어를 사용하는 것이 바람직하며, 이렇게 하면 씰의 경계를 더 쉽게 볼 수 있고 매니큐어 경계 아래에 있는 동물의 이미징을 방지할 수 있습니다. - 이미징하기 전에 매니큐어를 완전히 말리십시오. 젖은 매니큐어는 현미경 대물렌즈를 심각하게 손상시킬 수 있으므로 이 단계가 중요합니다.
알림: 슬라이드는 여기서부터 가능한 한 어두운 곳에 보관해야 합니다. 평평한 판지 상자를 사용하여 벤치에서 건조 할 때 덮으십시오.
- 이미징하기 전에 슬라이드를 4°C의 어두운 곳에 1-2주 동안 보관하십시오. 필요한 경우 슬라이드를 -20°C에서 더 오래 보관합니다.
- 표준 형광 복합 광학 현미경을 사용한 이미지.
- 먼저 각 슬라이드에 대해 DAPI 채널의 10x에서 전체 샘플을 검사하여 잘 압출된 생식선을 식별하고 해당 위치를 확인합니다. 대부분의 응용 분야에서 절단되거나 불완전하거나 동물의 다른 부분으로 부분적으로 덮인 생식선을 촬영하지 마십시오. 대부분의 동물의 경우 하나의 생식선 팔만 완전히 돌출되어 보입니다.
참고: DAPI 채널에서 전체 생식선의 10x에서 저배율 이미지를 촬영하여 나중에 방향을 잡거나 특정 핵의 위치를 식별하는 데 도움이 될 수 있습니다. - 응용 프로그램에 따라 이미지를 40x, 63x 또는 100x로 촬영할 수 있습니다. 전체 생식선을 캡처하려면 경계가 겹치는 몽타주를 만듭니다. 이미징하는 동안 생식선은 속이 빈 튜브이며 핵이 상단과 하단에서 가장 밀도가 높다는 것을 기억하십시오.
- 먼저 각 슬라이드에 대해 DAPI 채널의 10x에서 전체 샘플을 검사하여 잘 압출된 생식선을 식별하고 해당 위치를 확인합니다. 대부분의 응용 분야에서 절단되거나 불완전하거나 동물의 다른 부분으로 부분적으로 덮인 생식선을 촬영하지 마십시오. 대부분의 동물의 경우 하나의 생식선 팔만 완전히 돌출되어 보입니다.
결과
DAPI는 DNA에 강하게 결합하며 다양한 조건에서도 염색이 강력합니다 (그림 3A, B). 그것은 모든 핵에 존재해야하므로 슬라이드에있는 웜 조직의 존재와 현미경에서 형광을 검출하는 능력에 대해 효과적인 양성 대조군이됩니다. 염색은 항체가 감수 분열 핵 내에 존재할 때 효과적입니다 (그림 3A, B). 예를 들어, 그림 3A, B 는 DAPI로 염색된 중간 파키틴 핵과 이중 가닥 절단의 마커인 RAD-51을 표적으로 하는 항체를 보여줍니다. KLE-2는 유사분열과 감수분열에 대비하여 염색체를 구성하는 고도로 보존된 단백질 복합체인 콘덴신의 성분입니다. kle-2/+ 돌연변이체는 약간 무질서한 DAPI 염색과 더 많은 수의 RAD-51 초점에 반영된 이중 가닥 절단 수의 증가에서 알 수 있듯이 염색체 구조에 경미한 결함이 있습니다(그림 3B). 면역형광법의 일반적인 실수는 샘플을 수정 용액에 너무 오래 두는 것입니다. 과도한 고정은 일반적으로 항체가 핵으로 확산되는 것을 방지하기 때문에 염색에 실패할 수 있습니다. 이 실수는 항체가 생식선의 세포질 영역에서 확산 될 때 확인 될 수 있지만 핵에서 제외되는 것으로 보입니다.
생식계열(그림 1)에서 핵은 원위 끝에서 유사분열적으로 증식하고, 전이 영역 동안 감수 분열에 들어가고, 디플로텐과 마지막으로 디아키네시스에 들어가기 전에 파키텐(종종 여러 핵 열에 의해 3개의 동일한 단계로 나뉩니다)을 통해 진행됩니다. 이완증의 난모세포는 정자와의 근접성에 따라 번호가 매겨지며, -1 난모세포는 정자에 가장 근접하고 -2 난모세포는 다음 원위부입니다. C. elegans는 6 개의 염색체를 가지고 있으며, 이는 이완 핵에서 조밀 한 타원형으로 나타납니다. 이들 각각은 2가 (도 3C)라고도하는 교차 (chiasma)에 의해 함께 고정 된 두 자매 염색체의 상동 쌍을 나타냅니다 (그림 3C). 교차 형성을 방해하는 spo-11과 같은 돌연변이는 교차 결합을 형성하지 못합니다. 따라서 디아키네시스 핵은 각 자매 염색분체에 대해 하나씩 12개의 개별 DAPI 몸체(단가라고도 함)를 갖게 됩니다(그림 3D).
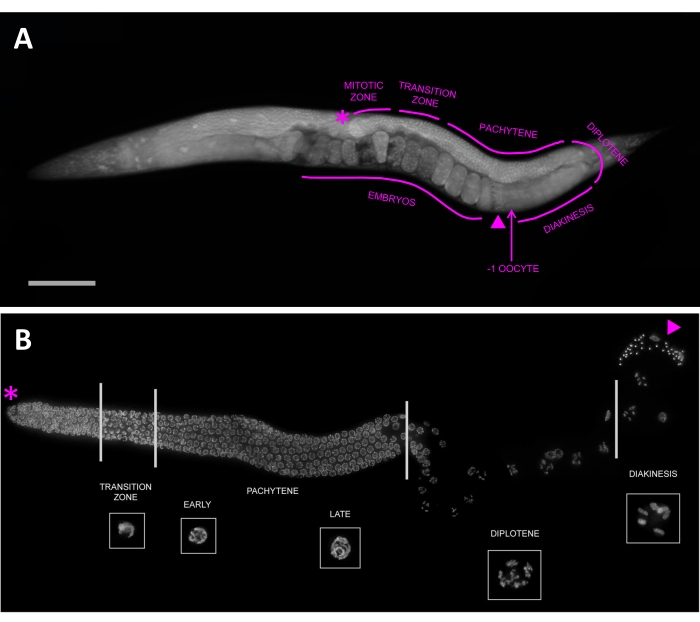
그림 1: 생식계열 핵은 감수 분열을 통한 진행을 나타내는 공간-시간적 방식으로 배열되어 있습니다. (A) DAPI로 염색 된 전체 마운트 젊은 성인 자웅 동체. 생식선과 감수 분열 단계는 원위 끝 (별표)에서 정자 (삼각형)를 포함하는 근위 영역 (화살표로 표시된 -1 난 모세포)까지 윤곽이 그려져 있습니다. 스케일 바는 100 μm를 나타낸다. (B) DAPI로 염색된 해부된 자웅동체 생식선의 투영된 형광 이미지. 감수 분열 단계가 표시되며 대표적인 핵이 인셋으로 표시됩니다 (모든 인셋은 서로 스케일링되는 것으로 표시됨). 핵은 생식계열에서의 위치와 특징적인 염색체 형태에 따라 쉽게 병기될 수 있으며, 원위 끝(별표)의 유사분열 영역에서 파키텐, 디플로텐 및 디아키네시스를 통해 전이 영역으로 진행됩니다. 정자는 삼각형으로 표시됩니다. 이 수치는 Hillers et al. 라이센스 CC BY 3.028. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 해부 설정 데모. (A) 해부 중 현미경 단계. 동물은 홀딩 슬라이드에 놓인 커버 슬립에 4 μL의 해부 용액으로 해부되며, 이는 커버 슬립을 시야로 옮기는 데 사용됩니다. 다이어그램은 이상적인 바늘 배치를 보여줍니다. 바늘은 경 사진 가장자리가 아래를 향하도록 잡고 인두 부위를 교차시킵니다. 분홍색 화살표는 바늘에 대한 가위와 같은 움직임을 보여줍니다. 분홍색 점선은 이상적인 절단 위치를 나타냅니다. (B) 전체 압출 및 불완전 압출의 예와 함께 해부된 동물의 이미지. 압출 된 생식선과 내장의 섹션에는 레이블이 붙어 있습니다. (C) 동결-균열 단계를 나타내는 이미지. 슬라이드는 커버슬립 쪽이 몸에서 반대쪽을 향하도록 한 손으로 단단히 잡아야 합니다. 반대쪽 가장자리는 벤치에 고정되어 있습니다. 면도기는 다른 손으로 잡아야합니다. 분홍색 화살표는 면도기가 슬라이드에서 커버슬립을 튕기는 이동 방향을 나타내며, 커버슬립이 몸에서 멀어지도록 약간 돌립니다. 커버슬립은 한쪽 모서리가 슬라이드의 긴 가장자리에 걸리도록 배치되었습니다. (D) 유리 배아 염색 접시에서 해부 실습을 위한 설정 이미지. 동물을 50-200 μL의 해부 용액에 넣어 증발 문제를 무효화하고 해부 시간을 연장시킵니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
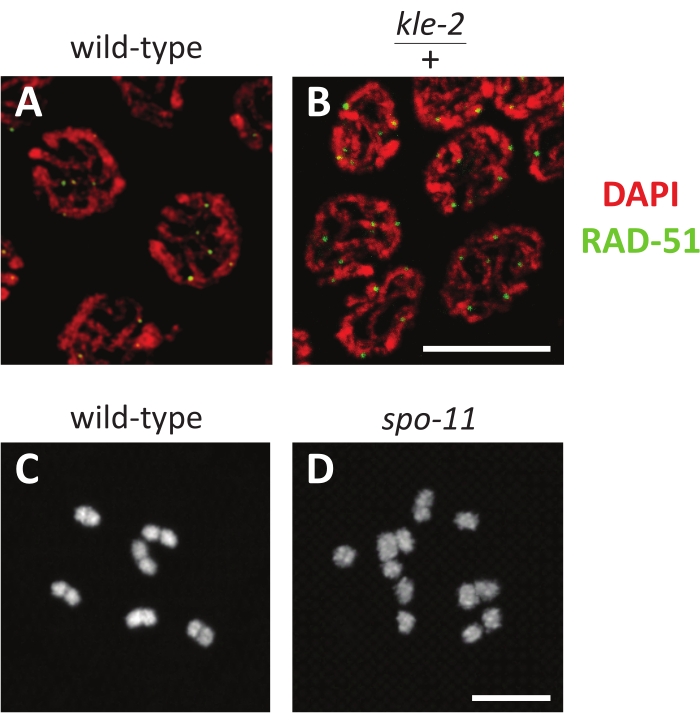
그림 3: 생식계열 핵의 대표적인 형광 결과. (A, B) 야생형 및 (B) kle-2/+ 이형접합체에서 RAD-51 항체(녹색) 및 DAPI(빨간색)로 염색된 후기 파키틴 핵의 Z-스택 투영. (씨,디) (C) 야생형(6개의 DAPI 염색체 포함) 및 (D) spo-11 돌연변이체(12개의 DAPI 염색체 포함)에서 DAPI로 염색된 단일 디아키네시스 핵의 Z-스택 투영. 스케일 바는 5μm를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
유성 생식은 감수 분열의 특수 세포 분열을 통해 생성되는 반수체 배우자의 생성을 필요로합니다. C. elegans는 광학 투명성, 편리한 생식선 해부학 및 강력한 유전학28로 인해 감수 분열의 세포학적 연구에 인기 있는 모델이 되었습니다. 생식력과 배아 치사율을 평가하는 간단한 유기체 실험을 분자 유전학과 결합하여 실험실이나 교실에서 많은 질문을 해결할 수 있습니다. 예를 들어, 교차는 적절한 염색체 분리에 필수적이기 때문에 형성이나 분해를 방해하는 과정은 이수성 배우자를 생성합니다. 차례로, 이수성 (aneuploidy)은 자손을 세거나 배아 치사율을 결정하는 약간 더 복잡한 방법을 통해 쉽게 평가할 수있는 생존 가능한 자손으로 이어진다. 세포학적으로, 크로스오버의 부족은 운동증 동안 관찰되는 DAPI 염색체의 수에 영향을 미칠 것이다. DAPI 염색의 견고성과 채점의 용이성은 세포학 기술을 가르치는 이상적인 실험입니다. 자웅 동체 생식 세포에서 핵의 시간적 공간 레이아웃은 한 순간에 감수 분열의 각 단계에 대한 스냅 샷을 제공합니다. 핵은 생식세포의 원위 유사분열 말단에서 근위 말단으로 진행하는 데 약 54시간이 걸립니다(예를 들어, Jaramillo-Lambert et al.33, Stamper et al.34 및 Libuda et al.35 참조). 감수 분열 진행의 잘 정립 된 타이밍은 펄스 추적 라벨링 또는 DNA 손상 실험을 허용합니다.
DAPI 염색은 거의 항상 작동하기 때문에 형광 현미경 검사에 유용한 기술 제어 역할을 합니다(훈련 중인 현미경 검사자에게 만족을 제공할 수 있음). 항체 염색은 더 가변적일 수 있으며 반복실험 간의 재현성을 측정하는 좋은 척도입니다. C.elegans 생식선은 염색체 구조를 보존하는 동시에 충분한 항체 확산을 허용하는 것 사이의 균형이 필요하기 때문에 일관되게 수정하기 어려울 수 있습니다. 포름알데히드로 고정하면 염색체 형태가 가장 잘 보존되고 파라포름알데히드 앰플에서 신선한 포름알데히드를 준비하면 가장 재현 가능한 결과를 얻을 수 있습니다. 포르말린 (37 % 수성 포름 알데히드 및 메탄올)으로부터 제조 된 포름 알데히드를 사용할 수도 있습니다. 고정 강도 및 타이밍은 각각의 항체에 대해 경험적으로 결정될 필요가 있을 수 있다. 대안적인 방법은 단계 2.4에서 포름알데히드 고정을 건너뛰고, 동결-균열 후, -20°C에서 100% 에탄올에 침지하거나, 100% 메탄올에 10분 동안 침지한 후 -20°C에서 10분 동안 100% 아세톤에 침지하는 것을 포함한다. 이러한 수정 조건은 더 나은 항체 침투를 허용하지만 조직 형태에 부정적인 영향을 미칩니다(염색체가 날아가고 더 부풀어 오를 것입니다).
타이밍은 2단계에서 설명한 해부 및 수정 단계에서 매우 중요합니다. 해부 용액의 부피가 너무 작기 때문에 증발은 최종 수정 농도에 영향을 미쳐 다양한 항체 염색을 유발할 수 있습니다. 숙련 된 C. elegans 핸들러는 시작 (2.3 단계)에서 2 분 이내에 슬라이드를 준비하여 수정 (2.4 단계)할 수 있습니다. 주요 기술적 장애물은 동물을 해부 용액 방울로 골라 신속하게 해부하는 능력입니다. 더 큰 볼륨으로 해부하는 방법을 배우는 것이 더 쉬울 수 있습니다. 새로운 연수생은 먼저 유리 배아 염색 접시에 50-200 μL의 해부 용액에 동물을 따는 것으로 시작합니다 (그림 2D). 더 넓은 표면은 좋은 생식선 압출을 위한 이상적인 바늘 위치를 식별할 때 더 많은 기동 공간을 제공하는 반면, 더 많은 양의 액체는 증발을 덜 문제로 만듭니다. 해부 동작에 익숙해지면 교육생은 접시에서 50μL만 사용하여 해부를 시작한 다음 슬라이드에서 20μL로 해부로 전환합니다. 슬라이드에서 해부한 후에는 연수생이 증발을 무시할 수 있을 정도로 4μL에서 작업할 수 있을 만큼 충분히 빨라질 때까지 용액의 양을 빠르게 줄이기 시작할 수 있습니다.
해부 시기가 여전히 문제가 되는 경우 연수생은 2.3단계에서 해부 용액의 8μL를 해부할 수 있습니다. 그런 다음 2.4단계에서 8μL의 고정 용액을 추가하고 부드럽게 피펫팅하여 완전히 혼합하고(시체가 파손되거나 피펫팅되지 않도록 면밀히 관찰) 혼합 용액에서 8μL를 제거할 수 있습니다. 이 대안적인 접근법은 8 μL의 동일한 최종 부피와 동일한 최종 수정 농도를 초래합니다. 이 부피는 2.5단계에서 동결 균열 동안 시체가 커버슬립과 슬라이드 표면 모두에 접촉하도록 하는 데 중요합니다. 더 큰 해부 부피에서도 각 슬라이드를 준비하는 타이밍이 문제로 남아 있는 경우, 생식계열 면역형광 프로토콜을 위한 현탁 방법이 Gervaise 및 Arur26에 의해 설명됩니다.
제자리 단백질을 시각화하기 위해 면역형광법을 사용하는 주요 한계는 관심 있는 특정 단백질을 표적으로 하는 1차 항체의 가용성입니다. 그러나 태그가 지정된 버전의 단백질이 설계된 경우 이 프로토콜을 조정하여 단백질 태그를 시각화할 수 있습니다. FLAG, HA 또는 GFP와 같은 일반적인 태그를 표적으로 하는 항체가 일반적으로 이용 가능합니다. GFP와 같은 형광 태그는 종종 고정 단계에 의해 소광될 수 있으므로 네이티브 형광 신호 자체에 의존하기보다는 GFP를 표적으로 하는 1차 항체를 사용하는 것이 좋습니다. 이 프로토콜의 또 다른 한계는 단일 기간 내에 생식세포를 포착한다는 것입니다(난자 생성의 모든 단계는 생식계열 내에서 표시되지만). 따라서이 기술은 난 모세포가 난자 생성을 통해 진행됨에 따라 발생할 수있는 동적 변화를 놓칠 수 있습니다. 그러나 배우자 생성시기는 C. elegans에서 잘 연구되었습니다. 야생형 젊은 성인에서 난 모세포는 생식 세포의 말단 끝 (유사 분열 영역)에서 이완 된33으로 진행되는 데 약 60 시간이 걸립니다. 따라서 맥박 추적 또는 조사와 같은 특정 개입 후 시간 경과를 통해 감수 분열의 여러 단계에서 효과를 관찰 할 수 있습니다.
결론적으로, 이 프로토콜은 C. elegans 생식선 해부와 형광 현미경을 위한 DAPI 및 항체 염색을 설명합니다. 해부 및 고정 (2 단계)은 생성 된 슬라이드 수에 따라 60-90 분이 걸립니다. 항체 염색(3단계)은 대부분 손을 떼고 항체 배양 시간에 따라 최소 7시간에서 1.5일까지 걸릴 수 있습니다. 장착 (4.1-4.7 단계)은 약 15 분이 소요됩니다. 생식계열 염색체와 생식선을 시각화하는 이 일반적인 접근 방식은 항체 또는 형광 태그 시약이 존재하는 경우 모든 단백질의 세포학적 연구에 사용할 수 있습니다. 가장 간단한 형태로, 이완 핵의 DAPI 염색은 감수 분열 재조합에 영향을 미치는 인자를 스크리닝하는 데 사용될 수 있습니다. 자손 수, 수컷 발생률(He 표현형) 및 배아 치사율에 대한 유기체 분석과 함께 이 세포학적 접근 방식은 인구 기반 분석에 대한 단일 세포 대위법을 제공합니다.
공개
저자는 공개 할 이해 상충이 없습니다. 이 원고의 내용은 전적으로 저자의 책임입니다. 반드시 국립 보건원 (National Institutes of Health) 또는 국립 과학 재단 (National Science Foundation)의 공식 견해를 나타내는 것은 아닙니다.
감사의 말
Lee 연구실에서의 작업은 국립 보건원의 수상 번호 1R15GM144861과 수상 번호 1R15HD104115의 국립 아동 및 인간 발달 연구소의 지원을 받았습니다. DA는 UML Kennedy College of Sciences Science Scholars 프로그램의 지원을 받았습니다. NW는 UML Honors College Fellowship 및 UMLSAMP Fellowship (보조금 번호 HRD-1712771에 따라 National Science Foundation에서 자금 지원)의 지원을 받았습니다. RAD-51 항체에 대해 A. Gartner에게 감사드립니다. 모든 C. elegans 균주는 Caenorhabditis 유전학 센터에서 제공했으며, 이 센터는 수상 번호P40 OD010440으로 국립 보건원의 연구 인프라 프로그램 사무소에서 자금을 지원합니다.
자료
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 488 Donkey Anti-Rabbit IgG Secondary Antibody | Molecular Probes | 711-545-152 | |
| Aluminum heating/cooling block | Millipore Sigma | Z743497 | |
| Bacto Peptone | Gibco | DF0118 17 0 | |
| Borosilicate Glass Pasteur Pipets, Disposable, 5.75 inches | Fisherbrand | 13 678 20B | Used to make worm picks |
| BSA, Bovine Serum Albumin | VWR | 97061 420 | |
| C. elegans wild type (ancestral) | Caenorhabditis Genetics Center | N2 (ancestral) | |
| C. elegans kle-2 (ok1151) mutants | Caenorhabditis Genetics Center | VC768 | The full genotype of this strain is: kle-2(ok1151) III/hT2 [bli-4(e937) let-?(q782) qIs48] (I;III). It has kle-2 balanced with a balancer chromosome marked with pharangeal GFP. Pick non-green animals to identify homozygous kle-2 mutants. |
| C. elegans spo-11 (me44) mutants | Caenorhabditis Genetics Center | TY4342 | The full genotype of this strains is: spo-11(me44) IV / nT1[qIs51] (IV:V). It has spo-11 balanced with a balancer chromosome marked with pharangeal GFP. Pick non-green animals to identify homozygous spo-11 mutants. |
| Calcium Chloride Anhydrous | VWR | 97062 590 | |
| Cholesterol | Sigma Aldrich | 501848300 | |
| DAPI | Life Technologies | D1306 | |
| EDTA, Disodium Dihydrate Salt | Apex Bioresearch Products | 20 147 | |
| Embryo Dish, glass, 30mm cavity | Electron Microscopy Services | 100492-980 | Used to practice dissecting; glass is preferred because dissected animals can stick to plastic |
| Escherichia coli | Caenorhabditis Genetics Center | OP50 | |
| Food storage container, plastic | various | n/a | Plastic containers with (1) relatively flat bottoms, to allow slides to rest level; (2) lids that are air-tight, but can still be easily removed without disturbing contents of container, and (3) are about 9 inches long by 6 inches wide are preferred |
| Glass Coplin Jar | DWK Life Sciences Wheaton | 08-813E | |
| Hydrophobic Barrier PAP Pen | ImmEdge | NC9545623 | |
| Kimwipes | Kimtech Science | 06 666A | |
| Levamisole Hydrochloride | Sigma Aldrich | L0380000 | |
| Magnesium Sulfate Anhydrous | Fisher Chemical | M65 500 | |
| Needles, Single-use, 25 G | BD PrecisionGlide | 14 821 13D | blue, 1 inch |
| NGM Agar, Granulated | Apex Bioresearch Products | 20 249NGM | |
| Parafilm | Bemis | 16 101 | |
| Paraformaldehyde (16% w/v) Aqueous Solution | Electron Microscopy Sciences | 50 980 487 | |
| PBS, Phosphate Buffered Saline (10x Solution) | Fisher BioReagents | BP399500 | |
| Petri Dishes, 60-mm | Tritech Research | NC9321999 | Non-vented, sharp edge |
| Platinum wire (90% platinum, 10% iridium) | Tritech Research | PT 9010 | Used to make worm picks |
| Potassium Chloride | Fisher | BP366-500 | |
| Potassium Phosphate Dibasic | VWR BDH Chemicals | BDH9266 500G | |
| Potassium Phosphate Monobasic | VWR BDH Chemicals | BDH9268 500G | |
| Premium Cover Glasses 18 mm x 18 mm | Fisherbrand | 12-548-AP | 0.13–0.17 mm thickness |
| Razor Blades, Single Edge | VWR | 55411 055 | |
| SlowFade Gold Antifade Mountant | Molecular Probes | S36937 | Alternatives: VectaShield Antifade Mounting Medium (Vector Laboratories, H-1000-10) or ProLong Diamond Antifade (Thermo Fisher Scientific, P36970). If using ProLong Diamond, no nail polish is required for sealing, but slides must cure for 24 hours before imaging. |
| Sodium Azide | Fisher BioReagents | BP922I 500 | |
| Sodium Chloride | Fisher Chemical | S271 500 | |
| Sodium Phosphate Dibasic Anhydrous | Sigma Aldrich | 7558 79 4 | |
| Sodium Phosphate Dibasic Heptahydrate | Sigma Aldrich | S9390 | |
| Styrofoam box | various | n/a | Approximate dimensions of interior: 12 inches long, 9 inches wide, 8 inches deep |
| Superfrost Plus Microscope Slides | Fisherbrand | 22 037 246 | |
| Triton X-100 | Fisher BioReagents | BP151 500 | |
| Tryptone | Apex Bioresearch Products | 20 251 | |
| Tween 20 | Fisher Chemical | BP337 500 | |
| Yeast Extract | Apex Bioresearch Products | 20 254 |
참고문헌
- Newman, D. L., Wright, L. K. Meiosis: A play in three acts, starring DNA sequence. CourseSource. 4, (2017).
- Ohkura, H. Meiosis: An overview of key differences from mitosis. Cold Spring Harbor Perspectives in Biology. 7 (5), 015859 (2015).
- Hassold, T., Hunt, P. To err (meiotically) is human: the genesis of human aneuploidy. Nature Reviews Genetics. 2 (4), 280-291 (2001).
- Keeney, S., Giroux, C. N., Kleckner, N. Meiosis-specific DNA double-strand breaks are catalyzed by Spo11, a member of a widely conserved protein family. Cell. 88 (3), 375-384 (1997).
- Rabitsch, K. P., et al. Kinetochore recruitment of two nucleolar proteins is required for homolog segregation in meiosis I. Developmental Cell. 4 (4), 535-548 (2003).
- Brown, C. R. Some misconceptions in meiosis shown by students responding to an advanced level practical examination question in biology. Journal of Biological Education. 24 (3), 182-186 (1990).
- Kalas, P., O'Neill, A., Pollock, C., Birol, G. Development of a meiosis concept inventory. CBE-Life Sciences Education. 12 (4), 655-664 (2013).
- McDonnel, L. M., Klenz, J. Teaching genetic linkage and recombination through mapping with molecular markers. CourseSource. 2, (2015).
- Wright, L. K., Cortez, P., Franzen, M. A., Newman, D. L. Teaching meiosis with the DNA triangle framework: A classroom activity that changes how students think about chromosomes. Biochemistry and Molecular Biology Education. 50 (1), 44-54 (2021).
- Shortlidge, E. E., Bangera, G., Brownell, S. E. Each to their own CURE: Faculty who teach course-based undergraduate research experiences report why you too should teach a CURE. Journal of Microbiology & Biology Education. 18 (2), 18 (2017).
- Auchincloss, L. C., et al. Assessment of course-based undergraduate research experiences: A meeting report. CBE-Life Sciences Education. 13 (1), 29-40 (2014).
- Lee, T. W., Carpenter, B. S., Birol, O., Katz, D. J., Schmeichel, K. L. The pipeline CURE: An iterative approach to introduce all students to research throughout a biology curriculum. CourseSource. 6, (2019).
- Lu, F. -. M., Eliceiri, K. W., Stewart, J., White, J. G. WormClassroom.org: an inquiry-rich educational web portal for research resources of Caenorhabditis elegans. CBE Life Sciences Education. 6 (2), 98-108 (2007).
- Corsi, A. K., Wightman, B., Chalfie, M. A Transparent window into biology: A primer on Caenorhabditis elegans. Genetics. 200 (2), 387-407 (2015).
- JoVE Science Education Database. Biology I: yeast, Drosophila and C. elegans. An Introduction to Caenorhabditis elegans. JoVE Science Education Database. , (2022).
- JoVE. Science Education Database. Biology I: yeast, Drosophila and C. elegans. C. elegans Maintenance. JoVE Science Education Database. , (2022).
- Lee, R. Web resources for C. elegans studies. WormBook. , (2005).
- JoVE. Science Education Database. Biology I: yeast, Drosophila and C. elegans. RNAi in C. elegans. JoVE Science Education Database. , (2022).
- Meneely, P. M., Dahlberg, C. L., Rose, J. K. Working with worms: Caenorhabditis elegans as a model organism. Current Protocols Essential Laboratory Techniques. 19 (1), 35 (2019).
- Lemons, M. L. An inquiry-based approach to study the synapse: Student-driven experiments using C. elegans. Journal of Undergraduate Neuroscience Education. 15 (1), 44-55 (2016).
- Kowalski, J. R., Hoops, G. C., Johnson, R. J. Implementation of a collaborative series of classroom-based undergraduate research experiences spanning chemical biology, biochemistry, and neurobiology. CBE-Life Sciences Education. 15 (4), 55 (2016).
- Mordacq, J., Drane, D., Swarat, S., Lo, S. Research and teaching: Development of course-based undergraduate research experiences using a design-based approach. Journal of College Science Teaching. 46 (4), (2017).
- Palmisano, N. J., et al. A laboratory module that explores RNA interference and codon optimization through fluorescence microscopy using Caenorhabditis elegans. bioRxiv. , 344069 (2021).
- Hillers, K. J., Villeneuve, A. M. Analysis of meiotic recombination in Caenorhabditis elegans. Meiosis. 557, 77-97 (2009).
- Phillips, C. M., McDonald, K. L., Dernburg, A. F. Cytological analysis of meiosis in Caenorhabditis elegans. Meiosis. 558, 171-195 (2009).
- Gervaise, A. L., Arur, S. Spatial and temporal analysis of active ERK in the C. elegans germline. Journal of Visualized Experiments. (117), e54901 (2016).
- Shakes, D. C., Miller, D. M., Nonet, M. L. Immunofluorescence microscopy. Methods in Cell Biology. 107, 35-66 (2012).
- Hillers, K. J., Jantsch, V., Martinez-Perez, E., Yanowitz, J. L. Meiosis. Wormbook. , (2017).
- Hunter, A. -. B., Seymour, E., Laursen, S., Thiry, H., Melton, G. . Undergraduate Research in the Sciences: Engaging Students in Real Science. , (2010).
- Wei, C. A., Woodin, T. Undergraduate research experiences in biology: Alternatives to the apprenticeship model. CBE-Life Sciences Education. 10 (2), 123-131 (2011).
- Elgin, S. C. R., et al. Insights from a convocation: Integrating discovery-based research into the undergraduate curriculum. CBE-Life Sciences Education. 15 (2), (2016).
- Stiernagle, T. Maintenance of C. Elegant. WormBook. , (2006).
- Jaramillo-Lambert, A., Ellefson, M., Villeneuve, A. M., Engebrecht, J. Differential timing of S phases, X chromosome replication, and meiotic prophase in the C. elegans germ line. Developmental Biology. 308 (1), 206-221 (2007).
- Stamper, E. L., et al. Identification of DSB-1, a protein required for initiation of meiotic recombination in Caenorhabditis elegans, illuminates a crossover assurance checkpoint. PLoS Genetics. 9 (8), 1003679 (2013).
- Libuda, D. E., Uzawa, S., Meyer, B. J., Villeneuve, A. M. Meiotic chromosome structures constrain and respond to designation of crossover sites. Nature. 502 (7473), 703-706 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유