Method Article
الانصمام الإشعاعي Y-90 ومثبط PD-1 كعلاج مساعد جديد في سرطان الخلايا الكبدية
* These authors contributed equally
In This Article
Summary
توضح هذه الدراسة الإمكانات المنهجية للجمع بين الانصمام الإشعاعي عبر الشرايين Yttrium-90 (Y-90 TARE) مع الجسم المضاد أحادي النسيلة المضاد ل PD-1 كاستراتيجية مساعدة جديدة فعالة تؤدي إلى استئصال الكبد في مرضى سرطان الخلايا الكبدية (HCC) الذين يعانون من مخاطر تكرار أولية عالية. ويؤكد على السلامة والجدوى والتوجيه الإجرائي خطوة بخطوة لهذا النهج.
Abstract
تعرض هذه الدراسة بروتوكول علاج شامل لمرضى سرطان الخلايا الكبدية عالي الخطورة (HCC) ، مع التركيز على الاستخدام المشترك للانصمام الإشعاعي عبر الشرايين Y-90 (TARE) ومثبطات موت الخلايا المبرمج -1 (PD-1) كعلاج مساعد جديد. تم تسليط الضوء عليه من خلال تقرير حالة ، ويقدم مرجعا خطوة بخطوة للتدخلات العلاجية المماثلة. تم إجراء تحليل بأثر رجعي على مريض خضع لاستئصال الكبد بعد العلاج بمثبطات Y-90 TARE و PD-1. تم تسجيل التفاصيل الديموغرافية والسريرية الرئيسية عند القبول لتوجيه اختيار العلاج. استندت ملاءمة Y-90 TARE وحساب الجرعة إلى اختبارات رسم خرائط التروية المجمعة من Technetium-99m (Tc-99m) (MAA). تم تأكيد تغطية الآفة بواسطة الكريات المجهرية Y-90 من خلال التصوير المقطعي المحوسب / التصوير المقطعي المحوسب (SPECT / CT) ، وتم توثيق ردود الفعل السلبية ونتائج المتابعة بدقة. اختار المريض ، الذي يعاني من 7.2 سم من سرطان الكبد في الفص الكبدي الأيمن (T1bN0M0 ، BCLC A ، CNLC Ib) ومستوى أولي من alpha-fetoprotein (AFP) يبلغ 66،840 نانوغرام / مل ، Y-90 TARE بسبب ارتفاع مخاطر التكرار ورفض الجراحة الأولية. كانت معلمات العلاج ، بما في ذلك جزء تحويل الرئة (LSF) والنسبة غير الورمية (TNR) ، ضمن الحدود العلاجية. تم إعطاء ما مجموعه 1.36 جيجابايت Q Y-90. بعد شهر واحد من العلاج ، تقلص الورم إلى 6 سم مع نخر جزئي ، وانخفضت مستويات AFP إلى 21،155 نانوغرام / مل ، وظلت مستقرة لمدة 3 أشهر. بعد 3 أشهر ، أدى العلاج بمثبطات PD-1 إلى مزيد من التقليل من الورم إلى 4 سم وانخفاض AFP إلى 1.84 نانوغرام / مل. ثم خضع المريض لاستئصال الكبد. أكد علم الأنسجة المرضي نخر الورم الكامل. بعد 12 شهرا من الجراحة ، لم يلاحظ تكرار الورم أو ورم خبيث في جلسات المتابعة. يوضح هذا البروتوكول المزيج الفعال من Y-90 TARE ومثبط PD-1 كاستراتيجية تجسير للجراحة لمرضى سرطان الكبد المعرضين لخطر التكرار المرتفع ، مما يوفر دليلا عمليا لتنفيذ هذا النهج.
Introduction
يمثل سرطان الخلايا الكبدية (HCC) 85٪ -90٪ من حالات سرطان الكبد الأولية في جميع أنحاء العالم وهو ورم خبيث منتشر في الجهاز الهضمي1 . المشكلة أسوأ في الصين ، حيث يصنف سرطان الكبد على أنه4 أكثر الأورام الخبيثة شيوعا والسبب الرئيسي الثاني للوفيات المرتبطة بالسرطان2،3. ومما يضاعف هذا التحدي هو ارتفاع معدل التكرار بعد استئصال الكبد ، والذي لوحظ في مجموعة فرعية كبيرة من المرضى في غضون عامين. غالبا ما تتطور هذه التكرارات إلى أشكال مقاومة علاجيا وخبيثة بقوة ، مما يؤدي بسرعة إلى نتائج مميتة. وبالتالي ، فإن التخفيف من تكرار ما بعد استئصال الكبد أمر بالغ الأهمية لتوسيع معدلات البقاء على قيد الحياة بين مرضى سرطان الكبد4،5.
يشير العلاج المساعد الجديد إلى مجموعة شاملة من العلاجات التي يتم إجراؤها قبل الجراحة ، والتي تهدف إلى زيادة معدل إزالة الورم بالكامل (استئصال R0) ، والقضاء على المرض النقيلي الدقيق غير المرئي في التصوير ، وتقليل خطر تكرار ما بعد الجراحة ، وإطالة بقاء المريض على المدى الطويل6. إنه مناسب بشكل خاص لمرضى سرطان الكبد الذين يقدمون عوامل عالية الخطورة ، بما في ذلك الاستئصال غير التشريحي ، وغزو الأوعية الدموية المجهري ، ومستويات AFP المرتفعة في الدم التي تتجاوز 32 نانوغرام / مل ، وأبعاد الورم أكبر من 5 سم ، والأورام المتعددة ، وتليف الكبدالأساسي 7. يشمل ذخيرة العلاج المساعد الجديد تقنيات مختلفة مثل الانصمام الكيميائي الشرياني عبر القسطرة (TACE) ، والعلاج الكيميائي بالتسريب الشرياني الكبدي (HAIC) ، والعلاج الإشعاعي الداخلي الانتقائي (SIRT). غالبا ما يتم دمجها مع العلاجات المناعية المستهدفة ، والتي يتم تطبيقها إما منفردة أومجتمعة 8.
يمثل الانصمام الإشعاعي عبر الشرايين Yttrium-90 (Y-90 TARE) ، وهو شكل متخصص من العلاج الإشعاعي الداخلي الانتقائي (SIRT) ، خيارا علاجيا مهما لسرطانات الكبد الأولية غير القابلة للجراحة والنقائل الكبدية. تشتهر Y-90 TARE بمعدلات التحكم المحلية الاستثنائية ، وهي تتفوق من خلال توصيل جرعة عالية من الإشعاع β مباشرة إلى موقع الورم ، في حين أن متوسط مسافة الاختراق المحدودة البالغ 2.5 مم فقط يساعد على حماية الأنسجة السليمةالمجاورة 9. تم استخدام العلاج الإشعاعي الداخلي الانتقائي للكرة المجهرية Yttrium-90 (90Y-SIRT) سريريا في علاج الأورام الخبيثة في الكبد لأكثر من 50 عاما منذ عام 1970 ، مع تأكيد التطبيق السريري على نطاق واسع لأكثر من عقدين10. تم إثبات سلامته وفعاليته منذ الموافقة عليه في أوروبا والولايات المتحدة في القرن الماضي. تم إجراء العلاج الإشعاعي ب Yttrium-90 دوليا لعدة عقود ، مما أسفر عن بيانات سريرية وفيرة11،12،13. بالإضافة إلى ذلك ، فإن إيتريوم 90 ، وهو عنصر مشع اصطناعي يقع في المرتبة 39 في الجدول الدوري ، ينبعث منه أشعة بيتا عالية النقاء بطاقة عالية. لها عمر نصف قصير (64.2 ساعة) ومسافة اختراق محدودة للأنسجة ، مما يلغي الحاجة إلى العزل بعد الجراحة14،15،16. أيضا ، تكنولوجيا الأوعية الدموية ومنتجات التسوس غير ضارة بجسم الإنسان15،17. في الوقت نفسه ، تعمل الأجسام المضادة أحادية النسيلة المضادة ل PD-1 على تجديد إمكانات الخلايا المناعية السامة للخلايا ضد الخلايا السرطانية. مع وجود ملامح مناعية أكثر قوة لوحظت في مرضى سرطان الكبد في المراحل المبكرة ، يتم الاستفادة بشكل متزايد من مثبطات PD-1 في البيئات المساعدة الجديدة. من الناحية الوظيفية ، تعزز هذه الأجسام المضادة وحيدة النسيلة PD-1 موت الخلايا المناعية الناجم عن Y-90 ARE ، مما يعزز قدرة الجهاز المناعي على التعرف على الخلايا السرطانية والقضاء عليها. تتضمن آلية Y-90 TARE تدميرا مباشرا للخلايا السرطانية من خلال الإشعاع β ، والذي يعالج عدم تجانس الورم والتهرب المناعي ، وبالتالي زيادة تأثير الأجسام المضادة أحادية النسيلة PD-1. ومع ذلك ، من المهم ملاحظة أنه اعتبارا من الوقت الحاضر ، فإن الدراسات الشاملة حول الاستخدام المشترك لمثبطات Y-90 TARE و PD-1 في العلاج المساعد الجديد نادرة نسبيا18،19،20.
تعمل دراسة الحالة هذه كدليل عملي ، يوضح عملية وسلامة وإمكانات Y-90 TARE جنبا إلى جنب مع مثبط PD-1 كعلاج مساعد جديد يؤدي إلى استئصال الكبد. من خلال إجراء تقييم بأثر رجعي لمريض سرطان الكبد الذي عولج بهذا العلاج المساعد الجديد متبوعا باستئصال الكبد ، نقوم بتفصيل الخطوات العلاجية وإدارة الأحداث السلبية وتقييم النتائج. تهدف النتائج التي توصلنا إليها إلى تقديم مخطط شامل للأطباء في تطبيق العلاج المثبط Y-90 TARE و PD-1 في إدارة مرضى سرطان الكبد المعرضين لمخاطر عالية.
عرض الحالة:
كان طول المريض ، وهو رجل يبلغ من العمر 49 عاما ، 168 سم ، ووزنه 62 كجم ، ويبلغ إجمالي حجم الكبد (VOI) 1236 مل ، وحجم الورم 157 مل وحجم تروية الورم المستهدف 246 مل. كان إجمالي حجم الرئة 2124 مل ، مع LSF 17.17٪ و TNR 8.2. كان لديه سرطان الكبد بحجم 7.2 سم في الفص الكبدي الأيمن (T1bN0M0 ، BCLC A ، CNLC Ib) ومستوى أولي من بروتين ألفا الجنيني (AFP) يبلغ 66،840 نانوغرام / مل. تم تسجيل ECOG-PS قبل الجراحة للمريض (حالة أداء مجموعة الأورام التعاونية الشرقية) عند 0. لم يتلق أي علاج دوائي قبل اختيار Y-90 TARE ، والذي تم اختياره بسبب ارتفاع مخاطر التكرار ورفض الجراحة الأولية.
Protocol
تمت الموافقة على إجراء العلاج من قبل مجلس المراجعة المؤسسية للمستشفى الأول التابع لجامعة جينان. تم الحصول على الموافقة المستنيرة من المشارك المشمول في الدراسة.
1. اختيار المريض للعلاج المساعد الجديد
- معايير الاشتمال
- حدد المرضى الذين يعانون من آفات قابلة لإكمال الاستئصال الجراحي (استئصال R0).
- حدد المرضى الذين يظهرون عوامل عالية الخطورة للتكرار ، بما في ذلك الاستئصال غير التشريحي ، وغزو الأوعية الدموية ، وارتفاع مستويات AFP في الدم التي تتجاوز 32 نانوغرام / مل ، وأبعاد الورم أكبر من 5 سم ، ووجود أورام متعددة ، وتليف الكبد الأساسي.
- معايير الاستبعاد
- استبعاد المرضى الذين يعانون من عوامل تكرار عالية الخطورة والذين يحتاجون إلى علاج جراحي في وقت التشخيص الأولي. استبعاد المرضى غير القادرين على تحمل تكاليف العلاج ب Y90.
2. مؤشرات Y-90 وتقييم الجرعة
- تصوير الأوعية DSA لتحديد إمدادات الدم الورمي
- اطلب من المريض الاستلقاء للعمل. قم بإجراء التطهير واللف الروتيني. ضع محلول ليدوكائين 4٪ محليا في موقع ثقب الشريان الفخذي للتخدير.
- التزم بإجراءات غسل اليدين الروتينية ، وارتداء الملابس الجراحية ، وارتداء قفازات معقمة.
- أدخل إبرة بزل دقيق في الشريان الفخذي المشترك الأيمن باستخدام تقنية Seldinger. اتبع ذلك بوضع غمد متصل بنظام تدفق محلول ملحي.
- بمجرد نجاح ثقب الشريان الفخذي ووضع القسطرة (لوحظ دم شرياني أحمر فاتح) ، قم بدفع قسطرة تصوير الأوعية الدموية إلى الجذع البطني. إذا كان التصوير يشير إلى وجود أوعية تغذي الورم بخلاف الشريان الكبدي، فقم بإجراء تصوير الأوعية الدموية على الشريان المساريقي العلوي والشريان تحت الحاجز وما إلى ذلك، لتحديد أي أوعية تغذي الورم.
- إجراء تصوير الأوعية الدموية في أصل الجذع البطني لتحديد ما إذا كان الورم الكبدي يتم توفيره حصريا عن طريق فرع منفرد من الشريان الكبدي الأيمن.
- استخدم تقنية القسطرة الدقيقة المحورية للقسطرة الانتقائية الفائقة على الفرع السفلي الأيمن من الشريان الكبدي الأيمن. قم بإجراء تصوير الأوعية لتأكيد موقع السفينة المزودة.
- تكنيتيوم 99 م (Tc-99m) حقن وتصوير MAA
- حقن 2 ملي Ci من Tc-99m MAA من خلال القسطرة الدقيقة في الشرايين المغذية.
ملاحظة: يتم إجراء هذا الإجراء وفقا لتوصيات الجمعية الأمريكية للفيزيائيين في الطب بشأن قياس الجرعات والتصوير وإجراءات ضمان الجودة للعلاج الإشعاعي الموضعي المجهري 90Y في علاج الأورام الخبيثة الكبدية. تم تعيين الجرعة الموصى بها من Tc-99m MAA عند 2-4 mCi (74-148 MBq)16. من المهم ملاحظة أن جرعة Tc-99m MAA ثابتة ولا تختلف بناء على وزن المريض أو مساحة سطح الجسم أو حجم الآفة. - إجراء التصوير المقطعي المحوسب بالحزمة المخروطية (CBCT) لتحديد منطقة الورم المستهدفة لتوزيع Tc-99m MAA داخل الكبد. حدد المنطقة يدويا على المناظر السهمية والإكليلية والمحورية أثناء المرحلة الشريانية.
- احسب حجم منطقة الورم المستهدفة باستخدام خيار SEG4 Properties في CBCT.
- حقن 2 ملي Ci من Tc-99m MAA من خلال القسطرة الدقيقة في الشرايين المغذية.
- حسابات قياس جرعات الكرة المجهرية LSF و TNR و Y90
- قم بتكوين معلمات أوضاع المسح (SPECT و CT) على الماسح الضوئي وقم بإجراء تصوير SPECT / CT على المريض في غضون 1-2 ساعة بعد ضخ Tc-99m MAA. حدد وظيفة الانصهار لدمج صور SPECT و CT لتحديد توزيع Tc-99m MAA في الكبد والرئة والأعضاء الأخرى.
- احسب كسر تحويلة الرئة (LSF) باستخدام التصوير المستوي.
- ارسم يدويا مناطق الاهتمام (ROIs) ، وحدد المناطق المميزة داخل الكبد والرئتين حيث يمكن تمييز توزيع Tc-99m MAA في المناظر الأمامية والخلفية للكبد والرئة اليمنى والرئة اليسرى على الصور المستوية. يتم تنفيذ هذه الخطوة من قبل تقني الطب النووي.
ملاحظة: يمثل جزء تحويلة الرئة (LSF) جزء 99mTc-MAA الذي ينتقل من الكبد إلى كلتا الرئتين. باستخدام التصوير المستوي ، يقوم تقني الطب النووي يدويا برسم عائد الاستثمار حول الكبد والرئتين (بشكل منفصل للرئة اليمنى واليسرى) في كل من المنظرين الأمامي والخلفي. ثم يتم الحصول على نتيجة العد لكل جزء من محطة العمل هذه. - احسب الأعداد لكل عائد استثمار باستخدام محطة عمل قياسية للطب النووي. استخدم الصيغة:
عدد الرئة =
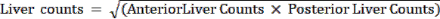
- احسب LSF باستخدام المعادلة:
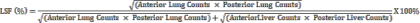
- ارسم يدويا مناطق الاهتمام (ROIs) ، وحدد المناطق المميزة داخل الكبد والرئتين حيث يمكن تمييز توزيع Tc-99m MAA في المناظر الأمامية والخلفية للكبد والرئة اليمنى والرئة اليسرى على الصور المستوية. يتم تنفيذ هذه الخطوة من قبل تقني الطب النووي.
- احسب نسبة الكبد الطبيعية للورم (TNR) باستخدام تطبيق التجزئة ثلاثي الأبعاد (3D) لتصوير SPECT / CT.
- ارسم يدويا عائد استثمار منفصل من نفس الحجم ليشمل كل من مناطق الورم والكبد الطبيعية بناء على شرائح التصوير المقطعي المحوسبة.
- احسب متوسط العد لكل وحدة خلية من الورم على متوسط العد لكل وحدة خلية من الكبد الطبيعي في كل عائد استثمار باستخدام محطة عمل.
- احسب نسبة TNR باستخدام المعادلة التالية:
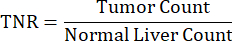
- استخدم معادلة نموذج التقسيم في متخيل الجرعة والنشاط لتطبيق Y-90 RE (DAVYR) بناء على نتائج الحسابات للحصول على النشاط الموصوف (Gbq) والجرعة (Gy).
3. علاج Y-90 فارغ
- اتبع النهج الموضح في الخطوة 2 ثم قم بإجراء تصوير الأوعية مباشرة على الشرايين التغذوية للدم المحددة في الخطوة 2.1.
- قارن الصورة الوعائية الحالية بتلك الموجودة في الخطوة 2 لتأكيد موقع الشرايين المغذية بشكل أكثر دقة.
- قم بدفع القسطرة إلى الشرايين المغذية بعد القسطرة الانتقائية الفائقة ، ثم قم بحقن الكريات المجهرية Y90 ، مع الجرعة والنشاط المحسوبين بالفعل ، في الشرايين المغذية.
- بالنسبة إلى Y-90 TAR، احصل على فحوصات مخصصة للجسم بالكامل بالإصدار البوزيتروني/التصوير المقطعي المحوسب من الصدر إلى فوق الحوض مباشرة. قم بإجراء PET-CT باستخدام المعلمات التالية: 80 ثانية إلى 110 ثانية ، 120 كيلو فولت في الدقيقة ، 40 مللي أمبير ، دوران أنبوب 1 ثانية ، موازاة شريحة 4 مم ، وسرعة سرير 8 مم / ثانية (أي الملعب ، 2).
- قم بتقييم TNR من عائد استثمار الحجم المرسوم على صور التصوير المبثبتروني / التصوير المقطعي المحوسب ثم قارنه ب TNR تم الحصول عليه من صور SPECT / CT لتوزيع Tc-99m MAA لتأكيد توزيع Y-90.
- عند الاستغناء عن الكريات المجهرية Tc-99m MAA و Y-90 وحقنها ، ارتد معدات الحماية المناسبة ، مثل مآزر الرصاص وواقيات العين وقفازات الرصاص.
- لا تقم بإجراء أي علاج خاص بعد علاج Y-90 TARE ، واطلب من المرضى الذين تلقوا علاج Y-90 تجنب الاتصال الوثيق مع الآخرين لمدة 7 أيام لتقليل مخاطر الإشعاع.
4. العلاج المتسلسل لمثبطات PD-1 بعد علاج Y90
- مراقبة استقرار الآفة لمدة شهرين على الأقل بعد علاج Y90. استخدم طرق التصوير المناسبة للمراقبة المتسقة. أعد تقييم المريض لتحديد وجود أي عوامل عالية الخطورة لتكرار المرض.
- إذا تم تحديد عوامل عالية الخطورة ، فقم بتقييم مدى ملاءمة المريض للعلاج المناعي ، والتأكد من عدم وجود موانع. حدد مثبطا مناسبا ل PD-1 ، مثل Nivolumab أو Pembrolizumab ، بناء على الاعتبارات المالية للمريض.
- قم بإدارة المثبط المختار في 1-2 دورات ، كل منها مفصولة ب 21 يوما. قم بإعطاء مثبط PD-1 ، المحضر باستخدام 100 مل من المحلول الملحي الفسيولوجي عند 2 مجم / مل ، عن طريق الحقن الوريدي المحيطي على مدار ساعة واحدة ، وبالتالي إكمال دورة واحدة من العلاج بمثبطات PD-1.
- تقييم ومتابعة ما بعد العلاج
- بعد الانتهاء من العلاج بمثبطات PD-1 ، ومتابعة دراسات التصوير ودراسات علامات الورم المطابقة لتلك المستخدمة قبل العلاج.
- تقييم استجابة المريض الشهرية للعلاج بمثبطات PD-1 باستخدام معايير التقييم القياسية21.
5. استئصال الكبد بعد مثبط Y90 TARE و PD-1
- قرار استئصال الكبد: تقييم موقع العلاج باستخدام نفس التقنيات الإشعاعية التي تم تطبيقها سابقا لتقييم استقرار الآفة لمدة شهرين على الأقل بعد العلاج بمثبطات PD-1 ، مع ضمان عدم وجود عوامل عالية الخطورة للتكرار.
- الاستعدادات قبل الجراحة لاستئصال الكبد: لتحديد هوامش استئصال الورم بدقة وفحص الآفات النقيلية المحتملة ، قم بإعطاء الإندوسيانين الأخضر للمريض قبل 3 أيام من الجراحة.
- الإجراء الجراحي
- إجراء التنبيب الرغامي للتخدير العام على المريض الموجود في حالة ضعيفة. إجراء التطهير الجراحي لمنطقة البطن العلوية الممتدة بشكل متفوق إلى خط الحلمة ، وأدنى من ارتفاق العانة ، وبشكل جانبي إلى خط منتصف الإبط.
- عند دخول التجويف البريتوني ، استخدم منظار البطن لإجراء فحص شامل للكبد والهياكل المحيطة بحثا عن أي تشوهات أو بؤر نقيلية.
- ارفع الحد السفلي للكبد الأيمن باستخدام المقبضين لفضح الورم الموجود في الجزء 6 (S6) من الكبد.
- بعد حقن الإندوسيانين الأخضر عن طريق الوريد ، قم بالتبديل إلى وضع التصوير الفلوري لتقييم مدى الورم بعناية ، مما يضمن عدم غزو الأنسجة المجاورة أو التصاقات كبيرة.
- قم بتشريح الأنسجة الضامة بين الحد السفلي للكبد الأيمن والصفاق الخلفي والكلية اليمنى باستخدام مشرط متناسق. التقدم بشكل متفوق تشريح الأربطة المثلثة والتاجية اليمنى ، وبالتالي تعريض التهاب الكبد البوتا الثاني.
- استخدام ملقط منقار البط لسحب الكبد إلى اليسار لكشف الفص الأيمن بالكامل.
- استخدم وضع التصوير الفلوري لتحديد الهامش بين الورم والأنسجة السليمة المجاورة بوضوح.
- ضع علامة على خطوط دليل الاستئصال على بعد حوالي 1-2 سم من هامش الورم باستخدام خطاف كي أحادي القطب.
- توقف تدفق الأوعية الدموية مؤقتا من الوريد البابي والشريان الكبدي لتقليل النزيف أثناء الجراحة. شد العاصبات في دورات من 15 دقيقة انسداد متبوعة ب 5 دقائق من إعادة التروية.
- قم بتمرير حمة الكبد بعناية على طول خطوط التوجيه باستخدام المشرط التوافقي. تخثر القنوات الصفراوية الصغيرة والأوعية باستخدام المشرط ، وقم بالتثبيت أولا ثم قم بتقطيع الهياكل الأكبر.
- بعد استئصال عينة الورم ، أرسلها للتقييم النسيجي المرضي.
- اشطف سطح القطع الكبدي بمحلول ملحي عادي دافئ ، متبوعا بتحقيق الإرقاء مع التخثر ثنائي القطب. استخدم خياطة قابلة للامتصاص لإغلاق جميع الشقوق. أقام المريض في المستشفى بعد الجراحة لمدة 10 أيام. للتحكم في الألم بعد الجراحة، يتم تطبيق الترامادول عن طريق الحقن العضلي.
- متابعة ما بعد استئصال الكبد
- للكشف الفوري عن أي تكرار محتمل بعد الجراحة أو آفات نقيلية ، قم بإجراء فحوصات المتابعة شهريا لأول 3 أشهر بعد الجراحة. بعد هذه الفترة ، قم بجدولة الفحوصات كل 3 أشهر لمدة عامين ثم كل 6 أشهر لمدة 3 سنوات لاحقة ، حتى ما مجموعه 5 سنوات بعد الجراحة.
النتائج
كشف التصوير بالرنين المغناطيسي عن انخفاض في حجم الكبد ، وسطح كبد متموج ، واتساع شقوق الكبد لدى المرضى في هذه الدراسة. تم تحديد كتلة كروية تقريبا ، بقياس حوالي 7.2 سم × 5.6 سم × 6.6 سم ، في الفص الخلفي الأيمن للكبد. أظهرت الكتلة إشارات منخفضة مختلطة على التصوير المرجح T1 (T1WI) ، وإشارات عالية مختلطة على التصوير المرجح T2 (T2WI) ، وإشارات عالية على التصوير المرجح بالانتشار (DWI). أظهرت حدودا واضحة وتحسينا غير متجانس للطور الشرياني ، مما يشير إلى إمكانية تليف الكبد وسرطان الكبد (الشكل 1).
أثناء مناورة القسطرة ، تم إجراء تقييم تصوير الأوعية الدموية لتأكيد عدم وجود أوعية تغذية للورم تنشأ من الشريان الأورطي البطني والشرايين الحجابية والشريان المساريقي العلوي. في تصوير الأوعية الدموية في أصل الجذع البطني ، أظهر الفرع القطعي للشريان الكبدي الأيمن (S6 أو الفرع السفلي الأيمن) التواء والتمدد الواضح. أثبتت هذه الملاحظة أن الورم الكبدي تلقى إمدادات الأوعية الدموية حصريا من هذا الفرع الشرياني الفردي (الشكل 2 أ). يتضمن التقييم المسبق التأسيسي ل Y-90 TARE رسم خرائط الاختبارات باستخدام نضح Tc-99m MAA ، واستغلال توزيع الجرعة المماثل بين الكريات المجهرية Tc-99m MAA و Y-90. بعد حقن Tc-99m MAA ، تم تحديد منطقة التروية ل Tc-99m MAA ، مع حجم التروية المحسوب للورم المستهدف هو 246.27 مل (الشكل 2 أ). المرضى الذين يظهرون LSF أكبر من 20٪ معرضون لخطر متزايد لتلف الرئة الناجم عن الإشعاع ، مما يجعلهم عادة غير مناسبين لعلاج Y-9022. يشير TNR المتزايد إلى تأثير أكثر فعالية في مبيد للأورام مع الالتزام بجرعة إشعاع الكبد القصوى المسموح بها. بلغ LSF المحسوب 17.17٪ ، وتم تسجيل TNR عند 8.2 (الشكل 2 ب).
يوفر نموذج التقسيم ، بالمقارنة مع طرق جرعة الإشعاع الداخلي الطبية (MIRD) ومساحة سطح الجسم (BSA) ، تقديرا ممتازا لجرعة الإشعاع الشخصية من خلال تحليل TNR ، مما يعزز تخطيط العلاج الفردي. تشير نتائج نموذج التقسيم إلى جرعات إشعاعية تبلغ 36.6 Gy للكبد الطبيعي (أقل من عتبة 40 Gy) ، و 17.6 Gy لأنسجة الرئة (ضمن حد 20 Gy) ، وجرعة ذروة تبلغ 300 Gy للورم ، مما يستلزم نشاط الكرة المجهرية Y-90 البالغ 1.36 جيجابايت (الشكل 3 أ). بعد العلاج بالفارغ الفارغ ل Y-90 (الشكل 3 ب) ، تم إجراء فحص التصوير المقطعي بالإصدار البوزيتروني / التصوير المقطعي المحوسب ، مما يشير إلى عدم وجود انتشار خارج الهدف أو تناقضات في التغطية (الشكل 3 ج).
في شهر واحد بعد علاج Y-90 TARE ، تم تقليل الورم إلى 6 سم ، وانخفض مستوى AFP إلى 21،155 نانوغرام / مل. بعد 3 أشهر من العلاج ، لم يظهر الورم أي تغييرات كبيرة. نظرا لاستمرار ارتفاع خطر التكرار ، بدأ العلاج بمثبط PD-1. بعد 5 أشهر من العلاج ب Y-90 TARE (بعد شهرين من بدء العلاج بمثبطات PD-1) ، انخفضت الآفة إلى 4 سم ، وانخفض مستوى AFP بشكل كبير إلى 1.84 نانوغرام / مل (الشكل 4 والجدول 1).
يتم عرض صور للورم أثناء استئصال الكبد تحت كل من الضوء الأبيض والمضان (الشكل 5 أ). تم تحويل عينات الورم التي تم الحصول عليها من استئصال الكبد إلى أقسام مجمدة لعلم الأمراض الجسيم. عند فحصها مجهريا ، كشفوا عن عدم وجود خلايا سرطانية ، وترسب كريات Y-90 المجهرية ، وتسلل الخلايا الليمفاوية الكبيرة ، وتليف الكبد في أنسجة الكبد الطبيعيةالمجاورة 23 (الشكل 5 ب). بعد 12 شهرا من العملية ، تم إجراء المتابعة وتقييم التكرار ، مع تصوير التصوير بالرنين المغناطيسي الذي يشير إلى عدم وجود دليل على التكرار أو ورم خبيث (الشكل 5 ج).
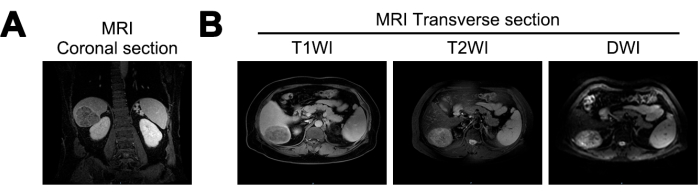
الشكل 1: التصوير بالرنين المغناطيسي (MRI) عند التشخيص الأولي. (أ) القسم الإكليلي لإشارة التصوير الموزون بالرنين المغناطيسي T1 (T1WI) ، (ب) المقاطع العرضية للتصوير بالرنين المغناطيسي T1WI ، والتصوير المرجح T2 (T2WI) ، وإشارات التصوير المرجح بالانتشار (DWI). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
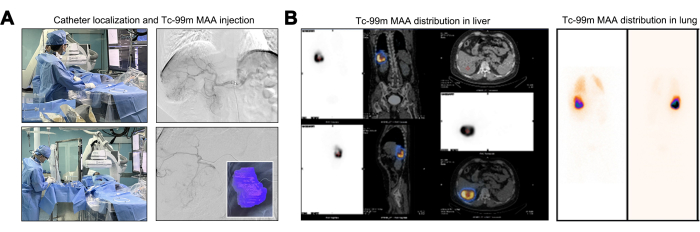
الشكل 2: حقن وتوزيع الألبومين الكبير المجمعة Technetium-99m (Tc-99m MAA). (أ) رسم توضيحي لعملية حقن الألبومين الكبير المجمعة Technetium-99m (Tc-99m MAA). (ب) عرض توزيع الجرعة ل 99mTc MAA في الكبد. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
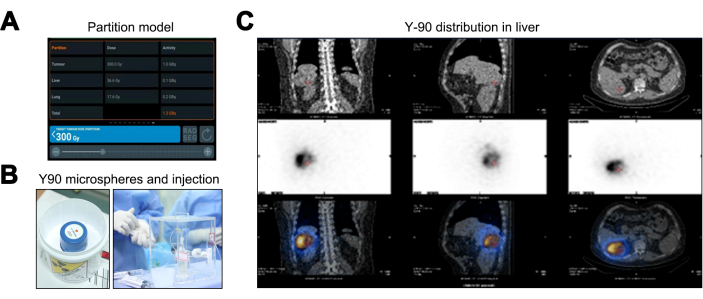
الشكل 3: عملية علاج الانصمام الإشعاعي عبر الشرايين Yttrium-90 (Y-90 TARE). (أ) تصوير البيانات المحسوبة باستخدام نموذج القسم. (ب) تعبئة وحقن الكريات المجهرية Y-90. (ج) التصوير المقطعي المحوسب بإصدار فوتون واحد / التصوير المقطعي المحوسب (SPECT / CT) للتحقق من صحة توزيع جرعة الكريات المجهرية Y-90. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
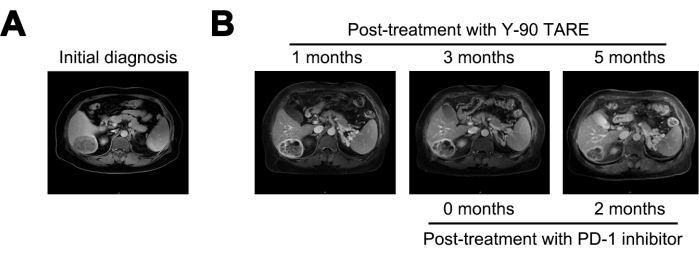
الشكل 4: مقارنة الورم. (أ) عرض صورة التصوير بالرنين المغناطيسي عند التشخيص الأولي ، بينما (ب) يعرض صور التصوير بالرنين المغناطيسي بعد 1 و 3 و 5 أشهر بعد العلاج باستخدام Y-90 TARE. تم إجراء العلاج بمثبطات موت الخلايا المبرمج -1 (PD-1) بعد 3 أشهر من Y-90 TARE. خضع المريض للعلاج بمثبط PD-1 بعد 3 أشهر من إجراء Y-90 TARE. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
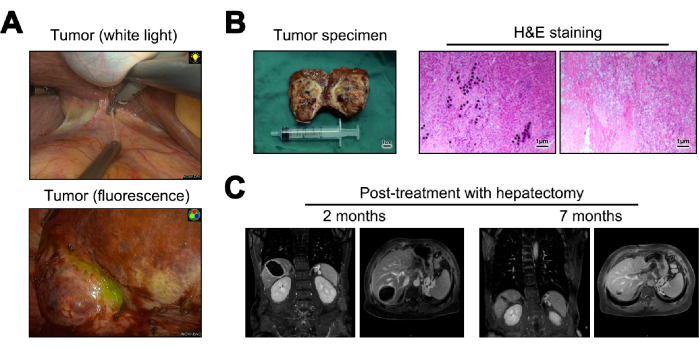
الشكل 5: استئصال الكبد والمتابعة اللاحقة. (أ) عرض الورم الذي لوحظ أثناء الجراحة. (ب) رسم توضيحي لعينة الورم بعد الجراحة وتلوين الهيماتوكسيلين والإيوسين (H & E). (ج) صور التصوير بالرنين المغناطيسي بعد 2 و 12 شهرا من الجراحة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| ما بعد العلاج باستخدام Y-90 TARE | |||||
| التشخيص الأولي | 1 أشهر | 3 أشهر | 5 أشهر | ||
| AFP (نانوغرام/مل) | 66840 | 21155 | 19535 | 1.84 | |
الجدول 1: قياس مستوى AFP بعد العلاج.
Discussion
بالنسبة لمرضى سرطان الكبد الذين يعانون من عوامل تكرار عالية الخطورة ، يستمر التشخيص السلبي حتى بعد استئصال الكبد العلاجي ، مما يؤكد أهمية العلاج المساعد الجديد الفعال لتعزيز معدلات البقاء على قيد الحياة24،25. بالنسبة للعلاجات التداخلية ، يتميز Y-90 TARE بمعدل تحكم محلي فائق26. في حين أن Y-90 TARE يمكن أن ينشط استجابة الجسم المضادةللورم 22 ، لم يتم الإبلاغ بعد عن الاستخدام المشترك ل Y-90 مع مثبطات PD-1 في العلاج المساعد الجديد لسرطان الكبد. تستعرض هذه الدراسة بأثر رجعي حالة من المساعد الجديد Y-90 TARE متبوعا بعلاج الأجسام المضادة أحادية النسيلة المضادة ل PD-1 في مريض سرطان الكبد مع عوامل تكرار عالية الخطورة وحققوا مغفرة كاملة. يقدم بروتوكول علاج مفصل للرجوع إليه.
هناك عدة نقاط رئيسية في بروتوكول هذه الدراسة تستحق الاهتمام. أولا ، نظرا لإمكانية تدهور وإعادة توزيع MAA99 ، يجب إجراء التصوير المقطعي المحوسب / التصوير المقطعي المحوسب في غضون 1-2 ساعة بعد حقن MA99. ثانيا ، من الضروري حساب جرعة الكريات المجهرية Y-90 بدقة لمنع التنسيب خارج الرحم والجرعة الزائدة ، مما قد يؤدي إلى تلف كبدي ورئوي. أخيرا ، بالنظر إلى الجراحة اللاحقة للمساعدة الجديدة ، قد يكون الاستئصال غير التشريحي الذي يضمن هوامش واضحة هو الأفضل لتقصير مدة الجراحة وتقليل تثبيط المناعة المرتبط بالجراحة.
في هذه الدراسة ، أظهر المريض أعراض اضطرابات النوم والإمساك بعد العلاج المساعد الجديد. تم تناول هذه باستخدام eszopiclone لاضطرابات النوم وأقراص bisacodil معوية مغلفة للإمساك. يشير هذا إلى أن ردود الفعل السلبية المتعلقة بمثبطات Y-90 TARE و PD-1 ضئيلة ويمكن إدارتها دوائيا. علاوة على ذلك ، لم يحفز مثبط Y-90 TARE و PD-1 وذمة أنسجة الكبد أو آفة أو الالتصاق الشديد أو زيادة الهشاشة ، والتي يمكن أن تؤدي الأخيرة إلى نزيف كبير أو استئصال غير مكتمل أثناء الاستئصال الجراحي اللاحق. وبالتالي ، لم يتداخل Y-90 TARE مع الإجراءات الجراحية اللاحقة أو يؤثر عليها.
بناء على مستويات AFP والتغيرات في الآفة ، قمنا بإجراء علاج الأجسام المضادة أحادية النسيلة المضادة ل PD-1 بالتتابع بعد Y-90 TARE. بعد 5 أشهر ، حققت الآفة استجابة مرضية كاملة (pCR) ، مما يشير إلى أن توقيت واختيار العلاج كانا مناسبين. يمكن أن يؤدي تعديل استراتيجية العلاج قبل متوسط فترة الاستجابة في Y-90 TARE إلى تقليل خطر تطور المرضبشكل فعال 27. ومع ذلك ، على الرغم من أن درجة حل الآفة ترتبط ارتباطا واضحا باستئصال السرطان الكبدي بعد البقاء على قيد الحياة28 ، إلا أن ما إذا كان التدخل الجراحي اللاحق له ما يبرره لحالات pCR الناجم عن Y-90 TARE يظل موضوعا لمزيد من التحقيق. إلى جانب ذلك ، لا يزال يتعين التحقق من صحة التوقيت والجرعة المثلى لعلاج الأجسام المضادة أحادية النسيلة Y-90 TARE ومكافحة PD-1 ، بالإضافة إلى أفضل توقيت ونهج للجراحة اللاحقة. بالإضافة إلى ذلك ، قد تفرض التكلفة العالية لعملية العلاج بأكملها عبئا ماليا كبيرا على المرضى.
يفترض أن حدوث pCR بعد العلاج بمثبطات Y-90 TARE و PD-1 في حالتنا يرتبط بعدة عوامل في الدراسة الحالية. في البداية ، يتم النظر في جرعة الإشعاع داخل الورم. استخدمنا منهجية تقليدية تعتمد على Tc-99m MAA (نموذج التقسيم) لتقييم جرعة العلاجY-90 24. والجدير بالذكر أنه بسبب ارتفاع TNR للمريض ، كانت جرعة الإشعاع التي تتخلل الآفة في هذه الدراسة مرتفعة ، حيث غطت الكريات المجهرية Y-90 الورم بشكل شامل ، وبالتالي تحقيق تأثير علاجي. ثانيا ، لا يمكن التغاضي عن التسلل الكبير للخلايا المناعية داخل الورم ، مما يشير إلى دور محوري للمناعة المضادة للورم للمريض تجاه pCR. بالنظر إلى أن هذا كان التشخيص الأولي للمريض وأن الورم لم يكن في مرحلة متقدمة ، استمرت المناعة الجوهرية المضادة للورم. بعد موت الخلايا السرطانية الناجم عن مثبط Y-90 TARE و PD-1 ، قد يتم تشغيل استجابة التهابية ، مما يعزز التعرض لمستضد الورم ، وينشط مناعة المضيف المضادة للورم ، ويبلغ ذروته في تسلل الخلايا المناعية وما يترتب على ذلك من عمل مبيد للأورام29. بالإضافة إلى ذلك ، اكتشف بحثنا السابق وجود علاقة بين التهاب الكبد حول الورم ومقاومة الورم ، مما قد يؤدي إلى تفاقم تحمل المناعة الكبدية30،31. على الرغم من وجود تغيرات تليف الكبد في الأنسجة المحيطة بالورم للمريض في هذه الدراسة ، إلا أنه لم يلاحظ أي استجابة التهابية كبيرة ، وكانت جميع الفحوصات المتعلقة بالتهاب الكبد B غير ملحوظة. يشير هذا إلى أن البيئة المكروية المناعية الكبدية للمريض تنتمي إلى مجموعة فرعية يمكن تعديلها ، حيث يمثل مثبط Y-90 TARE و PD-1 استراتيجية حاسمة في تعزيز البيئة المكروية المناعية الكبدية.
يتطلب تنفيذ علاج Y-90 TARE شروطا صارمة وجهودا تعاونية عبر أقسام متعددة ، بما في ذلك الطب النووي والأشعة التداخلية وجراحة الكبد الصفراوية والتصوير والأورام. تؤكد احتمالية حدوث مضاعفات ناتجة عن الإشعاع مثل الالتهاب الرئوي وقرحة المعدة والتهاب البنكرياس الحاد الحاجة إلى حسابات دقيقة للجرعة. يمكن لتقييمات المحاكاة قبل الجراحة وتقديرات الجرعات التي أجراها قسم الطب النووي إطالة دورة علاج Y90 TARE ، مما قد يؤدي إلى تطور الورم. قد لا يكون Y90 TARE مناسبا لجميع سرطانات الكبد ، خاصة تلك التي تعاني من نقائل متعددة داخل الكبد وسرطانات الكبد المنتشرة أو صغيرة القطر (<0.5 سم) ، بسبب التحديات في التمييز بين مناطق الورم وأنسجة الكبد الطبيعية ، مما قد يؤدي إلى سوء تقدير الجرعة. التقارير حول استخدام Y90 بالتزامن مع مثبطات PD-1 للعلاج المساعد الجديد في سرطان الخلايا الكبدية محدودة. لا تزال هناك حاجة إلى دراسات سريرية واسعة النطاق لإثبات فعاليتها وتفاصيلها العلاجية.
باختصار ، يقدم الجمع بين Y-90 TARE ومثبط PD-1 نهجا آمنا وفعالا للعلاج المساعد الجديد لمرضى سرطان الكبد. لا تخفف هذه الاستراتيجية من عبء الورم الموضعي وتقلل من النقائل الدقيقة إلى أقصى حد ممكن فحسب ، بل تفعل ذلك أيضا دون زيادة خطر تطور المرض. وبالتالي ، فإنه يحمل القدرة على تمديد فترة التكرار بعد الجراحة للمرضى. نحن نقدم بروتوكولا قابلا للتكرار وممكنا للعلاج المساعد الجديد للمرضى الذين يعانون من سرطان الكبد عالي الخطورة.
Disclosures
ويعلن المؤلفون أن البحث أجري في غياب أي علاقات تجارية أو مالية يمكن تفسيرها على أنها تضارب محتمل في المصالح.
Acknowledgements
تم تمويل هذه الدراسة من قبل المؤسسة الوطنية للعلوم الطبيعية في الصين (82303287) ، ومؤسسة قوانغدونغ للبحوث الأساسية والتطبيقية (2021A1515110083) ، ومشاريع العلوم والتكنولوجيا في قوانغتشو (202201010267) ، وصناديق البحوث الأساسية للجامعات المركزية (21621058).
Materials
| Name | Company | Catalog Number | Comments |
| ARTIS pheno Cutting-edge robotic imaging system | SIEMENS HEALTHINEERS | 10849000 | |
| DISPOSABLE LAPAROSCOPIC INSTRUMENT | Hangzhou Kangji Medical Instruments | 108Y series | |
| Endoscopic fluorescence camera system | Stryker | PC9000 | |
| ENSEAL G2 Curved Tissue Sealer | Ethicon from Johnson | NSLG2C14 | |
| Fluorescent laparoscopic lens | Stryker | SC9534 | |
| laparoscopic stapler | Ethicon from Johnson | PCEE45A | |
| Optima NM/CT 640 SPECT/CT | GE healthcare | 200439 | |
| SURGICEL FIBRILLAR Hemostat | Ethicon from Johnson | 1962 | |
| Tc-99m macroaggregated albumin [MAA](DAXIMAGE-MAA) | JUBILANT RADIOPHARMA | 877003-93-5 | |
| Tislelizumab Injection(PD-1 inhibitor) | BeiGene, Ltd | 10-848 | |
| ultrasound knife | Ethicon from Johnson | HARHD36 | |
| Xeleris Functional Imaging Workstation | GE healthcare | 5436592-22 | |
| Y-90 resin microspheres(SIR-Spheres) | Sirtex Medical Limited | SIR-Y001 |
References
- Su, H., et al. Molecular mechanism of CK19 involved in the regulation of postoperative recurrence of HBV-associated primary hepatocellular carcinoma in Guangxi. Ann Transl Med. 9 (24), 1780(2021).
- Zheng, R., et al. Cancer incidence and mortality in China, 2016. J Natl Cancer Center. 2 (1), 1-9 (2022).
- Sung, H., et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA. 71 (3), 209-249 (2021).
- Heimbach, J. K., et al. AASLD guidelines for the treatment of hepatocellular carcinoma. Hepatology (Baltimore, Md.). 67 (1), 358-380 (2018).
- Sato, T., et al. A prospective study of fully covered metal stents for different types of refractory benign biliary strictures. Endoscopy. 52 (5), 368-376 (2020).
- Zhou, H., Song, T. Conversion therapy and maintenance therapy for primary hepatocellular carcinoma. Biosci Trends. 15 (3), 155-160 (2021).
- Xu, X. F., et al. Risk factors, patterns, and outcomes of late recurrence after liver resection for hepatocellular carcinoma. JAMA Surg. 154 (3), 209-217 (2019).
- Song, T., Lang, M., Ren, S., Gan, L., Lu, W. The past, present, and future of conversion therapy for liver cancer. Am J Cancer Res. 11 (10), 4711-4724 (2021).
- Sangro, B., Salem, R., Kennedy, A., Coldwell, D., Wasan, H. Radioembolization for hepatocellular carcinoma: A review of the evidence and treatment recommendations. Am J Clin Oncol. 34 (4), 422(2011).
- Chinese Medical Doctor Association, Clinical Guidelines Committee of Chinese College of Interventionalists, Chinese Research Hospital Association, Society for Hepatopancreatobiliary Surgery. Expert consensus on the standardized procedure of selective internal radiation therapy with Yttrium-90 microspheres for liver malignancies (2024 edition). Zhonghua Yi Xue Za Zhi. 104 (7), 486-498 (2024).
- Vilgrain, V., et al. Efficacy and safety of selective internal radiotherapy with yttrium-90 resin microspheres compared with sorafenib in locally advanced and inoperable hepatocellular carcinoma (SARAH): an open-label randomised controlled phase 3 trial. Lancet Oncol. 18 (12), 1624-1636 (2017).
- Villalobos, A., et al. Safety and efficacy of concurrent Atezolizumab/Bevacizumab or Nivolumab combination therapy with Yttrium-90 radioembolization of advanced unresectable hepatocellular carcinoma. Curr Oncol (Toronto, Ont.). 30 (12), 10100-10110 (2023).
- Kulik, L. M., et al. Safety and efficacy of 90Y radiotherapy for hepatocellular carcinoma with and without portal vein thrombosis. Hepatology (Baltimore, Md.). 47 (1), 71-81 (2008).
- Singh, P., Anil, G. Yttrium-90 radioembolization of liver tumors: what do the images tell us. Cancer Imaging. 13 (4), 645(2013).
- Kim, Y. C., et al. Radiation safety issues in Y-90 microsphere selective hepatic radioembolization therapy: Possible radiation exposure from the patients. Nuc Med Mol Imag. 44 (4), 252-260 (2010).
- Kennedy, A., et al. Recommendations for radioembolization of hepatic malignancies using yttrium-90 microsphere brachytherapy: a consensus panel report from the radioembolization brachytherapy oncology consortium. Int J Radiation Oncol, Biol, Phys. 68 (1), 13-23 (2007).
- Molvar, C., Lewandowski, R. Yttrium-90 radioembolization of hepatocellular carcinoma-performance, technical advances, and future concepts. Semin Intervent Radiol. 32 (4), 388-397 (2015).
- Aliseda, D., et al. Liver resection and transplantation following Yttrium-90 radioembolization for primary malignant liver tumors: A 15-year single-center experience. Cancers. 15 (3), 733(2023).
- Wehrenberg-Klee, E., Goyal, L., Dugan, M., Zhu, A. X., Ganguli, S. Y-90 radioembolization combined with a PD-1 inhibitor for advanced hepatocellular carcinoma. Cardiovas Intervent Radiol. 41 (11), 1799-1802 (2018).
- Maleux, G., et al. Predictive factors for adverse event outcomes after transarterial radioembolization with Yttrium-90 resin microspheres in Europe: Results from the prospective observational CIRT study. Cardiovas Intervent Radiol. 46 (7), 852-867 (2023).
- Lencioni, R., Llovet, J. M. Modified RECIST (mRECIST) assessment for hepatocellular carcinoma. Semin Liver Dis. 30 (1), 52-60 (2010).
- Yu, Q., Khanjyan, M., Fidelman, N., Pillai, A. Contemporary applications of Y90 for the treatment of hepatocellular carcinoma. Hepatol Comm. 7 (10), e0288(2023).
- Zhou, J., et al. Guidelines for the diagnosis and treatment of primary liver cancer (2022 Edition). Liver Cancer. 12 (5), 405(2023).
- Pasciak, A. S., Erwin, W. D. Effect of voxel size and computation method on Tc-99m MAA SPECT/CT-based dose estimation for Y-90 microsphere therapy. IEEE Trans Med Imag. 28 (11), 1754-1758 (2009).
- Sun, H. C., Zhu, X. D. Downstaging conversion therapy in patients with initially unresectable advanced hepatocellular carcinoma: An overview. Front Oncol. 11, 772195(2021).
- Dhondt, E., et al. 90Y radioembolization versus drug-eluting bead chemoembolization for unresectable hepatocellular carcinoma: Results from the TRACE phase II randomized controlled trial. Radiology. 303 (3), 699-710 (2022).
- Taswell, C. S., et al. For hepatocellular carcinoma treated with Yttrium-90 microspheres, dose volumetrics on post-treatment Bremsstrahlung SPECT/CT predict clinical outcomes. Cancers. 15 (3), 645(2023).
- Xu, L., Chen, L., Zhang, W. Neoadjuvant treatment strategies for hepatocellular carcinoma. World J Gastrointes Surg. 13 (12), 1550-1566 (2021).
- Chew, V., et al. Immune activation underlies a sustained clinical response to Yttrium-90 radioembolisation in hepatocellular carcinoma. Gut. 68 (2), 335-346 (2019).
- Jiang, Y., et al. Inflammatory microenvironment of fibrotic liver promotes hepatocellular carcinoma growth, metastasis and sorafenib resistance through STAT3 activation. J Cell Mol Med. 25 (3), 1568-1582 (2021).
- Jiang, Y., et al. TANK-binding kinase 1 (TBK1) serves as a potential target for hepatocellular carcinoma by enhancing tumor immune infiltration. Front Immunol. 12, 612139(2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved