Method Article
Radioembolisation à l’y-90 et inhibiteur de-1 comme traitement néoadjuvant dans le carcinome hépatocellulaire
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Cette étude illustre le potentiel méthodologique de la combinaison de la radioembolisation transartérielle à l’yttrium-90 (Y-90 TARE) avec un anticorps monoclonal anti--1 en tant que stratégie néoadjuvante efficace conduisant à l’hépatectomie chez les patients atteints d’un carcinome hépatocellulaire (CHC) présentant un risque initial élevé de récidive. Il met l’accent sur la sécurité, la faisabilité et l’orientation procédurale étape par étape de cette approche.
Résumé
Cette étude présente un protocole de traitement complet pour les patients atteints d’un carcinome hépatocellulaire (CHC) à haut risque, en mettant l’accent sur l’utilisation combinée de la radioembolisation transartérielle à l’y-90 (TARE) et des inhibiteurs de la mort cellulaire programmée-1 (-1) comme traitement néoadjuvant. Mis en évidence par le biais d’un rapport de cas, il offre une référence étape par étape pour des interventions thérapeutiques similaires. Une analyse rétrospective a été réalisée sur un patient ayant subi une hépatectomie après un traitement par TARE à l’y-90 et un inhibiteur de-1. Des détails démographiques et cliniques clés ont été enregistrés à l’admission pour guider le choix du traitement. L’adéquation au TARE pour l’y-90 et le calcul de la posologie ont été basés sur des tests de cartographie de perfusion d’albumine macroagrégée (MAA) en technétium-99m (Tc-99m). La couverture des lésions par les microsphères Y-90 a été confirmée par l’imagerie de fusion par tomographie par émission de photons uniques et tomodensitométrie (SPECT/CT), et les effets indésirables et les résultats du suivi ont été méticuleusement documentés. Le patient, avec un CHC de 7,2 cm dans le lobe hépatique droit (T1bN0M0, BCLC A, CNLC Ib) et un taux initial d’alpha-fœtoprotéine (AFP) de 66 840 ng/mL, a opté pour la TARE Y-90 en raison d’un risque élevé de récidive et d’un refus initial de la chirurgie. Les paramètres de la thérapie, y compris la fraction de dérivation pulmonaire (LSF) et le rapport non tumoral (TNR), étaient dans les limites thérapeutiques. Au total, 1,36 GBq Y-90 a été administré. 1 mois après le traitement, la tumeur a rétréci à 6 cm avec nécrose partielle, et les niveaux d’AFP ont chuté à 21 155 ng / mL, restant stables pendant 3 mois. Après 3 mois, le traitement par inhibiteur de-1 a entraîné une réduction supplémentaire de la tumeur à 4 cm et une diminution de l’AFP à 1,84 ng/mL. Le patient a ensuite subi une hépatectomie ; L’histopathologie a confirmé une nécrose tumorale complète. À 12 mois après l’opération, aucune récidive tumorale ou métastase n’a été observée lors des séances de suivi. Ce protocole démontre l’efficacité de la combinaison de TARE Y-90 et d’inhibiteur de-1 comme stratégie de transition vers la chirurgie pour les patients atteints de CHC à haut risque de récidive, fournissant un guide pratique pour la mise en œuvre de cette approche.
Introduction
Le carcinome hépatocellulaire (CHC) représente 85 à 90 % des cas de cancer primitif du foie dans le monde et est une tumeur maligne prévalente du système digestif1 . Le problème est encore plus grave en Chine, où le CHC se classe au4e rang des tumeurs malignes les plus courantes et au deuxième rang des causes de mortalité liée au cancer 2,3. Ce défi est aggravé par le taux élevé de récidive après l’hépatectomie, observé chez un sous-ensemble significatif de patients dans les 2 ans. Ces récidives évoluent souvent vers des formes thérapeutiquement résistantes et agressivement malignes, conduisant rapidement à des issues fatales. Par conséquent, l’atténuation de la récidive post-hépatectomie est cruciale pour prolonger les taux de survie chez les patients atteints de CHC 4,5.
Le traitement néoadjuvant fait référence à un ensemble complet de traitements effectués avant la chirurgie, visant à augmenter le taux d’ablation complète de la tumeur (résection R0), à éliminer les maladies micrométastatiques non visibles à l’imagerie, à réduire le risque de récidive postopératoire et à prolonger la survie à long terme du patient6. Il est particulièrement approprié pour les patients atteints de CHC présentant des facteurs de risque élevés, notamment une résection non anatomique, une invasion vasculaire microscopique, des taux sériques élevés d’AFP supérieurs à 32 ng/mL, des dimensions tumorales supérieures à 5 cm, des tumeurs multiples et une cirrhose sous-jacente7. Le répertoire de la thérapie néoadjuvante englobe diverses techniques telles que la chimioembolisation artérielle transcathéter (TACE), la chimiothérapie par perfusion artérielle hépatique (HAIC) et la radiothérapie interne sélective (SIRT). Celles-ci sont souvent intégrées à des immunothérapies ciblées, appliquées seules ou en combinaison8.
La radioembolisation transartérielle à l’yttrium-90 (Y-90 TARE), une forme spécialisée de radiothérapie interne sélective (SIRT), constitue une option de traitement importante pour les cancers primitifs du foie inopérables et les métastases hépatiques. Réputé pour ses taux de contrôle local exceptionnels, Y-90 TARE excelle en délivrant des rayonnements β ciblés à forte dose directement sur le site de la tumeur, tandis que sa distance de pénétration moyenne limitée de seulement 2,5 mm aide à protéger les tissus sains adjacents9. La radiothérapie interne sélective aux microsphères d’yttrium 90 (90Y-SIRT) est utilisée cliniquement dans le traitement des tumeurs malignes du foie depuis plus de 50 ans depuis 1970, avec une application clinique à grande échelle confirmée depuis plus de deux décennies10. Son innocuité et son efficacité ont été prouvées depuis son approbation en Europe et aux États-Unis au siècle dernier. La radiothérapie à l’yttrium-90 est menée à l’échelle internationale depuis plusieurs décennies, ce qui a permis d’obtenir des données cliniques abondantes 11,12,13. De plus, l’yttrium-90, un élément radioactif synthétique classé 39e dans le tableau périodique, émet des rayons bêta de haute pureté à haute énergie. Il a une demi-vie courte (64,2 heures) et une distance de pénétration tissulaire limitée, éliminant ainsi le besoin d’isolement post-opératoire 14,15,16. De plus, la technologie vasculaire et les produits de décomposition sont inoffensifs pour le corps humain15,17. Parallèlement, les anticorps monoclonaux anti--1 rajeunissent le potentiel cytotoxique des cellules immunitaires contre les cellules cancéreuses. Avec des profils immunitaires plus robustes observés chez les patients atteints de CHC à un stade précoce, les inhibiteurs de-1 sont de plus en plus utilisés dans les contextes néoadjuvants. Sur le plan fonctionnel, ces anticorps monoclonaux-1 améliorent la mort cellulaire immunogène induite par Y-90 TARE, renforçant ainsi la capacité du système immunitaire à reconnaître et à éliminer les cellules tumorales. Le mécanisme de Y-90 TARE implique la destruction directe des cellules tumorales par β-rayonnement, qui traite l’hétérogénéité tumorale et l’évasion immunitaire, augmentant ainsi l’impact des anticorps monoclonaux-1. Cependant, il est important de noter qu’à l’heure actuelle, les études approfondies sur l’utilisation combinée de l’Y-90 TARE et des inhibiteurs de-1 dans le traitement néoadjuvant sont relativement rares 18,19,20.
Cette étude de cas sert de guide pratique, démontrant le processus, l’innocuité et le potentiel de l’Y-90 TARE combiné à l’inhibiteur de-1 en tant que traitement néoadjuvant conduisant à l’hépatectomie. En procédant à une évaluation rétrospective d’un patient atteint de CHC traité par ce traitement néoadjuvant suivi d’une hépatectomie, nous détaillons les étapes thérapeutiques, gérons les événements indésirables et évaluons les résultats. Nos résultats visent à fournir un plan complet aux cliniciens dans l’application de la thérapie par TARE à l’y-90 et l’inhibiteur de-1 dans la prise en charge des patients atteints de CHC à haut risque.
PRÉSENTATION DE CAS :
Le patient, un homme de 49 ans, mesurait 168 cm, pesait 62 kg et avait un volume hépatique total (VOI) de 1236 ml, avec un volume tumoral de 157 ml et un volume de perfusion tumorale cible de 246 ml. Le volume pulmonaire total était de 2124 ml, avec une LSF de 17,17 % et un TNR de 8,2. Il avait un CHC de 7,2 cm dans le lobe hépatique droit (T1bN0M0, BCLC A, CNLC Ib) et un taux initial d’alpha-fœtoprotéine (AFP) de 66 840 ng/mL. L’ECOG-PS (Eastern Cooperative Oncology Group Performance Status) préopératoire du patient a été noté à 0. Il n’avait reçu aucun traitement pharmacologique avant d’opter pour le TARE à l’yt-90, qui avait été choisi en raison d’un risque élevé de récidive et d’un refus initial de la chirurgie.
Protocole
La procédure de traitement a été approuvée par le conseil d’examen institutionnel du premier hôpital affilié de l’Université de Jinan. Le consentement éclairé a été obtenu auprès du participant inclus dans l’étude.
1. Sélection des patients pour le traitement néoadjuvant
- Critères d’inclusion
- Sélectionner les patients présentant des lésions susceptibles d’une ablation chirurgicale complète (résection R0).
- Sélectionnez des patients présentant des facteurs de risque élevés de récidive, notamment une résection non anatomique, une invasion vasculaire, des taux sériques élevés d’AFP supérieurs à 32 ng/mL, des dimensions tumorales supérieures à 5 cm, la présence de plusieurs tumeurs et une cirrhose sous-jacente.
- Critères d’exclusion
- Exclure les patients présentant des facteurs de récidive à haut risque qui nécessitent un traitement chirurgical au moment du diagnostic initial. Exclure les patients qui n’ont pas les moyens de se payer un traitement Y90.
2. Indications de l’Y-90 et évaluation de la dose
- Angiographie DSA pour déterminer l’apport sanguin tumoral
- Demandez au patient de s’allonger en décubitus dorsal pour la procédure. Effectuer la désinfection et le drapage de routine. Appliquez une solution de lidocaïne à 4 % localement au site de ponction de l’artère fémorale pour l’anesthésie.
- Respectez les procédures habituelles de lavage des mains, enfilez des vêtements chirurgicaux et portez des gants stériles.
- Insérez une aiguille de micropuncture dans l’artère fémorale commune droite en utilisant la technique Seldinger. Poursuivez avec la mise en place d’une gaine reliée à un système de chasse d’eau saline.
- Une fois que la ponction de l’artère fémorale et la mise en place du cathéter sont réussies (du sang artériel rouge vif est observé), faites avancer le cathéter angiographique vers le tronc cœliaque. Si l’imagerie suggère la présence de vaisseaux pourvoyeurs de tumeurs autres que l’artère hépatique, effectuez une angiographie sur l’artère mésentérique supérieure, l’artère infra-diaphragmatique, etc., afin d’identifier les vaisseaux tumoraux.
- Réaliser une angiographie à l’origine du tronc cœliaque pour déterminer si la tumeur hépatique est exclusivement alimentée par une branche solitaire de l’artère hépatique droite.
- Utilisez la technique du microcathéter coaxial pour un cathétérisme super sélectif sur la branche inférieure droite de l’artère hépatique droite. Effectuez une angiographie pour confirmer l’emplacement du vaisseau d’alimentation.
- Injection de technétium-99m (Tc-99m) MAA et imagerie
- Injecter 2 mCi de Tc-99m MAA à travers le microcathéter dans les artères d’alimentation.
REMARQUE : Cette procédure est effectuée conformément aux recommandations de l’American Association of Physicists in Medicine sur les procédures de dosimétrie, d’imagerie et d’assurance de la qualité pour la curiethérapie à microsphères 90Y dans le traitement des tumeurs malignes hépatiques. La posologie recommandée de Tc-99m MAA est fixée à 2-4 mCi (74-148 MBq)16. Il est important de noter que la posologie de Tc-99m MAA est fixe et ne varie pas en fonction du poids du patient, de la surface corporelle ou de la taille de la lésion. - Effectuer une tomodensitométrie à faisceau conique (CBCT) pour délimiter la région tumorale ciblée de la distribution intrahépatique du Tc-99m MAA. Délimitez manuellement la région sur les vues sagittale, coronale et axiale pendant la phase artérielle.
- Calculez le volume de la région tumorale ciblée à l’aide de l’option Propriétés SEG4 dans CBCT.
- Injecter 2 mCi de Tc-99m MAA à travers le microcathéter dans les artères d’alimentation.
- Calculs de dosimétrie des microsphères LSF, TNR et Y90
- Configurez les paramètres des modes de balayage (SPECT et CT) sur le scanner et effectuez une imagerie SPECT/CT sur le patient dans les 1 à 2 heures suivant la perfusion de Tc-99m MAA. Sélectionnez la fonction Fusion pour fusionner les images SPECT et CT afin de déterminer la distribution de la MAA Tc-99m dans le foie, les poumons et d’autres organes.
- Calculez la fraction de dérivation pulmonaire (LSF) à l’aide de l’imagerie planaire.
- Dessinez manuellement les régions d’intérêt (ROI), en marquant les zones distinctes du foie et des poumons où la distribution du Tc-99m MAA est discernable dans les vues antérieure et postérieure du foie, du poumon droit et du poumon gauche sur les images planes. Cette étape est effectuée par un technologue en médecine nucléaire.
REMARQUE : La fraction de dérivation pulmonaire (LSF) représente la fraction de 99mTc-MAA qui s’écoule du foie vers les deux poumons. À l’aide de l’imagerie planaire, le technologue en médecine nucléaire dessine manuellement les OI autour du foie et des poumons (séparément pour le poumon gauche et le poumon droit) dans les vues antérieure et postérieure. Le résultat du comptage de chaque pièce est ensuite obtenu à partir de ce poste de travail. - Calculez les chiffres pour chaque retour sur investissement à l’aide d’un poste de travail standard en médecine nucléaire. Utilisez la formule :
Nombre de poumons =
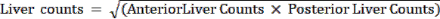
- Calculez la LSF à l’aide de l’équation :
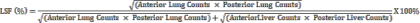
- Dessinez manuellement les régions d’intérêt (ROI), en marquant les zones distinctes du foie et des poumons où la distribution du Tc-99m MAA est discernable dans les vues antérieure et postérieure du foie, du poumon droit et du poumon gauche sur les images planes. Cette étape est effectuée par un technologue en médecine nucléaire.
- Calculez le rapport tumeur-foie normal (TNR) à l’aide de l’application de segmentation tridimensionnelle (3D) de l’imagerie SPECT/CT.
- Dessinez manuellement des zones d’intérêt discrètes de la même taille pour englober à la fois les zones tumorales et hépatiques normales sur la base des coupes de tomographie informatisée.
- Calculez le nombre moyen par unité de cellule de la tumeur par rapport au nombre moyen par unité de cellule du foie normal dans chaque retour sur investissement à l’aide d’une station de travail.
- Calculez le rapport TNR à l’aide de l’équation suivante :
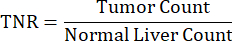
- Utilisez l’équation du modèle de partition dans le visualiseur de dose et d’activité pour l’application Y-90 RE (DAVYR) en fonction des résultats des calculs pour obtenir l’activité (Gbq) et la dose (Gy) prescrites.
3. Traitement de la tare à l’y-90
- Suivez l’approche décrite à l’étape 2, puis effectuez une angiographie directement sur les artères hématophones identifiées à l’étape 2.1.
- Comparez l’image angiographique actuelle avec celle de l’étape 2 pour confirmer plus précisément l’emplacement des artères d’alimentation.
- Faites avancer le cathéter vers les artères d’alimentation après un cathétérisme super sélectif, puis injectez les microsphères Y90, avec la dose et l’activité déjà calculées, dans les artères d’alimentation.
- Pour l’Y-90 TARE, obtenez des examens TEP/TDM dédiés du corps entier du thorax jusqu’au-dessus du bassin. Effectuez la TEP-TDM en utilisant les paramètres suivants : 80 s à 110 s, 120 kVp, 40 mA, rotation du tube de 1 s, collimation de coupe de 4 mm et une vitesse de lit de 8 mm/s (c’est-à-dire pas, 2).
- Évaluer le TNR à partir d’un retour sur investissement volumique tiré des images TEP/TDM, puis le comparer avec un TNR obtenu à partir des images SPECT/CT de la distribution MAA Tc-99m pour confirmer la distribution de Y-90.
- Lors de la distribution et de l’injection de microsphères Tc-99m MAA et Y-90, porter un équipement de protection approprié, comme des tabliers en plomb, des écrans oculaires et des gants en plomb.
- N’effectuez aucun traitement spécial après le traitement par Tare à l’Y-90 et demandez aux patients qui ont reçu un traitement par l’Y-90 d’éviter tout contact étroit avec d’autres personnes pendant 7 jours afin de minimiser le risque de radiation.
4. Traitement séquentiel par inhibiteur de-1 après un traitement par Y90
- Observer la stabilité des lésions pendant au moins 2 mois après le traitement par Y90. Utilisez des modalités d’imagerie appropriées pour une surveillance constante. Réévaluez le patient pour déterminer la présence de facteurs de risque élevé de récidive.
- Si des facteurs de risque élevés sont identifiés, évaluer l’aptitude du patient à l’immunothérapie, en s’assurant qu’il n’y a pas de contre-indications. Choisissez un inhibiteur de-1 approprié, comme le nivolumab ou le pembrolizumab, en fonction des considérations financières du patient.
- Administrez l’inhibiteur choisi en 1 à 2 cycles, chacun séparé de 21 jours. Administrer l’inhibiteur de-1, préparé à l’aide de 100 mL de solution saline physiologique à 2 mg/mL, par injection intraveineuse périphérique pendant 1 h, complétant ainsi un cycle de traitement par inhibiteur de-1.
- Évaluation et suivi post-traitement
- Après avoir terminé le traitement par inhibiteur de-1, des études d’imagerie de suivi et des études de marqueurs tumoraux identiques à celles utilisées avant le traitement.
- Évaluer la réponse mensuelle du patient au traitement par inhibiteur de-1 à l’aide des critères d’évaluation standard21.
5. Hépatectomie après Y90 TARE et inhibiteur de-1
- Décision d’hépatectomie : Évaluer le site de traitement à l’aide des mêmes techniques radiologiques que celles utilisées précédemment pour évaluer la stabilité de la lésion pendant au moins 2 mois après le traitement par inhibiteur de-1, en s’assurant qu’aucun facteur de risque élevé de récidive n’est présent.
- Préparations préopératoires pour l’hépatectomie : Pour définir avec précision les marges de résection tumorale et inspecter d’éventuelles lésions métastatiques, administrez du vert d’indocyanine au patient 3 jours avant l’opération.
- Intervention chirurgicale
- Effectuer une intubation trachéale pour une anesthésie générale sur le patient positionné en décubitus dorsal. Effectuer une désinfection chirurgicale de la région abdominale supérieure s’étendant en haut jusqu’à la ligne du mamelon, en dessous de la symphyse pubienne et latéralement en ligne axillaire médiane.
- En entrant dans la cavité péritonéale, utilisez un laparoscope pour effectuer une inspection approfondie du foie et des structures environnantes à la recherche d’anomalies ou de foyers métastatiques.
- Élevez le bord inférieur du foie droit avec des pinces pour exposer la tumeur située dans le segment 6 (S6) du foie.
- Après avoir injecté du vert d’indocyanine par voie intraveineuse, passez en mode d’imagerie par fluorescence pour évaluer soigneusement l’étendue de la tumeur, en veillant à ce qu’il n’y ait pas d’invasion dans les tissus adjacents ou d’adhérences significatives.
- Disséquez les tissus conjonctifs entre le bord inférieur du foie droit, le péritoine postérieur et le rein droit à l’aide d’un scalpel harmonique. Progression vers le haut en disséquant les ligaments triangulaires et coronaires droits, exposant ainsi la deuxième porte hépatienne.
- Utilisation d’une pince à bec de canard pour rétracter le foie vers la gauche afin d’exposer complètement le lobe droit.
- Utilisez le mode d’imagerie par fluorescence pour délimiter clairement la marge entre la tumeur et les tissus sains adjacents.
- Marquez les lignes de guidage de résection à environ 1-2 cm du bord de la tumeur à l’aide d’un crochet de cautérisation monopolaire.
- Interrompre temporairement l’afflux vasculaire de la veine porte et de l’artère hépatique pour réduire les saignements peropératoires. Serrez les garrots par cycles d’occlusion de 15 minutes suivis d’une reperfusion de 5 minutes.
- Transectez soigneusement le parenchyme hépatique le long des lignes guides avec le scalpel harmonique. Coagulez les petits canaux biliaires et les petits vaisseaux avec le scalpel, clampez d’abord, puis transectez les structures plus grandes.
- Après avoir excisé l’échantillon tumoral, envoyez-le pour une évaluation histopathologique.
- Rincer la surface coupée hépatique avec une solution saline normale chaude, suivie d’une hémostase avec coagulation bipolaire. Utilisez une suture résorbable pour fermer toutes les incisions. Le patient a été hospitalisé pendant 10 jours après l’opération. Pour la gestion de la douleur post-chirurgicale, administrer le tramadol par injection intramusculaire.
- Suivi post-hépatectomie
- Pour détecter rapidement toute récidive postopératoire potentielle ou lésions métastatiques, effectuez des examens de suivi mensuels pendant les 3 premiers mois suivant l’intervention. Après cette période, prévoyez des examens tous les 3 mois pendant les 2 années suivantes, puis tous les 6 mois pendant les 3 années suivantes, jusqu’à un total de 5 ans après l’opération.
Résultats
L’IRM a révélé une réduction du volume du foie, une surface hépatique ondulée et une élargissement des fissures hépatiques chez les patients de cette étude. Une masse presque sphérique, mesurant environ 7,2 cm x 5,6 cm x 6,6 cm, a été identifiée dans le lobe postérieur droit du foie. La masse présentait des signaux faibles mixtes sur l’imagerie pondérée en T1 (T1WI), des signaux élevés mixtes sur l’imagerie pondérée en T2 (T2WI) et des signaux élevés sur l’imagerie pondérée en diffusion (DWI). Il présentait des limites claires et une augmentation hétérogène de la phase artérielle, suggérant la possibilité d’une cirrhose hépatique et d’un CHC (Figure 1).
Lors de la manœuvre du cathéter, une évaluation angiographique a été réalisée pour confirmer l’absence de vaisseaux tumoraux provenant de l’aorte abdominale, des artères diaphragmatiques et de l’artère mésentérique supérieure. Lors de l’angiographie à l’origine du tronc cœliaque, la branche segmentaire de l’artère hépatique droite (S6 ou branche inférieure droite) présentait une tortuosité et une dilatation prononcées. Cette observation a permis d’établir que la tumeur hépatique recevait un apport vasculaire exclusivement de cette branche artérielle singulière (Figure 2A). Une pré-évaluation fondamentale de l’essai TARE à l’y-90 consiste à cartographier les essais à l’aide de la perfusion de l’AAM Tc-99m, en exploitant la distribution de dose comparable entre les microsphères de l’AAM et de l’AAM à l’acide Y-90. Après l’injection de Tc-99m MAA, la zone de perfusion pour Tc-99m MAA a été délimitée, le volume de perfusion calculé pour la tumeur cible étant de 246,27 mL (Figure 2A). Les patients présentant une LSF supérieure à 20 % courent un risque accru de lésions pulmonaires induites par les radiations, ce qui en fait généralement des candidats inappropriés pour le traitement à l’Y-9022. Un TNR élevé signifie un effet tumoricide plus puissant tout en respectant la dose maximale admissible de rayonnement hépatique. La LSF calculée s’élevait à 17,17 % et le TNR à 8,2 (figure 2B).
Le modèle de partition, par rapport aux méthodes Medical Internal Radiation Dose (MIRD) et Body Surface (BSA), fournit une estimation personnalisée supérieure de la dose de rayonnement en tenant compte du TNR, améliorant ainsi la planification individualisée du traitement. Les résultats du modèle de partition indiquent des doses de rayonnement de 36,6 Gy pour le foie normal (en dessous du seuil de 40 Gy), de 17,6 Gy pour le tissu pulmonaire (à l’intérieur de la limite de 20 Gy) et d’une dose maximale de 300 Gy pour la tumeur, nécessitant une activité de la microsphère Y-90 de 1,36 GBq (Figure 3A). Après le traitement par TARE à l’Y-90 (figure 3B), une TEP/TDM a été effectuée, indiquant qu’il n’y avait pas de propagation hors cible ou d’écarts de couverture (figure 3C).
1 mois après le traitement par Y-90 TARE, la tumeur a été réduite à 6 cm et le taux d’AFP a diminué à 21 155 ng/mL. 3 mois après le traitement, la tumeur n’a montré aucun changement significatif. Compte tenu du risque élevé persistant de récidive, un traitement par un inhibiteur de-1 a été instauré. 5 mois après le traitement par TARE à l’Y-90 (2 mois après le début du traitement par inhibiteur de-1), la lésion avait encore diminué à 4 cm et le taux d’AFP avait considérablement diminué à 1,84 ng/mL (figure 4 et tableau 1).
Des images de la tumeur pendant l’hépatectomie sous lumière blanche et fluorescence sont présentées (Figure 5A). Les échantillons tumoraux obtenus par hépatectomie ont été transformés en coupes congelées pour une pathologie macroscopique. Lorsqu’ils ont été examinés au microscope, ils n’ont révélé aucune cellule tumorale, un dépôt de microsphères Y-90, une infiltration lymphoïde significative et des modifications cirrhotiques dans le tissu hépatique normal adjacent23 (Figure 5B). 12 mois après l’opération, un suivi et une évaluation de la récidive ont été effectués, l’imagerie par IRM n’indiquant aucun signe de récidive ou de métastases (Figure 5C).
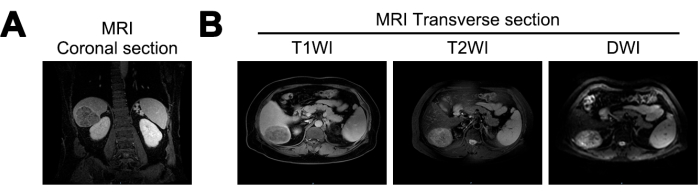
Figure 1 : Imagerie par résonance magnétique (IRM) au moment du diagnostic initial. (A) Coupe coronale du signal d’imagerie pondérée IRM T1 (T1WI), (B) coupes transversales des signaux IRM T1WI, imagerie pondérée T2 (T2WI) et imagerie pondérée en diffusion (DWI). Veuillez cliquer ici pour voir une version agrandie de cette figure.
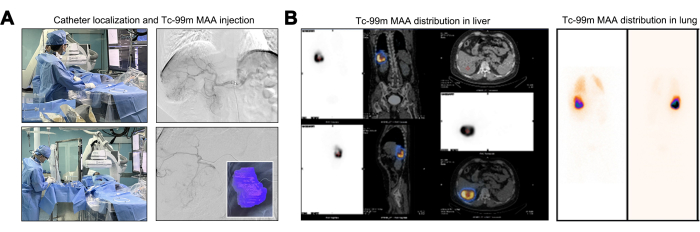
Figure 2 : Injection et distribution d’albumine macroagrégée de technétium-99m (Tc-99m MAA). (A) Illustration du processus d’injection d’albumine macroagrégée de technétium-99m (Tc-99m MAA). (B) Présentation de la distribution de la dose de 99mTc MAA dans le foie. Veuillez cliquer ici pour voir une version agrandie de cette figure.
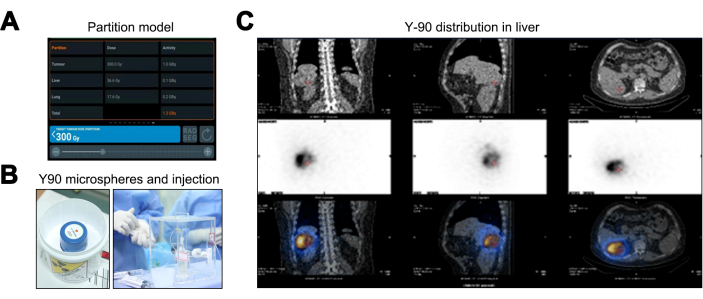
Figure 3 : Procédé de traitement par radioembolisation transartérielle à l’yttrium-90 (Y-90 TARE). (A) Représentation des données calculées à l’aide du modèle de partition. (B) L’emballage et l’injection des microsphères d’Y-90. (C) Tomographie par émission monophotonique/tomodensitométrie (SPECT/CT) pour valider la distribution posologique des microsphères Y-90. Veuillez cliquer ici pour voir une version agrandie de cette figure.
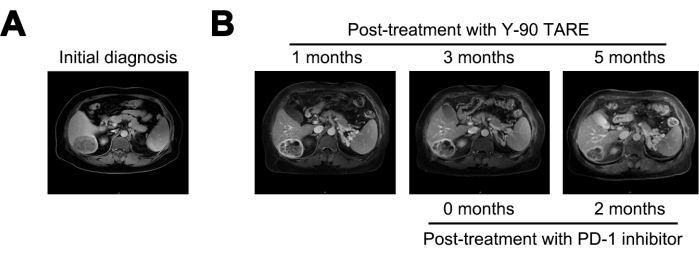
Figure 4 : Comparaison de tumeur. (A) Présentation de l’image IRM lors du diagnostic initial, tandis que (B) Affichage des images IRM à 1, 3 et 5 mois après le traitement avec Y-90 TARE. Un traitement par inhibiteur de la mort cellulaire programmée-1 (-1) a été effectué 3 mois après le TARE à l’Y-90. Le patient a subi un traitement avec un inhibiteur de-1 3 mois après la procédure TARE à l’y-90. Veuillez cliquer ici pour voir une version agrandie de cette figure.
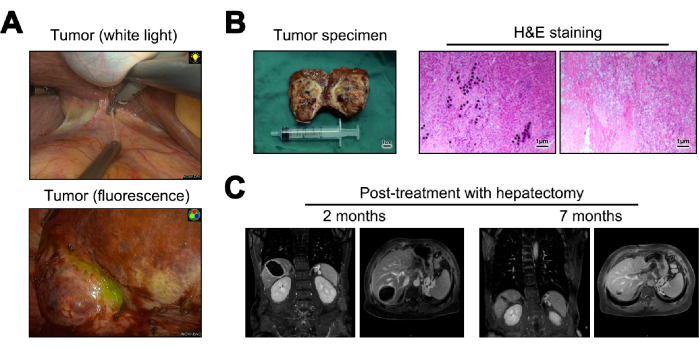
Figure 5 : Hépatectomie et suivi ultérieur. (A) Présentation de la tumeur observée en peropératoire. (B) Illustration de l’échantillon tumoral postopératoire et coloration à l’hématoxyline et à l’éosine (H&E). (C) Images IRM à 2 et 12 mois après la chirurgie. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Post-traitement avec Y-90 TARE | |||||
| Diagnostic initial | 1 mois | 3 mois | 5 mois | ||
| AFP (ng/mL) | 66840 | 21155 | 19535 | 1.84 | |
Tableau 1 : Mesure du taux de PFA après le traitement.
Discussion
Pour les patients atteints de CHC présentant des facteurs de récidive à haut risque, un pronostic défavorable persiste même après une hépatectomie curative, ce qui souligne l’importance d’un traitement néoadjuvant efficace pour améliorer les taux de survie24,25. Par rapport aux traitements interventionnels, Y-90 TARE présente un taux de contrôle local supérieur26. Alors que l’Y-90 TARE peut activer la réponse antitumorale de l’organisme22, l’utilisation combinée de l’Y-90 avec des inhibiteurs de-1 dans le traitement néoadjuvant du cancer du foie n’a pas encore été rapportée. Cette étude examine rétrospectivement un cas de TARE néoadjuvant à l’Y-90 suivi d’un traitement par anticorps monoclonaux anti--1 chez un patient atteint de CHC présentant des facteurs de récidive à haut risque qui a obtenu une rémission complète. Il présente un protocole de traitement détaillé à titre de référence.
Plusieurs points clés du protocole de cette étude méritent notre attention. Tout d’abord, compte tenu du potentiel de dégradation et de redistribution de MAA99, l’imagerie SPECT/CT doit être réalisée dans les 1 à 2 heures suivant l’injection de MA99. Deuxièmement, il est impératif de calculer méticuleusement la dose de microsphères d’Y-90 pour éviter le placement ectopique et un dosage excessif, qui pourraient entraîner des lésions hépatiques et pulmonaires. Enfin, compte tenu de la chirurgie post-néoadjuvante, une résection non anatomique assurant des marges claires peut être préférable pour raccourcir la durée de l’intervention et minimiser l’immunosuppression liée à la chirurgie.
Dans la présente étude, le patient présentait des symptômes de troubles du sommeil et de constipation après un traitement néoadjuvant. Ceux-ci ont été abordés à l’aide d’eszopiclone pour les troubles du sommeil et de comprimés entérosolus bisacodyliques pour la constipation. Cela suggère que les effets indésirables liés à l’Y-90, à la TARE et à l’inhibiteur de-1 sont minimes et peuvent être gérés pharmacologiquement. De plus, l’inhibiteur de l’Y-90 TARE et de-1 n’a pas induit d’œdème du tissu hépatique ou de lésion, d’adhésion sévère ou d’augmentation de la fragilité, cette dernière pouvant précipiter une hémorragie importante ou une résection incomplète lors de l’ablation chirurgicale ultérieure. Par conséquent, la TARE Y-90 n’a pas interféré avec les interventions chirurgicales subséquentes et n’a pas eu d’impact.
Sur la base des niveaux d’AFP et des changements dans la lésion, nous avons administré séquentiellement un traitement par anticorps monoclonaux anti--1 après une TARE à l’Y-90. Après 5 mois, la lésion a obtenu une réponse pathologique complète (pCR), indiquant que le moment et le choix du traitement étaient appropriés. L’ajustement de la stratégie de traitement avant la période de réponse médiane en Y-90 TARE peut réduire efficacement le risque de progression de la maladie27. Cependant, bien que le degré de résolution des lésions soit manifestement corrélé avec la survie après la résection d’un carcinome hépatique28, la question de savoir si une intervention chirurgicale ultérieure est justifiée pour les cas de pCR induite par la TARE à l’yt-90 reste un sujet d’étude plus approfondi. En outre, le moment et la posologie optimaux du traitement par Y-90 TARE et anticorps monoclonaux anti--1, ainsi que le meilleur moment et la meilleure approche pour la chirurgie ultérieure, doivent encore être validés. De plus, le coût élevé de l’ensemble du processus de traitement peut imposer un fardeau financier important aux patients.
Dans notre cas, la survenue d’une pCR après un traitement par TARE à l’y-90 et un inhibiteur de-1 est en corrélation avec plusieurs facteurs dans l’étude actuelle. Dans un premier temps, la dose de rayonnement intratumoral est prise en compte ; nous avons utilisé une méthodologie conventionnelle basée sur le Tc-99m MAA (modèle de partition) pour évaluer la dosede traitement Y-90 24. Notamment, en raison du TNR élevé du patient, la dose de rayonnement imprégnant la lésion dans cette étude a été élevée, avec des microsphères Y-90 couvrant complètement la tumeur, obtenant ainsi un effet curatif. Deuxièmement, une infiltration significative de cellules immunitaires au sein de la tumeur, indiquant un rôle central de l’immunité antitumorale du patient envers la pCR, ne peut être négligée. Étant donné qu’il s’agissait du diagnostic initial du patient et que la tumeur n’était pas à un stade avancé, l’immunité antitumorale intrinsèque a persisté. Après la mort des cellules tumorales induite par l’inhibiteur de l’Y-90 TARE et de-1, une réponse inflammatoire peut être déclenchée, augmentant l’exposition à l’antigène tumoral, activant l’immunité antitumorale de l’hôte et aboutissant à l’infiltration des cellules immunitaires et à son action tumoricide conséquente29. De plus, nos recherches antérieures ont discerné une corrélation entre l’inflammation hépatique péritumorale et la résistance tumorale, ce qui pourrait potentiellement exacerber la tolérance immunitaire hépatique30,31. Bien que des altérations cirrhotiques hépatiques aient été présentes dans le tissu péritumoral du patient dans cette étude, aucune réponse inflammatoire significative n’a été observée, et tous les examens liés à l’hépatite B n’ont pas été remarquables. Cela suggère que le microenvironnement immunitaire hépatique du patient appartient à un sous-groupe potentiellement modifiable, pour lequel Y-90 TARE et l’inhibiteur de-1 représentent une stratégie cruciale pour améliorer le microenvironnement immunitaire hépatique.
La mise en œuvre du traitement TARE à l’yt-90 nécessite des conditions strictes et des efforts de collaboration entre plusieurs départements, notamment la médecine nucléaire, la radiologie interventionnelle, la chirurgie hépatobiliaire, l’imagerie et l’oncologie. Le risque de complications radio-induites telles que la pneumonie, les ulcères gastriques et la pancréatite aiguë souligne la nécessité de calculs de dose méticuleux. Les évaluations de simulation préopératoires et les estimations de dose effectuées par le service de médecine nucléaire peuvent prolonger le cycle de traitement Y90 TARE, ce qui peut entraîner une progression tumorale. Y90 TARE peut ne pas convenir à tous les cancers du foie, en particulier ceux présentant de multiples métastases intrahépatiques et des cancers du foie diffus ou de petit diamètre (<0,5 cm), en raison des difficultés à différencier les zones tumorales du tissu hépatique normal, ce qui peut entraîner une erreur d’estimation de la dose. Les rapports sur l’utilisation de Y90 en association avec des inhibiteurs de-1 pour le traitement néoadjuvant du carcinome hépatocellulaire sont limités. Des études cliniques à grande échelle sont encore nécessaires pour étayer son efficacité et ses détails thérapeutiques.
En résumé, l’association de TARE à l’y-90 et d’un inhibiteur de-1 présente une approche sûre et efficace pour le traitement néoadjuvant des patients atteints de CHC. Cette stratégie permet non seulement d’alléger la charge tumorale locale et de minimiser les micro-métastases dans la mesure du possible, mais aussi sans augmenter le risque de progression de la maladie. Par conséquent, il a le potentiel de prolonger la période postopératoire sans récidive pour les patients. Nous proposons un protocole reproductible et réalisable pour le traitement néoadjuvant des patients atteints de CHC à haut risque.
Déclarations de divulgation
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Remerciements
Cette étude a été financée par la Fondation nationale des sciences naturelles de Chine (82303287), la Fondation pour la recherche fondamentale et appliquée du Guangdong (2021A1515110083), des projets scientifiques et technologiques à Guangzhou (202201010267), des fonds de recherche fondamentale pour les universités centrales (21621058).
matériels
| Name | Company | Catalog Number | Comments |
| ARTIS pheno Cutting-edge robotic imaging system | SIEMENS HEALTHINEERS | 10849000 | |
| DISPOSABLE LAPAROSCOPIC INSTRUMENT | Hangzhou Kangji Medical Instruments | 108Y series | |
| Endoscopic fluorescence camera system | Stryker | PC9000 | |
| ENSEAL G2 Curved Tissue Sealer | Ethicon from Johnson | NSLG2C14 | |
| Fluorescent laparoscopic lens | Stryker | SC9534 | |
| laparoscopic stapler | Ethicon from Johnson | PCEE45A | |
| Optima NM/CT 640 SPECT/CT | GE healthcare | 200439 | |
| SURGICEL FIBRILLAR Hemostat | Ethicon from Johnson | 1962 | |
| Tc-99m macroaggregated albumin [MAA](DAXIMAGE-MAA) | JUBILANT RADIOPHARMA | 877003-93-5 | |
| Tislelizumab Injection(PD-1 inhibitor) | BeiGene, Ltd | 10-848 | |
| ultrasound knife | Ethicon from Johnson | HARHD36 | |
| Xeleris Functional Imaging Workstation | GE healthcare | 5436592-22 | |
| Y-90 resin microspheres(SIR-Spheres) | Sirtex Medical Limited | SIR-Y001 |
Références
- Su, H., et al. Molecular mechanism of CK19 involved in the regulation of postoperative recurrence of HBV-associated primary hepatocellular carcinoma in Guangxi. Ann Transl Med. 9 (24), 1780 (2021).
- Zheng, R., et al. Cancer incidence and mortality in China, 2016. J Natl Cancer Center. 2 (1), 1-9 (2022).
- Sung, H., et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA. 71 (3), 209-249 (2021).
- Heimbach, J. K., et al. AASLD guidelines for the treatment of hepatocellular carcinoma. Hepatology (Baltimore, Md.). 67 (1), 358-380 (2018).
- Sato, T., et al. A prospective study of fully covered metal stents for different types of refractory benign biliary strictures. Endoscopy. 52 (5), 368-376 (2020).
- Zhou, H., Song, T. Conversion therapy and maintenance therapy for primary hepatocellular carcinoma. Biosci Trends. 15 (3), 155-160 (2021).
- Xu, X. F., et al. Risk factors, patterns, and outcomes of late recurrence after liver resection for hepatocellular carcinoma. JAMA Surg. 154 (3), 209-217 (2019).
- Song, T., Lang, M., Ren, S., Gan, L., Lu, W. The past, present, and future of conversion therapy for liver cancer. Am J Cancer Res. 11 (10), 4711-4724 (2021).
- Sangro, B., Salem, R., Kennedy, A., Coldwell, D., Wasan, H. Radioembolization for hepatocellular carcinoma: A review of the evidence and treatment recommendations. Am J Clin Oncol. 34 (4), 422 (2011).
- Chinese Medical Doctor Association, Clinical Guidelines Committee of Chinese College of Interventionalists, Chinese Research Hospital Association, Society for Hepatopancreatobiliary Surgery. Expert consensus on the standardized procedure of selective internal radiation therapy with Yttrium-90 microspheres for liver malignancies (2024 edition). Zhonghua Yi Xue Za Zhi. 104 (7), 486-498 (2024).
- Vilgrain, V., et al. Efficacy and safety of selective internal radiotherapy with yttrium-90 resin microspheres compared with sorafenib in locally advanced and inoperable hepatocellular carcinoma (SARAH): an open-label randomised controlled phase 3 trial. Lancet Oncol. 18 (12), 1624-1636 (2017).
- Villalobos, A., et al. Safety and efficacy of concurrent Atezolizumab/Bevacizumab or Nivolumab combination therapy with Yttrium-90 radioembolization of advanced unresectable hepatocellular carcinoma. Curr Oncol (Toronto, Ont.). 30 (12), 10100-10110 (2023).
- Kulik, L. M., et al. Safety and efficacy of 90Y radiotherapy for hepatocellular carcinoma with and without portal vein thrombosis. Hepatology (Baltimore, Md.). 47 (1), 71-81 (2008).
- Singh, P., Anil, G. Yttrium-90 radioembolization of liver tumors: what do the images tell us. Cancer Imaging. 13 (4), 645 (2013).
- Kim, Y. C., et al. Radiation safety issues in Y-90 microsphere selective hepatic radioembolization therapy: Possible radiation exposure from the patients. Nuc Med Mol Imag. 44 (4), 252-260 (2010).
- Kennedy, A., et al. Recommendations for radioembolization of hepatic malignancies using yttrium-90 microsphere brachytherapy: a consensus panel report from the radioembolization brachytherapy oncology consortium. Int J Radiation Oncol, Biol, Phys. 68 (1), 13-23 (2007).
- Molvar, C., Lewandowski, R. Yttrium-90 radioembolization of hepatocellular carcinoma-performance, technical advances, and future concepts. Semin Intervent Radiol. 32 (4), 388-397 (2015).
- Aliseda, D., et al. Liver resection and transplantation following Yttrium-90 radioembolization for primary malignant liver tumors: A 15-year single-center experience. Cancers. 15 (3), 733 (2023).
- Wehrenberg-Klee, E., Goyal, L., Dugan, M., Zhu, A. X., Ganguli, S. Y-90 radioembolization combined with a PD-1 inhibitor for advanced hepatocellular carcinoma. Cardiovas Intervent Radiol. 41 (11), 1799-1802 (2018).
- Maleux, G., et al. Predictive factors for adverse event outcomes after transarterial radioembolization with Yttrium-90 resin microspheres in Europe: Results from the prospective observational CIRT study. Cardiovas Intervent Radiol. 46 (7), 852-867 (2023).
- Lencioni, R., Llovet, J. M. Modified RECIST (mRECIST) assessment for hepatocellular carcinoma. Semin Liver Dis. 30 (1), 52-60 (2010).
- Yu, Q., Khanjyan, M., Fidelman, N., Pillai, A. Contemporary applications of Y90 for the treatment of hepatocellular carcinoma. Hepatol Comm. 7 (10), e0288 (2023).
- Zhou, J., et al. Guidelines for the diagnosis and treatment of primary liver cancer (2022 Edition). Liver Cancer. 12 (5), 405 (2023).
- Pasciak, A. S., Erwin, W. D. Effect of voxel size and computation method on Tc-99m MAA SPECT/CT-based dose estimation for Y-90 microsphere therapy. IEEE Trans Med Imag. 28 (11), 1754-1758 (2009).
- Sun, H. C., Zhu, X. D. Downstaging conversion therapy in patients with initially unresectable advanced hepatocellular carcinoma: An overview. Front Oncol. 11, 772195 (2021).
- Dhondt, E., et al. 90Y radioembolization versus drug-eluting bead chemoembolization for unresectable hepatocellular carcinoma: Results from the TRACE phase II randomized controlled trial. Radiology. 303 (3), 699-710 (2022).
- Taswell, C. S., et al. For hepatocellular carcinoma treated with Yttrium-90 microspheres, dose volumetrics on post-treatment Bremsstrahlung SPECT/CT predict clinical outcomes. Cancers. 15 (3), 645 (2023).
- Xu, L., Chen, L., Zhang, W. Neoadjuvant treatment strategies for hepatocellular carcinoma. World J Gastrointes Surg. 13 (12), 1550-1566 (2021).
- Chew, V., et al. Immune activation underlies a sustained clinical response to Yttrium-90 radioembolisation in hepatocellular carcinoma. Gut. 68 (2), 335-346 (2019).
- Jiang, Y., et al. Inflammatory microenvironment of fibrotic liver promotes hepatocellular carcinoma growth, metastasis and sorafenib resistance through STAT3 activation. J Cell Mol Med. 25 (3), 1568-1582 (2021).
- Jiang, Y., et al. TANK-binding kinase 1 (TBK1) serves as a potential target for hepatocellular carcinoma by enhancing tumor immune infiltration. Front Immunol. 12, 612139 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon