A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
نمذجة وتقييم نموذج اعتلال عضلة القلب السكري في الفئران
* These authors contributed equally
In This Article
Summary
يحدد هذا البروتوكول طريقة لتحفيز اعتلال عضلة القلب السكري من خلال مزيج من التغذية الغذائية الغنية بالدهون وحقن الستربتوزوتوسين. يهدف هذا النهج إلى توفير إطار عمل موثوق به للتحقيق العلمي في اعتلال عضلة القلب السكري واستكشاف السبل المحتملة لتطبيقات العلاج السريري.
Abstract
لا تزال الآليات الفيزيولوجية المرضية الأساسية لاعتلال عضلة القلب السكري (DbCM) ، وهو سبب رئيسي للوفيات بين مرضى السكري من النوع 2 (T2DM) ، غير مفهومة جيدا. تعزى سمية عضلة القلب المرتبطة ب T2DM إلى عوامل مثل السمية الدهنية ، والسمية الجلوكوزية ، والإجهاد التأكسدي ، وانخفاض كفاءة القلب ، والتهاب الدهون بالمقارنة مع الفئران ، توفر الفئران إمكانية وصول أكبر وفعالية من حيث التكلفة وقابلية تطبيق أوسع للتجارب على. تعد مقاومة الأنسولين وضعف إفراز الأنسولين من العوامل الحاسمة في الفيزيولوجيا المرضية ل T2DM. نقدم نموذجا جديدا للفئران غير الوراثية يكرر تطور DbCM البشري الناجم عن مزيج من التغذية الغذائية عالية الدهون (HFD) وحقن الستربتوزوتوسين (STZ). في هذه الدراسة ، استخدمنا الفئران C57BL / 6J من النوع البري ، حيث أدارت نظام HFD لمدة 12 أسبوعا ، متبوعا بالحقن داخل الصفاق ل STZ لمدة 12 أسبوعا إضافيا للحث على المظاهر المميزة ل T2DM. أجرينا اختبارات تحمل الجلوكوز عن طريق الفم وقمنا بقياس تركيزات الأنسولين في الدم لتأكيد تطور مقاومة الأنسولين وعدم كفاية إفراز الأنسولين. تم تقييم بنية القلب ووظيفته بدقة من خلال تخطيط صدى القلب عبر الصدر غير الغازي. تم تقييم الخصائص المرضية من خلال تلطيخ ماسون ثلاثي الألوان وتلوين جنين القمح (WGA) ، مما يكشف عن السمات المرضية المتعلقة ب DbCM. لذلك ، نحن نقدم طريقة قوية ومتعددة الاستخدامات لإنشاء نموذج فئران غير وراثي ل DbCM.
Introduction
داء السكري من النوع 2 (T2DM) هو مصدر قلق صحي عالمي يتصاعد تدريجيا ، ويقف كسبب رئيسي للمراضة والوفيات بين الأفراد المصابين. يرتبط انتشار T2DM ارتباطا وثيقا بوباء السمنة المتزايد1،2. أكثر من ثلث المرضى الذين يعانون من T2DM يظهرون نمطا ظاهريا متميزا للقلب والأوعية الدموية يسمى اعتلال عضلة القلب السكري (DbCM) ، ويتميز بخلل عضلة القلب الذي يحدث بشكل مستقل عن مرض الشريان التاجي وارتفاع ضغط الدم وأمراض القلبالصمامية 3. تشير الأدلة الناشئة إلى أن ما يقرب من 20٪ من مرضى السكري معرضون للإصابة بقصور القلب3 ، وهي حالة مرتبطة ارتباطا وثيقا بتشخيصهم4. تم اقتراح العديد من الآليات الفيزيولوجية المرضية ل DbCM ، بما في ذلك الالتهاب5 ، وإعادة تشكيل القلب والخللالوظيفي 6 ، والخلل الوظيفي في الميتوكوندريا7 ، والإجهاد التأكسدي8 ، والاضطرابات الأيضية9. على الرغم من البحث المكثف ، لا تزال الطيف الكامل للآليات ومساهماتها الفردية في DbCM غير مفهومةتماما 10. لذلك ، فإن النماذج الحيوانية قبل السريرية الراسخة ضرورية للنهوض بدراسة هذه الحالة.
يتميز T2DM بمقاومة الأنسولين وقصور الأنسولين التدريجي11 ، حيث يعاني معظمهم من زيادة الوزن أو السمنة12. في هذه الدراسة ، أنشأنا نموذجا مستقرا ومعدلا للفئران ل DbCM بناء على دراسات سابقة ، يجمع بين التغذية بالنظام الغذائي الغني بالدهون (HFD) وحقن الستربتوزوتوسين (STZ). في T2DM ، تساهم مقاومة الأنسولين وتدمير خلايا البنكرياس β في الفيزيولوجيا المرضيةللمرض 12. يستفيد هذا النموذج من عوامل الخطر البارزة ل T2DM. على وجه التحديد ، تطور الفئران التي تتغذى على HFD مقاومة الأنسولين ، كما أن حقن STZ اللاحقة تضعف وظيفة β الخلية في جزيرة البنكرياس ، مما يؤدي بشكل كبير إلى تطور الفيزيولوجيا المرضية الشبيهة ب T2DM. تم وصف STZ ، المعزول من Streptomyces achromogenes ، لأول مرة في عام 1963 لتدمره الانتقائي لخلايا β جزيرة البنكرياس وخصائصها المسببة لمرض السكري13. هناك نوعان من نماذج علاج STZ: يؤدي إعطاء جرعة عالية نسبيا من STZ إلى نموذج اعتلال عضلة القلب قصير المدى ، بينما تؤدي الحقن المتكررة بجرعة منخفضة من STZ إلى تحفيز نموذج T2DM الذي يتطور بشكل طبيعي إلى DbCM. نتيجة للطريقة الأخيرة ، تصاب بارتفاع السكر في الدم ، وتعدد الأدب ، والتبول ، وكلها خصائص T2DM البشري وتطور DbCM بشكل طبيعي.
وجدت هذه الدراسة أن الفئران C57BL / 6J من النوع البري التي تتغذى على HFD متبوعة بحقن STZ داخل الصفاق (30 مجم / كجم) أظهرت وظيفة القلب والتشكل والأنسجة المتوافقة مع خصائص DbCM بنهاية التجربة. يوفر هذا النهج طريقة فعالة لإنشاء نموذج DbCM للفئران.
Protocol
اتبعت جميع الإجراءات المبادئ التوجيهية المؤسسية للبحوث على وفقا لدليل رعاية واستخدام المختبر الذي حددته المعاهد الوطنية الأمريكية للصحة (منشور المعاهد الوطنية للصحة رقم 85-23 ، المنقح في عام 1996). تمت الموافقة على جميع التجارب على من قبل لجنة الأخلاقيات لرعاية ولجنة الأخلاقيات بجامعة سيتشوان. تم شراء ذكور الفئران C57BL / 6J من شركة Beijing Vital River Laboratory Animal Technology Co. (الصين). طوال المدة التجريبية ، تم إيواء الفئران في ظروف خاضعة للرقابة تبلغ 24 درجة مئوية ودورة إضاءة / ظلام منظمة لمدة 12 ساعة ، مع إمكانية الوصول إلى الغذاء والماء.
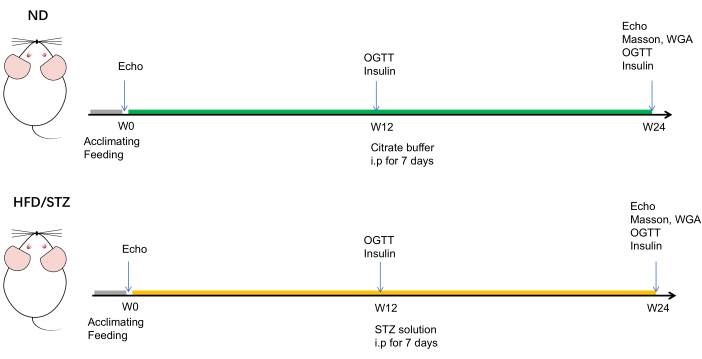
الشكل 1: الجدول الزمني للتجربة التخطيطية. كانت الفئران المستخدمة في مجموعات HFD / STZ و ND في عمر 7-8 أسابيع تقريبا. تم تسجيل وزن الجسم ومستوى الجلوكوز العشوائي في الدم لكل فأر على أساس أسبوعي. في فترات التغذية لمدة 12 أسبوعا و 24 أسبوعا ، تم تقييم النمط الظاهري الأيضي للفئران عن طريق اختبار تحمل الجلوكوز عن طريق الفم (OGTT) وقياس مستوى الأنسولين في الدم. بالإضافة إلى ذلك ، تم تقييم تخطيط صدى القلب في خط الأساس (الأسبوع 0) و 12 أسبوعا و 24 أسبوعا. بعد فترة التغذية التي استمرت 24 أسبوعا ، تم قتل الفئران رحيم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
1. تغذية HFD
- قم بإطعام ذكور الفئران C57BL / 6J (7-8 أسابيع) إما بنظام غذائي عادي (ND) أو HFD (60٪ دهون سعرات حرارية) لمدة 24 أسبوعا للحث على السمنة.
- سجل وزن جسم كل فأر كل 4 أسابيع. تأكد من أن منحنى الوزن يظهر نمطا تصاعديا مشابها قبل 12 أسبوعا ، مع ملاحظة منحدر أكثر حدة في مجموعة HFD.
2. تحضير محلول STZ والحقن
ملاحظة: قم بتخزين STZ عند -20 درجة مئوية لمنع التدهور بسبب عدم ثباته العالي في درجة حرارة الغرفة (RT). امزج STZ مع مخزن السترات المؤقت مباشرة في غضون 5 دقائق قبل الحقن.
- تحضير عازلة السترات. تزن 2.1 غرام من حامض الستريك (الكتلة الجزيئية النسبية: 210.14) وتذويبها جيدا في 100 مل من الماء المقطر لتحضير المحلول أ ؛ تزن 2.94 جم من سترات الصوديوم (الكتلة الجزيئية النسبية: 294.10) وقم بإذابتها جيدا في 100 مل من الماء المقطر لتحضير المحلول ب. امزج المحلول A و B بنسبة 1: 1.32 للحصول على محلول عمل حامض الستريك. قم بتصفية الشوائب باستخدام غشاء مرشح 0.45 ميكرومتر.
- قم بوزن 1 جم من STZ وقم بإذابه جيدا في 100 مل من محلول عمل حامض الستريك المختلط المحضر. قم بتخزين محلول STZ الناتج عند 4 درجات مئوية. تأكد من حدوث حقن محلول STZ في غضون 30 دقيقة كلما أمكن ذلك.
- باستخدام حقنة سعة 1 مل ، قم بإعطاء الحقن داخل الصفاق لمحلول يحتوي على 30 مجم / كجم من STZ يوميا لمدة 7 أيام متتالية للفئران في مجموعة HFD / STZ مع توفير حجم متساو من عازلة السترات (0.1 مليمول / لتر ، درجة الحموضة = 4.5) للفئران في مجموعة الكثافة المحايدة المحايدة
- فحص مستويات الجلوكوز في الدم بعد أسبوع واحد من الحقن النهائي. تصنيف الفئران التي تظهر تركيزات عشوائية من جلوكوز الدم تتجاوز 16.7 مليمول / لتر على أنها فئران T2DM.
- ضع الماوس بحذر على جهاز تقييد ، مع التأكد من أن ذيله يمتد بالكامل إلى الخارج.
- قبل جمع الدم ، قم بتعقيم موقع جمع الدم في الذيل جيدا باستخدام مسحة كحولية بنسبة 70٪ ، مع الحفاظ على العقم والنظافة.
- باستخدام إبرة حادة الرأس ، أدخلها في وريد الذيل ، وتقدم من الحافة باتجاه القاعدة على عمق 3-4 مم. بمجرد وضع الإبرة في مكانها بإحكام ، اضغط برفق على الجزء العلوي من الذيل لتشجيع تدفق الدم.
- اجمع ما يقرب من 10 ميكرولتر من الدم من الفأر وقم بتطبيق الدم الذي تم جمعه بعناية على شريط الاختبار المخصص. بمجرد امتصاص الدم ، سيعرض مقياس الجلوكوز على الفور قراءة جلوكوز الدم.
3. اختبار تحمل الجلوكوز عن طريق الفم (OGTT) 14
- قبل OGTT ، قم بالصيام كل ماوس طوال الليل لمدة 14 ساعة ، بينما يمكنه الوصول غير المقيد إلى الماء.
- تحضير ما يقرب من 10 مل من محلول الجلوكوز بنسبة 20٪. يجب إعطاء جرعة 1 غ/كغ من الغلوكوز عن طريق التزقيم الفموي لكل فأر أثناء عملية زراعة الوظيفة المهنية.
- مراقبة مستويات الجلوكوز في الدم في عدة نقاط زمنية: على الفور (0 دقيقة) ، و 15 دقيقة ، و 30 دقيقة ، و 60 دقيقة ، و 120 دقيقة بعد الإعطاء.
4. تقييم تخطيط صدى القلب لوظائف القلب
- إجراء تخطيط صدى القلب على كل فأر في خط الأساس (0 أسابيع) و 12 أسبوعا و 24 أسبوعا بعد الرضاعة إما ب HFD أو ND.
- قبل تخطيط صدى القلب ، قم بتخدير الفأر عن طريق استنشاق 3٪ من الأيزوفلوران الذي يتم إعطاؤه بأكسجين بنسبة 100٪ باستخدام جهاز تخدير. تأكد من أن الفأر لا يظهر أي رد فعل على قرص الجلد باستخدام ملاقط مسنن أو تحفيز أصابع قدميه وذيله. ضع مرهما بيطري على العينين لمنع الجفاف أثناء التخدير.
- ضع الماوس على وسادة تسخين للحفاظ على درجة حرارة الجسم ، وقم بتثبيت مخالبه في قطب كهربائي لضمان وضع ضعيف ثابت. اضبط تركيز الأيزوفلوران بين 1٪ -2٪ للتخدير المداومة للحفاظ على معدل ضربات القلب المستهدف يبلغ حوالي 450 نبضة في الدقيقة.
- قم بإزالة فرو الفأر باستخدام كريم إزالة الشعر وتطبيق الجل بالموجات فوق الصوتية على صدره. قم بإزالة كريم إزالة الشعر والجل بالموجات فوق الصوتية بمحلول ملحي معقم بعد تخطيط صدى القلب.
- تقييم وظيفة القلب والمعلمات الهيكلية باستخدام مسبار 50 ميجاهرتز.
- للحصول على رؤية مثالية للبطين الأيسر (LV) طويل المحور ، ضع المسبار على الجانب الأيسر من صدر.
- اعتمادا على التشريح الفردي ، قم بتدوير المسبار عكس اتجاه عقارب الساعة بين 15 درجة و 45 درجة بالنسبة للخط القصي الأيسر ، مع توجيه الشق نحو كتفه الأيمن. اضبط المحور x والمحور y ضمن الوضع B15.
ملاحظة: يجب أن يشمل عرض المحور الطويل LV المناسب (أنا) الصمام الأبهري وجذر الأبهر. (2) تم وضع غرفة الجهد المنخفض في وسط المنظر ؛ (ثالثا) يجب أن يكون المحور من القاعدة إلى القمة موازيا لمحول الطاقة16. - اضغط على الوضع M 2x لعرض خط القياس. ضع هذا الخط على مستوى العضلة الحليمية. بعد ذلك ، قم بإجراء قياسات لثلاث ضربات قلب متتالية على الأقل لضمان الدقة. اضغط على حفظ المقطع لحفظ الحلقة السينمائية في السلسلة.
- حدد البعد الانقباضي النهائي على أنه المرحلة التي تزامنت مع موجة ECG T ، وحدد البعد الانبساطي النهائي كمرحلة مقابلة لموجة ECG R.
- قم بإمالة لوحة التشغيل ، مع التأكد من أن الزاوية اليسرى العليا هي الأدنى ، وأن الزاوية اليمنى السفلية هي الأعلى. اضبط المسبار ليخترق على طول اتجاه قمة قلب الفأر ، بالتوازي مع المحور الطويل للقلب ، للحصول على عرض عبر القمي من أربع غرف.
- حدد على التوالي أوضاع C (Color Doppler) و PW (PW Doppler) ، ضع حجم العينة عند أعلى نقطة سرعة ، واضبط اتجاه أخذ العينات ليتناسب مع اتجاه تدفق الدم ، وسجل معلومات ديناميكية الدم للصمام التاجي (الموجة E و A) 16. اضغط على حفظ المقطع لحفظ الحلقة السينمائية في السلسلة.
- توقف عن استنشاق الأيزوفلوران للسماح للفئران باستعادة الوعي. أعد إلى أقفاصها ، الموجودة في بيئة خاضعة للرقابة مع دورة إضاءة / ظلام مدتها 12 ساعة عند علامتي 0 و 12 أسبوعا. بعد تقييم تخطيط صدى القلب لمدة 24 أسبوعا ، قم بالقتل الرحيم للفئران بشكل إنساني من خلال خلع عنق الرحم بعد استنشاق الأيزوفلوران.
- قم بإجراء تحليل الكسر القذفي (EF) ، وتقصير الكسر (FS) ، والجدار الخلفي للبطين الأيسر (LVPW) ، والقطر الداخلي للبطين الأيسر (LVID) ، والحاجز بين البطينين (IVS) ، ونسبة E / A باستخدام دونجل محطة العمل.
5. تلطيخ نسيجي
- بعد الانتهاء من تحليل تخطيط صدى القلب عند علامة 24 أسبوعا ، قم بالقتل الرحيم للفأر عن طريق خلع الحبل الشوكي بعد استنشاق الأيزوفلوران.
- قم بتشريح الفأر باستخدام مقص العين والملاقط. اقطع الضلوع بعناية لضمان التعرض الكامل للقلب.
- قم بنقف القلب من خلال القمة بمحلول ملحي حتى يصبح الكبد شاحبا ، مما يشير إلى نجاح التروية. قم بإزالة القلب واشطفه جيدا في محلول ملحي لضمان إزالة الدم بالكامل.
- قم بتضمين البارافين17.
- ثبت القلب بالفورمالين بنسبة 4٪ في RT لمدة 24 ساعة على الأقل.
- ضع صندوق التجفيف الذي يحتوي على القلب في مجفف للخضوع لعملية تجفيف تدريجية تتضمن ترشيح الكحول المتدرج والشمع عند 65 درجة مئوية.
- تحضير أقسامالأنسجة 17.
- ضع كتلة الشمع المشذبة التي تحتوي على عضلة حليمية في ميكروتوم للتقطيع ، بسمك 4 ميكرومتر ، وقم بتخزينها في RT للتلوين المرضي.
- قم بإجراء البقع باستخدام تلطيخ ثلاثي الألوان18 من Masson وجنين القمح (WGA) 19 .
النتائج
تضمنت هذه الدراسة التخصيص العشوائي للفئران إلى مجموعتين: مجموعة ND ومجموعة HFD / STZ ، مع 6 فئران في كل مجموعة. بعد إجراء عمليات تخطيط صدى القلب النهائية واختبارات OGTT بعد 24 أسبوعا من الرضاعة ، تم القتل الرحيم للفئران لحصاد أنسجة قلبها لإجراء تقييم نسيجي.
تسبب HFD ...
Discussion
نظرا لانتشار داء السكري على نطاق واسع ومضاعفات القلب والأوعية الدموية المرتبطة به على مستوى العالم ، هناك حاجة ملحة للكشف عن الآليات الجزيئية الأساسية وتطوير استراتيجيات وقائية وعلاجية لهذه الحالة20. لا يزال التسبب في DbCM ، وهو أحد مضاعفات القلب والأوعية ال?...
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
تم دعم هذا العمل من قبل المؤسسة الوطنية للعلوم الطبيعية في الصين (أرقام المنح: U23A20395 و 81900258 و 82170375). مشروع البحث والتطوير الرئيسي لإدارة العلوم والتكنولوجيا في مقاطعة سيتشوان (2022ZDZX0020) ؛ مشروع الصندوق الخاص للأبحاث السريرية التابع للجمعية الطبية الصينية (CSC) (CSCF2020B04) ؛ 1· 3· 5 مشروع مستشفى غرب الصين ، جامعة سيتشوان (ZYGD23021). شكرا لتشينغ يانغ (المرافق الأساسية لتصوير ، مستشفى غرب الصين ، جامعة سيتشوان) لمساعدتهم في التصوير بالموجات فوق الصوتية للحيوانات الصغيرة.
Materials
| Name | Company | Catalog Number | Comments |
| Animal ultrosound system | Fujifilm Visual Sonics | VEVO 3100 | Echocardiography |
| Blood glucometer | Yuwell | GU100 | Assess blood glucose level |
| Citric acid | Sigma-Aldrich | 251275 | |
| Isoflurane | RWD life science | R510-22 | Anesthesia |
| Isoflurane vaporizer | RWD life science | R500 | Anesthesia |
| Mouse insulin (INS) ELISA Kit | Wuhan Feiyue Biotechnology Co.,Ltd | FY-EM14029 | Assess serum insulin level |
| Nair hair removal cream | Nair | 255g | Remove the fur of mouse |
| Rodent diet with 60% kcal fat | Research Diets Inc | D12492 | High fat diet feeding |
| Sodium citrate | Sigma-Aldrich | S4641 | |
| Sterile filter | Merck Millipore | SLHV033N | |
| Streptozocin | Solarbio | S8050 | |
| Ultrasound gel | Keppler | KL-250 | Echocardiography |
| Workstation Dongle | Fujifilm Visual Sonics | Vevo LAB | Echocardiographic data analysis |
References
- Defronzo, R. A., et al. Type 2 diabetes mellitus. Nat Rev Dis Primers. 1, 15019 (2015).
- Htay, T., et al. Mortality and cardiovascular disease in type 1 and type 2 diabetes. Curr Cardiol Rep. 21 (6), (2019).
- Jia, G., Hill, M. A., Sowers, J. R. Diabetic cardiomyopathy: An update of mechanisms contributing to this clinical entity. Circ Res. 122 (4), 624-638 (2018).
- Kenny, H. C., Abel, E. D. Heart failure in type 2 diabetes mellitus. Circ Res. 124 (1), 121-141 (2019).
- Biernacka, A., et al. Smad3 signaling promotes fibrosis while preserving cardiac and aortic geometry in obese diabetic mice. Circ Heart Fail. 8 (4), 788-798 (2015).
- Van Linthout, S., et al. Reduced MMP-2 activity contributes to cardiac fibrosis in experimental diabetic cardiomyopathy. Basic Res Cardiol. 103 (4), 319-327 (2008).
- Ni, R., et al. Therapeutic inhibition of mitochondrial reactive oxygen species with mito-tempo reduces diabetic cardiomyopathy. Free Radic Biol Med. 90, 12-23 (2016).
- Tan, Y., et al. Diabetic downregulation of Nrf2 activity via erk contributes to oxidative stress-induced insulin resistance in cardiac cells in vitro and in vivo. Diabetes. 60 (2), 625-633 (2011).
- Maack, C., et al. Heart failure and diabetes: Metabolic alterations and therapeutic interventions: A state-of-the-art review from the translational research committee of the heart failure association-european society of cardiology. Eur Heart J. 39 (48), 4243-4254 (2018).
- Ho, K. L., et al. structural and biochemical changes in diabetes and the development of heart failure. Diabetologia. 65 (3), 411-423 (2022).
- Saisho, Y. Beta-cell dysfunction: Its critical role in prevention and management of type 2 diabetes. World J Diabetes. 6 (1), 109-124 (2015).
- Galicia-Garcia, U., et al. Pathophysiology of type 2 diabetes mellitus. Int J Mol Sci. 21 (17), 6275 (2020).
- Junod, A., et al. Studies of the diabetogenic action of streptozotocin. Proc Soc Exp Biol Med. 126 (1), 201-205 (1967).
- Einwallner, E., Nagy, C. Study of in vivo glucose metabolism in high-fat diet-fed mice using oral glucose tolerance test (OGTT) and insulin tolerance test (ITT). J Vis Exp. (131), e56672 (2018).
- Wang, Q., et al. Induction of right ventricular failure by pulmonary artery constriction and evaluation of right ventricular function in mice. J Vis Exp. (147), e59431 (2019).
- Zacchigna, S., et al. Towards standardization of echocardiography for the evaluation of left ventricular function in adult rodents: A position paper of the ESC working group on myocardial function. Cardiovasc Res. 117 (1), 43-59 (2021).
- . Paraffin sides experiment report Available from: https://www.servicebio.com/data-detail?id=5556&code=BLZPSYBG (2022)
- . staining experiment report Available from: https://www.servicebio.com/data-detail?id=5588&code=RSSYBG (2022)
- . Paraffin WGA staining protocol Available from: https://www.servicebio.com/data-detail?id=5041&code=MYYGSYBG (2022)
- Guariguata, L., et al. Global estimates of diabetes prevalence for 2013 and projections for 2035. Diabetes Res Clin Pract. 103 (2), 137-149 (2014).
- Tan, Y., et al. Mechanisms of diabetic cardiomyopathy and potential therapeutic strategies: Preclinical and clinical evidence. Nat Rev Cardiol. 17 (9), 585-607 (2020).
- Prasad, M., et al. A comprehensive review on high -fat diet-induced diabetes mellitus: An epigenetic view. J Nutr Biochem. 107, 109037 (2022).
- Zhang, Y., et al. Positional cloning of the mouse obese gene and its human homologue. Nature. 372 (6505), 425-432 (1994).
- Adingupu, D. D., et al. Sglt2 inhibition with empagliflozin improves coronary microvascular function and cardiac contractility in prediabetic ob/ob(-/-) mice. Cardiovasc Diabetol. 18 (1), 16 (2019).
- Huynh, K., et al. Coenzyme q10 attenuates diastolic dysfunction, cardiomyocyte hypertrophy and cardiac fibrosis in the db/db mouse model of type 2 diabetes. Diabetologia. 55 (5), 1544-1553 (2012).
- Moellmann, J., et al. Empagliflozin improves left ventricular diastolic function of db/db mice. Biochim Biophys Acta Mol Basis Dis. 1866 (8), 165807 (2020).
- Ramirez, E., et al. Eplerenone attenuated cardiac steatosis, apoptosis and diastolic dysfunction in experimental type-ii diabetes. Cardiovasc Diabetol. 12, 172 (2013).
- Fuentes-Antras, J., et al. Updating experimental models of diabetic cardiomyopathy. J Diabetes Res. 2015, 656795 (2015).
- Riehle, C., Bauersachs, J. Of mice and men: Models and mechanisms of diabetic cardiomyopathy. Basic Res Cardiol. 114 (1), 2 (2018).
- Zhao, S., Kusminski, C. M., Scherer, P. E. Adiponectin, leptin and cardiovascular disorders. Circ Res. 128 (1), 136-149 (2021).
- Parilla, J. H., Willard, J. R., Barrow, B. M., Zraika, S. A mouse model of beta-cell dysfunction as seen in human type 2 diabetes. J Diabetes Res. 2018, 6106051 (2018).
- Wang, B., Chandrasekera, P. C., Pippin, J. J. Leptin- and leptin receptor-deficient rodent models: Relevance for human type 2 diabetes. Curr Diabetes Rev. 10 (2), 131-145 (2014).
- Vasanji, Z., Cantor, E. J., Juric, D., Moyen, M., Netticadan, T. Alterations in cardiac contractile performance and sarcoplasmic reticulum function in sucrose-fed rats is associated with insulin resistance. Am J Physiol Cell Physiol. 291 (4), C772-C780 (2006).
- Wright, J. J., et al. Mechanisms for increased myocardial fatty acid utilization following short-term high-fat feeding. Cardiovasc Res. 82 (2), 351-360 (2009).
- Flister, K. F. T., et al. Long-term exposure to high-sucrose diet down-regulates hepatic endoplasmic reticulum-stress adaptive pathways and potentiates de novo lipogenesis in weaned male mice. J Nutr Biochem. 62, 155-166 (2018).
- Kanwal, A., Pillai, V. B., Samant, S., Gupta, M., Gupta, M. P. The nuclear and mitochondrial sirtuins, sirt6 and sirt3, regulate each other's activity and protect the heart from developing obesity-mediated diabetic cardiomyopathy. FASEB J. 33 (10), 10872-10888 (2019).
- Winzell, M. S., Ahren, B. The high-fat diet-fed mouse: A model for studying mechanisms and treatment of impaired glucose tolerance and type 2 diabetes. Diabetes. 53 Suppl 3, S215-S219 (2004).
- Poucher, S. M., et al. Effects of saxagliptin and sitagliptin on glycaemic control and pancreatic beta-cell mass in a streptozotocin-induced mouse model of type 2 diabetes. Diabetes Obes Metab. 14 (10), 918-926 (2012).
- Islam, M. S., Loots Du, T. Experimental rodent models of type 2 diabetes: A review. Methods Find Exp Clin Pharmacol. 31 (4), 249-261 (2009).
- Heydemann, A. An overview of murine high fat diet as a model for type 2 diabetes mellitus. J Diabetes Res. 2016, 2902351 (2016).
- Surwit, R. S., Kuhn, C. M., Cochrane, C., Mccubbin, J. A., Feinglos, M. N. Diet-induced type ii diabetes in c57bl/6j mice. Diabetes. 37 (9), 1163-1167 (1988).
- Clee, S. M., Attie, A. D. The genetic landscape of type 2 diabetes in mice. Endocr Rev. 28 (1), 48-83 (2007).
- Lee, J. Y., Kim, M. J., Moon, C. K., Chung, J. H. Degradation products of streptozotocin do not induce hyperglycemia in rats. Biochem Pharmacol. 46 (11), 2111-2113 (1993).
- Ozturk, N., Uslu, S., Ozdemir, S. Diabetes-induced changes in cardiac voltage-gated ion channels. World J Diabetes. 12 (1), 1-18 (2021).
- Bohne, L. J., Johnson, D., Rose, R. A., Wilton, S. B., Gillis, A. M. The association between diabetes mellitus and atrial fibrillation: Clinical and mechanistic insights. Front Physiol. 10, 135 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved