È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Modellazione e valutazione del modello di cardiomiopatia diabetica murina
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo delinea un metodo per indurre la cardiomiopatia diabetica attraverso una combinazione di dieta ricca di grassi e iniezione di streptozotocina. Questo approccio mira a fornire un quadro affidabile per l'indagine scientifica sulla cardiomiopatia diabetica e ad esplorare potenziali strade per applicazioni di trattamento clinico.
Abstract
I meccanismi fisiopatologici alla base della cardiomiopatia diabetica (DbCM), una delle principali cause di mortalità tra i pazienti con diabete mellito di tipo 2 (T2DM), rimangono poco compresi. La tossicità miocardica associata al diabete di tipo 2 è attribuita a fattori quali la lipotossicità, la glucotossicità, lo stress ossidativo, la ridotta efficienza cardiaca e la lipoapoptosi. Rispetto ai ratti, i topi offrono una maggiore accessibilità, economicità e una più ampia applicabilità per gli esperimenti sugli animali. L'insulino-resistenza e l'alterata secrezione di insulina sono fattori cruciali nella fisiopatologia del diabete di tipo 2. Introduciamo un nuovo modello murino non genetico che replica la progressione della DbCM umana indotta da una combinazione di dieta ricca di grassi (HFD) e iniezione di streptozotocina (STZ). In questo studio, abbiamo utilizzato topi C57BL/6J wild-type, somministrando un regime HFD per 12 settimane, seguito da iniezioni intraperitoneali di STZ per ulteriori 12 settimane per indurre manifestazioni caratteristiche di T2DM. Sono stati condotti test orali di tolleranza al glucosio e misurate le concentrazioni sieriche di insulina per confermare lo sviluppo di insulino-resistenza e un'insufficiente secrezione di insulina. La struttura e la funzione cardiaca sono state rigorosamente valutate attraverso l'ecocardiografia transtoracica non invasiva. Le caratteristiche patologiche sono state valutate attraverso la colorazione tricromica di Masson e la colorazione con agglutinine del germe di grano (WGA), rivelando caratteristiche patologiche correlate alla DbCM. Pertanto, forniamo un metodo robusto e versatile per stabilire un modello murino non genetico di DbCM.
Introduzione
Il diabete mellito di tipo 2 (T2DM) è un problema di salute globale in progressiva escalation, che rappresenta una delle principali cause di morbilità e mortalità tra gli individui colpiti. La prevalenza del diabete di tipo 2 è strettamente correlata all'aumento dell'epidemia di obesità 1,2. Più di un terzo dei pazienti con diabete di tipo 2 presenta un fenotipo cardiovascolare distinto chiamato cardiomiopatia diabetica (DbCM), caratterizzato da disfunzione miocardica che si verifica indipendentemente dalla malattia coronarica, dall'ipertensione e dalla cardiopatia valvolare3. Evidenze emergenti suggeriscono che circa il 20% dei pazienti diabetici è predisposto a sviluppare insufficienza cardiaca3, una condizione strettamente associata alla prognosi4. Sono stati proposti diversi meccanismi fisiopatologici della DbCM, tra cui l'infiammazione5, il rimodellamento cardiaco e la disfunzione6, la disfunzione mitocondriale7, lo stress ossidativo8 e i disturbi metabolici9. Nonostante un'ampia ricerca, l'intero spettro dei meccanismi e i loro contributi individuali alla DbCM rimangono incompleti10. Pertanto, modelli animali preclinici ben consolidati sono essenziali per far progredire lo studio di questa condizione.
Il diabete di tipo 2 è caratterizzato da insulino-resistenza e insufficienza progressiva di insulina11, con la maggior parte di persone in sovrappeso o obese12. In questo studio, stabiliamo un modello murino stabile e modificato di DbCM basato su studi precedenti, combinando l'alimentazione con dieta ricca di grassi (HFD) e l'iniezione di streptozotocina (STZ). Nel diabete di tipo 2, l'insulino-resistenza e la distruzione delle cellule β pancreatiche contribuiscono alla fisiopatologia della malattia12. Questo modello sfrutta due importanti fattori di rischio del diabete di tipo 2. In particolare, i topi alimentati con HFD sviluppano insulino-resistenza e le successive iniezioni di STZ compromettono ulteriormente la funzione delle cellule β delle isole pancreatiche, portando in modo significativo alla progressione della fisiopatologia simile al T2DM. La STZ, isolata da Streptomyces achromogenes, è stata descritta per la prima volta nel 1963 per la sua distruzione selettiva delle cellule β delle isole pancreatiche e per le sue proprietà diabetogene13. Esistono due modelli di trattamento STZ: la somministrazione di una dose relativamente alta di STZ si traduce in un modello di cardiomiopatia a breve termine, mentre iniezioni ripetute di STZ a basse dosi inducono un modello di T2DM che progredisce naturalmente in DbCM. Come risultato di quest'ultimo metodo, gli animali sviluppano iperglicemia, polidipsia e poliuria, tutte caratteristiche del diabete di tipo 2 umano e sviluppano naturalmente il DbCM.
Questo studio ha rilevato che i topi C57BL/6J wild-type alimentati con HFD seguiti da iniezioni intraperitoneali di STZ (30 mg/kg) hanno mostrato funzione cardiaca, morfologia e istologia coerenti con le caratteristiche del DbCM entro la fine dell'esperimento. Questo approccio fornisce un metodo efficace per stabilire un modello DbCM murino.
Protocollo
Tutte le procedure hanno seguito le linee guida istituzionali per la ricerca sugli animali in conformità con la Guida per la cura e l'uso degli animali da laboratorio delineata dal National Institutes of Health degli Stati Uniti (NIH Publication No. 85-23, rivista nel 1996). Tutti gli esperimenti sugli animali sono stati approvati dal Comitato Etico per la Cura degli Animali e dal Comitato Etico dell'Università del Sichuan. I topi maschi C57BL/6J sono stati acquistati da Beijing Vital River Laboratory Animal Technology Co. (Cina). Per tutta la durata dell'esperimento, i topi sono stati alloggiati in condizioni controllate di 24 °C e un ciclo regolato di luce/buio di 12 ore, con accesso ad libitum a cibo e acqua.
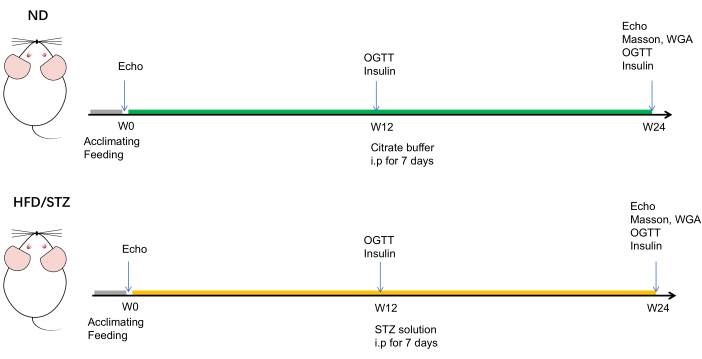
Figura 1: Sequenza temporale schematica dell'esperimento. I topi utilizzati nei gruppi HFD/STZ e ND avevano entrambi un'età di circa 7-8 settimane. Il peso corporeo e il livello casuale di glucosio nel sangue di ciascun topo sono stati registrati su base settimanale. Agli intervalli di alimentazione di 12 e 24 settimane, il fenotipo metabolico dei topi è stato valutato mediante un test di tolleranza al glucosio orale (OGTT) e una misurazione del livello sierico di insulina. Inoltre, l'ecocardiografia è stata valutata al basale (settimana 0), 12 settimane e 24 settimane. Dopo il periodo di alimentazione di 24 settimane, i topi sono stati soppressi. Clicca qui per visualizzare una versione più grande di questa figura.
1. Alimentazione HFD
- Nutrire topi maschi C57BL/6J (7-8 settimane di età) con una dieta normale (ND) o HFD (60% kcal di grassi) per 24 settimane per indurre l'obesità.
- Registra il peso corporeo di ciascun topo ogni 4 settimane. Assicurarsi che la curva del peso mostri un andamento ascendente simile prima delle 12 settimane, con una pendenza più ripida osservata nel gruppo HFD.
2. Preparazione e iniezione della soluzione STZ
NOTA: Conservare STZ a -20 °C per evitare la degradazione dovuta alla sua elevata instabilità a temperatura ambiente (RT). Miscelare STZ con il tampone citrato immediatamente entro 5 minuti prima dell'iniezione.
- Preparare il tampone citrato. Pesare 2,1 g di acido citrico (massa molecolare relativa: 210,14) e scioglierlo accuratamente in 100 ml di acqua distillata per preparare la soluzione A; pesare 2,94 g di citrato di sodio (massa molecolare relativa: 294,10) e scioglierlo accuratamente in 100 mL di acqua distillata per preparare la soluzione B. Mescolare le soluzioni A e B in rapporto 1:1,32 per ottenere la soluzione di lavoro dell'acido citrico. Filtra le impurità utilizzando una membrana filtrante da 0,45 μm.
- Pesare 1 g di STZ e scioglierlo accuratamente in 100 mL della soluzione di lavoro preparata con acido citrico miscelato. Conservare la soluzione STZ risultante a 4 °C. Assicurarsi che l'iniezione della soluzione STZ avvenga entro 30 minuti, quando possibile.
- Utilizzando una siringa da 1 ml, somministrare iniezioni intraperitoneali di una soluzione contenente 30 mg/kg di STZ al giorno per 7 giorni consecutivi ai topi del gruppo HFD/STZ, fornendo un volume uguale di tampone citrato (0,1 mmol/L, pH = 4,5) ai topi del gruppo ND.
- Dosare i livelli di glucosio nel sangue 1 settimana dopo l'iniezione finale. Classificare i topi che presentano concentrazioni casuali di glucosio nel sangue superiori a 16,7 mmol/L come topi T2DM.
- Posizionare con cura il mouse su un dispositivo di contenimento, assicurandosi che la coda si estenda completamente all'esterno.
- Prima del prelievo del sangue, disinfettare accuratamente il sito di raccolta del sangue della coda con un tampone alcolico al 70%, mantenendo la sterilità e la pulizia.
- Con un ago a punta affilata, inserirlo nella vena della coda, avanzando dalla punta verso la base ad una profondità di 3-4 mm. Una volta che l'ago è saldamente in posizione, premere delicatamente la parte superiore della coda per favorire il flusso sanguigno.
- Raccogliere circa 10 μL di sangue da un topo e applicare con cura il sangue raccolto sulla striscia reattiva dedicata. Una volta assorbito il sangue, il glucometro visualizzerà prontamente la lettura della glicemia.
3. Test di tolleranza al glucosio orale (OGTT)14
- Prima dell'OGTT, digiunare ogni topo durante la notte per 14 ore, mentre ha accesso illimitato all'acqua.
- Preparare circa 10 ml di una soluzione di glucosio al 20%. Somministrare una dose di 1 g/kg di glucosio tramite sonda gastrica orale a ciascun topo durante l'OGTT.
- Monitorare i livelli di glucosio nel sangue in diversi momenti: immediatamente (0 min), 15 min, 30 min, 60 min e 120 min dopo la somministrazione.
4. Valutazione ecocardiografica della funzione cardiaca
- Condurre l'ecocardiografia su ciascun topo al basale (0 settimane), 12 settimane e 24 settimane dopo l'alimentazione con HFD o ND.
- Prima dell'ecocardiografia, anestetizzare il topo mediante inalazione di isoflurano al 3% che viene somministrato con ossigeno al 100% utilizzando una macchina anestetica. Assicurati che il mouse non mostri alcuna reazione al pizzicamento della pelle utilizzando una pinzetta dentata o la stimolazione delle dita e della coda. Applicare un unguento veterinario sugli occhi per prevenire la secchezza durante l'anestesia.
- Posizionare il mouse su un termoforo per mantenere la temperatura corporea e fissare gli artigli a un elettrodo per garantire una posizione supina stabile. Regolare la concentrazione di isoflurano tra l'1% e il 2% per l'anestesia di mantenimento per mantenere una frequenza cardiaca target di circa 450 battiti al minuto.
- Rimuovere il pelo del topo usando una crema depilatoria e applicare il gel ad ultrasuoni sul petto. Rimuovere la crema depilatoria e il gel ad ultrasuoni con soluzione fisiologica sterile dopo l'ecocardiografia.
- Valutare la funzione cardiaca e i parametri strutturali con una sonda da 50 MHz.
- Per ottenere una visuale ottimale dell'asse lungo del ventricolo sinistro (LV), posizionare la sonda sul lato sinistro del torace dell'animale.
- A seconda dell'anatomia individuale, ruotare la sonda in senso antiorario tra 15° e 45° rispetto alla linea parasternale sinistra, con la tacca diretta verso la spalla destra. Regolare l'asse x e l'asse y in modalità B15.
NOTA: Un'appropriata vista dell'asse lungo del ventricolo sinistro dovrebbe includere (i) la valvola aortica e la radice aortica; (ii) la camera LV è posizionata al centro del campo visivo; iii) l'asse base-apice deve essere parallelo al trasduttore16. - Premere M-mode 2 volte per visualizzare la linea di misurazione. Posizionare questa linea a livello del muscolo papillare. Successivamente, eseguire misurazioni per almeno tre battiti cardiaci consecutivi per garantire l'accuratezza. Tocca Salva clip per salvare il cine loop della serie.
- Identificare la dimensione telesistolica come la fase che coincide con l'onda T dell'ECG e determinare la dimensione telediastolica come la fase corrispondente all'onda R dell'ECG.
- Inclinare il pad operativo, assicurandosi che l'angolo superiore sinistro sia il più basso e l'angolo inferiore destro sia il più alto. Regolare la sonda in modo che penetri lungo la direzione dell'apice cardiaco del topo, parallelamente all'asse lungo del cuore, per ottenere una vista transapicale a quattro camere.
- Selezionare successivamente le modalità C (Color Doppler) e PW (PW Doppler), posizionare il volume del campione al punto di velocità più alto, regolare la direzione di campionamento in modo che corrisponda alla direzione del flusso sanguigno e registrare le informazioni emodinamiche della valvola mitrale (onda E e A)16. Tocca Salva clip per salvare il cine loop della serie.
- Interrompere l'inalazione di isoflurano per consentire ai topi di riprendere conoscenza. Rimetti gli animali nelle loro gabbie, alloggiate in un ambiente controllato con un ciclo luce/buio di 12 ore sia alla 0 che alla 12 settimana. Dopo la valutazione ecocardiografica di 24 settimane, sopprimere umanamente i topi attraverso la lussazione cervicale dopo inalazione di isoflurano.
- Eseguire l'analisi della frazione di eiezione (EF), dell'accorciamento della frazione (FS), della parete posteriore del ventricolo sinistro (LVPW), del diametro interno del ventricolo sinistro (LVID), del setto interventricolare (IVS) e del rapporto E/A utilizzando il dongle della workstation.
5. Colorazione istologica
- Dopo aver completato l'analisi ecocardiografica alla 24a settimana, sopprimere il topo mediante lussazione del midollo spinale dopo inalazione di isoflurano.
- Sezionare il mouse usando forbici oftalmiche e pinzette. Recidere accuratamente le costole per garantire la completa esposizione del cuore.
- Perfondere il cuore attraverso l'apice con soluzione salina fino a quando il fegato diventa pallore, indicando una perfusione riuscita. Rimuovere il cuore e sciacquarlo accuratamente con soluzione fisiologica per garantire la completa rimozione del sangue.
- Eseguire l'inclusione in paraffina17.
- Fissare il cuore con formalina al 4% a RT per almeno 24 ore.
- Porre la scatola di disidratazione contenente il cuore in un essiccatore per sottoporla a un processo di disidratazione graduale che prevede la graduale disidratazione dell'alcol e della cera a 65 °C.
- Preparare le sezioni di tessuto17.
- Posizionare il blocco di cera rifilato contenente il muscolo papillare in un microtomo per l'affettatura, con uno spessore di 4 μm, e conservarlo in RT per la colorazione patologica.
- Eseguire la colorazione utilizzando la colorazione tricromica18 di Masson e l'agglutinina del germe di grano (WGA)19 .
Risultati
Questo studio ha comportato l'assegnazione casuale di topi in due gruppi: il gruppo ND e il gruppo HFD/STZ, con 6 topi in ciascun gruppo. Dopo l'ecocardiografia finale e i test OGTT 24 settimane dopo l'alimentazione, i topi sono stati soppressi per prelevare i loro tessuti cardiaci per una valutazione istologica.
HFD/STZ ha causato un evidente aumento di peso corporeo, raggiungendo il suo picco in 12 settimane, ed è stato significativamente più alto rispetto...
Discussione
Data l'ampia prevalenza del diabete mellito e delle complicanze cardiovascolari ad esso associate a livello globale, vi è un urgente bisogno di scoprire i meccanismi molecolari sottostanti e sviluppare strategie preventive e terapeutiche per questa condizione20. La patogenesi della DbCM, una delle complicanze cardiovascolari per i pazienti con T2DM, rimane poco chiara, senza approcci efficaci per prevenire e trattare21. L'assenza di modell...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dalla National Natural Science Foundation of China (numeri di sovvenzione: U23A20395, 81900258 e 82170375); il progetto chiave di ricerca e sviluppo del Dipartimento di Scienza e Tecnologia della Provincia del Sichuan (2022ZDZX0020); Progetto del Fondo Speciale per la Ricerca Clinica (CSCF2020B04) del Ramo Cardiovascolare dell'Associazione Medica Cinese (CSC); 1· 3· 5 progetto del West China Hospital, Università del Sichuan (ZYGD23021). Grazie a Qing Yang (Animal Imaging Core Facilities, West China Hospital, Sichuan University) per il loro aiuto nell'ecografia di piccoli animali.
Materiali
| Name | Company | Catalog Number | Comments |
| Animal ultrosound system | Fujifilm Visual Sonics | VEVO 3100 | Echocardiography |
| Blood glucometer | Yuwell | GU100 | Assess blood glucose level |
| Citric acid | Sigma-Aldrich | 251275 | |
| Isoflurane | RWD life science | R510-22 | Anesthesia |
| Isoflurane vaporizer | RWD life science | R500 | Anesthesia |
| Mouse insulin (INS) ELISA Kit | Wuhan Feiyue Biotechnology Co.,Ltd | FY-EM14029 | Assess serum insulin level |
| Nair hair removal cream | Nair | 255g | Remove the fur of mouse |
| Rodent diet with 60% kcal fat | Research Diets Inc | D12492 | High fat diet feeding |
| Sodium citrate | Sigma-Aldrich | S4641 | |
| Sterile filter | Merck Millipore | SLHV033N | |
| Streptozocin | Solarbio | S8050 | |
| Ultrasound gel | Keppler | KL-250 | Echocardiography |
| Workstation Dongle | Fujifilm Visual Sonics | Vevo LAB | Echocardiographic data analysis |
Riferimenti
- Defronzo, R. A., et al. Type 2 diabetes mellitus. Nat Rev Dis Primers. 1, 15019 (2015).
- Htay, T., et al. Mortality and cardiovascular disease in type 1 and type 2 diabetes. Curr Cardiol Rep. 21 (6), (2019).
- Jia, G., Hill, M. A., Sowers, J. R. Diabetic cardiomyopathy: An update of mechanisms contributing to this clinical entity. Circ Res. 122 (4), 624-638 (2018).
- Kenny, H. C., Abel, E. D. Heart failure in type 2 diabetes mellitus. Circ Res. 124 (1), 121-141 (2019).
- Biernacka, A., et al. Smad3 signaling promotes fibrosis while preserving cardiac and aortic geometry in obese diabetic mice. Circ Heart Fail. 8 (4), 788-798 (2015).
- Van Linthout, S., et al. Reduced MMP-2 activity contributes to cardiac fibrosis in experimental diabetic cardiomyopathy. Basic Res Cardiol. 103 (4), 319-327 (2008).
- Ni, R., et al. Therapeutic inhibition of mitochondrial reactive oxygen species with mito-tempo reduces diabetic cardiomyopathy. Free Radic Biol Med. 90, 12-23 (2016).
- Tan, Y., et al. Diabetic downregulation of Nrf2 activity via erk contributes to oxidative stress-induced insulin resistance in cardiac cells in vitro and in vivo. Diabetes. 60 (2), 625-633 (2011).
- Maack, C., et al. Heart failure and diabetes: Metabolic alterations and therapeutic interventions: A state-of-the-art review from the translational research committee of the heart failure association-european society of cardiology. Eur Heart J. 39 (48), 4243-4254 (2018).
- Ho, K. L., et al. structural and biochemical changes in diabetes and the development of heart failure. Diabetologia. 65 (3), 411-423 (2022).
- Saisho, Y. Beta-cell dysfunction: Its critical role in prevention and management of type 2 diabetes. World J Diabetes. 6 (1), 109-124 (2015).
- Galicia-Garcia, U., et al. Pathophysiology of type 2 diabetes mellitus. Int J Mol Sci. 21 (17), 6275 (2020).
- Junod, A., et al. Studies of the diabetogenic action of streptozotocin. Proc Soc Exp Biol Med. 126 (1), 201-205 (1967).
- Einwallner, E., Nagy, C. Study of in vivo glucose metabolism in high-fat diet-fed mice using oral glucose tolerance test (OGTT) and insulin tolerance test (ITT). J Vis Exp. (131), e56672 (2018).
- Wang, Q., et al. Induction of right ventricular failure by pulmonary artery constriction and evaluation of right ventricular function in mice. J Vis Exp. (147), e59431 (2019).
- Zacchigna, S., et al. Towards standardization of echocardiography for the evaluation of left ventricular function in adult rodents: A position paper of the ESC working group on myocardial function. Cardiovasc Res. 117 (1), 43-59 (2021).
- . Paraffin sides experiment report Available from: https://www.servicebio.com/data-detail?id=5556&code=BLZPSYBG (2022)
- . staining experiment report Available from: https://www.servicebio.com/data-detail?id=5588&code=RSSYBG (2022)
- . Paraffin WGA staining protocol Available from: https://www.servicebio.com/data-detail?id=5041&code=MYYGSYBG (2022)
- Guariguata, L., et al. Global estimates of diabetes prevalence for 2013 and projections for 2035. Diabetes Res Clin Pract. 103 (2), 137-149 (2014).
- Tan, Y., et al. Mechanisms of diabetic cardiomyopathy and potential therapeutic strategies: Preclinical and clinical evidence. Nat Rev Cardiol. 17 (9), 585-607 (2020).
- Prasad, M., et al. A comprehensive review on high -fat diet-induced diabetes mellitus: An epigenetic view. J Nutr Biochem. 107, 109037 (2022).
- Zhang, Y., et al. Positional cloning of the mouse obese gene and its human homologue. Nature. 372 (6505), 425-432 (1994).
- Adingupu, D. D., et al. Sglt2 inhibition with empagliflozin improves coronary microvascular function and cardiac contractility in prediabetic ob/ob(-/-) mice. Cardiovasc Diabetol. 18 (1), 16 (2019).
- Huynh, K., et al. Coenzyme q10 attenuates diastolic dysfunction, cardiomyocyte hypertrophy and cardiac fibrosis in the db/db mouse model of type 2 diabetes. Diabetologia. 55 (5), 1544-1553 (2012).
- Moellmann, J., et al. Empagliflozin improves left ventricular diastolic function of db/db mice. Biochim Biophys Acta Mol Basis Dis. 1866 (8), 165807 (2020).
- Ramirez, E., et al. Eplerenone attenuated cardiac steatosis, apoptosis and diastolic dysfunction in experimental type-ii diabetes. Cardiovasc Diabetol. 12, 172 (2013).
- Fuentes-Antras, J., et al. Updating experimental models of diabetic cardiomyopathy. J Diabetes Res. 2015, 656795 (2015).
- Riehle, C., Bauersachs, J. Of mice and men: Models and mechanisms of diabetic cardiomyopathy. Basic Res Cardiol. 114 (1), 2 (2018).
- Zhao, S., Kusminski, C. M., Scherer, P. E. Adiponectin, leptin and cardiovascular disorders. Circ Res. 128 (1), 136-149 (2021).
- Parilla, J. H., Willard, J. R., Barrow, B. M., Zraika, S. A mouse model of beta-cell dysfunction as seen in human type 2 diabetes. J Diabetes Res. 2018, 6106051 (2018).
- Wang, B., Chandrasekera, P. C., Pippin, J. J. Leptin- and leptin receptor-deficient rodent models: Relevance for human type 2 diabetes. Curr Diabetes Rev. 10 (2), 131-145 (2014).
- Vasanji, Z., Cantor, E. J., Juric, D., Moyen, M., Netticadan, T. Alterations in cardiac contractile performance and sarcoplasmic reticulum function in sucrose-fed rats is associated with insulin resistance. Am J Physiol Cell Physiol. 291 (4), C772-C780 (2006).
- Wright, J. J., et al. Mechanisms for increased myocardial fatty acid utilization following short-term high-fat feeding. Cardiovasc Res. 82 (2), 351-360 (2009).
- Flister, K. F. T., et al. Long-term exposure to high-sucrose diet down-regulates hepatic endoplasmic reticulum-stress adaptive pathways and potentiates de novo lipogenesis in weaned male mice. J Nutr Biochem. 62, 155-166 (2018).
- Kanwal, A., Pillai, V. B., Samant, S., Gupta, M., Gupta, M. P. The nuclear and mitochondrial sirtuins, sirt6 and sirt3, regulate each other's activity and protect the heart from developing obesity-mediated diabetic cardiomyopathy. FASEB J. 33 (10), 10872-10888 (2019).
- Winzell, M. S., Ahren, B. The high-fat diet-fed mouse: A model for studying mechanisms and treatment of impaired glucose tolerance and type 2 diabetes. Diabetes. 53 Suppl 3, S215-S219 (2004).
- Poucher, S. M., et al. Effects of saxagliptin and sitagliptin on glycaemic control and pancreatic beta-cell mass in a streptozotocin-induced mouse model of type 2 diabetes. Diabetes Obes Metab. 14 (10), 918-926 (2012).
- Islam, M. S., Loots Du, T. Experimental rodent models of type 2 diabetes: A review. Methods Find Exp Clin Pharmacol. 31 (4), 249-261 (2009).
- Heydemann, A. An overview of murine high fat diet as a model for type 2 diabetes mellitus. J Diabetes Res. 2016, 2902351 (2016).
- Surwit, R. S., Kuhn, C. M., Cochrane, C., Mccubbin, J. A., Feinglos, M. N. Diet-induced type ii diabetes in c57bl/6j mice. Diabetes. 37 (9), 1163-1167 (1988).
- Clee, S. M., Attie, A. D. The genetic landscape of type 2 diabetes in mice. Endocr Rev. 28 (1), 48-83 (2007).
- Lee, J. Y., Kim, M. J., Moon, C. K., Chung, J. H. Degradation products of streptozotocin do not induce hyperglycemia in rats. Biochem Pharmacol. 46 (11), 2111-2113 (1993).
- Ozturk, N., Uslu, S., Ozdemir, S. Diabetes-induced changes in cardiac voltage-gated ion channels. World J Diabetes. 12 (1), 1-18 (2021).
- Bohne, L. J., Johnson, D., Rose, R. A., Wilton, S. B., Gillis, A. M. The association between diabetes mellitus and atrial fibrillation: Clinical and mechanistic insights. Front Physiol. 10, 135 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon