6.3 : 内能
一种物质中存在的所有可能的各种能量的总和称为内部能量( U ),有时也表示为 E 。假设一个具有初始内部能量Uinitial的系统发生了能量变化(功或热传递),并且该系统的最终内部能量为 U final 。内部能量的变化等于 U final 和 U initial 之间的差异。
尽管无法确定系统的 U final 和 U initial 的值,但第一定律热力学只需要< U 的值,即使不知道 U final   和 U的值也可以确定 initial 。当 U final >出现正值时,< U U 为正。 U initial ,表示系统已从周围环境获取能量。当 U final <等于负值时,< U U 为负。 U initial ,表示系统已向周围环境失去能量。
热量(热能)和功(机械能)是系统与周围环境交换能量的两种不同方式。当能量从周围环境吸收热量( q )或周围环境在系统上起作用时( w ),能量就会转移到系统中。
例如,如果将能量浸入热水中(金属丝吸收水的热量),或者当金属丝快速来回弯曲(由于金属丝变热,则能量会转移到室温金属丝中)完成的工作)。这两个过程都增加了导线的内部能量,这反映在导线温度的升高中。相反,当热量从系统散失或系统确实在周围环境中工作时,能量会从系统中转移出去。例如,火箭燃料的燃烧释放出大量的热量,并且还通过施加一定距离的作用力(使航天飞机从地面升空)在周围环境中进行工作。这两个过程都会降低系统的内部能量。
内部能量,热量和功之间的关系可以用以下等式表示:
这是热力学第一定律的一个版本,它表明系统的内部能量通过流入或流出系统的热量变化或在系统上或由系统完成工作而发生变化。发热和工作的迹象取决于系统获得能量还是损失能量。正 q 是从周围进入系统的热量,而负 q 是从系统流出的热量。如果 w 工作是在系统上完成的,则为正;如果是由系统完成的,则为负。
当 q 和 w 均为正数(> 0)时,< U U 始终为正数(> 0),并且系统的内部能量增加。当 q 和 w 均为负数(< 0)时,< U 始终为负数(< 0),内部能量系统的数量减少。如果 q 和 w 具有不同的符号约定,则< U 的符号取决于 q 和 w 。    
能量,热量和功的SI单位是焦耳(J)。
本文改编自 OpenStax 化学2e,第5.3节:焓。 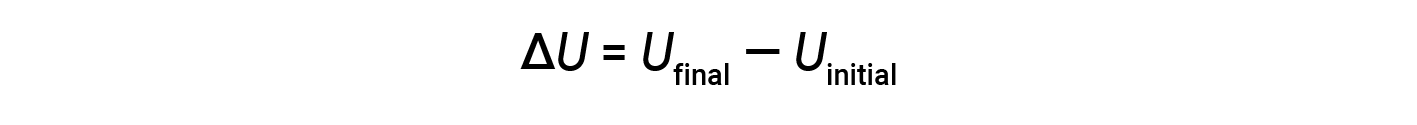
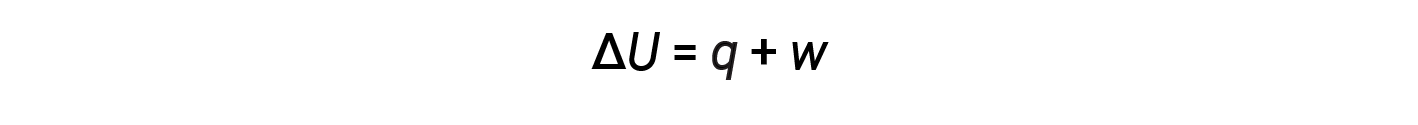
来自章节 6:

Now Playing
6.3 : 内能
热化学
28.7K Views

6.1 : 能源基础
热化学
36.9K Views

6.2 : 热力学第一定律
热化学
31.4K Views

6.4 : 量化热量
热化学
53.8K Views

6.5 : 量化做功
热化学
19.0K Views

6.6 : 焓值
热化学
34.7K Views

6.7 : 热化学方程
热化学
28.2K Views

6.8 : 恒压量热法
热化学
84.6K Views

6.9 : 定容量热法
热化学
26.8K Views

6.10 : 赫斯定律
热化学
44.4K Views

6.11 : 标准生成焓
热化学
41.0K Views

6.12 : 反应焓
热化学
31.4K Views
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。