7.13 : 原子轨道的能量
在一个原子中,带负电的电子被吸引到带正电的原子核上。在多电子原子中,还观察到电子-电子排斥。吸引力和排斥力取决于粒子之间的距离,以及各个粒子上电荷的符号和大小。当粒子上的电荷相反时,它们会相互吸引。如果两个粒子具有相同的电荷,则它们会互相排斥。
随着电荷量的增加,力的量也增加。然而,当电荷分离更多时,力减小。因此,电子与其核之间的吸引力与它们之间的距离成正比。如果电子更靠近原子核,则它与原子核的结合会更紧密;因此,不同壳(不同距离)中的电子具有不同的能量。
对于具有多个能级的原子,由于电子电子排斥,内部电子部分地屏蔽了外部电子免受原子核的吸引。核心电子屏蔽外壳中的电子,而同一价壳中的电子不会有效地阻碍彼此经历的核吸引。这可以用有效核电荷 Z eff 的概念来解释。考虑到任何电子-电子排斥,这是原子核对特定电子施加的拉力。对于氢,只有一个电子,因此核电荷( Z )和有效核电荷( Z eff )相等。对于所有其它原子,内部电子部分屏蔽了外部电子免受原子核的吸引,因此:
屏蔽和穿透的影响很大,并且4 s 电子的能量可能低于3 d 电子。
 轨道穿透描述了电子更靠近原子核的能力。 s 轨道中的电子可以更靠近原子核,并且具有更高的穿透能力。球形 s 轨道的概率密度在原子核处不为零。  不同的子壳具有不同的空间方向。由于哑铃形的轨道, p -电子的渗透要少得多。它的波函数有一个穿过原子核的节点,在那里发现电子的概率为零。因此,与 p 电子相比, s 轨道电子与原子核的结合更紧密,能量更低。与 p 轨道电子相比, d 电子具有更低的穿透力和更高的能量。
轨道穿透描述了电子更靠近原子核的能力。 s 轨道中的电子可以更靠近原子核,并且具有更高的穿透能力。球形 s 轨道的概率密度在原子核处不为零。  不同的子壳具有不同的空间方向。由于哑铃形的轨道, p -电子的渗透要少得多。它的波函数有一个穿过原子核的节点,在那里发现电子的概率为零。因此,与 p 电子相比, s 轨道电子与原子核的结合更紧密,能量更低。与 p 轨道电子相比, d 电子具有更低的穿透力和更高的能量。
对于各种壳和子壳,电子的穿透能力趋势可以描述如下
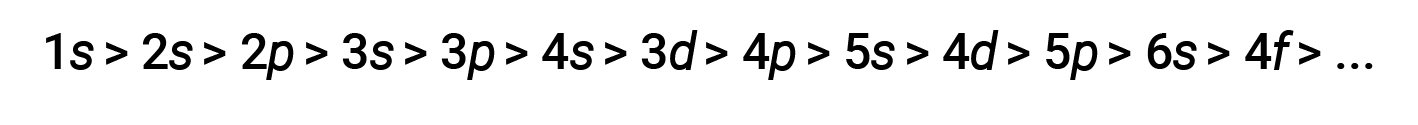
Tags
来自章节 7:

Now Playing
7.13 : 原子轨道的能量
元素的周期律
23.8K Views

7.1 : 光的波动本质
元素的周期律
48.4K Views

7.2 : 电磁频谱
元素的周期律
52.6K Views

7.3 : 干涉和衍射
元素的周期律
31.9K Views

7.4 : 光电效应
元素的周期律
29.3K Views

7.5 : 玻尔模型
元素的周期律
51.2K Views

7.6 : 发射光谱
元素的周期律
50.8K Views

7.7 : 德布罗意波长
元素的周期律
25.3K Views

7.8 : 不确定性原则
元素的周期律
23.1K Views

7.9 : 原子的量子力学模型
元素的周期律
41.9K Views

7.10 : 量子数
元素的周期律
34.3K Views

7.11 : 原子轨道
元素的周期律
33.2K Views

7.12 : 保利排除原则(PEP)亦称:泡利不相容原理
元素的周期律
35.2K Views

7.14 : 构造原理与洪德规则
元素的周期律
46.3K Views

7.15 : 多电子原子的电子构型
元素的周期律
39.2K Views
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。