液体中气体的溶液
对于任何溶液,液体中气体的溶解度都会受到溶质和溶剂物种之间的吸引分子间作用力的影响。 但是,与固体和液体溶质不同,当气体溶质溶解在液体溶剂中时,没有需要克服的 溶质-溶质 分子间吸引力,因为气体的原子或分子是分离得太远,相互作用微不足道。 因此, 溶质-溶剂 相互作用是影响溶解度的唯一能动因素。 例如,氧气的水溶性大约是氦的三倍 (水和较大氧分子之间的色散力越大) ,但比氯甲烷的溶解度高 100 倍,即 CHCl3 (极高氯甲烷分子经历 取向力(即:偶极-偶极作用力) 到极高水分子)。 同样,请注意,六烷 (C6H14) 中的氧气溶解度大约是水中氧气溶解度的 20 倍,因为氧气和较大的六烷分子之间存在更大的色散力。
温度是影响溶解度的另一个因素,气体溶解度通常随着温度的升高而下降。 温度和溶解气体浓度之间的这种反比关系是导致自然水热污染的主要影响之一。
气体溶质的溶解度也受到溶质在溶液所接触的气体中的部分压力的影响。 气体溶解度随着气体压力的增加而增加。
对于许多气体溶质,溶解度,气体和部分压力 PGA 之间的关系是成比例的:
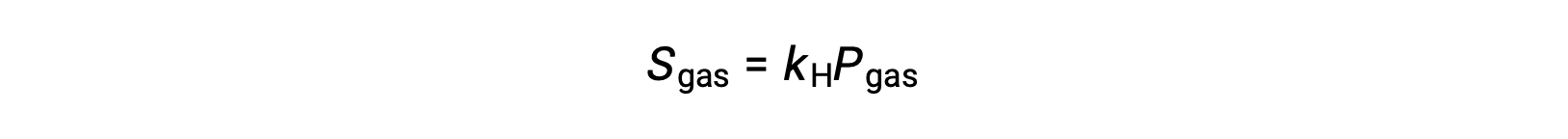
其中 KH 是一种比例常数,取决于气体溶质和溶剂的特性和溶液温度。 这是 亨利定律(Henry's law) 的数学陈述:在一定的体积液体中溶解的理想气体的数量与气体的压力直接成比例。
来自章节 12:

Now Playing
12.6 : 影响溶解度的物理性质
溶液和胶体
22.1K Views

12.1 : 溶液生成
溶液和胶体
30.8K Views

12.2 : 溶液中的分子间力
溶液和胶体
32.5K Views

12.3 : 溶解焓
溶液和胶体
24.4K Views

12.4 : 水溶液与水合热
溶液和胶体
14.1K Views

12.5 : 溶液平衡与饱和
溶液和胶体
18.1K Views

12.7 : 表达溶液浓度
溶液和胶体
57.9K Views

12.8 : 蒸汽压降低
溶液和胶体
25.4K Views

12.9 : 理想溶液
溶液和胶体
18.7K Views

12.10 : 凝固点降低和沸点升高
溶液和胶体
33.6K Views

12.11 : 溶液的渗透和渗透压
溶液和胶体
38.6K Views

12.12 : 电解质: 范特霍夫因子(van't Hoff Factor)
溶液和胶体
32.4K Views

12.13 : 胶体
溶液和胶体
17.2K Views
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。