Solutions de gaz dans les liquides
Comme pour toute solution, la solubilité d'un gaz dans un liquide est influencée par les forces intermoléculaires d'attraction entre les espèces de soluté et de solvant. Cependant, contrairement aux solutés solides et liquides, il n'y a aucune attraction intermoléculaire soluté-soluté à surmonter lorsqu'un soluté gazeux se dissout dans un solvant liquide car les atomes ou les molécules qui constituent un gaz sont éloignés et présentent des interactions négligeables. Par conséquent, les interactions soluté-solvant sont le seul facteur énergétique qui influence la solubilité. Par exemple, la solubilité de l'oxygène dans l'eau est environ trois fois plus grande que celle de l'hélium (il y a des forces de dispersion plus importantes entre l'eau et les molécules d'oxygène plus grosses), mais 100 fois moins importante que la solubilité du chlorométhane, CHCl3 (les molécules de chlorométhane polaire subissent des attractions dipôle-dipôle vers les molécules d'eau polaires). De même, notez que la solubilité de l'oxygène dans l'hexane, C6H14, est environ 20 fois plus grande que dans l'eau parce qu'il existe des forces de dispersion plus importantes entre l'oxygène et les molécules d'hexane plus grosses.
La température est un autre facteur qui influence la solubilité, la solubilité du gaz diminuant généralement à mesure que la température augmente. L'un des principaux impacts de la pollution thermique dans les eaux naturelles est dû à cette relation inverse entre la température et la concentration de gaz dissous.
La solubilité d'un soluté gazeux est également influencée par la pression partielle du soluté dans le gaz auquel la solution est exposée. La solubilité du gaz augmente à mesure que la pression du gaz augmente.
Pour de nombreux solutés gazeux, la relation entre la solubilité, Sgaz, et la pression partielle, Pgaz, est une relation proportionnelle :
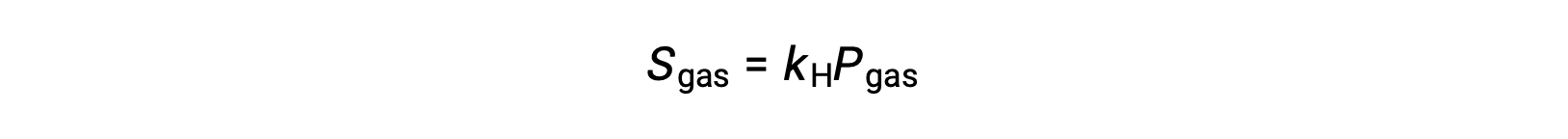
où kH est une constante de proportionnalité qui dépend de l'identité du soluté gazeux et du solvant ainsi que de la température de la solution. C'est une expression mathématique de la loi de Henry : la quantité d'un gaz parfait qui se dissout dans un volume défini de liquide est directement proportionnelle à la pression du gaz.
Ce texte est adapté de Openstax, Chimie 2e, Section 11.3 : Solubilité.
Du chapitre 12:

Now Playing
12.6 : Propriétés physiques affectant la solubilité
Solutions et colloïdes
22.1K Vues

12.1 : Formation de la solution
Solutions et colloïdes
30.8K Vues

12.2 : Forces intermoléculaires dans les solutions
Solutions et colloïdes
32.5K Vues

12.3 : Enthalpie de solution
Solutions et colloïdes
24.4K Vues

12.4 : Solutions aqueuses et enthalpie d'hydratation
Solutions et colloïdes
14.1K Vues

12.5 : Équilibre et saturation de la solution
Solutions et colloïdes
18.1K Vues

12.7 : Exprimer la concentration d'une solution
Solutions et colloïdes
57.9K Vues

12.8 : Abaissement de la pression de vapeur saturante
Solutions et colloïdes
25.4K Vues

12.9 : Solutions idéales
Solutions et colloïdes
18.7K Vues

12.10 : La loi de l'ébulliométrie et la loi de la cryométrie
Solutions et colloïdes
33.6K Vues

12.11 : Osmose et pression osmotique des solutions
Solutions et colloïdes
38.6K Vues

12.12 : Électrolytes : facteur de van 't Hoff
Solutions et colloïdes
32.4K Vues

12.13 : Colloïdes
Solutions et colloïdes
17.2K Vues