反应的平衡常数是根据其反应物和生成物的平衡浓度 (或压力) 计算得出的。 如果已知这些浓度,计算结果只是将其替换为 KC 表达式。
例如,根据该方程,气体二氧化氮形成二氧化丁氮氧化物:
当在 25 °C 条件下将 0.10 mol NO2 添加到 1.0-L 瓶中时,浓度会发生变化,因此在平衡状态下, [NO2] = 0.016 M , [N2O4] = 0.042 M。 反应的平衡常数的值可以按以下公式计算:
接下来将提供一个略具挑战性的示例,其中使用反应化学计量法从提供的信息中得出平衡浓度。 这种计算的基本策略对许多类型的平衡计算非常有用,并且依赖于使用最初出现的反应物和生成物浓度的术语,它们在反应过程中的变化以及系统达到平衡时的变化。 首字母缩略词 ICE 通常用于引用此数学方法,浓度术语通常以表格形式收集,称为 ICE 表。
平衡常数的计算
碘分子与碘离子发生可逆反应,以产生三碘离子。
如果反应前 I2 和 I− 的浓度均等于 1000 × 10−3 M 的溶液产生 6.61 × 10−4 M 的 I2 平衡浓度,反应的平衡常数是多少?
要计算平衡常数,所有反应物和生成物都需要平衡浓度:
提供了反应物的初始浓度和生成物的平衡浓度。 这些信息可用于为反应物的平衡浓度得出术语,并在 ICE 表中显示所有信息。
| I2 (AQ) | I− (AQ) | i3− (AQ) | |
| 初始浓度 (M) | 1.000 × 10−3. | 1.000 × 10−3. | 0|
| 变化 (M) | −x | −x | +x |
| 平衡浓度 (M) | 1000 × 10−3 − x | 1.000 × 10-3 − x | X |
均衡时, I2 的浓度为 6.61 × 10−4 答
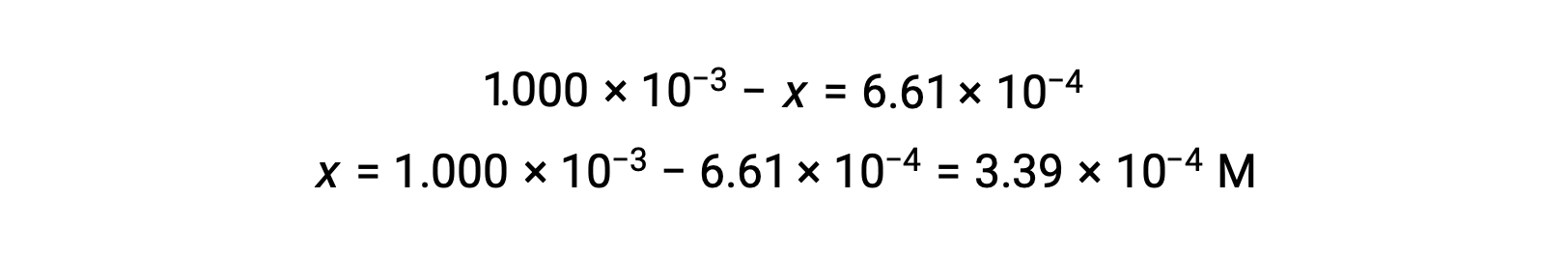
ICE 表现在可以使用所有浓度的数值进行更新:
| I2 (AQ) | I− (AQ) | i3− (AQ) | |
| 初始浓度 (M) | 1.000 × 10−3. | 1.000 × 10−3. | 0|
| 变化 (M) | −3.39 × 10−4. | −3.39 × 10−4. | +3.39 × 10-4. |
| 平衡浓度 (M) | 6.61 × 10−4. | 6.61 × 10−4. | 3.39 × 10−4. |
最后,平衡浓度可以被替代为 KC 表达式并解出:
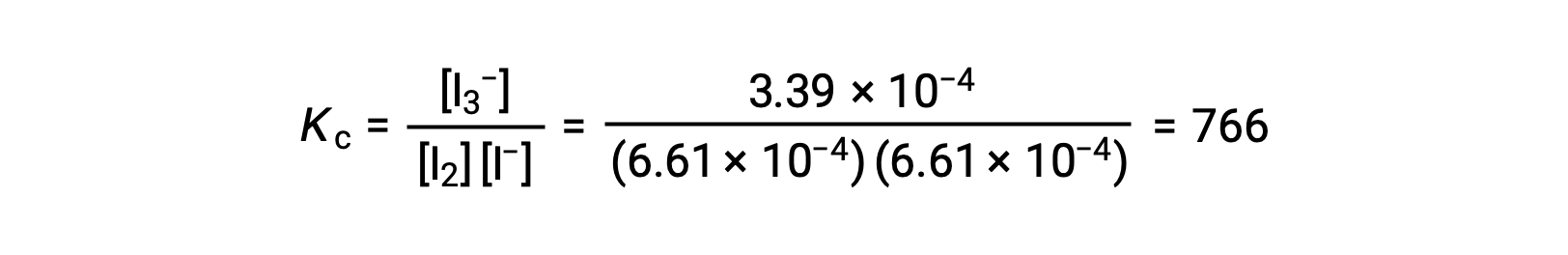
来自章节 14:

Now Playing
14.4 : 计算平衡常数
化学平衡
29.7K Views

14.1 : 动态平衡
化学平衡
48.5K Views

14.2 : 平衡常数
化学平衡
45.0K Views

14.3 : 气态反应和非均相反应的平衡
化学平衡
23.2K Views

14.5 : 反应商
化学平衡
47.1K Views

14.6 : 计算平衡浓度
化学平衡
46.0K Views

14.7 : 勒夏特列原理(Le Chatelier's Principle) :浓度变化
化学平衡
56.3K Views

14.8 : 勒夏特列原理(Le Chatelier's Principle) :体积变化 (压力)
化学平衡
33.2K Views

14.9 : 勒夏特列原理(LeChatelier's Principle) :温度变化
化学平衡
28.2K Views

14.10 : 未知数小x假设
化学平衡
45.3K Views
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。