15.7 : 弱酸溶液
很少有化合物充当强酸。 更多的化合物表现为弱酸,并且只与水发生部分反应,留下大部分溶解分子的原始形式,并产生相对较小的水合氢离子数量。 弱酸在自然环境中常见,是部分导致柑橘果味的物质,昆虫叮咬的刺痛感,以及与身体气味有关的难闻气味。 一个常见的弱酸示例是醋中的主要成分醋酸:
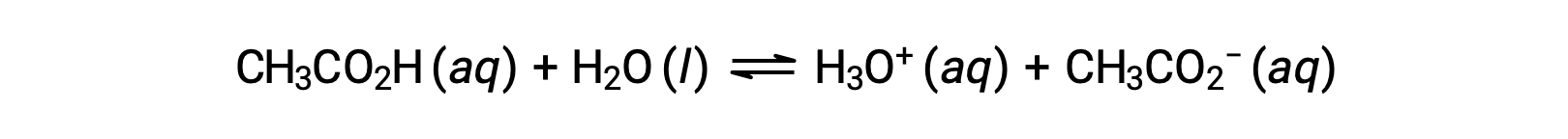
在上述方程中使用双箭头表示此过程的部分反应方面。 在典型条件下,当溶解在水中时,只有大约 1% 的乙酸分子以电离形式出现,即 CH3COO−。
计算水合氢离子浓度, 和一个弱酸溶液的pH值
甲酸 HCO2H 是一种刺激性物质,可导致身体对一些蚂蚁咬和眩目的反应。 什么是水合氢离子的浓度和甲酸 0.534-M 溶液的 pH 值?
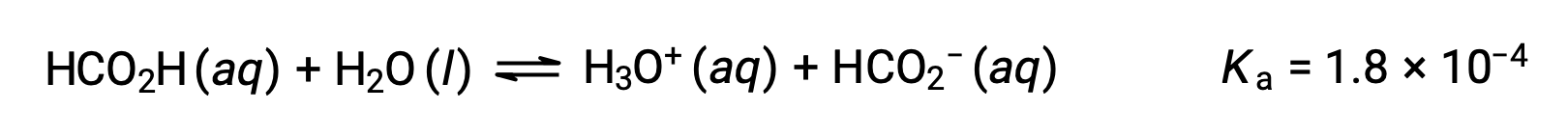
此系统的 ICE表格 是
| HCO2H (AQ) | H3O+ (AQ) | HCO2− (AQ) | |
| 初始浓度 (M) | 0.534 | ~0 | 0|
| 变化 (M) | −x | +x | +x |
| 平衡浓度 (M) | 0.534 − x | X | X |
在 Ka 表达式中用平衡浓度术语代替
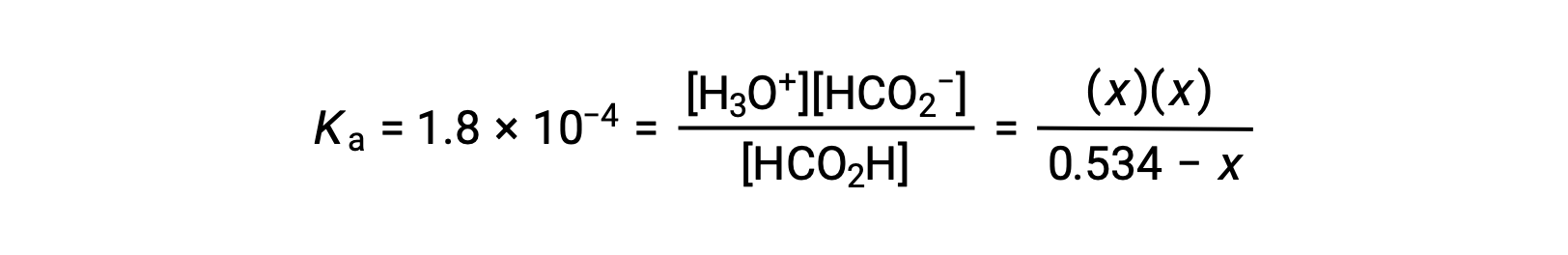
相对较大的初始浓度和较小的平衡常数允许简化假设:x 将大大低于 0.534 ,因此方程将变为
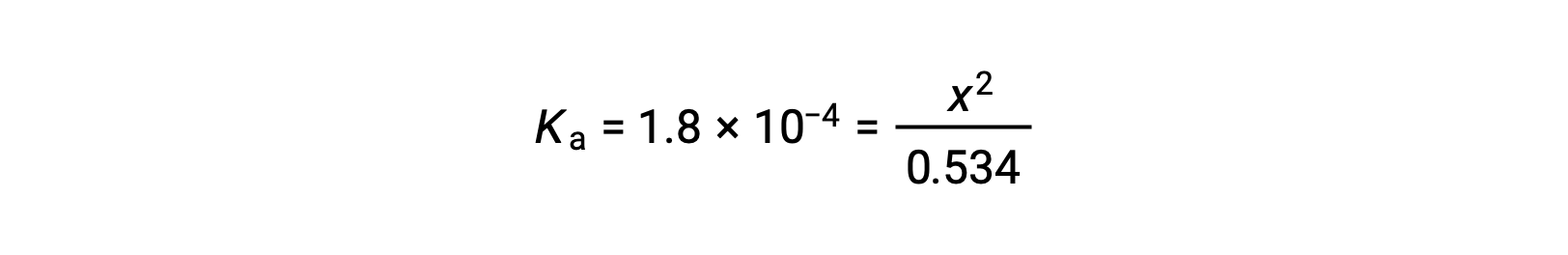
解决方程的 x 产量问题
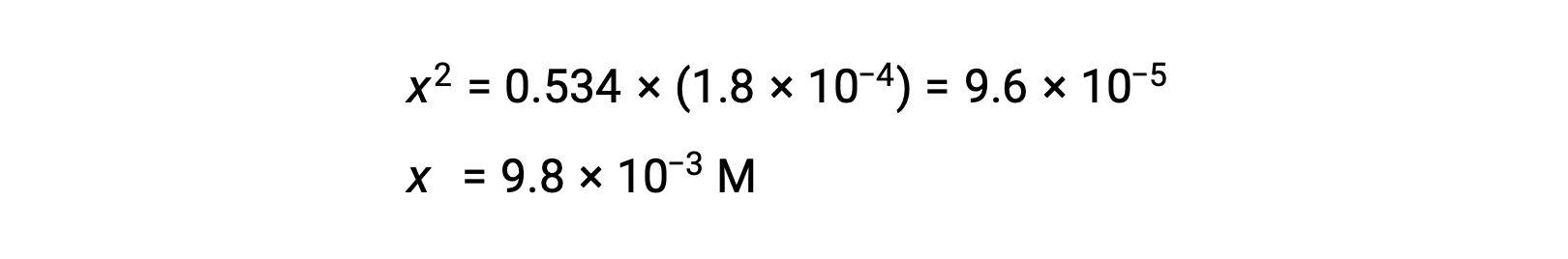
要检查 x 小于 0.534 的假设,可以估计其相对大小:
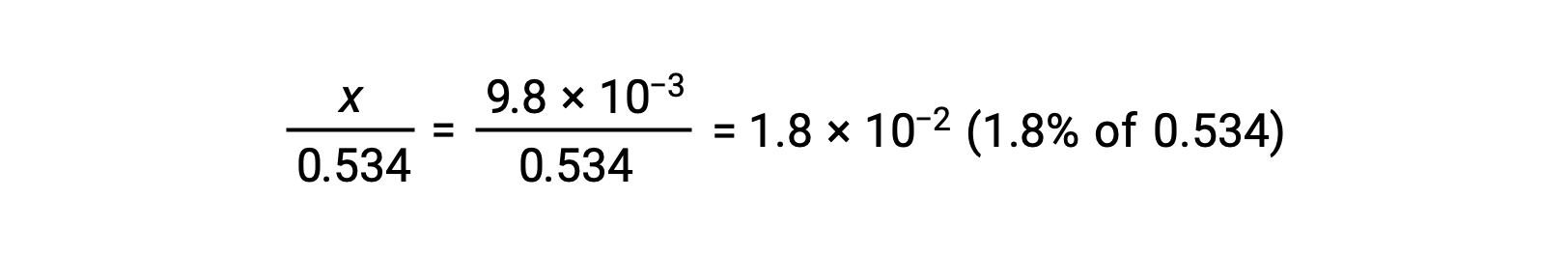
由于x 小于初始浓度的 5% ,因此该假设是有效的。 根据 ICE表格 中的定义,x 等于水合氢离子的平衡浓度:
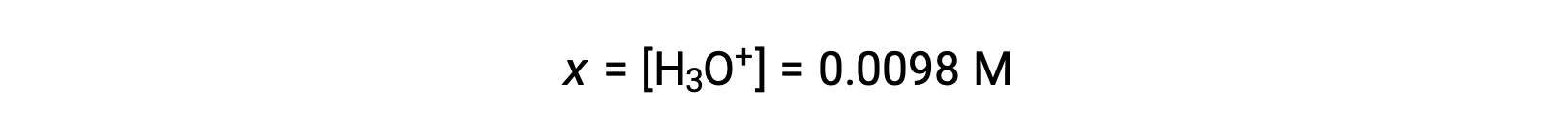
最后, pH 值被计算为
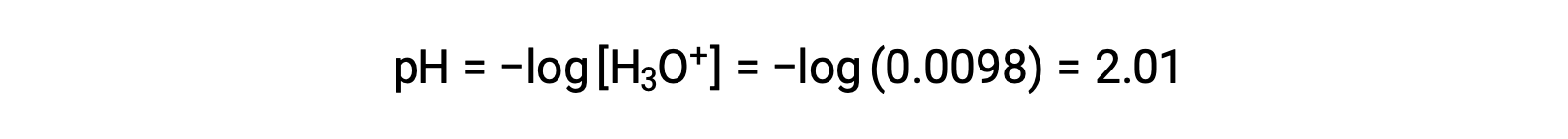
从 pH 值中测定Ka
一种 0.0516 M 溶液的亚氮酸 HNO2 的 pH 值为 2.34。 它是什么?
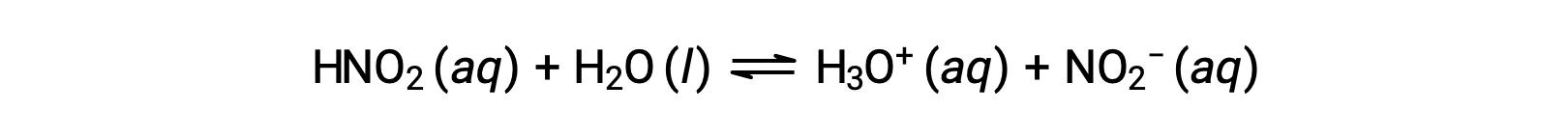
所提供的氮酸浓度是一种正式的浓度,它不会对溶液中可能建立的任何化学平衡产生影响。 使用 ICE表格 方法计算平衡时,此类浓度被视为"初始"值。 请注意,水合氢离子的初始值大约为零,因为水的自电离 (水的体积) 导致 H3O+的小浓度存在 (1 × 10−7 M)。 在许多情况下,这种浓度远远低于相关酸 (或碱) 电离所产生的 ,可能会被忽视。
所提供的 pH 值是一种对数测量水合氢离子浓度的方法,该方法是由一氧化二氮酸的酸电离引起的,因此它代表了 ICE表格 的"均衡"值:
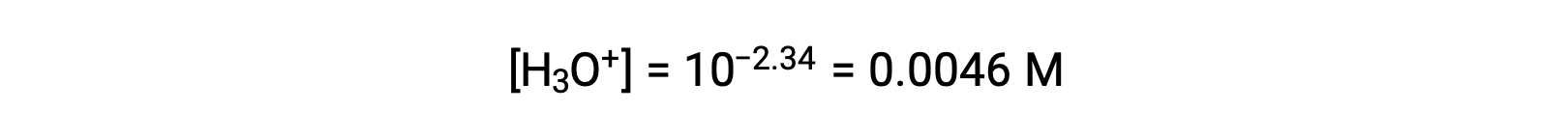
此时,此系统的 ICE表格 就在
| HNO2 (AQ) | H3O+ (AQ) | NO2− (AQ) | |
| 初始浓度 (M) | 0.0516 | ~0 | 0|
| 变化 (M) | −0.0046 | +0.0046 | +0.0046 |
| 平衡浓度 (M) | 0.0470 | 0.0046. | 0.0046. |
最后,使用下表中的数据计算平衡常数的值:
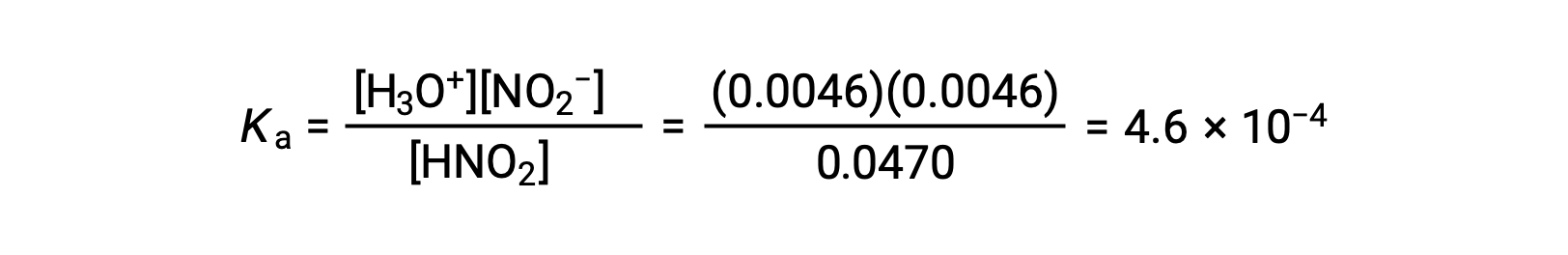
本文改编自 Openstax, 化学 2e, 第 4.2 节:对化学反应和 Openstax, 化学 2e, 第14.3节:酸和碱的相对强度进行分类。
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。