15.7 : 약산 용액
강한 산으로 작용하는 화합물은 거의 없습니다. 훨씬 더 많은 수의 화합물이 약한 산으로 행동하고 부분적으로만 물과 반응하여 용존 분자의 대부분을 원래 형태로 남기고 상대적으로 적은 양의 하이드로늄 이온을 생성합니다. 약한 산은 일반적으로 자연에서 발생, 부분적으로 감귤류 과일의 짜릿한 맛에 대 한 책임 물질 되 고, 벌레 물린의 쏘는 감각, 그리고 신체 냄새와 관련 된 불쾌 한 냄새. 약한 산의 친숙한 예는 식초의 주요 성분인 아세트산입니다.
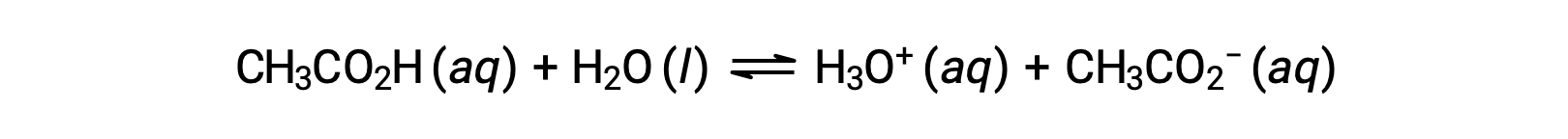
위의 방정식에서 이중 화살표를 사용하면 이 프로세스의 부분 반응 측면을 나타냅니다. 일반적인 조건하에서 물에 용해될 때, 아세트산 분자의 약 1%만이 이온화된 형태로 존재하며, CH3COO-.
하이드로늄 이온 농도 및 약한 산용액의 pH 계산
포믹산, HCO2H는 일부 개미 물린 및 찌르기에 신체의 반응을 일으키는 하나의 자극제입니다. 포름산0.534-M 용액의 하이드로늄 이온과 pH의 농도는 무엇입니까?
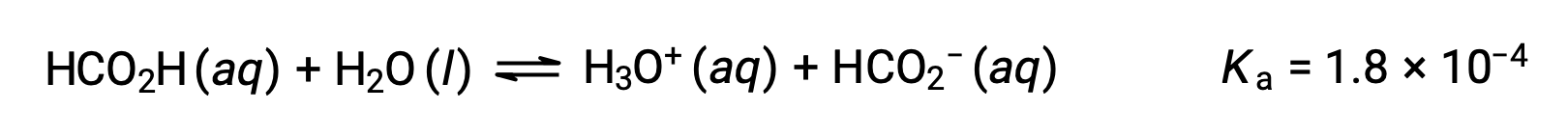
이 시스템의 ICE 테이블은
| HCO2H (aq) | H3O+ (aq) | HCO2- (아크) | |
| 초기 농도(M) | 0.534 | ~0 | 0 |
| 변경(M) | -x | +x | +x |
| 평형 농도 (M) | 0.534 - x | Ⅹ | Ⅹ |
평형 농도 용어를 K로대체하면표현이
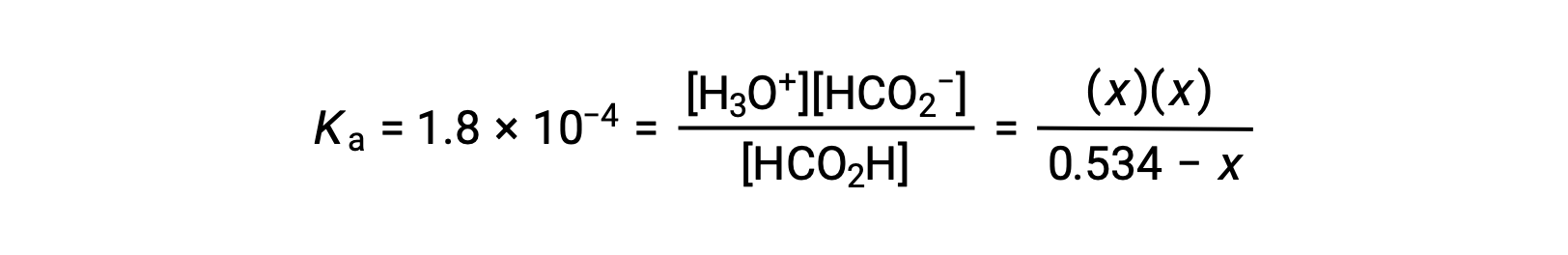
상대적으로 큰 초기 농도와 작은 평형 상수는 x가 0.534보다 훨씬 작다는 단순화 가정을 허용하므로 방정식은
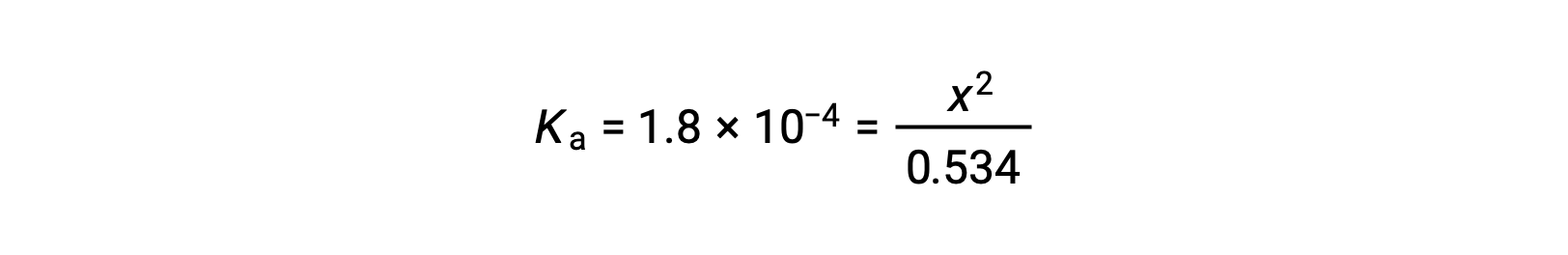
x 수율방정식 해결
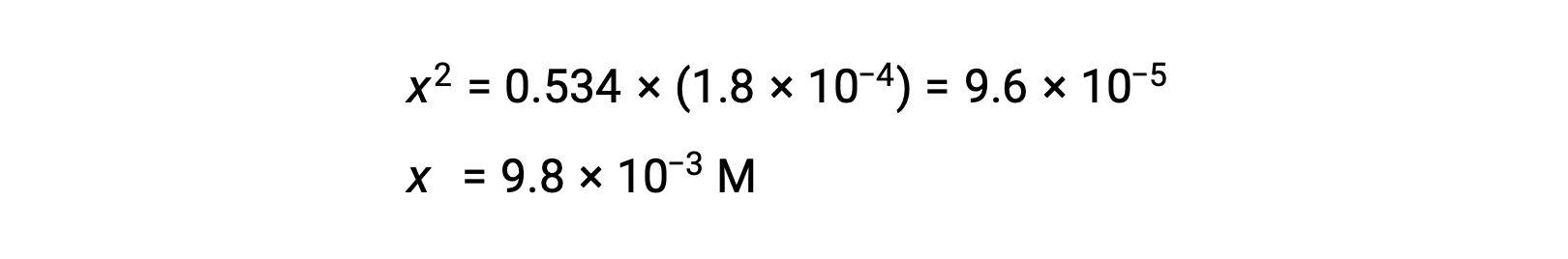
x가 0.534에 비해 작다는 가정을 확인하려면 상대 크기를 추정할 수 있습니다.
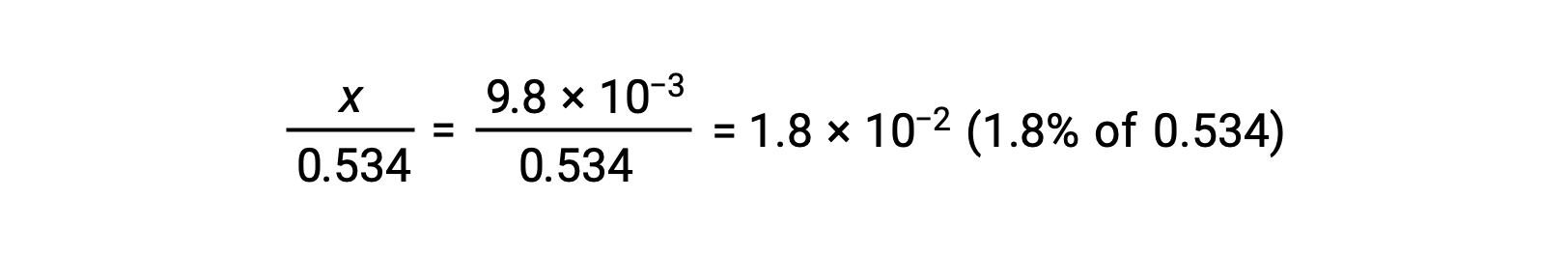
x는 초기 농도의 5% 미만이기 때문에 가정이 유효합니다. ICE 테이블에 정의된 바와 같이 x는 하이드로늄 이온의 평형 농도와 같습니다.
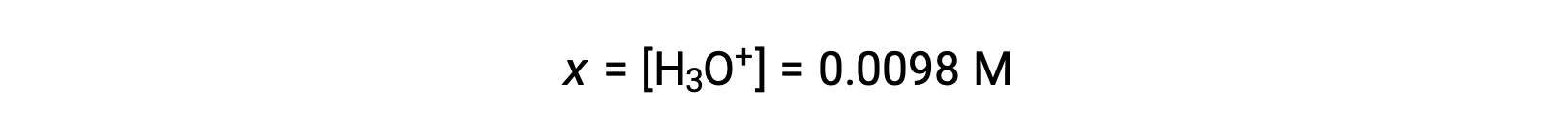
마지막으로, pH는
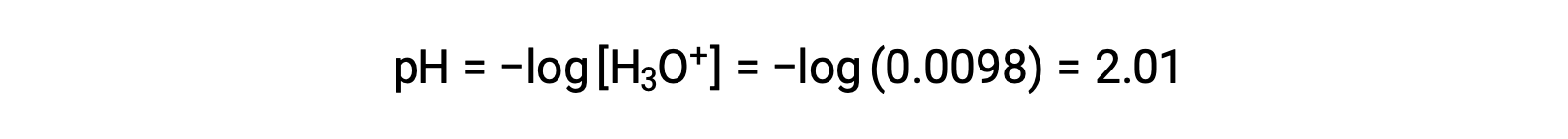
pH로부터 KA의 결정
아산화산의 0.0516 M 용액의 pH, HNO2는2.34이다. 그것의 Ka는 무엇입니까?
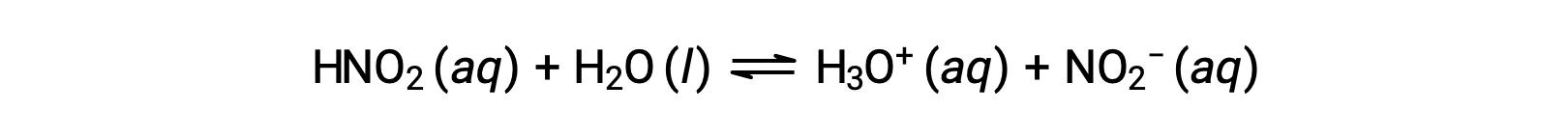
제공된 아질산 농도는 정식 농도이며, 용액에서 확립될 수 있는 화학적 평형을 고려하지 않는다. 이러한 농도는 ICE 테이블 접근 방식을 사용하여 평형 계산을 위한 "초기" 값으로 처리됩니다. 하이드로늄 이온의 초기 값은 물의 자가화로 인해 H3O+의 작은 농도가 존재하기 때문에 약 제로로 나열됩니다 (1 × 10-7 M) 많은 경우에, 이 농도는 문제의 산 (또는 기지)의 이온화에 의해 생성된 것보다 훨씬 적고 소홀히 할 수 있습니다.
제공된 pH는 아산화질소의 산 이온화로 인한 하이드로늄 이온 농도의 로그자리움 측정제이므로 ICE 테이블에 대한 "평형" 값을 나타냅니다.
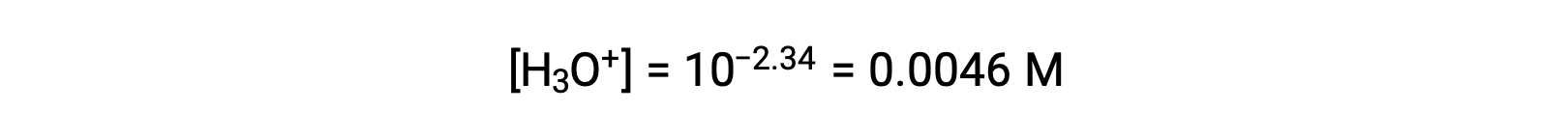
이 시스템의 ICE 테이블은 다음과 같은 것입니다.
| HNO2 (aq) | H3O+ (aq) | NO2- (아크) | |
| 초기 농도(M) | 0.0516 | ~0 | 0 |
| 변경(M) | -0.0046 | +0.0046 | +0.0046 |
| 평형 농도 (M) | 0.0470 | 0.0046 | 0.0046 |
마지막으로 테이블의 데이터를 사용하여 평형 상수값을 계산합니다.
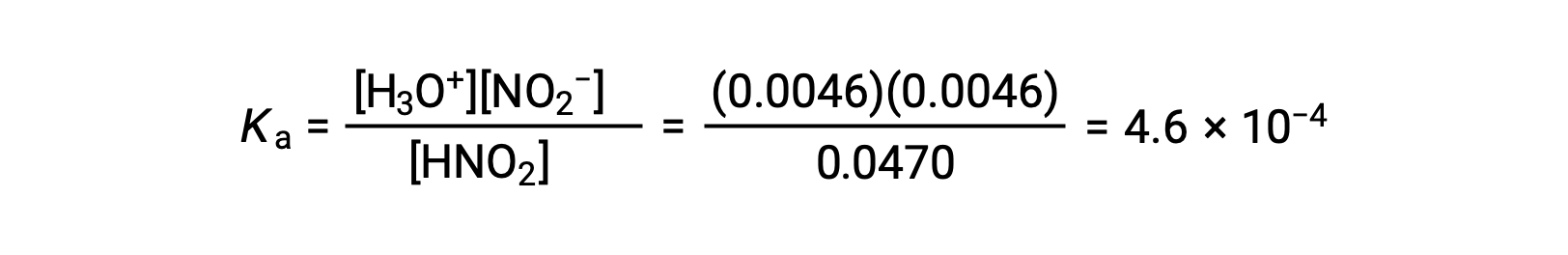
이 텍스트는 Openstax, 화학 2e, 섹션 4.2: 화학 반응을 분류하고 열탁세, 화학 2e,14.3 산및 기지의 상대적 강점에서 채택됩니다.
Copyright © 2025 MyJoVE Corporation. 판권 소유