计算滴定溶液的 pH 值:弱酸 / 强碱
对于带有 0.100 M NaOH 的 25.00 mL 0.100 M CH3CO2H 滴定,反应可以表示为:
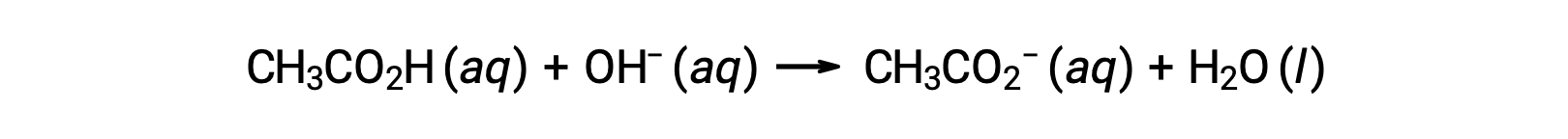
添加不同数量的 NaOH 滴定剂后滴定溶液的 pH 值可按以下公式计算:
(a) 在通常的冰法中为乙酸溶液计算初始 pH 值:
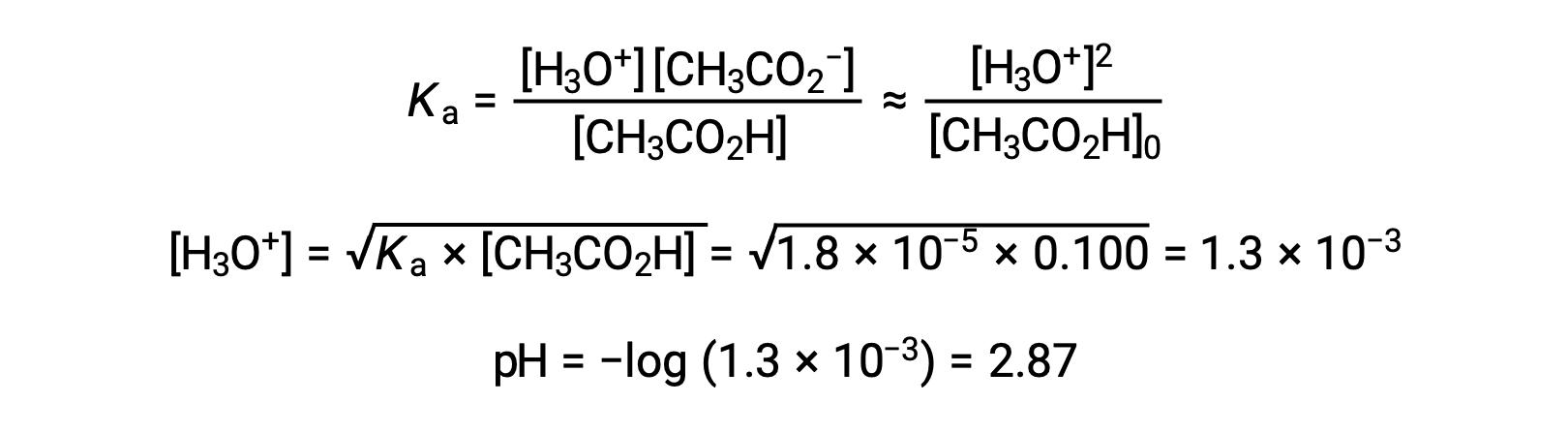
(b) 酸和滴定剂都是单原子体,样本和滴定剂溶液也同样浓度;因此,滴定剂的这一体积代表等效点。 与强酸示例不同,本例中的反应混合物含有弱共轭碱 (醋酸盐离子)。 溶液 pH 值是根据乙酸盐的碱电离计算得出的,该电离存在于的浓度中
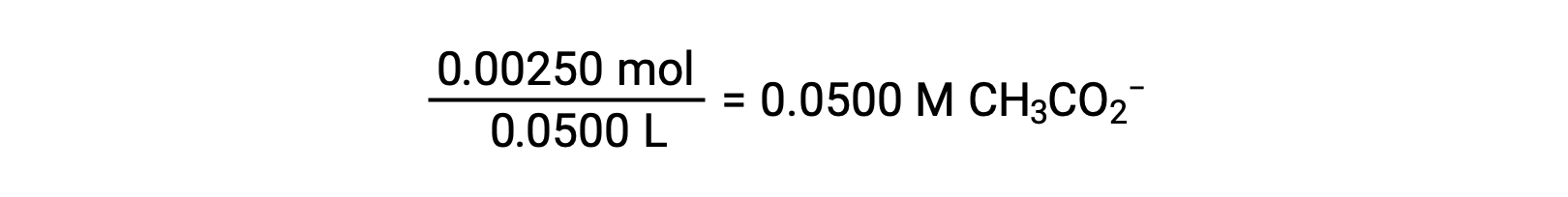
乙酸乙酸的碱电离由方程表示
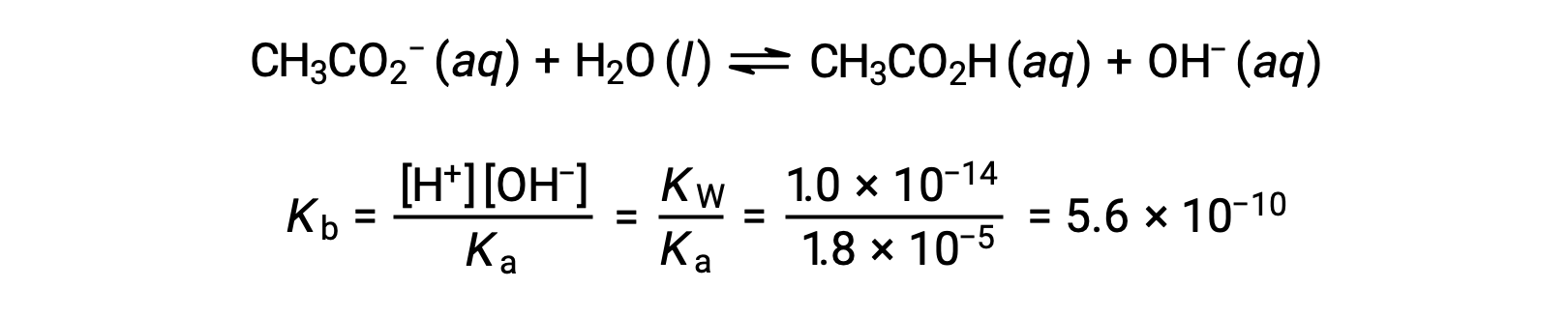
假设 x <<0.0500 , pH 值可以通过通常的冰法计算:
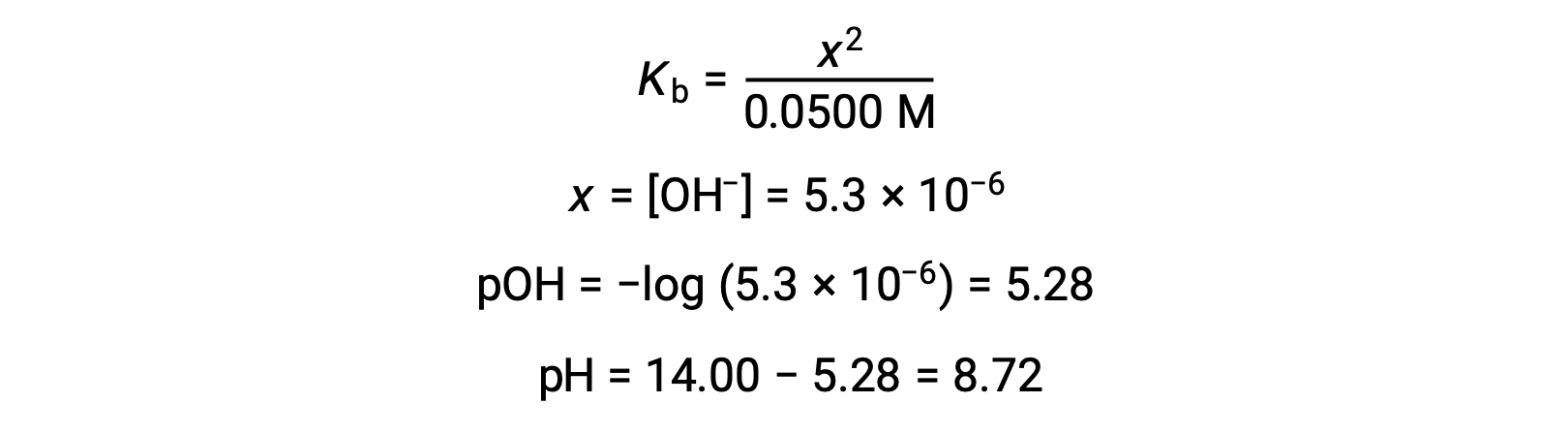
请注意,当对具有强碱的弱酸进行滴定时,该滴定的等效点的 pH 值明显为大于 7。
(C) 滴液体积 = 12.50 mL。 这种体积代表滴定物质的化学化学比数量的一半,因此,半数乙酸被中和到产率等效的醋酸离子数量。 因此,这些共轭 酸-碱 合作伙伴的浓度相等。 计算 pH 值的一个方便方法是使用 亨德森-哈塞尔巴尔赫方程(Henderson-Hasselbalch Equation) :
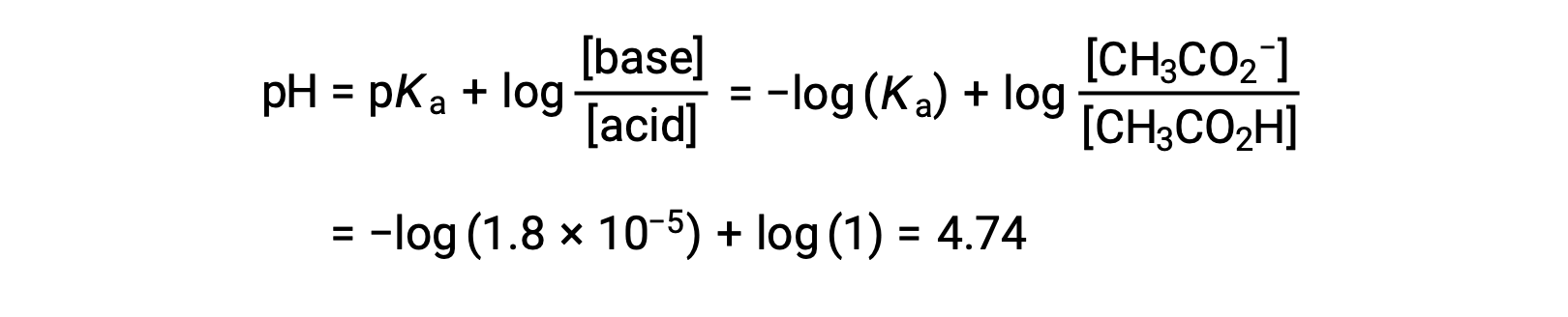
(pH = 滴定中半等效点的 pka 弱酸)
(d) 滴液体积 = 37.50 mL。 该体积表示滴定物质的化学比浊度过量,以及含有滴定生成物,醋酸盐离子和强滴定物质的反应溶液。 在这种溶液中,溶液 pH 主要由超强碱的数量测定:

来自章节 16:

Now Playing
16.7 : 滴定计算:弱酸 - 弱碱
酸碱和溶解度平衡
43.5K Views

16.1 : 同离子效应
酸碱和溶解度平衡
40.7K Views

16.2 : 缓冲液
酸碱和溶解度平衡
163.1K Views

16.3 : 亨德森-哈塞尔巴尔赫方程(Henderson-Hasselbalch Equation)
酸碱和溶解度平衡
67.8K Views

16.4 : 计算缓冲溶液中的 pH 值变化
酸碱和溶解度平衡
52.3K Views

16.5 : 缓冲液效力
酸碱和溶解度平衡
48.3K Views

16.6 : 滴定计算:强酸 - 强碱
酸碱和溶解度平衡
28.8K Views

16.8 : 指标
酸碱和溶解度平衡
47.6K Views

16.9 : 多质子酸的滴定
酸碱和溶解度平衡
95.5K Views

16.10 : 溶解度平衡
酸碱和溶解度平衡
51.4K Views

16.11 : 影响溶解度的因素
酸碱和溶解度平衡
32.8K Views

16.12 : 错合离子的形成
酸碱和溶解度平衡
23.0K Views

16.13 : 离子沉淀
酸碱和溶解度平衡
27.3K Views

16.14 : 定性分析
酸碱和溶解度平衡
19.9K Views

16.15 : 酸-碱 滴定曲线
酸碱和溶解度平衡
125.7K Views
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。