需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
含量测定扩散的信号分子能够重新调整胚胎脊髓连合轴突
摘要
这种检测评估的一种信号分子的能力,这里骨形态发生蛋白7(BMP7),调整连合轴突。一个胚胎脊髓背侧的外植体是培养毗邻COS细胞分泌候选人生长因子的总和。重新调整连合轴突生长外植体内免疫组织化学显示。
摘要
在脊椎动物的脊髓后连合轴突一直是非常宝贵的模型系统,在其中找出轴突导向信号。在这里,我们描述了一个在体外实验中,“转岗检测”,已广泛用于研究方向 2连合轴突的外在和内在信号的影响。此法简多德,托马斯Jessell和安德鲁拉姆斯登的实验室中的许多人(详情请参阅确认),这个实验版本用于演示重新定位的关键轴突导向分子的活动,包括BMP在chemorepellent顶板3,4和Netrin1 5和刺猬(SHH)在脊髓中的底板 6 chemoattractive活动。
外植体,包括2-3段脊髓背三分之二是从胚胎一天(五)11大鼠解剖,并在三维胶原凝胶 7中培养。 E11背脊髓植包含新出生的连合神经元,他们的糖蛋白,TAG1 8轴突的表达,可以通过确定的。在30-40小时在培养过程中,连合轴突轨迹是在同一个时间过程相似,在体内看到这些背植详。这轴突的轨迹,可以放置或者测试组织或一个背外植体的外侧边缘接触的候选信号分子表达的COS细胞总的挑战。连合轴突延长追加组织附近的内源性顶板和信号从横向组织异位的影响下成长。在这种情况下,重新调整的程度,连合轴突可以量化的。使用这个实验中,它可能既要研究的一个特定的信号重新调整连合轴突,以及为这个信号直接连合的轨迹9的必要性3,4自给自足。
研究方案
第1部分:使用悬滴转染COS细胞聚合制备
- 种子COS - 7(COS)在35mm培养皿中的细胞。当他们到达80%汇合,到使用Lipofectamine2000根据制造商S协议细胞的表达质粒转染1μg。
- 为了准备吊滴,吸转染介质和细胞的转染COS1毫升的1X的磷酸盐缓冲液(PBS)冲洗。治疗与无细胞酶的解离15分钟的中等0.5毫升的细胞。添加OPTI - MEM + 1青霉素/链霉素/谷氨酰胺(P / S / G)+ 10%小牛血清(FBS),停止反应的解决方案1毫升。
- 磨碎的细胞培养皿的表面删除,并转移到一个15毫升锥形管。旋转2分钟沉淀细胞在2000K。删除OPTI - MEM + 1X P / S / G + 10%FBS的100μL上清,重悬沉淀。
- 点上一个35mm培养皿的盖子内的多个20μL滴,反转盘底部顶部的盖子和地点,并在37 ° C培养箱离开几个小时,待细胞总。
第2部分:背侧脊髓外植体的制备
- 从母亲的子宫解剖E11大鼠胚胎,并保持在L15的介质上的冰,直到需要。
- 有了一个削尖的钨针,请从每个胚胎的躯干4-6段部分,从下方前肢芽的区域。用塑料吸管,收集在一个4以及NUNC菜的组织块,置于冰上。
- 当所有的胚胎段已被解剖,用塑料吸管转移到一个解决方案,为1ml L15 + 1mg的dispase在NUNC盘的第二件。在室温下孵育时间不超过5分钟。不要过度的孵化与dispase组织块。
- 在孵化期间,加入热灭活正常山羊血清(HIGS)0.5毫升L1510毫升到培养皿中,漩涡混合。转移到第三NUNC菜的这一解决方案1毫升,并转移到该解决方案的组织块,孵化结束时。置于冰上。注意:如果允许一个小时“休息”冰的组织块,随后的剥离会比较容易。
第3部分:底漆胶原蛋白
- 加入40μl10倍最小的必不可少的中等至360μl胶原蛋白,混合迅速,彻底地轻弹或简要涡旋管。在picofuge迅速降速。该解决方案将是黄色的。,尽可能保持在冰上 。
- 添加足够的0.8M的碳酸氢钠( 碳酸氢钠3)打开略有橙色的胶原蛋白溶液(见下面的说明) 。再次,混合迅速,彻底地弹和自旋向下picofuge简要。如果解决方案仍然是粉红色混合后,你有太多碳酸氢钠 3,将需要再次开始的胶原蛋白的新鲜管。
- 此时,胶原溶液催芽。它仍将在冰上的液体,但巩固带来至室温时,将在5分钟左右(车削粉红色)。
- 在每一个4孔NUNC菜以及胶原蛋白的现货20μL。使用吸管的笔尖,摊开的胶原蛋白,以形成一个小型的“垫”。让我们在室温胶原。
注:3碳酸氢钠的确切数额将需要每批胶原蛋白的滴定。起点低(11μl),然后添加0.5 -1μl进逐步直到解决方案是一个橙色轻微阴影。 “正 确”的数额通常会变成胶原蛋白粉红色的最小量的碳酸氢钠 3 1ul 。碳酸氢钠3量并不线性比例上升或下降。
第4部分:夹层背侧脊髓外植体和他们的定位与COS在胶原蛋白基质细胞聚集
- 使用新鲜削尖的钨针和一双细镊子(#5或#55),取出脊髓周围的中胚层。
- 平行切割的底板与钨针,小心取出脊髓腹侧第五。
- 对开背侧脊髓外植体,确保边缘尽可能干净切。重新修剪的边缘,如果有必要。每个背侧脊髓外植体转移到单独的胶原蛋白,使用移液器装上拉至大约用玻璃毛细管管口垫。 0.5毫米直径。
- 切转染COS细胞约背侧脊髓外植体的外侧边缘的宽度相同的平方的总和。
- 这些广场之一转移到背侧脊髓外植体的胶原蛋白垫,使用口吸管。
- 用口吸管,吸过任何多余的液体,用口吸管。不要过度吸。
- 应用到催芽胶原4μl,垫,使用钨针不直接接触组织的胶原蛋白,在植。通过移动在植体周围的胶原的钨针,东方植,使COS细胞总量的背侧脊髓外植体外侧缘旁。
- 胶原蛋白后,重复的胶原蛋白4μl的应用,以确保外植体完全包裹在胶原。
- 在组织培养罩中,添加OPTI - MEM + 1xP/S/G和30-40小时的文化0.5毫升。
- 修复植0.5毫升4%多聚甲醛在1xPBS 45分钟,冰板。
- 洗两次的1xPBS封闭液+ 0.1%,1%TRITON - X100 HIGS(PBTN)0.5毫升。座在4 ° C的至少几个小时,孵育过夜,是可取的,然后通过免疫组化的过程中。
第5部分:通过免疫组连合轴突的可视化
- PBTN阻断后,削减的植产钳和一个48孔盘的4孔板。
- 新增的主要抗体200μL,每孔,留在4℃过夜° C。为了形象化连合轴突,使用鼠抗TAG1抗体1:6的解决方案。要确定转染是否成功,还包括对被测试的信号分子,或相关的抗原表位的信号分子已被抗原表位标记的抗体。
- 每个样品洗5 × 1小时PBTN在4 ° C。
- 新增二级抗体200μL,每孔,留在4℃过夜° C。如果反TAG1抗体作为第一抗体,羊抗小鼠IgM二抗耦合FITC或Cy3标记。 如果加上使用光敏二级抗体FITC或Cy3标记,保持箔覆盖从这个角度上的48孔盘。
- 洗净每个样品5 × 1小时PBTN 4 ° C。
- 转移的外植体,以3以及抑郁症的幻灯片,删除多余的液体,Vectashield中型和盖玻片的安装。在轻保险箱商店,4 ° C或-20 ° C
第6部分:外植体的代表图片
在一个成功的实验,外植体和COS的总将保持彼此相邻,而不是疏远胶原套。会有最小的轴突的繁茂;显着的轴突的繁茂表示,背侧脊髓外植体培养时间过长。将有从外植体生长无滤过泡;出泡发生,如果组织直接接触带有培养基。
使用共聚焦显微镜的信号分子的能力,重新调整轴突评估。通过测量平均角度调整最接近的COS细胞总3的轴突,轴突转岗程度可以量化。如图1所示,COS细胞中表达myc基因标签BMP7(蓝色)重新调整TAG1连合轴突+(绿色),类似的方式,顶板的外植体排斥连合轴突(图BMP7源(图1B ) 1A)。 COS细胞中表达的控制向量3,4连合轴突的方向没有影响。这些植也被标记抗体对转录因子Isl1 / 2(红色),其中装饰运动神经元和背interneurons。这一结果首次显示了BMP家族介导成员顶板chemorepellent 3的活性。
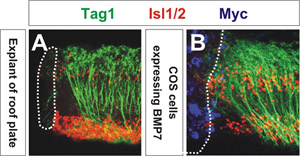
图1:请点击这里看到图1的放大版本。
讨论
确定在执行这个实验成功的关键因素,首先,组织不应与太长时间的一个时期dispase治疗,这种治疗会导致组织变得很粘和减少可行性。二,胶原蛋白,必须完全底漆和保持尽可能在冰上。这将成为越来越难以处理,如果它开始设置,即变成粉红色。三,钨针必须始终保持非常尖锐的。
致谢
此协议是在简多德,托马斯Jessell和安德鲁拉姆斯登的实验室开发的。许多人,包括康拉德巴斯勒,安Calof,托马斯埃德伦德,菲尔汉密尔顿,Domna Karagogeos,沙龙鲁伊斯我Altaba和俊山田决定如何脊髓胶原蛋白的文化植。 Marysia Placzek和马克特西尔儿率先使用在体外植体作为识别轴突导向分子的手段的轴突的生长技术。巴特勒实验室的工作是从3月从美国国立卫生研究院/ NINDS优生优育基金会和R01 NS063999的赠款支持。
材料

参考文献
- Altman, J., Bayer, S. A. . The development of the rat spinal cord. , (1984).
- Placzek, M. Tissue recombinations in collagen gels. Methods in molecular biology. , 325-335 (2008).
- Augsburger, A., Schuchardt, A. BMPs as mediators of roof plate repulsion of commissural neurons. Neuron. 24, 127-141 (1999).
- Butler, S. J., Dodd, J. A role for BMP heterodimers in roof plate-mediated repulsion of commissural axons. Neuron. 38, 389-401 (2003).
- Kennedy, T. E., Serafini, T. Netrins are diffusible chemotropic factors for commissural axons in the embryonic spinal cord. Cell. 78, 425-435 (1994).
- Charron, F., Stein, E. The morphogen sonic hedgehog is an axonal chemoattractant that collaborates with netrin-1 in midline axon guidance. Cell. 113, 11-23 (2003).
- Lumsden, A. G., Davies, A. M. Chemotropic effect of specific target epithelium in the developing mammalian nervous system. Nature. 323, 538-539 (1986).
- Dodd, J., Morton, S. B. Spatial regulation of axonal glycoprotein expression on subsets of embryonic spinal neurons. Neuron. 1, 105-116 (1988).
- Yamauchi, K., Phan, K. D., Butler, S. J. BMP type I receptor complexes have distinct activities mediating cell fate and axon guidance decisions. Development. 135, 1119-1128 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。