需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
活细胞成像和胚胎上皮细胞的定量分析非洲爪蟾
摘要
非洲爪蟾胚胎上皮细胞是一个理想的模型系统来研究细胞极性的发展,并在上皮细胞形态发生改变形状等行为。传统的固定标本组织学正越来越多地辅以活细胞共聚焦成像。在这里,我们展示了隔离青蛙组织和可视化生活的上皮细胞和其骨架采用活细胞共聚焦显微镜的方法。
摘要
胚胎上皮细胞作为一个理想的模型来研究多细胞组织进行,如在细胞表面的面积和单元格的高度的变化,其几何形状的变化的形态发生,细胞进行有丝分裂和迁移。此外,上皮细胞也可以调节在癌旁组织的形态
研究方案
开始之前
- 皑皑的mRNA合成荧光标记的蛋白质和净化的mRNA(AmpliCap转录试剂盒;震中的生物技术,麦迪逊无线网络)的标准方法进行编码,从线性DNA模板。表达应为单一的使用时间在0.2 mL离心管分装,储存在-80 ° C
- 标准的方法来获得试管受精鸡蛋,,并去除鸡蛋皮已被描述以前 2 。前面3,一个程序,以获得从非洲爪蟾雌蛙卵已被证明。 在体外卵受精后,立即获得使用,从男性青蛙以前孤立睾丸的女蛙。果冻蛋的受精后20分钟,注入mRNA,蛋白质,DNA,或右旋糖酐立即允许足够的扩散显微注射试剂。注射受精后1个多小时,往往不能从注射部位扩散。
- 卵母细胞显微注射法已被证明以前使用压力阀控制的喷油器(PLI - 100,美国哈佛大学器械)。按照类似的方法为注入青蛙胚胎的动物半球的mRNA在1 - 4细胞期。受精的胚胎转移到3%聚蔗糖(Sigma公司,密苏里州圣路易斯)1X按揭证券(MBS -聚蔗糖)和microinject所需的量上限绿色荧光蛋白的mRNA编码的针对性膜(MEM - GFP)或F(2到4 NL)肌动蛋白(MOE - GFP)。为了获得均匀分布在4等距网站在动物极注入的mRNA。胚胎可以保持几个小时,但需要转移,原肠开始前1 / 3 ×按揭证券MBS -聚蔗糖。
所需的材料(*标记的项目,如图1所示):
- 解剖立体显微镜,光纤照明。冷却夹层阶段建议,但可选的。
- 美发工具(头发刀和头发循环)*
- 钳(杜蒙#5不锈钢;精细的科学工具,福斯特城,加利福尼亚)*.
- 修改巴特的盐水胚胎文化传媒(按揭证券; 88 mM的氯化钠,2.4 mM的碳酸氢钠3 1 mM的氯化钾,0.33 mM的氯化钙2,0.41 mM的(卡诺3)2,0.82 mM的硫酸镁4,10(H3375,Sigma - Aldrich公司毫米HEPES,圣路易斯MO))。
- Danilchik的艾米植文化传媒(DFA;氯化钠2 53毫米,5毫米的Na 2 CO 3的 ,4.5毫米钾葡萄糖酸钙,葡萄糖酸钠32毫米,1毫米氯化钙 , 硫酸镁 1MM)。包括0.1%的牛血清白蛋白(BSA; A7906,Sigma - Aldrich公司与DFA)。 DFA必须无菌过滤,但可以分装在50 ml锥形管,并储存在-20 ° C抗生素和antimycotics(在媒体的0.8%; A5955,Sigma - Aldrich公司)应加入到刚刚解冻的DFA抑制细菌或真菌生长。
- 60或100毫米的培养皿*。
- 大型玻璃盖,由50毫米(12 - 544 - F#1.5;费舍尔科学,汉普顿,NH)45 *.
- 小盖玻璃,40毫米(12 - 544C,#1.5;费舍尔科学)24。
- 硅脂(高真空,陶氏化学)装入注射器“嵌缝枪”*.
- 自定义丙烯酸商会或尼龙垫圈(小零件有限公司,美丽华,佛罗里达州)*.自定义商会可以被碾碎5毫米丙烯酸块提供内宅为1.2厘米,2.8厘米,从25 50在一台机器店。这个会议厅内,有一个工作容积168毫升。在多种尺寸可以选择可选的尼龙垫圈,我们宁愿尺寸18毫米直径的圆形盖玻片的兼容。
- 钻石铅笔*。
第1部分:动物帽外植体切除
- 文化胚胎所需的阶段,1 / 3 ×按揭证券5。可控制温度° C,使实验可以在方便的时候一天做15和21之间的文化发展速度。室温下可使用,但胚胎将更快发展。
- 胚胎转移到DFA。
- 使用镊子取出卵黄膜。
- 动物帽外植体,体视显微镜下解剖,消费使用的头发,刀和头发循环 6 。使用吹风循环支持或保持在胚胎的位置和头发刀,做一个胚胎的动物极小切口。使用反复轻弹头发刀“切”,使360 °切口,从胚胎中删除的动物第外胚层。通过实践,我们可以顺利削减,在造成损害最小的保证金外植体或裂解的细胞(图2A)。
- 重复步骤4,消费3至4个动物第植,并进行第2部分。一个切割外植体的同时,一定要快,因为他们有一种倾向,球迅速。冷却夹层阶段可以缓慢的过程,或者你也可以少植。
第2部分:准备钱伯斯,负载外植体,和密封的长期文化室
- 使用硅脂胶或密封的丙烯酸室的大玻璃盖。
- 减少外植体的附着力与非粘性基板玻璃大衣内室的玻璃,孵化室2至4小时,在室温或4℃过夜° C,1%BSA的1 / 3 ×按揭证券(牛血清白蛋白- MBS)。
- 准备使用钻石铅笔的小盖玻片片段(约8毫米2)。与BSA的按揭证券的预涂层的片段。
- 冲洗室BSA MBS和替换与DFA媒体。
- 海关动物第植(S)(第1部分;图2A),转移到会议厅。每个外植体,用头发循环(面临腔底部的上皮细胞层)的位置,轻轻地固定在玻璃盖玻片高真空润滑脂(图2B)由小DABS举行的片段外植体。要非常小心,同时按下盖玻片,因为过大的压力,可以很容易地打破了外植体。多植,可装入大小的小盖玻片片段,用来固定到位植基于每个分庭。随着实践多达20个外植体可以被加载到这里描述的丙烯酸室。即使在顶部的开放与DFA的商会,直到填写。使用硅脂密封室顶部的24个40毫米的玻璃盖。添加或删除DFA的密封腔室印迹溢出,以减少气泡。
- 这种密封腔大,降低玻璃表面的商会将允许通过长期文化的动物第植和实时成像。这是至关重要的,以保持以后的成像玻璃表面室无污物,油脂,或媒体。我们建议准备纸毛巾见底的培养皿中存储商会,因为他们是成像准备。
第3部分:高高分辨率实时成像的共聚焦显微镜
本节中的协议已被开发利用共聚焦显微镜提供给我们的实验室(徕卡TCS SP5徕卡显微系统,班诺克IL)。不同的共聚焦显微镜,可能需要稍作修改,我们建议用户按照各自的操作说明。
- 电成像系统,初始化显微镜阶段,打开激光器荧光团的适当,即荧光或EGFP氩激光和543氦氖激光罗丹明或RFP。
- 将腔住房显微镜舞台上的外植体。在此之前定位室移动到一个适当的目标。我们推荐使用高数值孔径的20倍空中目标(0.7 NA)为初始成像;我们建议using1.4 NA 40X或63X石油目标高分辨率成像和跟踪大细胞领域。 (注:一旦浸油是适用于客观的使用注意事项时使用的空中目标,这样你就不会在无意中浸在油的目标。)使用小重量总商会举行的地方。
- 使用明场或荧光照明,调整焦距,直到你看到的表层细胞,根尖结束。小心不“撞车”进入会议厅基地的目标。避免包括或使用油浸目标时产生气泡。一旦样品使用“粗”的定位模式,定位,改变“精品”的定位模式。
- 实时成像的共聚焦调整的建议:
- 激光功率应保持尽可能低的:1)防止脱色,2),以防止光毒效应,和3),以防止任何意外触发细胞形状的改变7。激光功率的要求会有所不同,取决于的表达水平和类型的胚胎中表达的分子记者。
- 使用实时成像扫描格式为1024,因为它提供了良好的的图像分辨率为1024像素。如果您需要非常高帧频(最低是我们的系统1.3s),然后用扫描格式为512 512像素。这会降低图像的分辨率的,但仍然可以足以提取合理数量的信息。
- 调整的排放量,分色,并激发适当的过滤器的光谱范围。
- 调整到1和1.5之间的艾里单位共聚焦针孔。
- 光电倍增管的增益必须保持在最低水平,以减少噪音,还提供足够的信号,以确定细胞结构和蛋白定位。
- 调整黑电平偏移调整的背景,以改善图像质量。
- (6)通过步骤(1)反复适用于生产最好的图像质量。高质量的图像,应该可以解决与像素点多面广的动态范围强度或本地化的蛋白质的结构。如果定量分析的目标应该是零强度或饱和像素的最小数字。
- 步骤(1),(3),(5),(6)需要为每个额外的荧光通道反复产生可能的最佳图像质量。
- 当成像两个或荧光探针重要的是要确保有最小的光谱出血通过从一个蛋白第二个蛋白质的发射光谱。渗出,可减少令人兴奋的第一个蛋白质的激光功率,并观察在第二个蛋白质所使用的波长产生的信号进行测试。光谱通过排气,可减少更多限制性选择的过滤器或通过降低激光功率激发和增加用于检测的第一个蛋白质增益。
- 随着焦使用这些指导方针的调整,应该可以捕捉单个图像,在一个单一的震源深度在XY模式(图3A)。
- 如果一个人在一个形状如在细胞收缩7变化的动态发生的过程中收集的时间推移电影感兴趣,从以下替代焦模式选择:
- XYT:此模式允许收集了一系列的图像随着时间的推移,在不改变Z平面。我们使用这种模式下,观察在上皮细胞内源性的波动。通常情况下,我们获得了超过20分钟,每5秒一帧观察由外部刺激上皮细胞引起的内源性变化或形状的变化。帧速率的选择是完全依赖上的内容是什么,在观察和如何动态的过程感兴趣。
- 某某:使用这种模式,我们可以通过上皮细胞收集单一的Z系列栈。我们的默认设置收集Z系列超过5微米的范围内0.1微米的步骤。我们使用这种模式来确定骨架的变化是否发生,只有在一定的位置,如粘附路口水平,或在细胞皮层到处。
- XZT(图3A“):这种模式主要是用来观察在上皮细胞的顶端 - 基底组织快速变化。此模式适用于它的效用确认,XYT模式是一种可靠的记者在根尖细胞域和共聚焦图像采集不漂流沿Z轴的变化。
- XYZT:XYZ和XYT结合模式。这种模式可以提供完整的心尖,基底上皮细胞动力学的丰富细节,但速度很慢,以获得完整的图像栈,并会严重降低细胞活力由于漂白和光毒性的影响。
- 在有限的范围内,通过使用一个或结合了以下四个方法:1)平均线,2)线的积累,3)帧平均,4)帧积累,可以改善图像质量。这些图像采集的平均模式,可以提高图像质量,反而会降低细胞活力,需要更多的时间来收集图像。
- 所有的设置仔细调整,收集和保存图像,Z系列,和时间序列数据到外部硬盘驱动器,USB记忆棒,或网络连接的服务器。
- 一旦你已经完成了实验,降低安全性的目标,从客观清洁石油和显微镜用镜头纸阶段,掉电共聚焦系统。
第4部分:实时成像的F -肌动蛋白微丝
正如已在第3部分所示,MEM - GFP本地化蛋白膜可用于荧光标记细胞膜。实时成像亚细胞成分是通过使用其他蛋白质。可以使用一个包含F -肌动蛋白结合结构域的蛋白质,如moesin - GFP标签F -肌动蛋白在活细胞。活细胞成像和时间推移序列的集合,类似的策略遵循第3部分所述的程序。实时成像F - actin的涉及比成像MEM - GFP显微镜的技能,因为结构更比膜更紧密的本地化。例如,在浸油的小气泡产生畸变的工件,如模糊或在拍摄的图像中的变量亮度。此外,任何的协调或Z平面的小漂移可以导致moesin - GFP标记的皮质F -肌动蛋白迁出焦。因此,人们应加倍努力,以稳定的阶段,外植体,以及香港总商会,而成像皮质的F -肌动蛋白和其他亚细胞蛋白质。 XY和XZT moesin - GFP标记的F -肌动蛋白的图像显示的例子(图3B和B')。
第5部分:图像分析
从活细胞共聚焦会议获得的图像和时间推移序列进行分析,以检验假设的关于形状的变化或蛋白定位模式。肉眼往往是定性分析的最佳工具,但可以增加或自动图像分析技术提取的量化数据。徕卡共聚焦系统的图像数据可以被保存在一个开放的格式,如TIF格式的图像文件或专有技术。LIF的格式,保留在显微镜条件收购期间的详细信息。双方德州仪器F和LIF文件可直接导入一个可以自由使用图像分析程序中的图像J(Rasband,WS,ImageJ,美国国立卫生研究院,马里兰州贝塞斯达,美国,http://rsb.info.nih.gov/ij / 1997-2009)用Bio -格式的插件(凯文Eliceiri,位点,美国威斯康星大学麦迪逊,威斯康星)。在下面的章节中,我们提供两个例子来说明用户如何可能开始共聚焦图像数据的定量分析。
- 打开任何。TIF或LIF的文件(图A和A')的使用文件>打开
- 例1:测量细胞的上皮细胞(图4B到B区''').
- 选择分析>设置测量面积。
- 从图像J“工具栏上选择多边形选择工具,并勾勒出细胞。
- 开放的投资回报率经理从分析>“工具”>“投资回报率管理”,并添加按[控制- T]大纲,这是为增加任何新的“感兴趣区域”或ROI投资回报率经理的快捷方式。重要的是要添加这种选择和节省投资回报,因为你可以回去在稍后的时间和任何其他参数测量。可重新套保存的投资回报率(点击“保存”)后,作进一步的分析。
- 一个可以重复步骤(c)与图像中的任何细胞的数量和经理的投资回报率的投资回报。一旦有足够的投资回报记录,点击“测量”的投资回报率管理。在结果窗口,现在可以看到对投资回报的领域。图片尺寸有相应的测量参数值。
- 例2:测量细胞膜(图4C到C的力度''').
- 选择“直线”工具,从图像J工具栏,并绘制一条线,即垂直于细胞膜的利益,并穿过细胞膜上的形象。选择这条直线是另一种类型的投资回报率,并可以添加到经理的投资回报率,如上。
- 剧情分析> PLOT简介任意单位的相对强度。保存为图像和值列表,单击保存和LIST>文件>保存在绘图窗口的分别。
- 各种定量测量,可使用根据研究人员的利益和假设是被测试的图像J。微软Excel(微软公司,西雅图,华盛顿州)或Sigma剧情(SYSTAT软件公司,加利福尼亚州圣何塞)可以用来绘制数据图形化。在图像分析的其他例子已提交以前 7 。
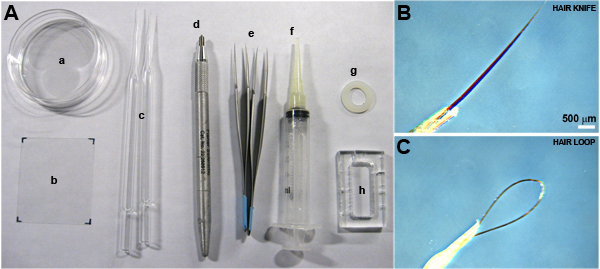
图1。所需材料。一)所需的显微和文化室的装配工具。培养皿(一),大盖玻片(二),发工具(C),钻石铅笔(D),镊子(E),硅脂“压胶枪”(F),尼龙垫圈(G),和自定义丙烯酸文化室(H)。 b)关闭的头发刀,和C)头发循环。
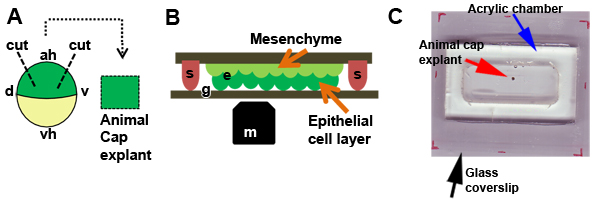
图2。切除动物第植。一)用于去除的动物帽外植体(D,背的显微操纵示意图,V,腹;啊,动物半球; VH,植物半球)。二)外植体示意图(E)定位下apposed BSA镀膜玻璃(G)根尖表面硅脂(S)在举行地方盖玻片片段。外植体的位置,使上皮细胞层是最接近的显微镜物镜(M)。三)动物第植(红色箭头)是培养在DFA和丙烯酸室,一个大型的玻璃盖玻片(蓝色箭头)(黑色箭头),坐落在玻璃盖玻片片段和硅脂的地方举行。
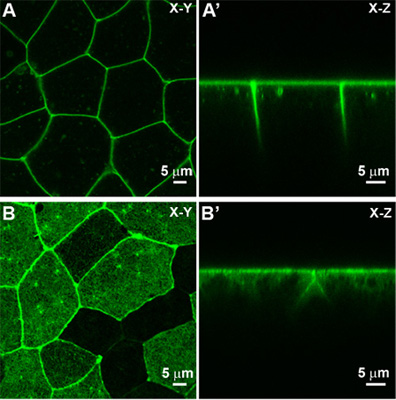
图3。上皮细胞共聚焦显微镜观察使用。 a)在XY视图和征(一)膜本地化GFP(MEM - GFP)的看法标记上皮表。 b)在XY视图和XZ查看一个moesin - GFP标记(B'),F -肌动蛋白根尖细胞皮层。
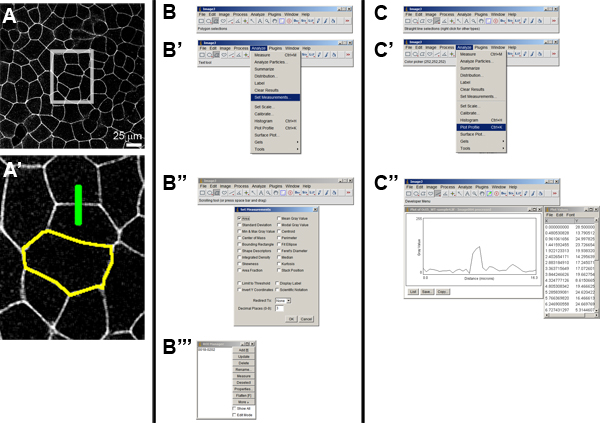
图4图像分析使用图像J.)的膜本地化的GFP标记的细胞片的原始图像。插图框(一)(A')的一个高分辨率的视图显示了两个“地区的利益”或投资回报率。黄色的轮廓表示使用多边形工具(B组)和绿线选择一个单元格的边界表示使用直线工具(C组)选择一个细胞与细胞间的边界跨越的强度分布的路径。 B“)的方法,选择测量选项,并选择”区“(B”)。一旦选择了投资回报率是可以存储的投资回报率管理(二'''). C“)的方法来选择配置文件中的测量选项了。 C“),一旦直线或分割线工具选择沿路径的强度分布可以用”剧情简介“命令绘制。的intens名单性值也可以在电子表格中可读的形式保存。
讨论
我们已经介绍了实验方案,在我们的实验室中经常使用图像动态变化的根尖细胞皮层和摆动爪蟾胚胎中的上皮细胞的细胞膜骨架。应该使用这些协议作为出发点,为上皮细胞形状的生活成像;本议定书的优化是必不可少的,一些设置将改变视显微镜系统类型和类型的蛋白质之一,是在成像感兴趣。总之,该协议的步骤(植体隔离,成像和可视化的细胞和亚细胞成分,和定量方法)提供了一个...
披露声明
致谢
这项工作是支持由一个国家卫生研究院(R01 HD044750),一个由美国国家科学基金会的事业补助金,并在美国心脏协会(格兰特在急救开始)的支持。作者感谢戴维森实验室成员:HY金,冯达索和J.周(负责日常实验室的帮助),和张琳为她在分子生物学和合成的mRNA的援助。我们承认,从本协议的某些部分,通过多年来的开发和测试的各种方法,作出了贡献的所有青蛙实验室(尤其是雷凯勒和Doug德西蒙的)试点工作。我们感谢理查德Harland和约翰沃林福德MEM - GFP和moesin - GFP质粒分别他们的实物礼品。
参考文献
- Ninomiya, H., Winklbauer, R. Epithelial coating controls mesenchymal shape change through tissue-positioning effects and reduction of surface-minimizing tension. Nat Cell Biol. 10 (1), 61-61 (2008).
- Kay, B. K., Peng, H. B. . Xenopus laevis: Practical Uses in Cell and Molecular Biology. , (1991).
- Cross, M. K., Powers, M. Obtaining eggs from Xenopus laevis females. J Vis Exp. , (2008).
- Cohen, S., Au, S., Pante, N. Microinjection of Xenopus laevis oocytes. J Vis Exp. , (2009).
- Nieuwkoop, P. D., Faber, J. . Normal Tables of Xenopus laevis (Daudin). , (1967).
- Davidson, L. A., Ezin, A. M., Keller, R. Embryonic wound healing by apical contraction and ingression in Xenopus laevis. Cell Motil Cytoskeleton. 53 (3), 163-163 (2002).
- Joshi, S. D., Dassow, M. v. o. n., Davidson, L. A. Experimental control of excitable embryonic tissues: three stimuli induce rapid epithelial contraction. Exp Cell Res. 316 (1), 103-103 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。