このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
生細胞イメージングとの胚上皮細胞の定量分析アフリカツメガエル
要約
アフリカツメガエル胚上皮は、上皮形態形成時の極性の開発と形状の変化などの細胞の挙動を研究する理想的なモデルシステムです。固定試料の伝統的な組織は、ますます生細胞の共焦点イメージングによって補完されています。ここでは、カエルの組織を分離し、生きた細胞の共焦点顕微鏡を使用して、ライブ上皮細胞とその細胞骨格を可視化する方法を示しています。
要約
胚上皮細胞は多細胞組織がそのような細胞表面の面積とセルの高さの変化など、その形状の変化を、受ける場所形態形成を研究する理想的なモデルとして機能し、細胞が有糸分裂を経て、移行先。さらに、上皮細胞は、隣接する組織に形態形成の動きを規制することができます
プロトコル
作業を始める前に
- 標準的な方法(; EPICENTREのバイオテクノロジー、マディソンWI AmpliCap転写キット)による蛍光標識タンパク質の精製mRNAをエンコードする直鎖状DNAテンプレートからキャップmRNAを合成する。 mRNAは、0.2 mlの遠心チューブで単一時間の使用のために分注し、-80℃で保存してください。
- 体外受精、そして卵のコートの除去に 、卵を得るために標準的な方法は、以前は次の2記載されている。 アフリカツメガエル女性のカエルから卵を取得する手順は、以前の3実証されています。すぐに以前に男性のカエルから分離された精巣を使って女性カエルからそれらを取得した後、in vitroで卵を受精させる。脱ゼリーの卵は、20分後の受精およびmRNA、タンパク質、DNA、またはデキストランを注入するには、すぐにマイクロインジェクション試薬の十分な拡散を可能にする。注射は1時間以上のポスト受精は、多くの場合、注射部位から拡散に失敗する。
- 卵母細胞のマイクロインジェクションはインジェクター(PLI - 100、ハーバード装置)制御圧力バルブを使用して、以前に4実証されている。 4細胞期に - 1でカエルの胚の動物半球にmRNAを注入するための同様の方法に従ってください。 1X MBS(MBS -フィコール)で3%フィコール(シグマ、セントルイスMO)に受精胚を移し、膜(MEM - GFP)またはFをターゲットにキャップをコードするmRNAのGFPの目的のボリューム(2〜4 NL)と顕微注入する-アクチン(MOE - GFP)。均一に分布を得るためには、動物極の4等間隔のサイトでmRNAを注入する。胚は数時間のためにMBS -フィコールに残りますが、原腸陥入開始前の1 / 3 × MBSに転送する必要がありますできます。
必要な材料(*印の項目は図1に示す。):
- 光ファイバー照明による解剖の実体顕微鏡。冷却解剖の段階は、推奨されていますが、必須。
- ヘアツール(毛のナイフと毛のループ)*
- 鉗子(デュモン#5ステンレス鋼、ファイン科学ツール、フォスターシティー、CA)*.
- 修正されたバルトの生理食塩水胚培養用培地(MBS、88 mMのNaCl、2.4 mMの炭酸水素ナトリウム、1mMのKClを、0.33 mMのCaCl 2を 、0.41 mMの(カノ3)2、0.82 mMのMgSO 4を 、10mMのHEPES(H3375、Sigma - Aldrich社、セントルイスミズーリ))。
- Danilchikのエイミー移植片培養培地(DFA、53 mM NaClを2、5 mMののNa 2 CO 3、4.5 mmのグルコン酸カリウム、32 mMリン酸ナトリウムグルコン酸、1mMのCaCl 2を 、1mMのMgSO 4)してください。 DFA(; A7906、Sigma - Aldrich社BSA)とアルブミン0.1%ウシ血清が含まれています。 DFAは、滅菌濾過する必要がありますが、50 mlコニカルチューブに分注し、-20℃で保存することができます抗生物質と抗真菌薬(メディアで0.8%A5955、Sigma - Aldrich社)は、細菌や真菌の増殖を抑制することが新鮮に解凍DFAに追加する必要があります。
- 60または100 mmのペトリ皿*
- 大規模なカバーガラス、50ミリメートル(12 - 544 - F、#1.5、フィッシャーサイエンティフィック、ハンプトン、ニューハンプシャー州)で45 *
- 40ミリメートルで小型のカバーガラス、24(12 - 544C、#1.5、フィッシャーサイエンティフィック)。
- シリコーングリース(高真空、ダウケミカルは)シリンジ"コーキングガン"に読み込む*.
- カスタムアクリルチャンバーまたはナイロンワッシャー(小部品(株)、ミラマー、フロリダ州)*カスタムチャンバーは2.8 cmの1.2センチメートルである内部チャンバーを提供するために、5 mmのアクリルブロックが50で25から機械工場で粉砕することができます。このチャンバーは1.68 mlの作業容量を持っています。オプションのナイロンワッシャーは、さまざまなサイズで選択することができる我々は、直径18mmの円形カバーガラスとの互換性のあるサイズを好む。
- ダイヤモンド鉛筆*.
パート1:アニマルキャップの外植片の切除
- 1 / 3 ×のMBSの目的のステージ5〜文化胚。開発の速度は、実験日の都合の良いときに行うことができます℃のように15および21間培養温度で制御することができます。部屋の温度が使用されることがありますが、胚は、より迅速に開発します。
- DFAに胚を移す。
- 鉗子を使用して卵黄膜を取り外します。
- 解剖顕微鏡、ヘアナイフ、ヘアループ6を使用して物品税アニマルキャップの外植片の下に。胚の動物極に小さな切開をする立場とヘアナイフで胚を支持または保持するために髪ループを使用してください。胚からアニマルキャップの外胚葉を除去するために360 °の切開を行うために髪をナイフで繰り返し"フリックカット"を使用してください。練習すれば、人はそのマージン(図2A)における植または溶解した細胞に与えるダメージを最小限に結果をスムーズにカットすることができます。
- 消費税3〜4アニマルキャップの外植片に、手順4を繰り返しますとパート2に進みます。外植片を削減しながら、彼らはすぐにボールまでの傾向があるので、一つには、迅速にする必要があります。冷却解剖の段階では、プロセスを遅くしたり、あるいは、より少ない外植片を作ることができます。
パート2:長期培養のための準備室、負荷の外植片、およびシールチャンバー
- 使用してくださいシリコン接着剤にグリースまたは大規模なカバーガラスにアクリルチャンバーを密封。
- 2から4まで、室温で時間または4℃で一晩のためのチャンバーをインキュベートすることにより、非粘着性の基板とガラスコートにチャンバ内のガラスの外植片の付着を軽減するため° C 1 / 3 × MBSの1%BSAで(BSA - MBS)。
- ダイヤモンドの鉛筆を使って小さなカバースリップの断片(8ミリメートルで約2)を準備する。 BSA - MBSとプリコートフラグメント。
- チャンバーからBSA - MBSをすすぎ、DFAでメディアを交換。
- 物品動物キャップ外植片(S)(第1部;図2A)とチャンバーへの転送。髪ループを(チャンバーの底部が直面している上皮層を持つ)を使用して各外植片を置き、そっと小さな高真空グリース(図2B)の指紋が保持しているガラスのカバースリップの断片と場所に植片を修正。過度の圧力が簡単に外植片を破ることができるので、カバースリップを押しながら、非常に注意してください。複数の外植片を所定の位置に植片を保持するために使用される小型のカバースリップの断片のサイズに基づいて、各チャンバーにロードすることができます。 20片までの練習では、ここで説明するアクリルチャンバーにロードすることができます。さらに上部の開口部までDFAとチャンバーを埋める。 40mmのカバーガラスで24がチャンバの上部を密封するためにシリコーングリースを使用してください。チャンバーから密閉室とブロットのオーバーフローで気泡を減らすためにDFAを追加または削除します。
- この密閉室では、チャンバーの大規模な、より低いガラスの表面を通してアニマルキャップの外植片の長期的な文化とライブイメージングが可能になります。それは、後で画像処理のために下部ガラス汚れの自由チャンバーの表面、グリース、またはメディアを保つことが重要です。我々は、彼らが撮影のために準備されるチャンバーを格納するために、紙タオル底ペトリ皿を準備することをお勧めします。
パート3:高解像度のライブイメージング共焦点顕微鏡
このセクションにあるプロトコルは、私たちの研究室(;ライカマイクロシステムズ、バノックバーンILライカTCS SP5)に利用可能な共焦点顕微鏡を使用するために開発されました。別の共焦点顕微鏡は、わずかな修正が必要になることがありますし、我々は、ユーザーが、それぞれの操作指示に従うことをお勧めします。
- イメージングシステムのパワーアップ、顕微鏡のステージを初期化し、蛍光体の適切なレーザーをオンに、フルオレセインまたはEGFPのためのアルゴンレーザーとローダミンまたはRFPに対して543 HeNeレーザ、すなわち。
- チャンバハウジングを顕微鏡ステージ上に外植片を置きます。前のチャンバー内が所定の位置に適切な目標を移動位置決めする。我々は最初のイメージングのための高開口数20倍の空気の目標(0.7 NA)を使用することをお勧めします。我々は、高分解能イメージングと追跡大型セルのフィールドの40倍または63x油の目標Naのusing1.4をお勧めします。 (注:あなたが誤って油で客観的に浸漬しないように空気の目標を使用する場合は一度イマージョンオイルが客観的使用の注意に適用されます。)場所でチャンバーを保持するために小さな重みを使用してください。
- 明視野または蛍光照明を使用して、表面的な細胞の頂端に表示されるまでフォーカスを調整します。チャンバーベースに目標を"クラッシュ"しないように注意してください。を含む、または油浸対物を使用するときに気泡を生成しないように注意してください。サンプルは"粗い"位置決めモードを使用して配置されると、"ファイン"位置決めモードに変更してください。
- ライブイメージングのための共焦点をチューニングするための推奨事項:
- レーザーのパワーを可能な限り低く保たれるべきである:1)、2漂白を防ぐために)光毒性効果、および3を防ぐために)細胞の形状変化7のトリガ、不慮のを防ぐために。レーザパワーの要件は、発現レベルおよび胚で発現する分子記者のタイプによって異なります。
- それは良いイメージの解像度を提供するようにライブイメージングのための1024ピクセルで1024のスキャン形式を使用します。あなたが非常に高いフレームレートを(最小は私たちのシステムのための1.3Sである)必要がある場合は、512ピクセルで512のスキャン形式を使用します。これは、画像の解像度が低下しますが、それでも情報の適切な量を抽出するのに十分であることができる。
- 排出、ダイクロイック、および適切な励起フィルターのスペクトル範囲を調整します。
- 1と1.5の間エアリーユニットに共焦点ピンホールを調整します。
- 光電子増倍管のゲインは、ノイズを低減まだ細胞の構造とタンパク質の局在を同定するのに十分な信号を提供するために最低限のレベルに保たれている必要があります。
- 画像の品質を向上させるために背景を調整するオフセット黒レベルを調整します。
- (6)までのステップ(1)反復可能な限り最高品質の画像を生成するために適用されます。品質の画像は、広いダイナミックレンジでのピクセル強度を持つ構造体またはローカライズされたタンパク質を解決する必要があります。定量分析が目標である場合、ゼロ強度または飽和ピクセルの最小の番号があるはずです。
- 手順(1)、(3)、(5)、および(6)可能な限り最高品質の画像を生成する追加の各蛍光チャネルのために繰り返される必要がある。
- するときには、イメージング二つ以上蛍光プローブは、1つのタンパク質から第二のタンパク質の発光スペクトルへの最小限のスペクトルブリードスルーがあることを確認することが重要です。ブリードスルーは、最初の蛋白質刺激的なレーザーパワーを減少させると第二のタンパク質で使用される波長で生成された信号を観察することによってテストすることができます。スペクトルブリードスルーは、フィルタのより制限の選択、または励起に用いられるレーザのパワーを削減し、最初の蛋白質の検出に使用されるゲインを増加させることにより減少させることができる。
- これらのガイドラインを使用して共焦点調整されたと、それは、XYモード(図3A)の単一の焦点深度で単一の画像をキャプチャすることができるはずです。
- いずれかがそのような細胞の収縮7時の形状の変化に応じて動的に発生するプロセスのタイムラプスムービーを収集に興味を持っている場合、一方は、次の代替フォーカルのモードから選択することがあります。
- XYT:このモードは1つが、Z -面を変えることなく、時間をかけて一連の画像を収集することができます。我々は、上皮細胞における内因性の変動を観察するためにこのモードを使用してください。通常は、我々は、上皮細胞の外部刺激により誘導される内因性の変化や形状変化を観察するために20分間かけて一つのフレームを5秒ごとに取得する。フレームレートの選択は、いずれかが観測することにし、どのように動的なプロセスが興味を持っているものに完全に依存しています。
- XYZ:このモードを使用して、我々は、上皮細胞を介して単一のZシリーズのスタックを収集することができます。 Z -シリーズを収集するために私達のデフォルト設定では、5μmの範囲で0.1μmの手順です。我々は細胞骨格の変化が細胞の皮質にいたる唯一の接着結合のレベルで次のような特定の位置、で発生する、またはされているかどうかを判断するためにこのモードを使用してください。
- XZT(図3A'):このモードは主に上皮の細胞の先端 - 基底組織の急速な変化を観察するために使用されます。このモードでは、XYTモードは、共焦点画像取得は、Z -軸に沿って漂流されていない頂端細胞のドメイン内およびその変化の信頼性のレポーターであることを確認するには、そのユーティリティのために人気があります。
- XYZT:これは、XYZとXYTのモードを組み合わせた。このモードでは、上皮の完全な頂 - 基底ダイナミクスに関する詳細な情報を提供していますが、完全な画像スタックを取得するために低速で、退色や光毒性効果のために細胞の生存率を大幅にを減らすことができます。
- ラインの平均、2)回線の蓄積、3)フレームの平均化、および4)フレーム蓄積1):画像の品質は、1つまたは次の4つのアプローチの組み合わせを使用して限られた範囲内に改善することができます。画像取得のためのこれらの平均化モードは、画質を向上させることができますが、細胞の生存率を低減し、画像を収集するために多くの時間が必要になります。
- 慎重に調整したすべての設定で、外部ハードドライブ、USBメモリスティック、または、ネットワークに接続されたサーバへの画像、Zシリーズ、および時系列データを収集して保存する。
- 一度、あなたの実験を完了しているしている、、安全のために目標を下げる目的から石油とレンズペーパーで顕微鏡ステージをきれいにし、パワーダウン共焦点システム。
パート4:F -アクチンミクロフィラメントのライブイメージング
パート3に示されているように、タンパク質をローカライズする膜は、MEM - GFP蛍光細胞膜を標識するために使用することができます。サブ細胞成分のライブイメージングは、他のタンパク質を用いることにより達成される。 F -アクチン結合ドメインを含むようなモエシン- GFPのようなタンパク質は生細胞内でF -アクチンを標識するために使用することができます。タイムラプスシーケンスの生細胞イメージングとコレクションのための同様の戦略はパート3で説明した手順に従ってください。ライブイメージングF -アクチンの構造が膜よりも細かいとより緊密に局在しているのでイメージングMEM - GFPよりも顕微鏡のスキルを伴います。例えば、液浸オイルの任意の小さな気泡は、キャプチャされた画像のボケや変数明るさなどの収差のアーティファクトを生成することができます。さらに、局所またはZ -平面内の任意の小さなドリフトはモエシン- GFPは、アウトオブフォーカスを移動するために、F -アクチン皮質ラベル付け引き起こす可能性があります。このように、一段階、外植、そしてチャンバーを安定させるために再ダブル努力すべきだがイメージング皮質F -アクチンと他のサブ細胞タンパク質。 F -アクチンというラベルのモエシン- GFPを示すXYとXZT画像は例(図3BとB')として表示されます。
第5部:画像解析
生きた細胞の共焦点セッションから取得した画像と時間経過のシーケンスは、タンパク質の局在の形状の変更やパターンに関する仮説をテストするために分析することができます。肉眼では多くの場合、定性分析に最適なツールですが、定量的なデータを抽出する画像解析技術によって拡張または自動化することができます。ライカ共焦点システムからの画像データは、。TIF形式の画像ファイルや買収時に顕微鏡の条件に関する詳細な情報を保持する独自の。LIFフォーマットのようなオープン形式で保存することができます。両方。TIFと。LIFのファイルを直接自由に利用できる画像解析プログラムイメージJ(Rasband、WS、ImageJは、米国国立衛生研究所、ベセスダ、メリーランド州、米国、http://rsb.info.nih.gov/ijでインポートすることができます/、1997-2009)は、プラグイン(ケビンEliceiri、LOCI、ウィスコンシン大学、マディソン、WI)バイオフォーマットを使用して。以下のセクションでは、ユーザーが共焦点画像データの定量分析を開始する方法を説明するために二つの例を提供します。
- FILEを使用して、任意の。TIFまたは。LIFのファイル(図4、')> OPENを開きます。
- 例1:Bの上皮細胞(図4Bのセルの面積を測定''').
- > SETの測定を、ANALYZEでAREA]を選択します。
- 画像Jのツールバーからポリゴン選択ツールを選択し、セルの概要を説明。
- >ツール> ROIのMANAGERを分析し、ROI Managerへの新たな"関心領域"またはROIを追加するためのショートカットである[コントロールの- t]を、押すことによってそれにアウトラインを追加します。からオープンROIマネージャーあとで戻って、他のパラメータの測定を行うことができるので、この選択を追加し、ROIセットを保存することが重要です。保存されたROIの("保存"をクリック)のセットは、さらなる分析のために後で再ロードすることができます。
- 一つは、画像内のセルの任意の数のステップ(c)を繰り返すとROIマネージャーにROIを追加することができます。一度いずれかの記録に十分なROIを持って、ROI Managerで"MEASURE"をクリックします。結果ウィンドウで、1つは現在のROIに対して領域を見ることができます。画像の寸法は、測定パラメータに対応する値を持っている。
- 例2:Cの細胞膜(図4Cの強度を測定する''').
- 画像Jのツールバーから"直線"ツールを選択し、目的の細胞膜に垂直であり、膜を横切る画像上に線を引く。この直線を選択すると、ROIの別の種類であり、上記のようにROIマネージャーに追加することができます。
- > PLOTのプロファイルを分析することにより、任意の単位の相対強度をプロットします。この画像として保存してリストをクリックして値のリストとして情報> FILE> PLOTのウィンドウでASそれぞれセーブを保存します。
- 様々な定量的な測定は、研究者の関心とどのような仮説がテストされるに応じて画像Jを使用して行うことができます。をMicrosoft Excel(マイクロソフト社、シアトル、ワシントン州)やシグマプロット(SYSTAT Software社、カリフォルニア州サンノゼ)は、グラフィカルにデータをプロットするために使用することができます。画像解析の追加の例は、以前は次の7提示されている。
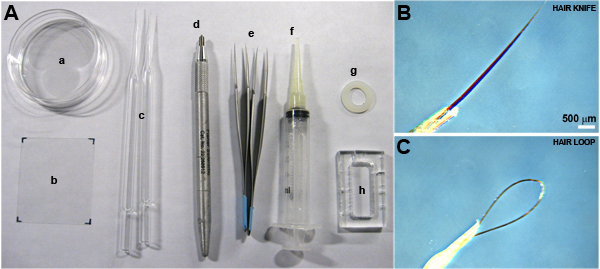
図1必要な材料。 A)マイクロサージェリーと文化室の組み立てに必要なツール。ペトリ皿()、大規模なカバースリップ(B)、毛ツール(C)、ダイヤモンド鉛筆(D)、鉗子(E)、シリコーングリース"コーキングガン"(F)、ナイロンワッシャー(G)、およびカスタムアクリルの文化チャンバー(H)。 B)毛のナイフのクローズアップ、およびC)髪のループ。
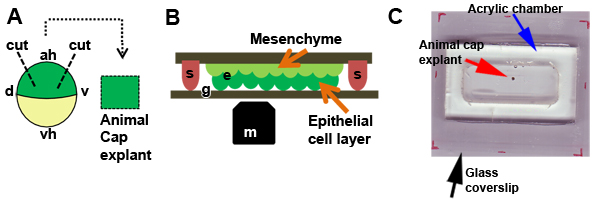
図2アニマルキャップの外植片の切除。アニマルキャップの外植片を(D、背削除するために使用される顕微操作の)回路図、V、腹、ああ、動物半球、VH、植物半球)。 B)外植片の模式図(e)は、BSAコーティングガラス(g)に並列した先端面にシリコーングリース(s)での場所で開催されたカバースリップのフラグメントの下に配置。上皮層は顕微鏡対物レンズ(m)の手前になるように外植片は配置されている。 C)アニマルキャップ植(赤矢印)は、DFAで培養し、大きなガラスのカバースリップ上にアクリルチャンバー(青矢印)(黒の矢印)に収容され、ガラスのカバースリップの断片とシリコーングリースで固定されています。
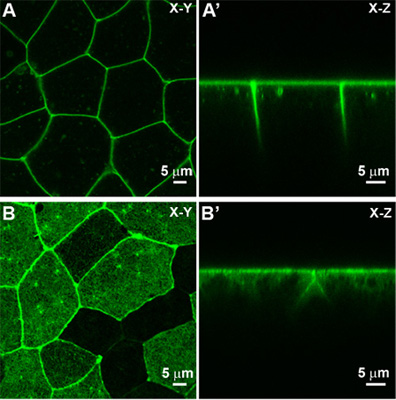
図3。上皮細胞は共焦点顕微鏡を用いて観察。 A)XYビューとGFP(MEM - GFP)標識された上皮シートをローカライズする膜のXZ(')ビューが。 B)モエシン- GFP標識F -アクチン頂端細胞の皮質のXYビューとXZビュー(をB')。
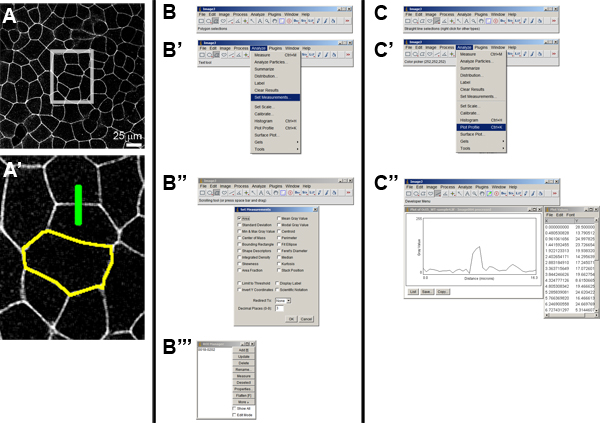
図4画像の解析はイメージJ. A膜局在するGFP標識細胞シートの)元の画像を使用して。 ()内のイラストをボックスの高解像度のビューは、(')は、2つ"の領域 - の - の関心"またはROIを示しています。黄色の輪郭が多角形ツールを使用して、選択した単一セルの境界を示している(パネルBを参照)と緑の線は、(パネルCを参照)直線ツールを使用して、選択した細胞間の境界を越えて強度プロファイルのパスを示します。測定オプションを選択し、"エリア"(B '')を選択してB')メソッド。 ROIが選択されると、それはROIマネージャー(B ''').に格納することができます。 C')プロファイルの測定オプションを選択する方法がかかりました。 C '')直線またはセグメント化されたラインのツールが選択されるパスに沿った強度プロファイルが"プロットプロファイル"コマンドを使ってプロットすることができます。 intensのリストITYの値は、スプレッドシートが読める形式で保存することができます。
ディスカッション
我々は、頂端細胞の皮質とアフリカツメガエル胚における上皮細胞の細胞膜を振動さで画像を動的に変化する細胞骨格に私たちの研究室で定期的に使用される実験的なプロトコルを提示している。一つは、上皮細胞の形状のライブイメージングのための出発点として、これらのプロトコルを使用する必要がありますが、このプロトコルの最適化が不可欠であるとの設定のいくつかは1つ...
開示事項
謝辞
この作品は、国立衛生研究所(R01 - HD044750)、国立科学財団からのキャリアグラント、および米国心臓協会(補助金の開始)からの支援によって支えられている。分子生物学および合成mRNAの彼女の援助のためにHY金、M.フォンDassowとJ.周(毎日研究室の責任のヘルプのための)、および林張:著者は、Davidsonのラボのメンバーに感謝。我々は、長年にわたって様々な方法を開発し、テストすることにより、このプロトコルの一部に寄与しているすべてのカエルラボ(特にレイケラーのとダグDeSimoneさん)から実験的な努力を認めます。我々は、それぞれMEM - GFPとモエシン- GFPプラスミドのその親切なギフトのためにリチャードハーランドとジョンウォリングフォードに感謝。
参考文献
- Ninomiya, H., Winklbauer, R. Epithelial coating controls mesenchymal shape change through tissue-positioning effects and reduction of surface-minimizing tension. Nat Cell Biol. 10 (1), 61-61 (2008).
- Kay, B. K., Peng, H. B. . Xenopus laevis: Practical Uses in Cell and Molecular Biology. , (1991).
- Cross, M. K., Powers, M. Obtaining eggs from Xenopus laevis females. J Vis Exp. , (2008).
- Cohen, S., Au, S., Pante, N. Microinjection of Xenopus laevis oocytes. J Vis Exp. , (2009).
- Nieuwkoop, P. D., Faber, J. . Normal Tables of Xenopus laevis (Daudin). , (1967).
- Davidson, L. A., Ezin, A. M., Keller, R. Embryonic wound healing by apical contraction and ingression in Xenopus laevis. Cell Motil Cytoskeleton. 53 (3), 163-163 (2002).
- Joshi, S. D., Dassow, M. v. o. n., Davidson, L. A. Experimental control of excitable embryonic tissues: three stimuli induce rapid epithelial contraction. Exp Cell Res. 316 (1), 103-103 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved