Method Article
聚焦离子束铣削和脑组织的扫描电子显微镜
摘要
这个协议描述树脂嵌入脑组织如何准备和聚焦离子束在三个层面成像,扫描电子显微镜。
摘要
这个协议描述的生物样本,如脑组织,可以使用聚焦离子束/扫描电子显微镜(FIB / SEM)在三个层面成像。该样本是固定的醛,重金属,使用四氧化锇和醋酸铀染色。然后,他们用酒精脱水和树脂,然后硬化渗透。利用光镜和玻璃刀ultramicrotome,小块状,含有接近地表的地区的利益。块,然后放在FIB / SEM和离子束大约一个垂直的面磨沿块的一侧,接近这一地区。采用背散射电子图像的基本结构,然后碾磨面较小的一个更好的离子束表面审议更密切合作,以确定脸的确切面积成像和碾磨。在显微镜的参数,然后使面部反复碾磨,使成像序列图像块的体积通过收集。图像堆栈通常会包含各向同性体素尺寸小的每个方向4海里。这在任何成像平面的图像质量,使用户能够分析在任何视角图像的堆栈内的细胞超微结构。
研究方案
1。样品的固定和树脂包埋
- 新鲜的组织和细胞的样品至少2个小时是固定的,在2%多聚甲醛和2.5%,0.1 M磷酸缓冲液pH值在7.4戊二醛。样本大小应不超过0.150毫米的厚度,以便有足够的渗透或固定液,不应该超过12小时修复左。
- 放置在20毫升玻璃闪烁瓶样品和冲洗三次,每次5分钟,在0.1M cacodylate缓冲区。
- 1.5%(W / V)在0.1 M的cacodylate缓冲区为30分钟(0.1M,pH值7.4)亚铁氰化钾和1%(W / V)的四氧化锇染色。
- 在0.1M cacodylate缓冲区的1.0%(W / V)30分钟的四氧化锇染色。
- 3分钟,用双蒸水冲洗一次。
- 1%(W / V)30分钟,双蒸水醋酸铀染色。
- 5分钟双蒸水冲洗的部分,然后脱水梯度酒精系列,每个变化(1 × 50%× 70%,1 × 90%× 95,1%,2 × 100%)2分钟。
- 嵌入在用乙醇Durcupan树脂混合30分钟,每一个变化,50%的乙醇Durcupan开始浓度的增加,然后依次为:70%,90%,95%和100%。
- 更换新鲜Durcupan和搅拌4小时慢慢。
- 放置节,使用鸡尾酒枝木,与模具分离剂涂在玻璃显微镜幻灯片,并在65个地点° C的烘箱24小时。
2。 FIB / SEM样品准备
- 单独的树脂层,包含的样本,从两者之间的玻璃显微镜幻灯片,并彻底清洗,以消除任何模具分离剂。
- 使用一个透射光显微镜,具有低功耗的目标或传输照明显微镜解剖,找出感兴趣的区域内的树脂片。
- 切一小(3毫米x 3毫米)周围地区使用刀片的利益方,并坚持这一空白树脂与丙烯酸酯胶块(图1)。胶变硬,等待5分钟,然后进行下一步。
- 块和钳入ulramicrotome持有人,使用附加的体视显微镜,修剪周围地区用刀片的兴趣,直到材料仍然只是一个小金字塔。
- 进一步削减块,使用玻璃刀固定到ultramicrotome,使感兴趣的区域,可以精确地尊重位于块的表面(图1)的尺寸。剪切块的一个边缘,邻近地区的利益,使垂直第一步是通过削减样品(图1和2)。这一步形成的成像面(图2)。
- 删除从ultramicrotome和照片的块内的利息区域块,使用透射光显微镜。
- 切修剪街区之遥,从剩余的树脂存根。这是通过使用一个珠宝商的锯和保证,只有一小块放在里面的FIB / SEM。这个区块的总高度不应超过5毫米。
- 胶块,碳糊铝存根,确保成像面的最外边缘(图1)。
- 在已经干涸的胶水,外套用薄金层(> 20纳米; Cressington真空蒸发系统)的块。
3。 FIB / SEM成像
- 在低倍率,使用二次电子成像(5千伏,0.5 NAMP),定位块,使选择的地区的利益和侧块进行成像和正面临着经营者(图2 C,D)。
- 东方在于使面部成像块铣削束平行。这将意味着在54 °面对这种情况(图2 B),电子束导向。
- 使用离子束电流13 - 30千伏27 NAMPS从前面的成像区域中删除的树脂的窄带。
- 切换到反向散射成像模式查看碾磨面覆盖在感兴趣的区域。
- 使用光学显微镜的参考图像(第16步)和碾磨面对的形象被碾碎和成像(图2),定位块的确切地区。
- 存款的碳(或金属)的保护层(约1微米厚),感兴趣的区域(图2),使用显微镜的气体喷射系统,到块的表面,上面。
- 使用目前的700 picoAmps,精细磨块区域内的最终图像将采取。
- 离开铣削束完全磨,直到没有铣削工件可以在脸上看到的形象面对。面对的一个完整的轧机检查通过观察每一个横跨整个视野的后续形象变化。不足铣也可以看作是白色条纹或出现Vertica的“窗帘”LLY中的形象。
- 保留任何消散的温度变化至少2小时的显微镜。这降低了风险,块面漂移在成像过程中,造成对齐图像。
- 面对连续成像显微镜参数选择。确保电子束的电压足够低,唯一的形象在块面的材料的深度很浅。这也应该比要删除的面厚度较浅。成像的典型参数电压介于1.2 - 2.0千伏之间的像素大小的4 - 20纳米。像素停留时间的需求将保持约10个这样的总时间磨脸,并获得一个图像保持低于2分钟(图3)μsecs。
4。成功的秘诀
步骤1)确保样本不超过150微米的厚度。这将使足够渗透到不同的污渍和树脂材料 。 这样就可以实现由一个vibratome切片后立即固定样本。这个厚度是适合于脑组织 。 其他组织需要进行测试,以确保有足够的固定和染色。
步骤3),样品必须自由地分布在整个解决方案,而不是一起成群在一个小瓶的一部分,而这一次要固定液介绍。 这将确保最大穿透样品,并减少样品,成为这个固定过程中扭曲。 这是通过轻轻摇动小瓶样品后,立即解决的办法是添加。
第15步)确保感兴趣的区域,位于下方(<30微米)的块面。这将减少离子束铣削量,在图像采集阶段 。
第22步)的离子束扫描时间需要adequte,以确保整个成像面对的是完全碾磨。不足铣床将显示为白色条纹,或垂直向下成像面出现“窗帘”。
步骤26)最后碾磨面对必须大于成像面。这是因为在附近的块面块和redeposits弹出铣削树脂 。 这再沉积可以侵犯到成像领域的观点,并避免铣得多大面积比成像。对于成像的窗口,是宽20微米,精块面是大于30微米,宽 。
步骤29),这是关键,从出现的第一个块的表面几纳米的电子所产生的图像是由电子束参数等。 这acheved最小的电压低于2千伏和保证,没有电子穿透太远。这也是帮助探测器上使用的电网电压,因此,只有具有最高能量的电子有助于最终图像。 通常情况下,1.3千伏电网的张力是用于一个1.5千伏的成像电压。
5。代表性的成果:

图1)树脂制备树脂块。嵌入steromicroscope查看通过一个成年大鼠脑冠状切面(80微米厚)。图像清楚地显示不同的大脑部分使用手术刀刀片(二)可以从削减地区。在这里,从1平方毫米的皮层被删除,(三)坚持一个空白树脂块D)树脂块,然后与装在一个ultramicrotome玻璃刀修剪,一旦区块已减少到只有离开感兴趣的区域(E),一步步被切断嵌入式材料的前表面垂直。F)修剪这整个地区,然后从其余的树脂削减,并安装到一的铝金属涂层的存根,在成像扫描电子显微镜。

图2。准备FIB / SEM成像的块面。a)和b)显示块和边缘研磨创建的成像面(与黑色的双箭头表示)中的插图。离子束(白)的位置是平行的成像面,并显示54 °打脸的离子束,电子束(灰色)。C)与电子束块二次电子成像。沿着这一侧块较暗的区域(虚线白盒表示)显示部分已大致碾磨面对(双头显示ED黑色箭头),以揭示底层样品。D)当本地区只用背散射电子成像包埋组织中可以看出。在这里,全宽包埋组织部分,是一个双头白色箭头指示。规模在 C栏)为100微米。
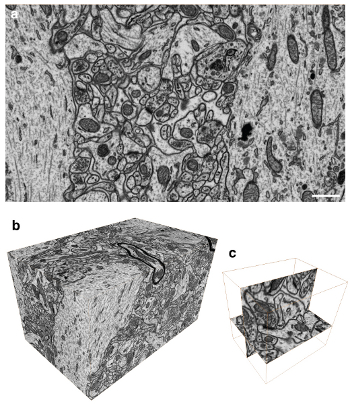
图3。成像与各向同性体素脑组织量A)反背散射图像块的对比显示大鼠脑区域内面对的超微结构。所有的膜是可见的,以及大型的大分子结构。B)共1600图像收集在5 nm的图像堆栈 C)本协议栈可在任何平面成像同一决议的各向同性体素的间距。此图像显示了在xy平面和yz平面成像的单突触连接。
讨论
FIB / SEM技术工程优化感兴趣的区域时不会太大。影像量上限取决于离子束和地区,它可以始终磨多小时反复。然而,到目前为止,已与约60 × 60微米的地区进行,成像这整个地区是不可能与一个合适的图像分辨率,主要是由于在收集这样一个大的图像的时间因素。作为一个例子,一个4 KX 4 K像素图像停留时间10微秒将采取2分40秒获得,并为60微米的领域,这将只给出了15纳米的像素大小。对于成像的细胞和组织的超微结构,一个更小的像素尺寸更适合;通常在4和10 nm /像素之间。对于一个面积为60 × 60微米的图像将在10小时内被收购,即使在显微镜有这个能力。基于这些原因,在显微镜图像卷,在10 × 10 × 10微米,或整个细胞显着的地区秩序的理想工具。这可以很容易地在48小时内完成,在此过程对比样品。
到目前为止,该协议主要用于脑组织,以及坚持以盖玻片培养的哺乳动物细胞的各类。然而,固定和染色过程,可用于许多其他类型的生物材料,包括植物材料,生产同样的对比的图像堆栈。
因此,这项技术的主要优势是它的各向同性体素的能力形象卷。这种类型的图像堆栈允许使用任何飞机在堆栈拍摄的图像的3D量的分析。这样做的好处是让来自任何方向的图像系列,并提供一个更大的图像细节(图3)的图像特征的观察员。
披露声明
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | |
|---|---|---|---|
| 氰基丙烯酸酯胶 | |||
| 解剖显微镜:莱卡MZ8 | 徕卡显微系统,德国 | ||
| Durcupan树脂 | Sigma - Aldrich公司Chemie GmbH德国,瑞士 | ||
| FIB / SEM显微镜(蔡司Nvision公司40) | |||
| 玻璃组织学幻灯片 | 德国门泽尔格拉泽, | AA00008032E | |
| 玻璃刀制造商:徕卡EM KMR2 | 徕卡显微系统,德国 | ||
| 玻璃闪烁瓶(20毫升) | (EMS),美国 | 72634 | |
| 戊二醛 | (EMS),美国 | 16222 | |
| 珠宝匠的锯 | (EMS),美国 | 72010 | |
| 模具分离剂 | 瑞士Glorex, | 62407445 | |
| 四氧化锇 | (EMS),美国 | 19110 | |
| 多聚甲醛 | (EMS),美国 | RT 19208 | |
| 磷酸盐缓冲液中的磷酸盐 | Sigma - Aldrich公司Chemie GmbH德国,瑞士 | 71642和71496 | |
| 钠cacodylate | Sigma - Aldrich公司Chemie GmbH德国,瑞士 | 20840 | |
| 与黄金的目标溅射涂布机 | 美国Cressington, | ||
| Tris碱公司(TBS) | Sigma - Aldrich公司Chemie GmbH德国,瑞士 | T1378 | |
| Ultramicrotome:莱卡UCT | 徕卡显微系统,德国 | ||
| 醋酸铀 | (EMS),美国 | RT 22451 |
参考文献
- Knott, G., Marchman, H., Wall, D., Lich, B. Serial section scanning electron microscopy of adult brain tissue using focused ion beam milling. J Neurosci. 28, 2959-2964 (2008).
- Hekking, L. H., Lebbink, M. N., De Winter, D. A., Schneijdenberg, C. T. Focused ion beam-scanning electron microscope: exploring large volumes of atherosclerotic tissue. J Microsc. 235, 336-347 (2009).
- Armer, H. E., Mariggi, G., Png, K. M., Genoud, C. Imaging transient blood vessel fusion events in zebrafish by correlative volume electron microscopy. PLoS One. 4, e7716-e7716 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。