Method Article
Ion Beam concentrato di fresatura e Microscopia Elettronica a Scansione di tessuto cerebrale
In questo articolo
Riepilogo
Questo protocollo descrive come il tessuto cerebrale resina incorporati possono essere preparati e ripreso nelle tre dimensioni del fascio di ioni focalizzato, microscopio elettronico a scansione.
Abstract
Questo protocollo descrive come campioni biologici, come il tessuto cerebrale, è possibile creare immagini in tre dimensioni con il fascio di ioni focalizzati / microscopio elettronico a scansione (FIB / SEM). I campioni sono fissati con aldeidi, macchiata da metalli pesanti utilizzando tetrossido di osmio e acetato di uranile. Essi vengono poi disidratate con alcool e infiltrati con resina, che viene poi fissata. Utilizzando un microscopio ottico e ultramicrotomo con coltelli in vetro, un piccolo blocco contenente l'interesse regione vicino alla superficie è fatto. Il blocco viene poi inserito all'interno della FIB / SEM, e il fascio di ioni utilizzato per circa mulino una parete verticale lungo un lato del blocco, nei pressi di questa regione. Utilizzando elettroni retrodiffusi per l'immagine delle strutture sottostanti, un volto più piccolo viene poi macinato con un fascio di ioni più fine e la superficie esaminata più da vicino per determinare l'area esatta del faccia a essere ripreso e fresati. I parametri del microscopio sono quindi impostare in modo che il volto è ripetutamente fresato e ripreso in modo che le immagini seriali sono raccolti attraverso un volume del blocco. La serie di immagini in genere contengono voxel isotropico di dimensioni più piccole uno nm 4 in ogni direzione. Questa qualità delle immagini in qualsiasi piano di imaging permette all'utente di analizzare ultrastruttura cellulare in qualsiasi angolo di visione all'interno della serie di immagini.
Protocollo
1. Esempio di fissazione e di inclusione in resina
- I campioni di tessuto fresco e le cellule sono fissati per almeno 2 ore nel 2% paraformaldeide e glutaraldeide al 2,5% in tampone fosfato 0,1 M a pH di 7,4. La dimensione del campione non deve superare i 0,150 millimetri di spessore per consentire la penetrazione adeguata o fissativo, e non deve essere lasciato in correzione per più di 12 ore.
- Mettere i campioni in fiale da 20 ml scintillazione vetro e sciacquarli per tre volte, 5 minuti ciascuno, in tampone 0,1 M cacodilato.
- Macchia con 1,5% (w / v) di tetrossido di osmio ferrocianuro di potassio e 1% (w / v) in tampone 0,1 M cacodilato (0,1 M, pH 7,4) per 30 minuti.
- Macchia con tetrossido di osmio 1,0% (w / v) in tampone 0,1 M cacodilato per 30 minuti.
- Sciacquare subito con acqua bidistillata per 3 minuti.
- Macchia con 1% (w / v) di acetato di uranile in camera doppia acqua distillata per 30 minuti.
- Sciacquare sezioni per 5 minuti in acqua bidistillata, disidratano e poi in serie alcool classificato, 2 minuti a ogni cambio (1 x 50%, 1 x 70%, 1 x 90%, 1 x 95%, 2 x 100%).
- Incorpora in concentrazioni crescenti di resina Durcupan mescolata con l'etanolo, 30 minuti ogni cambiamento, partendo da 50% Durcupan in etanolo, seguito da: 70%, 90%, 95%, e poi 100%.
- Sostituire con Durcupan fresco e agitare lentamente per 4 ore.
- Sezioni luogo, utilizzando stuzzicadenti di legno, su vetro microscopi vetrini rivestiti con l'agente di separazione dello stampo, e mettere in forno a 65 ° C per 24 ore.
2. Preparazione del campione per il FIB / SEM
- Separare lo strato di resina, contenenti i campioni, da tra i due vetrini e microscopio lavare accuratamente per rimuovere qualsiasi forma di separazione agente.
- Utilizzando un microscopio a luce trasmessa con gli obiettivi di bassa potenza, o dissezione microscopio con illuminazione trasmessa, per identificare la regione di interesse all'interno della fetta di resina.
- Tagliare un piccolo (3 mm x 3 mm) quadrati attorno alla regione di interesse con una lama di rasoio e questo bastone alla cima del blocco di resina bianca con colla acrilica (Figura 1). Attendere 5 minuti per la colla per indurire, e poi procedere con il passo successivo.
- Bloccare il blocco nel supporto del ulramicrotome e, utilizzando lo stereomicroscopio collegato, ritagliare intorno alla regione di interesse con una lama di rasoio fino a solo una piccola piramide di resti materiali.
- Ulteriori tagliare il blocco, con un coltello di vetro fisso nella ultramicrotomo, in modo che la regione di interesse può essere localizzato con precisione rispetto alle dimensioni della superficie del blocco (Figura 1). Tagliare un bordo del blocco, vicino alla regione di interesse, in modo che un passo perpendicolare viene tagliato attraverso il campione (Figura 1 e 2). Questa fase costituisce il volto di imaging (Figura 2).
- Rimuovere il blocco dal ultramicrotomo e fotografare la regione di interesse all'interno del blocco, utilizzando un microscopio a luce trasmessa.
- Tagliare il blocco tagliato fuori il mozzicone resina rimanenti. Questo viene fatto utilizzando visto una gioielleria ed assicura che solo un piccolo blocco è collocato all'interno del FIB / SEM. L'altezza totale di questo blocco non deve essere superiore a 5 mm.
- Incollare il blocco di uno stub in alluminio con pasta di carbonio garantire che il lato da acquisire è sul bordo più esterno (Figura 1).
- Dopo che la colla si è asciugata, rivestire il blocco con un sottile strato di oro (> 20 nm; sistema di aspirazione Cressington evaporazione).
3. Imaging nella FIB / SEM
- Con un ingrandimento basso, e con elettroni secondari di imaging (5 kV, 0,5 nAmp), orientare il blocco in modo che la regione di interesse e scelto il lato del blocco di essere ripreso sia rivolto verso l'operatore (Figura 2 c, d).
- Orientare il blocco in modo che la faccia ad essere ripreso è parallelo al fascio di fresatura. Ciò significa che il fascio di elettroni è orientato a 54 ° a questa faccia (Figura 2 b).
- L'utilizzo di un fascio di ioni di corrente 13-27 nAmps a 30 kV rimuovere una stretta banda di resina dalla parte anteriore della regione da acquisire.
- Passa alla modalità di imaging retrodiffusi per vedere il volto fresato che sovrasta la regione di interesse.
- Utilizzando la microscopia a luce immagine di riferimento (presa a passo 16) e l'immagine del volto fresato individuare l'area esatta sul blocco da fresare e ripreso (Figura 2).
- Depositare uno strato protettivo (circa 1 micron di spessore) di carbonio (o metallo), utilizzando il sistema di iniezione di gas del microscopio, sulla superficie del blocco, al di sopra della regione di interesse (Figura 2).
- Utilizzando una corrente di 700 picoAmps, mulino finemente la regione del blocco all'interno del quale le immagini finale sarà presa.
- Lascia il raggio di fresatura a questo mulino completamente volto immagine fino a quando non gli artefatti di fresatura può essere visto sul viso. Un mulino completa del viso è controllato da osservare i cambiamenti in ogni immagine successiva attraverso l'intero campo visivo. Fresatura inadeguato può anche visto come striature bianche o 'tende' apparire Vertically nell'immagine.
- Lasciare il microscopio per almeno 2 ore per tutte le modifiche termica da smaltire. Questo riduce il rischio che la faccia blocco andrà alla deriva durante l'imaging, con conseguente immagini disallineate.
- Selezionare i parametri microscopio per l'imaging del viso in serie. Assicurarsi che il fascio di elettroni ha una tensione che è abbastanza basso per l'immagine solo una profondità di materiale a fronte del blocco. Questo dovrebbe anche essere molto meno profonda di quanto lo spessore della faccia da rimuovere. I parametri tipici per l'imaging sono tensioni tra 1,2-2,0 kV con dimensioni in pixel di tra 4 - 20 nm. Il pixel sosta bisogno di tempo per essere mantenuta intorno al 10 μsecs in modo che il tempo totale per macinare il viso e acquisire una sola immagine viene mantenuta sotto i 2 minuti (Figura 3).
4. Segreti del successo
Passo 1) Assicurarsi che i campioni non sono più spessi 150 micron. Ciò consentirà un'adeguata penetrazione delle macchie diverse e resina nel materiale. Ciò può essere ottenuto sezionando i campioni con un vibratome subito dopo la fissazione. Questo spessore è appropriato per il tessuto cerebrale. Altri tessuti devono essere testati per garantire adeguato di fissazione e colorazione.
Fase 3) I campioni devono essere liberamente distribuiti in tutta la soluzione, e non raggruppate in una parte del flaconcino mentre questo fissativo secondario è introdotto. Questo garantirà la massima penetrazione del campione e di ridurre il campione diventa distorto durante questo processo di fissazione. Questo risultato è ottenuto rimestando delicatamente i campioni all'interno della fiala immediatamente dopo la soluzione è aggiunto.
Punto 15) Assicurarsi che la regione di interesse si trova immediatamente sotto (<30 micron) la superficie del blocco. Ciò consentirà di ridurre la quantità di fresatura dal fascio di ioni durante la fase di acquisizione delle immagini.
Punto 22) Il tempo di scansione del fascio di ioni deve essere adequte per assicurare che il volto di imaging intero è completamente fresato. Fresatura inadeguata verrà mostrato come striature bianche, o 'tende' che appaiono in verticale lungo il viso di imaging.
Punto 26) La faccia finale fresato deve essere più grande il volto che è immaginato. Questo perché la resina fresato viene espulso dal blocco e redeposits sulla superficie del blocco nelle immediate vicinanze. Questo rideposizione può sconfinare in campo dell'imaging di vista, ed è evitata mediante fresatura una zona molto più ampia di quella immaginata. Per una finestra di imaging che è di 20 micron di larghezza, il volto blocco fresato è maggiore di 30 micron di larghezza.
Punto 29) E 'fondamentale che i parametri di fascio di elettroni sono tali che l'immagine è generata da elettroni che emergono da solo il nanometri prime della superficie del blocco. Questo è un acheved riducendo al minimo la tensione al di sotto del 2 kV e assicurando che nessun elettrone penetrare troppo in là. Questo è anche aiutato con una tensione di griglia sul rivelatore in modo che solo l'elettrone con le più alte energie contribuire all'immagine finale. Tipicamente, una tensione di 1,3 kV griglia viene utilizzato per una tensione di imaging di 1,5 kV.
5. Rappresentante dei risultati:

Figura 1. Preparazione del blocco di resina. A) in resina incorporata sezione coronale (80 micron di spessore) con un cervello di ratto adulto visualizzati in un steromicroscope. L'immagine mostra chiaramente le differenti regioni del cervello che può essere tagliato dalla sezione (b) utilizzando un bisturi. Qui, un 1 mm quadrati dalla corteccia viene rimossa e (c) attaccato ad un blocco di resina bianca. D) Il blocco di resina viene poi tagliato con un coltello di vetro montato in un ultramicrotomo, e una volta che il blocco è stato ridotto a lasciare solo il regione di interesse (e), un passo è tagliata perpendicolarmente alla superficie anteriore del materiale incorporato. f) Tutta questa regione assettato è poi tagliato dal resto della resina e montato su un perno in alluminio pronto per il rivestimento di metallo e di imaging nella microscopio elettronico a scansione.

Figura 2. Preparazione del viso blocco per FIB / SEM imaging. A) e b) mostrano le illustrazioni del blocco e il bordo che viene macinato per creare il volto di imaging (indicata con il nero doppia freccia). La posizione del fascio di ioni (bianco) viene mostrata in parallelo alla faccia di imaging, e il fascio di elettroni (grigio) è indicata colpire la faccia a 54 ° rispetto al fascio di ioni. C) mostra una visione del blocco prese con il fascio di elettroni e ripreso con gli elettroni secondari. Lungo questo lato del blocco di una regione più scura (indicata con la scatola bianca punteggiata) mostra una parte del viso che è stato di circa lavorato (mostrato con doppia testatandr freccia nera) per rivelare il campione di fondo. d) Quando questa regione è ripreso solo con gli elettroni retrodiffusi il tessuto incorporato può essere visto. Qui, l'intera larghezza della sezione di tessuto incorporato è indicato con una doppia freccia a due punte bianche. Barra di scala in c) è di 100 micron.
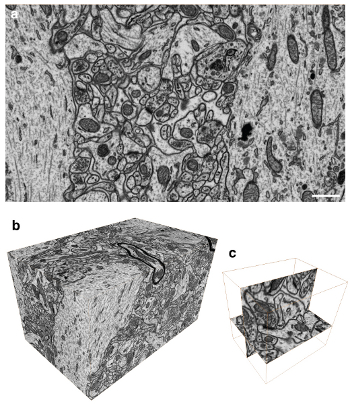
Figura 3. Imaging il volume del tessuto cerebrale con voxel isotropico. A) l'immagine invertita retrodiffusi contrasto del blocco che mostra il volto ultrastruttura all'interno di una regione del cervello di ratto. Tutte le membrane sono visibili così come le strutture macromolecolari di grandi dimensioni. B) Un totale di 1600 immagini sono state raccolte in 5 spaziatura nm con un conseguente serie di immagini con voxel isotropico. C) Questa pila può essere ripreso in qualsiasi aereo con la stessa risoluzione. Questa immagine mostra singola connessione sinaptica che è ripreso nel piano xy e il piano yz.
Discussione
La tecnica della FIB / SEM funziona in modo ottimale quando la regione di interesse non è troppo grande. Il limite massimo per un volume ripreso dipende dal fascio di ioni e la zona che può costantemente mulino ripetutamente nell'arco di molte ore. Finora questo è stato fatto con aree di circa 60 x 60 micron, tuttavia, questa immagine intera area non è possibile con una risoluzione di immagine adatta, soprattutto per il fattore tempo nella raccolta di una grande immagine. A titolo di esempio, un 4 immagine kx 4 k pixel con un tempo di permanenza a 10 microsecondi sarebbe prendere 2 minuti e 40 secondi di acquisire, e per un campo di vista di 60 micron questo sarebbe solo dare una dimensione del pixel di 15 nm. Per l'imaging l'ultrastruttura di cellule e tessuti, una dimensione del pixel più piccolo è più adatto, di solito tra i 4 ei 10 nm / pixel. Per una superficie di 60 x 60 micron l'immagine sarebbe stata acquisita in 10 ore, anche se il microscopio fosse questa possibilità. Per queste ragioni, il microscopio è uno strumento ideale per i volumi di immagini nell'ordine di 10 x 10 x 10 micron, o regioni significativa di cellule intere. Questo può essere fatto facilmente in un periodo di 48 ore su campioni che sono ben in contrasto con questa procedura.
Finora il protocollo è stato utilizzato principalmente con tessuto cerebrale, così come vari tipi di colture di cellule di mammifero aderire a lamelle. Tuttavia, la procedura di fissazione e la colorazione può essere utilizzato con molti altri tipi di materiale biologico, anche materiale vegetale per produrre ugualmente pile immagine ben contrastata.
Pertanto, il principale vantaggio di questa tecnica è la capacità di volumi di immagine con voxel isotropico. Pile immagine di questo tipo permettono di analisi del volume 3d con immagini scattate in qualsiasi aereo nello stack. Il vantaggio di questo è di permettere all'osservatore di caratteristiche dell'immagine nella serie di immagini da qualsiasi direzione e fornendo un maggiore dettaglio immagine (Figura 3).
Divulgazioni
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | |
|---|---|---|---|
| Collante cianoacrilato | |||
| Microscopio da dissezione: Leica MZ8 | Leica Microsystems, Germania | ||
| Durcupan resina | Sigma-Aldrich Chemie GmbH, Svizzera | ||
| FIB / SEM microscopio (Zeiss, nVision 40) | |||
| Vetro istologia diapositive | Menzel-Glaser, Germania | AA00008032E | |
| Vetro coltellinaio: Leica EM KMR2 | Leica Microsystems, Germania | ||
| Scintillazione fiale di vetro (20 ml) | SME, Stati Uniti d'America | 72634 | |
| Glutaraldeide | SME, Stati Uniti d'America | 16222 | |
| Gioielleria sega | SME, Stati Uniti d'America | 72010 | |
| Mould distaccante | Glorex, Svizzera | 62407445 | |
| Osmio tetrossido | SME, Stati Uniti d'America | 19110 | |
| Paraformaldeide | SME, Stati Uniti d'America | RT 19208 | |
| Sali di fosfato di tampone fosfato | Sigma-Aldrich Chemie GmbH, Svizzera | 71642 e 71496 | |
| Sodio cacodilato | Sigma-Aldrich Chemie GmbH, Svizzera | 20840 | |
| Sputter Coater con target d'oro | Cressington, Stati Uniti | ||
| Tris base (TBS) | Sigma-Aldrich Chemie GmbH, Svizzera | T1378 | |
| Ultramicrotomo: Leica UCT | Leica Microsystems, Germania | ||
| Acetato di uranile | SME, Stati Uniti d'America | RT 22451 |
Riferimenti
- Knott, G., Marchman, H., Wall, D., Lich, B. Serial section scanning electron microscopy of adult brain tissue using focused ion beam milling. J Neurosci. 28, 2959-2964 (2008).
- Hekking, L. H., Lebbink, M. N., De Winter, D. A., Schneijdenberg, C. T. Focused ion beam-scanning electron microscope: exploring large volumes of atherosclerotic tissue. J Microsc. 235, 336-347 (2009).
- Armer, H. E., Mariggi, G., Png, K. M., Genoud, C. Imaging transient blood vessel fusion events in zebrafish by correlative volume electron microscopy. PLoS One. 4, e7716-e7716 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon