需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
基于生物工程,人造血管使用脉动生物反应器
摘要
本集团已开发出一种生物反应器的文化系统,模仿对心血管系统的生理搏动强调,重新植入式小直径血管移植。
摘要
一直致力于发展和推进的方法再生功能的小直径动脉绕过许多努力。在生理环境,机械和化学刺激,需要保持适当的发展和1,2动脉血管的功能。
由本集团开发的生物反应器文化系统的设计,支持范围内的本地船只的精确控制化学机械模仿环境的血管再生。我们的生物反应器的组装和维修程序相当简单,高度可重复的 3,4的。平滑肌细胞(校董会)接种于管状聚乙醇酸(PGA)目,是超过兼容的硅胶管螺纹,带或不带长达12周的搏动刺激和生物反应器中培养。区别于一些前辈,我们的生物反应器有四个主要属性。 1)不同于其他文化系统,模拟生化本地血管周围,我们的生物反应器也创造文化的船只申请环径向应变生理搏动环境。 2)多个工程船只可以同时内控制化学环境不同的机械条件下培养。 3)生物反应器,允许单内皮细胞层(EC)可以很容易地涂到动物植入模型工程血管的管腔侧。 4)我们的生物反应器还可以具有不同直径大小的文化工程的船只从1毫米至3毫米不等,节约的努力调整每一个人的生物反应器,以适应特定的直径大小。
在我们的生物反应器培养工程船类似于原生的血管组织在一定程度上。在血管壁上的细胞表达成熟的SMC的收缩标记,如平滑肌肌球蛋白重链(SMMHC)3 。大量的胶原沉积在细胞外基质,这是负责的5个工程船只的最终机械强度。生化分析还表明,胶原蛋白的工程船只的内容是与 6个原生动脉。重要的是,脉冲式生物反应器一直再生的船只,表现出机械性能,允许在动物模型的成功植入实验3,7。此外,这种生物反应器,可以进一步修改,以允许实时跟踪和评估胶原重构随着时间的推移,非侵入性,使用一个非线性光学显微镜(NLOM)8。最后,这种生物反应器应该作为一个很好的平台,究其根本机制,规范再生功能的小口径血管移植。
研究方案
高压灭菌器
组装和高压灭菌管流系统和生物反应器组件(生物反应器本身和硅胶塞盖),在图1和图2的指示。鼻饲管,有一个男性一端连接器和一个对方开放。三是通过气体交换的硅胶帽插入短管段。
1。缝纫机的PGA网
- 剪下的PGA网格1.1厘米X〜8厘米表(依赖于生物反应器的大小)。
- 用蒸馏水(dH20)和空气干燥,使用前清洁硅胶管(3毫米内径)。
- 使用敌克松6.0缝合缝周围的清洁硅胶管,三个单针手术节开始的PGA网状。
2。美国PGA支架的表面处理
- 1M氢氧化钠浸在PGA支架为1 - 2分钟,并记录治疗时间和使用的同时为所有美国PGA支架。
- dH2O浴冲洗2分钟,3次美国PGA支架。
- 八PGA支架与彼此之间在卫生署2浴浸Kimwipes干。
- 组织培养罩下干的PGA支架鼓风机上15分钟的干燥空气。
3。缝纫针及涤纶武器
- 使用普理灵4.0缝合,缝到每个PGA 2 - 3mm的重叠网格的月底涤纶袖口(1厘米)的小块。注意:要小心,不要穿刺硅胶管(图3)。
- 使用相同的缝合围绕涤纶袖口缝三针。请一定要留在普理灵缝合步骤5.1(图3)自由端足够的缝合。
4。生物反应器大会(生物反应器培养开始前一天)
- 20-30分钟,浸泡在70%的乙醇浴缝制的网格,硅胶管,手术器械,和一个细铁丝。
- 打开包含至少30分钟,组装前高压灭菌器生物反应器和浸入70%乙醇浴袋。确保用乙醇冲洗彻底的生物反应器。所有生物反应器组件70%的乙醇暴露除了杀菌步骤。这一步也消除毒素,这是不会被删除蒸压和血管细胞有害。
- 将硅胶管通过用细线拉侧武器。
- 利用生物反应器乙醇浴(保持淹没在乙醇网)。修复生物反应器内的PGA支架紧固涤纶袖口紧缩和压制的普理灵缝合(图3),在燃烧的玻璃嘴唇。
- 生物反应器侧臂的一端连接通过硅胶管接头。
- 拉出硅胶管的另一端有足够的张力和其余两个连接器插入硅胶管。硅胶管插入连接器时,紧紧!
- 重新安装的生物反应器转化为乙醇浴,并用乙醇冲洗,轻轻拉侧臂连接。
- 翻转生物反应器,并允许浸泡10分钟。
- 右侧翻转生物反应器和一个额外的10分钟的浸泡。
- 漏极所有乙醇。
- 持有多余的乙醇滴从管的两端设置了三个大的中心菜系列和生物反应器中的Petri菜(10厘米)。
- 冲洗水使用一个5毫升或10ml吸管组织培养生物反应器和PGA网状。硅胶管冲洗组织到养殖水体。
- 彻底所有多余的水排入培养皿上的生物反应器的两侧。
- 干的生物反应器在引擎盖一夜之间与风机和紫外线关。
- 其他注意事项:确保无菌搅拌棒是在生物反应器。确保“悬停”在生物反应器从这个角度提出,以避免污染。削减大量的封口膜条,浸泡在一个小70%的乙醇浴(大培养皿中行之有效的)。
5。第1天:生物反应器的安装
- 无菌培养皿放在开放的每一个生物反应器,以防止污染物PGA支架内。
- 组装流系统,生物反应器,在图4和封口膜所有的连接关节表示。
- 先用酒精擦拭擦拭连接器。
- 第三,生物反应器中未使用的ARM将注射口。
- 删除海象油管和配合生理盐水稀释的蓝色端尽可能靠近Y型路口设置。拉管钳到位,以确保没有液体转移到这部分管
- 取下输液袋,及附加海象管(红色),远远输液袋。确保用酒精擦拭插入端口擦拭第一。
- 附加海象流系统的一面(通过白色端管)。
- 插入流系统3路阀。
- 卸下压力传感器及连接三路阀。
- 将压力传感器在袋中间开口的另一端。
- 连接通过Y型路口的生物反应器流系统。使用的60毫升注射器中添加1%fungizone350毫升(混合的PBS495毫升5毫升fungizone)输液袋。
- 挤压输液袋,以调整停止旋塞,让流动的PBS冲洗流动系统。注:生物反应器内检查,以确保有没有漏水。
- 在中等和种子到每个PGA scafffold1.25毫升重新挂起8 × 10 6校董会(约一融合T75)。确保细胞悬液均匀滴落到PGA的网底侧到PGA网状涤纶交界处以及。
- 用RIM的生物反应器与酒精擦拭通过旋转生物反应器侧身避免徘徊。
- 硅胶塞盖总成(图2)
- 剥离高压灭菌袋仔细,确保不暴露底部的盖子。
- 在男性的连接器,将鼻饲管注射口。
- 将聚四氟乙烯0.20微米的过滤器,每3个航空口岸。
- 要小心不暴露/在此过程中,触摸盖子底部。
- 封口膜的注射口。
- 玻璃生物反应器插入硅胶塞盖和确保生物反应器内的喂食管不接触种子PGA支架。封口膜周围的盖子。
- 放在培养箱内流系统(在其一侧)的生物反应器,旋转生物反应器为25-30分钟,每5分钟。
- 生物反应器室填写400毫升4-10文化中所述的媒体(见表1)。这种培养基是“优化”猪工程动脉。
6。 6-7日:打开泵,并一次投料
- 成长的种子棚架静态通过6-7天的硅胶管抽水没有任何搏动。有没有在这段时间中改变或补充维生素C的需要。
- 确保有PBS或流系统管扭结打开泵前没有泄漏。
- 打开泵的流量系统,确保调整泵设置压力读数约270/-30mmHg。
- 记录压力,每天整个文化,并保持在270/-30mmHg的压力。压力传感器可以连接到电脑上阅读和监控压力。
一次投料
- 进样口和PTFE过滤器组装到两种介质的变化和中浪费deposal目的喂养盖。
- 坚定地泵上的鼻饲管,一端插入喂养喂养盖生物反应器和另一端的端口。确保乙醇抹布擦拭注射口。
- 使用双定向的Masterflex泵泵出中等200毫升。然后使用一个新的鼻饲管泵入新鲜培养基200毫升生物反应器。总是以一个非常缓慢的速度,尤其是当泵送介质的生物反应器的回。
- 变更中和补充抗坏血酸2x/week。若要添加抗坏血酸,使用30ml注射器中等25毫升和地方组织罩在它放在一边。溶解在PBS的5毫升抗坏血酸25毫克,并通过一个0.22微米的过滤器过滤。首先鼻饲管注入无菌抗坏血酸,并加回较早时取出25毫升中等。表1给出了培养基配方。
7。代表性的成果:
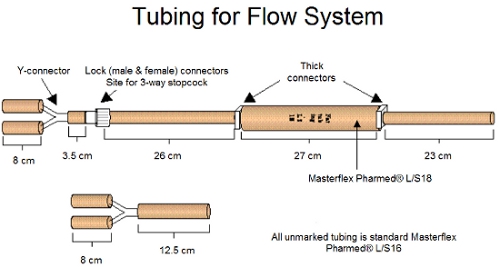
图1。流系统的组装连接器和油管如上图所示 。
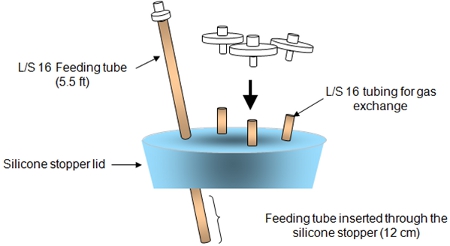
图2。以上显示的是硅胶塞盖大会。

图3。生物反应器的组装原理图如上图所示。,在生物反应器涤纶袖口内到与蓝色缝合节的玻璃武器固定。

图4。上面所示的连接管和生物反应器的流系统 。L/S18管会的Masterflex泵由泵,从而推动流。压力传感器将测量之前进入上游的生物反应器的压力。

图5。收获工程血管的图像 。工程船只会出现不透明和脉动条件下培养8周后达到了约250微米的壁厚。
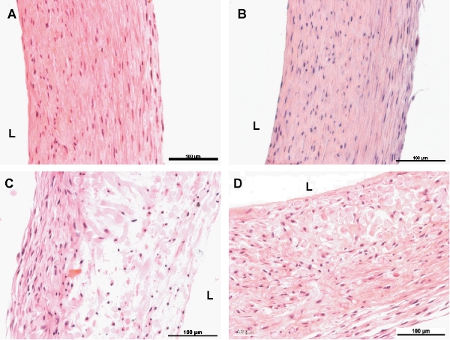
图6。苏木和曙红染色工程船的横截面。A和B是8周脉冲和非脉冲船只分别。C和D 4周非脉冲和脉冲的船只,分别为。 L表示血管的管腔侧。鳞栏是100微米。

图7。马森工程船的横截面为胶原蛋白的三色渍(蓝色)。A和B是8周的非脉冲和脉冲的船只,分别。 C和D 4周非脉冲和脉冲的船只,分别为。请注意,4周的脉冲船只超过其非脉冲胶原。白色箭头指向其余的船只PGA的片段。鳞栏是100微米。
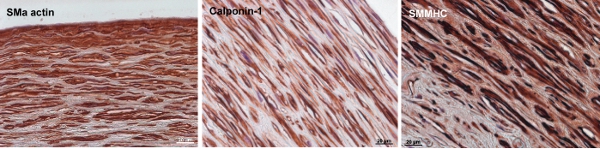
图8。免疫组织化学染色。校董会标记在牛工程动脉平滑肌α-肌动蛋白,调宁蛋白- 1,和平滑肌肌球蛋白重链(SMMHC)是早期,中期和后期的SMC收缩标记,分别。到12周的文化结束,在血管的细胞墙表达SMα-肌动蛋白和适量调宁蛋白- 1和SMMHC。鳞栏是20微米。
| 组件 | 金额 |
| DMEM(修改二甲醚/低) | 500毫升 |
| 胎牛血清(胎牛血清)热灭活 | 100毫升 |
| HEPES 1.0 M | 5毫升 |
| 维生素C(PBS或DMEM培养液溶解) | 25毫克 |
| 脯氨酸/甘氨酸/丙氨酸25 mg/25 mg/10毫克(在5毫升的PBS溶解) | 5毫升 |
| 硫酸铜4 1.5微克(第1毫升的PBS溶解) | 1毫升 |
| 在10000个单位/毫升青霉素G | 5毫升 |
| PDGF - BB(血小板衍生生长因子- BB)在10ng/ml | 5μg |
| 碱性成纤维细胞生长因子(碱性成纤维细胞生长因子)在10ng/ml | 5μg |
表1。 “4-10”中的组件是在上面的表格所示。PDGF - BB和碱性成纤维细胞生长因子的异常,所有其他组件都通过一个0.2微米的过滤器在使用前的过滤。
讨论
工程船的质量是在组织培养中使用的校董会的质量决定的很大一部分。 SMC的表型的一个关键方面,包括收缩形态,传代次数低,和生物反应器内的能力。我们建议,通过在细胞种植的时间比P3的更大的聚合物支架上。此外,关键是要确认,SMC源是支原体免费使用前。我们观察到,支原体污染的细胞在生物反应器培养细胞增殖和胶原基质沉积的大幅下跌导致。
40多万冠状?...
披露声明
致谢
这项工作是由美国国立卫生批准的EB - 008836 R01,R01 HL083895(包括到LEN)。我们要感谢为我们研究的生物反应器,大学吹玻璃,达瑞尔史密斯。
材料
| Name | Company | Catalog Number | Comments |
| 试剂/材料名称 | 供应商 | 目录编号 | |
|---|---|---|---|
| 胎牛血清(胎牛血清)热灭活 | Hyclone公司 | SH30071 | |
| DMEM培养液 | GIBCO公司 | 11885 | |
| rhFGF的基本 | R&B | 234 - FSE | |
| rrPDGF - BB | R&B | 520 - BB | |
| 青霉素摹 | 西格玛 | 彭纳 | |
| 铜(II)硫酸 | 西格玛 | C8027 | |
| Gylcine | 西格玛 | C8790 | |
| L -丙氨酸 | 西格玛 | A7469 - 25G | |
| L -脯氨酸 | 西格玛 | P5607 - 25G | |
| 抗坏血酸的 | 西格玛 | A4544 - 25G | |
| HEPES | 西格玛 | H3375 - 100G | |
| 硅胶塞 | 科尔 - 帕默 | 06298-24 | |
| 的Masterflex管的L / S | 科尔 - 帕默 | 06508-16,06508-18 | |
| 的Masterflex泵 | 科尔 - 帕默 | 7553-80 | |
| 涤纶袖 | MAQUET | 174406 | |
| PGA的感觉 | 康科迪亚 | MO000877 - 01 | |
| 4-0 1.5公吨Surgipro第二缝合 | Syneture | VP - 557 - X | |
| 6-0 0.7公吨敌克松缝合 | Syneture | 7538-11 | |
| 0.22μm的聚四氟乙烯滤波器 | 瓦特曼 | 6780-2502 | |
| 三通停止公鸡 | 爱德华生命科学 | 593WSC | |
| 压力传感器 | 爱德华生命科学 | PX212 | |
| 输液袋 | 巴克斯特 | R4R2110 | |
| 盐水稀释集 | 箭头 | W20030 | |
| 硅胶管 | 圣戈班 | F05027 |
参考文献
- Risau, W., Flamme, I. Vasculogenesis. Annu. Rev. Cell Dev. Biol. 11, 73-91 (1995).
- Fankhauser, F., Bebie, H., Kwasniewska, S. The Influcence of mechanical Forices and Flow Mechanisms on Vessel Occlusion. Lasers in Surgery and Medicine. 6, 530-532 (1987).
- Niklason, L. E., Gao, J., Abbott, W. M., Hirschi, K. K., Houser, S., Marini, R., Langer, R. Functional arteries grown in vitro. Science. 284, 489-493 (1999).
- Prabhakar, V., Grinstaff, M. W., Alarcon, J., Knors, C., Solan, A. K., Niklason, L. E. Engineering porcine arteries: Effects of scaffold modification. Journal of Biomedical Materials Research Part A. 67A, 303-311 (2003).
- Mitchell, S. L., Niklason, L. E. Requirements for growing tissue-engineered vascular grafts. Cardiovascular Pathology. 12, 59-64 (2003).
- Dahl, S. L. M., Rhim, C., Song, Y. C., Niklason, L. E. Mechanical properties and compositions of tissue engineered and native arteries. Annals of Biomedical Engineering. 35, 348-355 (2007).
- Quint, C., Kondo, Y., Manson, R. J., Lawson, J. H., Dardik, A., Niklason, L. E. Decellularized tissue-engineered blood vessel as an arterial conduit. Proc Natl Acad Sci U S A. 108, 9214-9219 (2011).
- Niklason, L. E., Yeh, A. T., Calle, E. A., Bai, Y., Valentín, A., Humphrey, J. D. Enabling Tools for Engineering Collagenous Tissues Integrating Bioreactors, Intravital Imaging, and Biomechanical Modeling. Proceedings of the National Academy of Sciences of the United States of America. 107, 3335-3339 (2010).
- Gong, Z., Calkins, G., Cheng, E. -. c., Krause, D., Niklason, L. E. Influence of Culture Medium on Smooth Muscle Cell Differentiation from Human Bone Marrow-Derived Mesenchymal Stem Cells. Tissue Engineering Part A. 15, 319-330 (2009).
- Gong, Z. D., Niklason, L. E. Small-diameter human vessel wall engineered from bone marrow-derived mesenchymal stem cells (hMSCs. Faseb Journal. 22, 1635-1648 (2008).
- Poh, M. Blood vessels engineered from human cells. Lancet. 365, 2122-2124 (2005).
- American Heart Association. . Biostatistical fact sheet: cardiovascular procedures. , (2002).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。