需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用全血刺激试验的促炎性细胞因子IL -1β的精确和简单的测量
* 这些作者具有相同的贡献
摘要
我们描述了一个简单的免疫autoinflammatory表型的患者,来衡量生产促炎性细胞因子,如IL -1β生产。通过激活细胞与病原体相关分子模式,特别是与脂多糖,全血培养,细胞因子的分泌,可以方便地评估全血上清。
摘要
从免疫细胞可溶性介质的分泌导致的炎症过程,导致各种表现在皮肤,关节和其他组织以及改变细胞因子的动态平衡。先天免疫系统中起着至关重要的作用在识别病原体和其他内源性危险刺激。先天免疫细胞释放的主要因子之一,是白细胞介素(IL)-1。因此,我们利用全血刺激试验,以衡量炎性细胞因子的分泌和专门的促炎症细胞因子IL -1β1,2,3 。
与先天免疫系统,导致autoinflammatory综合征的遗传功能障碍的患者表现夸张成熟后,单纯用LPS刺激IL -1β的释放。为了评估先天免疫与炎症相关的病症的患者组成部分,我们使用一个特定的免疫检测病原体相关分子模式(PAMPS),如革兰阴性细菌内毒素,细胞免疫反应,脂多糖(LPS )。这些PAMPS上的先天免疫系统4,5,6,7细胞中发现的病原体识别受体(PRRS),确认。原始信号,脂多糖,结合次要的信号,ATP,是必要的炎性激活,一个多蛋白复合物,处理亲IL -1β,其成熟, 生物活性,4,5,6,8 ,9, 10。
全血检测需要最少的样品操作,以评估需要劳力密集的隔离和特定的细胞群的培养等方法相比,细胞因子的产生。此方法不同于其他刺激全血化验的RPMI媒体的比例与稀释的样品,而不是我们执行一个白细胞计数直接从稀释的全血,因此,刺激的白血细胞在培养2。这个特殊的全血检测结果表明了一种新技术,有助于阐明病人同伙提出autoinflammatory pathophysiologies。
研究方案
1。收集全血
- 获取从受影响的个人,以及年龄和性别匹配的健康对照最小的10毫升外周血。静脉血应收集到,而不是使用其他抗凝血剂,如EDTA,倒几次,以确保适当的混合与肝素钠肝素钠真空采血管的血液收集管。请注意,10毫升是体积最小的电镀样品需要重复这个特殊的检测全血。
- 样品应尽快处理收集后,以取得最佳效果。但是,肝素血液可以存储在昏暗的灯光下下,长达24小时,直到准备好要处理的(2)在室温下。
2。全血制备
- 离心机在室温下10分钟3000转(带刹车关闭)的所有血液样本。互不干扰的棕黄色大衣,等离子可以从上面收集和储存其他实验目的。血浆样品可以暂时储存在-20 ° C或-80 ° C下长期贮存
- 一旦血浆收集,洗样品resuspending无血清(不全)的RPMI 1640介质(环境温度),红细胞(RBC)的颗粒和巴菲大衣。轻轻地在收集管吸液管的混合物,并转移至50 mL锥形管。
- 音量高达50毫升不完整的RPMI 1640培养基,轻轻颠倒管创建一个均匀混合物。离心10分钟3000转(带刹车关闭)的样品。确保有清晰的分离,吸出上清液,小心不要去打扰捉鬼外套。重复这个过程2-4次,以确保所有污染物和约束因子刺激前删除。
- 最后一次洗涤后,悬浮红细胞颗粒和棕黄色的外衣,使总体积为20毫升(10毫升最初制定的全血)与不完整的RPMI 1640媒体。基于最初制定的血液量,总量可以调整。
- 使用Cellometer的愿景,可稀释血液无裂解红细胞计数,通过选择使用吖啶橙(AO)的白细胞计数选项。添加一个部分稀释血液的一部分AO和负载20μL1:1混合成一个一次性的计数室。 AO的终浓度稀释后,应1μg/mL。
- 根据实际情况调整不完整的RPMI 1640媒体到最终细胞浓度为2.0 × 10 6细胞/ mL。
3。全血的刺激
- 检测需要至少四个条件(每个重复做):未刺激,除了单独的LPS,ATP的单独此外,终于LPS加ATP的加在一起。添加1毫升准备好的2.0 × 10 6细胞/ ml稀释全血到24孔组织培养板的适当以及。
- 兴奋剂应改组,并提出了到室温开始之前的刺激实验。冻干毒素和ATP应根据制造商的指示改组。经过重组,LPS和ATP可进一步稀释到一个适当的股权集中使用不完整的RPMI 1640媒体的。
- 加入脂多糖LPS的仅以及脂多糖加ATP使LPS浓度的最后工作是1微克/毫升。刺激的总时间为3小时。然而,全血是刺激与LPS 2小时40分钟。样品应放置在孵化器在37 ° C和5%的CO 2。
- ATP过程中添加3小时刺激期剩下的20分钟。 ATP ATP单独LPS和ATP良好,在孵化器的地方样本。最后工作ATP浓度为2mm。
- 3个小时的潜伏期后,收集上清aliquoting每个样品1.5 ml离心管,随后离心样品在室温下2分钟的转速在10000。上清转移到另一1.5离心管。
- 样品可以立即检测或存储暂时在-20 ° C或-80 ° C下长期贮存。
4。细胞因子含量
- 被冻结的样品需要分析前平衡至室温。细胞因子浓度的IL -1βcan使用多种方法进行评估。我们利用生物复杂的Pro X - plex的人类细胞因子与生物复杂的200系统的检测,每制造商的说明。在这个协议中,我们是专门测量的IL -1β,但是,我们利用这种多重细胞因子的检测,为了同时测量多种细胞因子,使用一个小样本量的好处之一检测。
5。代表性的成果
LPS和ATP成功的刺激后IL -1β生产的分析表明,一做SE的反应依赖于受到刺激的细胞数量。我们发现,2.0 × 10 6细胞/毫升是一个足够的浓度,以产生最佳的IL -1β和可衡量的的浓度以及其他细胞因子(图2 )。
全血分析研究目前autoinflammatory表现的患者,是有用的。这些患者可能会出现在先天免疫系统,生产过剩(图3)与LPS单独刺激(与对照组相比)的IL -1β后,可以通过特征的缺陷。
图1。AO染色核白血细胞,以用来确定细胞浓度稀释的全血标本的形象代表。
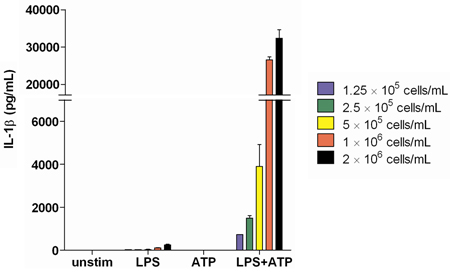
图2,IL -1β生产从一个健康捐赠者增加细胞浓度的脂多糖刺激后测定全血上清。被检测的样品一式三份。
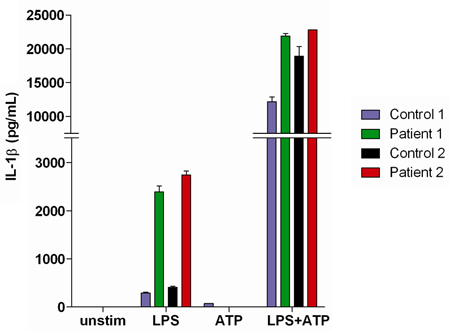
图3,两个健康的正常对照组,以及两个患者的IL -1β相关autoinflammatory表现呈现在全血上清测IL -1β分泌的代表结果。
讨论
整个血液检测是一个简单的方法,更加紧密地与其他的技术,将要求细胞的分离和广泛的来样加工和操纵相比,模仿生理条件。这种方法利用全血中的白细胞计数,因此,提供了一种基于细胞的数量要准确规范样品与AO Cellometer视觉。
必须指出,这个实验中,全血应卷入肝素钠收集管其他抗凝血剂已知钙螯合剂,从而影响检测结果。血清自由的媒体也应该使用,因为这可能会?...
披露声明
致谢
这项研究是支持的关节炎和肌肉骨骼及皮肤疾病,美国国立卫生研究院国立研究所院内研究计划。
材料
| Name | Company | Catalog Number | Comments |
| Sodium Heparin Blood Collection Tubes | BD Biosciences | 366480 | |
| RPMI 1640 Media | GIBCO, by Life Technologies | 21870-100 | |
| Acridine Orange | Invitrogen | A3568 | |
| Cellometer Vision | Nexcelom Bioscience | Contact company for instrument information | |
| Cellometer Cell Counting Chambers | Nexcelom Bioscience | CHT4-SD100 | |
| 24-well Tissue Culture Plate | Corning | 3524 | |
| Ultra Pure E. coli K12 LPS | Invitrogen | tlrl-eklps | |
| Adenosine 5´-tripohasphate disodium salt hydrate | Sigma-Aldrich | A26209 | |
| Bio-plex 200 system | Bio-Rad | Contact company for instrument information | |
| Bio-Plex Pro human cytokine x-plex assay | Bio-Rad | x-plex assays are custom made according to specified cytokines of interest |
参考文献
- Martinon, F., Mayor, A., Tschopp, J. The inflammasomes: guardians of the body. Annu Rev Immunol. 27, 229-265 (2009).
- Thurm, C. W., Halsey, J. F. Measurement of cytokine production using whole blood. Curr Protoc Immunol. 66, 7-18 .
- Mariathasan, S. Cryopyrin activates the inflammasome in response to toxins and ATP. Nature. 440, 228-232 (2006).
- Gabay, C., Lamacchia, C., Palmer, G. IL-1 pathways in inflammation and human diseases. Nat Rev Rheumatol. 4, 232-241 (2010).
- Franchi, L., Elgenbrod, T., Muñoz-Planillo, R., Nuñez, G. The inflammasome: a caspase-1-activation platform that regulates immune responses and disease pathogenesis. Nat Immunol. 3, 241-247 (2009).
- Sims, J. E., Smith, D. E. The IL-1 family: regulators of immunity. Nat Rev Immunol. 2, 89-102 (2010).
- Haug, R., Joø, G. B., Westvik, A. B., Kierulf, P. Chemokine production and pattern recognition receptor (PRR) expression in whole blood stimulated with pathogen-associated molecular patterns (PAMPs. Cytokine. 32, 304-315 (2005).
- Netea, M. G. Differential requirement for the activation of the inflammasome for processing and release of IL-1bin monocytes and macrophages. Blood. 113, 2324-2335 (2009).
- Latz, E. The inflammasomes: mechanisms of activation and function. Curr Opin Immnol. 22, 28-33 (2010).
- Masters, S. L., Simon, A., Aksentijevich, I., Kastner, D. L. Horror autoinflammaticus: the molecular pathophysiology of autoinflammtory disease. Annu Rev Immunol. 27, 621-668 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。