Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Mesure précise et simple de la cytokine pro-inflammatoire IL-1β en utilisant un dosage de sang total Stimulation
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous décrivons une méthode de dosage immunologique pour mesurer la production de cytokines pro-inflammatoires, tels que la production d'IL-1 bêta, chez les patients présentant des phénotypes auto-inflammatoires. En activant les cellules dans les cultures de sang total avec des agents pathogènes motifs moléculaires associés, en particulier avec les lipopolysaccharides, la sécrétion de cytokines peuvent être facilement évaluée dans les surnageants de sang total.
Résumé
Les processus inflammatoires résultant de la sécrétion de médiateurs solubles par les cellules immunitaires, conduire à diverses manifestations dans la peau, les articulations et autres tissus ainsi que l'homéostasie des cytokines modifiées. Le système immunitaire inné joue un rôle crucial dans la reconnaissance des pathogènes et d'autres stimuli endogènes de danger. Une des principales cytokines libérées par les cellules immunitaires innées est l'interleukine (IL) -1. Par conséquent, nous utilisons un dosage sanguin de l'ensemble de stimulation afin de mesurer la sécrétion de cytokines inflammatoires et plus particulièrement de l'cytokine pro-inflammatoire IL-1β 1, 2, 3.
Les patients atteints de dysfonctionnements génétiques du système immunitaire inné causant syndromes auto-inflammatoires montrent une libération exagérée de l'IL-1β matures lors de la stimulation avec le LPS seul. Afin d'évaluer la composante immunitaire inné des patients qui présentent des pathologies associées inflammatoires, nous utilisons un immunodosage spécifique pour détecter les réponses immunitaires cellulaires aux agents pathogènes motifs moléculaires associés (PAMP), tels que l'endotoxine bactérienne gram-négatif, le lipopolysaccharide (LPS ). Ces PAMPs sont reconnus par des récepteurs de reconnaissance des pathogènes (PRR), qui se trouvent sur les cellules du système immunitaire inné 4, 5, 6, 7. Un signal fort, LPS, en conjonction avec un signal secondaire, l'ATP, est nécessaire pour l'activation de l'inflammasome, un complexe multiprotéique que les processus pro-IL-1β à sa maturité, forme bioactive 4, 5, 6, 8, 9, 10.
Le dosage sanguin de l'ensemble nécessite une manipulation minimale de l'échantillon pour évaluer la production de cytokines par rapport à d'autres méthodes qui nécessitent une isolation de main-d'oeuvre et de la culture des populations de cellules spécifiques. Cette méthode diffère des autres toute la stimulation des dosages sanguins; plutôt que de diluer les échantillons avec un ratio de RPMI médias, nous réalisons un nombre de globules blancs du sang total directement dilué et donc, de stimuler un nombre connu de globules blancs dans la culture 2. Les résultats de ce dosage sanguin toute particulière de démontrer une nouvelle technique utile dans l'élucidation des cohortes de patients présentant des physiopathologies auto-inflammatoires.
Protocole
1. Collecte de sang total
- Obtenir un minimum de 10 ml de sang périphérique de personnes touchées ainsi que l'âge et le sexe témoins sains appariés. Le sang veineux doit être recueilli dans des tubes Vacutainer héparine sodique collecte de sang, plutôt que d'utiliser d'autres anticoagulants tels que l'EDTA, et retourné plusieurs fois pour s'assurer bon mélange avec l'héparine de sodium. Notez que 10 ml est le volume minimum de sang total requis pour les échantillons en double plaquage pour ce dosage particulier.
- Les échantillons doivent être traités dès que possible après le prélèvement pour obtenir les meilleurs résultats. Toutefois, le sang hépariné peuvent être stockés à température ambiante sous un faible éclairage, jusqu'à 24 heures jusqu'à ce que prêt à être traité (2).
2. Préparation de sang total
- Centrifuger tous les échantillons de sang à 3000 rpm (avec frein désactivé) pendant dix minutes à température ambiante. Sans déranger la couche leucocytaire, le plasma peut être recueilli par le haut et stockées à d'autres fins expérimentales. Les échantillons de plasma peuvent être stockés temporairement à -20 ° C ou -80 ° C pour le stockage à long terme
- Une fois que le plasma est recueilli, laver les échantillons par remise en suspension des globules rouges (RBC) et la couche leuco granulés avec du sérum libre (incomplète) du milieu RPMI 1640 (à température ambiante). Délicatement la pipette le mélange dans les tubes de prélèvement et le transfert d'un tube de 50 ml conique.
- Volume inférieur à 50 mL avec les médias RPMI incomplète de la culture 1640 et retourner doucement les tubes afin de créer un mélange homogène. Centrifuger les échantillons à 3000 rpm (avec frein désactivé) pendant dix minutes. Faire en sorte il ya une séparation claire, aspirer le surnageant, en faisant attention à ne pas perturber la couche leucocytaire. Répétez cette procédure 2-4 fois pour s'assurer que tous les contaminants et les cytokines liés sont retirés avant la stimulation.
- Après le dernier lavage, resuspendre le culot de RBC et de buffy coat sorte que le volume total est de 20 mL (pour 10 ml de sang total initialement établi) avec incomplète du milieu RPMI 1640. Le volume total peut être ajusté en fonction du volume de sang initialement élaboré.
- Utilisation de la Vision Cellometer, sang dilué peut être compté, sans globules rouges lyse en choisissant l'option de globules blancs comptent utilisant l'acridine orange (AO). Ajouter un seul sang, une partie dilué avec un AO partie et charge de 20 uL du mélange 1:1 dans une chambre de comptage à usage unique. La concentration finale de AO après dilution devrait être 1μg/mL.
- Ajuster en conséquence avec incomplète du milieu RPMI 1640 à une concentration cellulaire finale de 2,0 x 10 6 cellules / ml.
3. La stimulation du sang total
- Le dosage nécessite un minimum de quatre conditions (chacun fait en double exemplaire): non stimulées, l'ajout de LPS seul, l'ajout d'ATP seul, et enfin, plus LPS ATP additionnées. Ajouter 1 mL de l'2,0 préparés x 10 6 cellules / ml de sang diluée dans l'ensemble bien appropriés d'une plaque de 24 puits de culture de tissu.
- Les stimulants doit être reconstitué et mis à la température ambiante avant de commencer l'essai de stimulation. Lyophilisée LPS et l'ATP doit être reconstitué selon les instructions du fabricant. Après reconstitution, le LPS et l'ATP peut être encore diluée à une concentration correcte des stocks en utilisant incomplète du milieu RPMI 1640.
- Ajouter au LPS LPS seule aussi bien que le LPS, plus l'ATP ainsi afin que la concentration de travail finale du LPS est 1 ug / ml. Le temps de stimulation totale est de 3 heures. Cependant, le sang entier est stimulé par le LPS pendant 2 heures et 40 minutes. Les échantillons doivent être placés dans une étuve à 37 ° C et 5% de CO 2.
- L'ATP est ajoutée au cours des 20 dernières minutes de la période de trois heures de stimulation. Ajouter de l'ATP aux seuls ATP et le LPS et le bien de l'ATP et des échantillons dans l'incubateur. La concentration finale de travail de l'ATP est de 2mm.
- Après la période d'incubation de 3 heures, recueillir surnageants par aliquotage chaque échantillon dans un tube de 1,5 ml et ensuite centrifugation des échantillons à 10000 rpm pendant 2 minutes à température ambiante. Transférer les surnageants à un autre ensemble de 1,5 microtubes.
- Les échantillons peuvent être analysés immédiatement ou stockées temporairement à -20 ° C ou -80 ° C pour stockage à long terme.
4. Assay cytokines
- Les échantillons qui sont congelés doivent s'équilibrer à température ambiante avant l'analyse. Les concentrations de cytokines IL-1βcan être évalués en utilisant une variété de méthodes. Nous utilisons la Bio-Plex cytokine pro-Plex humaine x dosage avec le Bio-Plex 200 système, selon les instructions du fabricant. Dans ce protocole, nous sommes particulièrement l'IL-1β mesure, cependant, nous utilisons ce test multiplex de cytokines dans le but de mesurer simultanément multiples cytokines dans un essai avec l'avantage d'utiliser un petit volume d'échantillon.
5. Les résultats représentatifs
Analyse de l'IL-1β de production lors de la stimulation de succès avec le LPS et l'ATP ne montre unesoi la réponse dépend du nombre de cellules étant stimulée. Nous avons constaté que 2,0 x 10 6 cellules / ml est une concentration suffisante pour produire une concentration optimale et mesurable de l'IL-1β ainsi que d'autres cytokines (figure 2).
Dosages de sang total sont utiles dans l'étude les patients qui présentent des manifestations auto-inflammatoires. Ces patients peuvent présenter un défaut dans le système immunitaire inné, ce qui peut être caractérisée par la surproduction d'IL-1β (comparativement aux témoins) après stimulation par le LPS seul (figure 3).
Figure 1. Image représentative de la coloration AO pour nucléées globules blancs utilisés afin de déterminer la concentration de cellules dans le nombre dilué échantillons de sang total.
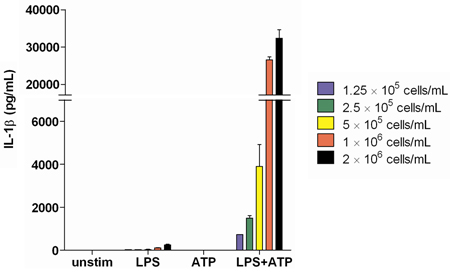
Figure 2. IL-1β production mesurée dans les surnageants de sang total d'un donneur sain après stimulation par le LPS à des concentrations de cellules augmente. Les échantillons ont été dosés en triple exemplaire.
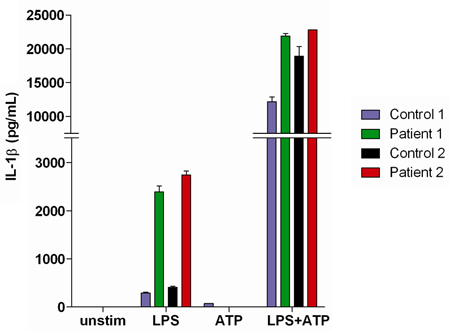
Figure 3. Les résultats représentatifs de l'IL-1β sécrétion mesurée dans les surnageants de sang entier à partir de deux témoins sains normaux, ainsi que deux patients se présentant avec de l'IL-1β associée manifestations auto-inflammatoires.
Discussion
Le dosage sanguin de l'ensemble décrit est une méthode simple qui se rapproche le plus des conditions physiologiques par rapport aux autres techniques qui nécessitent l'isolement cellulaire et de traitement des échantillons vaste et la manipulation. Cette méthode utilise la Vision Cellometer avec AO pour compter les globules blancs dans le sang et fournit donc un moyen de normaliser les échantillons avec précision en fonction du nombre de cellules.
Il est à noter que pour ce ...
Déclarations de divulgation
Remerciements
Cette recherche a été financée par le Programme de recherche intra-muros de l'Institut national de l'arthrite et les maladies musculo-squelettiques et la peau du National Institutes of Health.
matériels
| Name | Company | Catalog Number | Comments |
| Sodium Heparin Blood Collection Tubes | BD Biosciences | 366480 | |
| RPMI 1640 Media | GIBCO, by Life Technologies | 21870-100 | |
| Acridine Orange | Invitrogen | A3568 | |
| Cellometer Vision | Nexcelom Bioscience | Contact company for instrument information | |
| Cellometer Cell Counting Chambers | Nexcelom Bioscience | CHT4-SD100 | |
| 24-well Tissue Culture Plate | Corning | 3524 | |
| Ultra Pure E. coli K12 LPS | Invitrogen | tlrl-eklps | |
| Adenosine 5´-tripohasphate disodium salt hydrate | Sigma-Aldrich | A26209 | |
| Bio-plex 200 system | Bio-Rad | Contact company for instrument information | |
| Bio-Plex Pro human cytokine x-plex assay | Bio-Rad | x-plex assays are custom made according to specified cytokines of interest |
Références
- Martinon, F., Mayor, A., Tschopp, J. The inflammasomes: guardians of the body. Annu Rev Immunol. 27, 229-265 (2009).
- Thurm, C. W., Halsey, J. F. Measurement of cytokine production using whole blood. Curr Protoc Immunol. 66, 7-18 .
- Mariathasan, S. Cryopyrin activates the inflammasome in response to toxins and ATP. Nature. 440, 228-232 (2006).
- Gabay, C., Lamacchia, C., Palmer, G. IL-1 pathways in inflammation and human diseases. Nat Rev Rheumatol. 4, 232-241 (2010).
- Franchi, L., Elgenbrod, T., Muñoz-Planillo, R., Nuñez, G. The inflammasome: a caspase-1-activation platform that regulates immune responses and disease pathogenesis. Nat Immunol. 3, 241-247 (2009).
- Sims, J. E., Smith, D. E. The IL-1 family: regulators of immunity. Nat Rev Immunol. 2, 89-102 (2010).
- Haug, R., Joø, G. B., Westvik, A. B., Kierulf, P. Chemokine production and pattern recognition receptor (PRR) expression in whole blood stimulated with pathogen-associated molecular patterns (PAMPs. Cytokine. 32, 304-315 (2005).
- Netea, M. G. Differential requirement for the activation of the inflammasome for processing and release of IL-1bin monocytes and macrophages. Blood. 113, 2324-2335 (2009).
- Latz, E. The inflammasomes: mechanisms of activation and function. Curr Opin Immnol. 22, 28-33 (2010).
- Masters, S. L., Simon, A., Aksentijevich, I., Kastner, D. L. Horror autoinflammaticus: the molecular pathophysiology of autoinflammtory disease. Annu Rev Immunol. 27, 621-668 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon