需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
激活细胞凋亡的细胞色素的细胞质显微注射 C
摘要
在这个协议中,我们描述直接胞浆内显微注射细胞色素 C蛋白的成纤维母细胞和初级交感神经元。这种技术可以引进的细胞色素 C蛋白进入细胞的细胞质和模仿释放细胞色素 C从线粒体,细胞凋亡过程中发生。
摘要
凋亡或程序性细胞死亡,是一个保守的和高度管制的途径,其中的细胞死亡 , 1。可以触发细胞凋亡的细胞时遇到一个广泛的细胞毒性强调。这些侮辱启动信号级联反应,最终导致细胞色素 C从线粒体intermembrane空间释放到细胞质2。细胞色素 C从线粒体释放,是一个关键的事件触发迅速激活caspases的,关键的细胞蛋白酶,其最终执行细胞死亡3-4。
细胞凋亡通路是调节细胞色素 C从线粒体释放5点的上游和下游。为了研究线粒体调节caspase活化后,许多研究者纷纷转向直接holocytochrome C(血红素附后)蛋白质进入细胞6-9的胞浆内显微注射。细胞色素 c通常是本地化的线粒体一个血红素组的附件是必要的,使其能够激活细胞凋亡 10-11 。因此,直接激活caspases的,这是必要的,因为细胞色素 C的基因结构表达,而将导致线粒体定位和血红素附件,它将会从胞质caspases的螯合注入holocytochrome C蛋白,而不是其cDNA。因此,直接附加纯化的血红素细胞色素C蛋白的胞浆内显微注射是一个有用的工具,以模仿不使用造成细胞线粒体损伤的有毒侮辱的线粒体细胞色素C释放和凋亡。
在这篇文章中,我们描述了细胞色素 c蛋白进入细胞的显微注射的方法,用小鼠胚胎成纤维细胞(MEFs)和主要交感神经元作为例子。虽然这个协议对细胞色素 C注射液对细胞凋亡的调查重点,这里显示的技术也可以很容易地适应注射其他感兴趣的蛋白质。
研究方案
1。生产的微量注射针
- 商业预制的显微注射针(如Eppendorf公司Femtotips)是有用的,如果没有进行大量的microinjections。然而,对于那些希望建立长期的能力,为显微注射,另一种方法是在实验室采用薄壁高硼硅玻璃毛细管和商业针拉马生产的微量注射针。这也使针的形状是多种多样的,可用于不同类型的细胞。
- Narishige PC - 10显微注射针拖轮,将所有4个重量和58.0相对热定型(第二热水器)使用一个单步拉方案(第1步设置)。请务必放置在中心的每一个毛细血管加热元件,使这两个导致针头长度是一个类似的。
- 拉几个毛细血管(约2为每个感兴趣的蛋白质的毛细血管)。
- 商店针在一个容器中,同时确保不损坏针尖。在容器内,可用于材料,如泡沫或Blu - TACK举行显微注射针。
2。注射蛋白质混合物的制备
- 准备了10倍的显微注射缓冲液pH值在7.4 1米氯化钾和0.1 M磷酸钾(KPI),缓冲区(K 2 HPO 4和 KH 2 PO 4摩尔混合物)。这个缓冲区,可以在室温下长期存放。
- 为了形象化注射,这样的荧光染料罗丹明-葡聚糖需要加以补充。在水中稀释the10x显微注射缓冲和罗丹明-葡聚糖粉末溶于5倍的显微注射缓冲液中含有20-40毫克/毫升罗丹明右旋糖酐。
- 商店这个解决方案,在黑暗中,在4 ° C。它应为多达100个个人的蛋白质溶液的准备工作有足够。其它染料,如异硫氰酸荧光素葡聚糖,可以替代。
- 准备溶于水纯化细胞色素 c的浓度为20毫克/毫升细胞色素 c的股票。商店细胞色素 c在-80 ° C下长期贮存和小(〜10μL)分装储存在细胞色素 c,避免反复冻融。
- 准备注射10μL蛋白质混合物2μL5倍显微注射缓冲液3μL水和5μL的细胞色素 C终浓度为10 mg / mL的细胞色素 c在1x缓冲液(氯化钾100毫米,10毫米KP罗丹明-葡聚糖结合我 4-8毫克/毫升罗丹明葡聚糖)。
3。细胞质显微注射细胞色素 c
- 之前,以显微注射,离心16,000克的细胞色素 C和显微注射缓冲的混合物为10分钟,在4 ° C至单独的任何微粒物质可能堵塞显微注射针。
- 在离心过程中,微量允许气压建立。
- 放在显微镜阶段的中心一碟的细胞和细胞的重点。为了尽量减少时间,细胞外的孵化器,的数量,细胞通常返回在30分钟内的孵化器。
- 吸取0.5-1微升到钝端的毛细管顶面的蛋白质混合物。小心不要吸管已离心管底部的粒子。一分钟内,蛋白质混合物将分发到针尖通过毛细作用。
- 毛细管持有人的显微和位置,因此,其尖端通过在显微镜透射光经过约45 °角的针针连接牢固。
- 调整针尖的位置,使其位于视野中心直接。中心针,用显微针移动,同时通过显微镜目镜。针的阴影应该是可见的。使只看到它的身影在视野的一半,表明针尖以上的细胞为中心,调整针。
- 设置的微量连续流动模式,并设定工作压力为20 - 100百帕。每一针,可能需要不同的工作压力,工作压力可能会需要在显微注射过程中的调整,以保持一个稳定的的流量。
- 下针,使用粗旋钮位置正上方的细胞。要做到这一点,提高显微镜的焦平面位置正上方的细胞。然后重点是降低对使用粗旋钮细胞的针,直到针尖。
- 中心视野范围内的针尖,并增加通过改变显微镜物镜的放大倍率。
- 慢慢放下针使用罚款操纵旋钮unti升针略高于细胞焦平面。
- 检查红色荧光的罗丹明蛋白质混合物的流动。蛋白质混合物应退出针薄,络绎不绝。针应更换和重新加载如果针被攻破或如果流量是过于强烈。有时,是封闭的玻璃毛细管尖端和无流针。如果发生这种情况,更换针头或仔细降低到培养皿的底部针尖轻轻破裂。
- 针尖,这是对一个细胞在大约45 °角指向的位置。然后用一个平滑的运动,降低针,而走向细胞。与第二个平滑的运动,立即扭转针的方向,从细胞中移除。
- 一个成功的注入细胞往往会略微膨胀,可以通过可视化细胞内的红色荧光的罗丹明确认。有时,将意外注入细胞中的细胞核,这将是可见的的。
- 继续注资,通过调整显微镜阶段,直到约50-100细胞注入细胞。当移动显微镜阶段,一定要提高显微注射针,以便它清除细胞的顶部。
4。代表性的成果:
胞浆内显微注射细胞色素 C从线粒体细胞凋亡过程中模仿其释放。因此,正如所料,成纤维细胞迅速进行胞浆内显微注射的牛细胞色素 c(图1A)后,细胞凋亡。为了确保单独注射过程不负责细胞死亡,注射酵母细胞色素 c作为一个重要的控制的,因为酵母细胞色素 c是无法激活caspases 的 12 。
有趣的是,有丝分裂后的交感神经元胞浆细胞色素c( 图 1B)8,13显着的抗。我们的实验室已经确定了内源性caspase抑制剂XIAP的是一个 14神经细胞caspase活化的关键抑制剂。因此,神经元细胞色素C注射液后死亡,XIAP的必须先成为灭活。例如,显微注射到XIAP - / -交感神经元细胞色素 C是足以让在这些细胞中caspase活化和细胞凋亡(图2)。
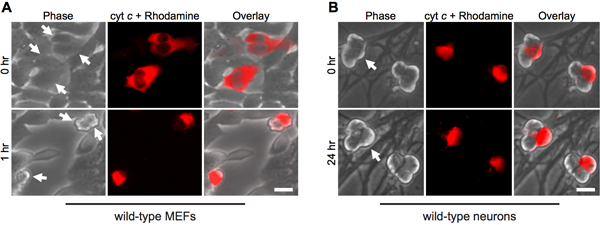
图1。细胞质显微注射细胞色素 C诱导成纤维细胞迅速死亡,但没有神经元。一)野生型MEFs或(B)出生后5野生型交感神经元牛细胞色素C(10毫克/毫升),连同罗丹明-葡聚糖标记注射细胞显微注射。图像显示细胞后立即注射(0小时)相同的领域,或在指定的时间。箭头指示注入细胞。比例尺,20微米。
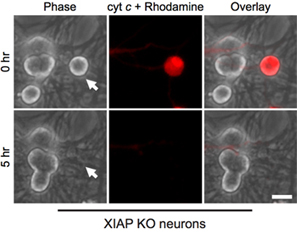
图2。 XIAP的缺陷神经元容易胞浆细胞色素 C显微注射。产后第5天XIAP的基因敲除小鼠的交感神经元,与牛的细胞色素 C(10毫克/毫升),连同罗丹明-葡聚糖标记注射细胞显微注射。图像显示,同一领域的细胞立即注射后(0小时),或细胞色素 c显微注射后5小时(5小时)。比例尺,20微米。
讨论
直接进入细胞胞浆内显微注射细胞色素 C是一种独特而强大的的工具,它允许后线粒体调控细胞凋亡的研究。更重要的是,这种技术可以让没有使用导致细胞或线粒体损伤的代理的直接激活线粒体凋亡下游。
虽然这个协议对微量注射细胞色素 C对细胞凋亡的研究重点,这里显示的蛋白质显微注射法的一般原则也可以用于其他感兴趣的蛋白质。例如,一些研究者已?...
披露声明
致谢
这项工作是由美国国立卫生研究院授予NS042197到MD支持。 AJK支持补助T32GM008719和F30NS068006。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | 评论 |
|---|---|---|---|
| 马克IRE2倒置显微镜 | 徕卡 | ||
| PC - 10显微注射针拖轮 | Narishige | ||
| 最低工资的202微操作机器人 | Narishige | ||
| FemtoJet微量 | Eppendorf公司 | ||
| 薄壁Boroscilicate毛细管玻璃与微丝 | 上午系统 | 615000 | 4英寸长,1.00毫米外径,内径0.75 |
| 罗丹明B异硫氰酸-葡聚糖 | Sigma - Aldrich公司 | R9379 | 平均分子量约70000大 |
| 牛细胞色素C蛋白 | Sigma - Aldrich公司 | C3131 |
参考文献
- Danial, N. N., Korsmeyer, S. J. Cell death: critical control points. Cell. 116, 205-219 (2004).
- Wang, X. The expanding role of mitochondria in apoptosis. Genes Dev. 15, 2922-2933 (2001).
- Hengartner, M. O. The biochemistry of apoptosis. Nature. 407, 770-776 (2000).
- Fuentes-Prior, P., Salvesen, G. S. The protein structures that shape caspase activity, specificity, activation and inhibition. Biochem. J. 384, 201-232 (2004).
- Tait, S. W., Green, D. R. Mitochondria and cell death: outer membrane permeabilization and beyond. Nat Rev Mol Cell Biol. 11, 621-632 (2010).
- Brustugun, O. T., Fladmark, K. E., Doskeland, S. O., Orrenius, S., Zhivotovsky, B. Apoptosis induced by microinjection of cytochrome c is caspase-dependent and is inhibited by Bcl-2. Cell Death Differ. 5, 660-668 (1998).
- Li, F. Cell-specific induction of apoptosis by microinjection of cytochrome c. Bcl-XL has activity independent of cytochrome c release. J. Biol. Chem. 272, 30299-30305 (1997).
- Deshmukh, M., Johnson, E. M. Evidence of a novel event during neuronal death: development of competence-to-die in response to cytoplasmic cytochrome c. Neuron. 21, 695-705 (1998).
- Vaughn, A. E., Deshmukh, M. Glucose metabolism inhibits apoptosis in neurons and cancer cells by redox inactivation of cytochrome c. Nat. Cell Biol. 10, 1477-1483 (2008).
- Yang, J. Prevention of apoptosis by Bcl-2: release of cytochrome c from mitochondria blocked. Science. 275, 1129-1132 (1997).
- Gonzales, D. H., Neupert, W. Biogenesis of mitochondrial c-type cytochromes. J Bioenerg Biomembr. 22, 753-768 (1990).
- Ellerby, H. M. Establishment of a cell-free system of neuronal apoptosis - comparison of premitochondrial, mitochondrial, and postmitochondrial phases. J. Neurosci. 17, 6165-6178 (1997).
- Neame, S. J., Rubin, L. L., Philpott, K. L. Blocking cytochrome c activity within intact neurons inhibits apoptosis. J. Cell Biol. 142, 1583-1593 (1998).
- Potts, P. R., Singh, S., Knezek, M., Thompson, C. B., Deshmukh, M. Critical function of endogenous XIAP in regulating caspase activation during sympathetic neuronal apoptosis. J. Cell Biol. 163, 789-799 (2003).
- Estus, S. Altered gene expression in neurons during programmed cell death: identification of c-jun as necessary for neuronal apoptosis. J. Cell Biol. 127, 1717-1727 (1994).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。