Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Die Aktivierung der Apoptose durch cytoplasmatische Mikroinjektion von Cytochrom C
In diesem Artikel
Zusammenfassung
In diesem Protokoll, beschreiben wir die direkte zytoplasmatische Mikroinjektion von Cytochrom C Protein in Fibroblasten und primäre sympathischen Neuronen. Diese Technik ermöglicht die Einführung von Cytochrom C Protein in das Zytoplasma der Zellen und ahmt die Freisetzung von Cytochrom C Aus den Mitochondrien, die auftritt, während der Apoptose.
Zusammenfassung
Apoptose oder der programmierte Zelltod, ist eine konservierte und stark regulierten Weg durch die Zellen sterben 1. Apoptose ausgelöst, wenn die Zellen Begegnung eine breite Palette von zytotoxischen betont werden. Diese Beleidigungen initiieren Signalkaskaden, die letztlich zur Freisetzung von Cytochrom c aus den Mitochondrien Intermembranraum in das Cytoplasma 2. Die Freisetzung von Cytochrom c aus den Mitochondrien ist ein wichtiges Ereignis, dass die schnelle Aktivierung von Caspasen, die wichtigsten zellulären Proteasen, die letztlich zum Zelltod führen 3-4 auslöst.
Der Weg der Apoptose wird an den Punkten vor-und nachgelagerten von Cytochrom c Freisetzung aus Mitochondrien 5 geregelt. Um die post-mitochondrialen Regulation der Caspase-Aktivierung Studie haben viele Forscher den direkten cytoplasmatischen Mikroinjektion von Holocytochrom c (Häm-attached)-Protein in Zellen 6-9 gedreht. Cytochrom c ist in der Regel in die Mitochondrien, wo Anbringung eines Häm-Gruppe ist notwendig, damit es zur Apoptose 10-11 aktivieren lokalisiert. Deshalb, um direkt zu aktivieren Caspasen, ist es notwendig, die Holocytochrom c Protein anstelle des cDNA injizieren, denn während die Expression von Cytochrom c aus cDNA-Konstrukte in der mitochondrialen Targeting-und Häm-Anlage führen wird, ist es von der zytosolischen Caspasen beschlagnahmt werden. So ist die direkte cytosolische Mikroinjektion von gereinigtem Häm-attached Cytochrom c-Protein ein nützliches Instrument zur mitochondrialen Cytochrom c Freisetzung und Apoptose, ohne die Verwendung von giftigen Beleidigungen, die zellulären und mitochondrialen Schäden verursachen imitieren.
In diesem Artikel beschreiben wir eine Methode für die Mikroinjektion von Cytochrom c-Proteins in Zellen mit embryonalen Maus-Fibroblasten (MEFs) und der primären sympathischen Neuronen als Beispiele. Während dieses Protokoll konzentriert sich auf die Injektion von Cytochrom c für Untersuchungen der Apoptose, können die hier gezeigten Techniken auch leicht für die Mikroinjektion der andere Proteine von Interesse angepasst werden.
Protokoll
1. Produktion von Mikroinjektion Needles
- Vorgefertigte Mikroinjektion Nadeln sind im Handel erhältlich (z. B.. Femtotips von Eppendorf) und sind nützlich, wenn man nicht die Durchführung einer großen Anzahl von microinjections. Doch für diejenigen, die langfristigen Möglichkeiten für Mikroinjektion aufbauen wollen, ist eine Alternative zur Mikroinjektion Nadeln im Labor mit dünnwandigen Borosilikatglas Kapillaren und eine kommerzielle Nadel puller produzieren. Dies ermöglicht auch die Form von Nadeln variiert werden, was nützlich sein kann für verschiedene Zelltypen.
- Mit dem Narishige PC-10 Mikroinjektionsnadel Puller, legen alle vier Gewichte und benutzen Sie eine Ein-Schritt-Zug-Programms (Schritt 1 Einstellung) mit der relativen Wärme-Einstellung bei 58,0 (No.2 Heizung). Achten Sie darauf, das Heizelement in der Mitte jeder Kapillare so Platz, dass die beiden entstehenden Nadeln eine ähnliche Länge haben.
- Ziehen Sie mehrere Kapillaren (ca. 2 Kapillaren für jedes Protein von Interesse).
- Shop Nadeln in einem Container, während sie sicher nicht an der Nadelspitze Schäden. Materialien wie Schaumstoff oder Blu-Tack können in Containern eingesetzt werden, um die Mikroinjektion Nadeln halten.
2. Herstellung von Protein-Mischungen für die Injektion
- Bereiten Sie eine 10-Mikroinjektion Puffer mit 1 M Kaliumchlorid und 0,1 M Kaliumphosphatpuffer (KPI)-Puffer (äquimolare Mischung aus K 2 HPO 4 und KH 2 PO 4) bei einem pH von 7,4. Dieser Puffer kann langfristig aufbewahrt bei Raumtemperatur.
- Zur Visualisierung der Injektion muss ein fluoreszierender Farbstoff wie Rhodamin-Dextran hinzugefügt werden. Verdünnen the10x Mikroinjektion Puffer in Wasser auflösen und Rhodamin-Dextran Pulver zu einer 5x Mikroinjektion Pufferlösung mit 20-40 mg / mL Rhodamin Dextran zu machen.
- Bewahren Sie diese Lösung im Dunkeln bei 4 ° C. Es sollte ausreichen, für bis zu 100 einzelnen Protein-Lösung Vorbereitungen. Andere Farbstoffe, wie Fluoresceinisothiocyanat-Dextran ersetzen können.
- Bereiten Cytochrom c Aktien durch Auflösen von gereinigtem Cytochrom c in Wasser zu einer Konzentration von 20 mg / mL. Shop Cytochrom c bei -80 ° C für die langfristige Lagerung und zur Vermeidung von Frost-Tau-Zyklen durch die Speicherung Cytochrom c in klein (~ 10 l) Aliquots.
- Bereiten Sie eine 10 l Protein-Mischung für die Injektion durch die Kombination von 2 ul 5x Mikroinjektion Puffer mit Rhodamin-Dextran mit 3 ul Wasser und 5 ul Cytochrom c für eine endgültige Konzentration von 10 mg / mL Cytochrom c in 1x Puffer (100 mM KCl, 10 mM KP i, 4-8 mg / mL Rhodamin Dextran).
3. Zytoplasmatische Mikroinjektion von Cytochrom c
- Kurz vor der Mikroinjektion, Zentrifuge die Mischung von Cytochrom c und Mikroinjektion Puffer bei 16.000 g für 10 Minuten bei 4 ° C zu jedem Partikel, die Mikroinjektion Nadeln verstopfen können zu trennen.
- Während der Zentrifugation auf die Mikroinjektor wiederum zu ermöglichen Luftdruck zu bauen.
- Legen Sie ein Gericht von Zellen in der Mitte des Mikroskoptisches und den Fokus auf die Zellen. Zur Minimierung der Menge an Zeit, dass die Zellen außerhalb des Inkubators gehalten werden, werden die Zellen in der Regel in den Inkubator innerhalb von 30 min zurück.
- Pipette 0,5-1 ul von der Oberfläche des Proteins Mischung in das stumpfe Ende der Kapillare. Seien Sie vorsichtig, um nicht Pipette alle Partikel, die an der Unterseite des Rohres wurden zentrifugiert. Innerhalb einer Minute wird das Proteingemisch auf die Nadelspitze durch Kapillarwirkung zu verteilen.
- Befestigen Sie die Nadel fest mit der Kapillare Inhaber der Mikromanipulator und die Position der Nadel so dass seine Spitze durch das übertragene Licht des Mikroskops verläuft bei ca. 45 °-Winkel.
- Passen Sie die Position der Nadelspitze, so dass es direkt in der Mitte des Sichtfeldes liegt. Zur Zentrierung der Nadel, mit der Mikromanipulator, um die Nadel zu bewegen, während Sie durch das Mikroskop-Okular. Die Nadel Schatten sichtbar sein soll. Stellen Sie die Nadel so, dass ihr Schatten ist nur in einer Hälfte des Gesichtsfeldes zu sehen, was darauf hinweist, dass die Nadelspitze über den Zellen zentriert ist.
- Stellen Sie die Mikroinjektor der Continuous Flow-Modus und stellen Sie den Betriebsdruck auf 20 bis 100 hPa. Jede Nadel kann eine andere Betriebsdruck und der Betriebsdruck wird wahrscheinlich angepasst werden müssen während der Mikroinjektion Verfahren, um einen stetigen Fluss zu halten.
- Senken Sie die Nadel mit dem groben Drehknopf um eine Position oberhalb der Zellen. Um dies zu tun, heben Sie die Fokusebene des Mikroskops in eine Position oberhalb der Zellen. Dann senken Sie die Nadel auf die Zellen unter Verwendung des groben Regler, bis die Nadelspitze im Fokus ist.
- Re-Center die Nadelspitze in das Sichtfeld und die Vergrößerung zu erhöhen, indem Sie die Mikroskop-Objektiv.
- Langsam senken Sie die Nadel mit dem feinen Manipulator Knopf until die Nadel knapp über der Brennebene der Zellen.
- Überprüfen Sie den Ablauf der Protein-Mischung, indem man die rote Fluoreszenz des Rhodamin. Das Protein Mischung sollte Verlassen der Nadel als eine dünne, konstanten Strom. Needles sollte ersetzt werden und wieder geladen werden, wenn die Nadel gefährdet ist oder wenn die Strömung ist viel zu stark. Manchmal ist die Spitze der Glaskapillare geschlossen und keine Strömung wird von der Nadel zu sehen. Wenn dies der Fall, ersetzen Sie die Nadel oder sorgfältig niedrigeren es auf den Boden der Kulturschale zu sanft Bruch der Spitze der Nadel.
- Position der Nadelspitze, so dass es zu einer Zelle verweist auf ca. 45 °-Winkel. Dann mit einer geschmeidigen Bewegung, senken Sie die Nadel, während Sie sie in Richtung der Zelle. Mit einer zweiten glatten Bewegung, sofort rückwärts Richtung der Nadel, um sie aus der Zelle zu entfernen.
- Ein erfolgreich injizierten Zellen wird oft leicht anschwellen und kann durch die Visualisierung der rot fluoreszierende Rhodamin innerhalb der Zelle zu bestätigen. Gelegentlich wird eine Zelle versehentlich in den Zellkern, die sichtbar sein wird injiziert werden.
- Fahren Sie mit Zellen, die durch die Anpassung der Mikroskoptisch bis etwa 50-100 Zellen injiziert werden zu injizieren. Beim Bewegen des Mikroskops, müssen Sie die Mikroinjektionsnadel erhöhen, so dass es Anfang der Zellen löscht.
4. Repräsentative Ergebnisse:
Die cytoplasmatische Mikroinjektion von Cytochrom c ahmt seine Freisetzung aus Mitochondrien während der Apoptose. So, wie erwartet, Fibroblasten schnell Apoptose auf zytosolische Mikroinjektion von Rindern Cytochrom c (Abb. 1A). Um sicherzustellen, dass die Injektion allein nicht verantwortlich für den Zelltod, dient Injektion von Hefe Cytochrom c als eine wichtige Kontrolle, da Hefe Cytochrom c ist unfähig, die Aktivierung Caspasen 12.
Interessanterweise sind post-mitotischen sympathischen Neuronen bemerkenswert widerstandsfähig gegenüber cytosolischen Cytochrom c (Abb. 1B) 8,13. Unser Labor hat festgestellt, dass die endogene Caspase-Inhibitor XIAP eine Schlüsselrolle Inhibitor der Caspase-Aktivierung in Neuronen 14 ist. So Neuronen nach Cytochrom c Injektion sterben müssen XIAP werden erst inaktiviert. Zum Beispiel, Mikroinjektion von Cytochrom c in XIAP - wird sympathischen Neuronen ausreichend, um Caspase-Aktivierung und Apoptose in diesen Zellen (Abb. 2) ermöglichen - /.
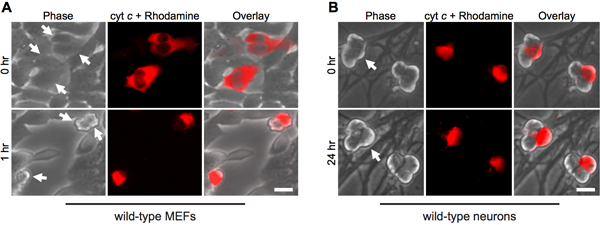
Abbildung 1. Zytoplasmatische Mikroinjektion von Cytochrom c induziert einen schnellen Tod in Fibroblasten, aber nicht Neuronen. A) Wildtyp-MEFs oder (B) postnatalen Tag 5 Wildtyp-sympathischen Neuronen wurden mit Rinder-Cytochrom c (10 mg / ml) zusammen mit Rhodamin-Dextran injizierten Zellen markieren mikroinjiziert. Bilder zeigen den gleichen Bereich der Zellen unmittelbar nach der Injektion (0 h), oder zu den angegebenen Zeiten. Die Pfeile zeigen die injizierten Zellen. Scale-bar, 20 um.
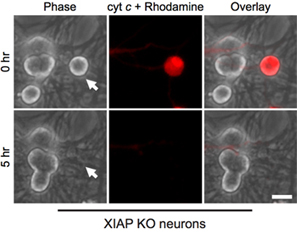
Abbildung 2. XIAP-defizienten Neuronen anfälliger für zytoplasmatische Cytochrom c Mikroinjektion. Postnatale Tag 5 sympathischen Neuronen von XIAP-Knockout-Mäusen wurden mit Rinder-Cytochrom c (10 mg / ml) zusammen mit Rhodamin-Dextran injizierten Zellen markieren mikroinjiziert. Bilder zeigen den gleichen Bereich der Zellen unmittelbar nach der Injektion (0 h) oder 5 Stunden nach der Cytochrom-c-Mikroinjektion (5 Std.). Scale-bar, 20 um.
Diskussion
Die Mikroinjektion von Cytochrom c direkt in das Zytoplasma der Zellen ist ein einzigartiges und leistungsfähiges Werkzeug, das für die Untersuchung der post-mitochondrialen Regulation der Apoptose ermöglicht. Wichtig ist, ermöglicht diese Technik für die direkte Aktivierung der Apoptose stromabwärts von Mitochondrien ohne den Einsatz von Mitteln, die zellulären oder mitochondriale Schäden verursachen.
Während dieses Protokoll auf die Mikroinjektion von Cytochrom c...
Offenlegungen
Danksagungen
Diese Arbeit wurde vom NIH NS042197 zu MD unterstützt. AJK wurde durch Zuschüsse T32GM008719 und F30NS068006 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
|---|---|---|---|
| DM IRE2 Inverses Mikroskop | Leica | ||
| PC-10 Mikroinjektionsnadel Puller | Narishige | ||
| MWO-202 Mikromanipulator | Narishige | ||
| FemtoJet Mikroinjektor | Eppendorf | ||
| Dünnwandige Boroscilicate Kapillar-Glas mit Microfilament | AM-Systeme | 615000 | 4 inch Länge, 1,00 mm Außendurchmesser, 0,75 mm Innendurchmesser |
| Rhodamin B-Isothiocyanat-Dextran | Sigma-Aldrich | R9379 | Durchschnittliches Molekulargewicht ~ 70.000 Da |
| Bovine Cytochrom c Protein | Sigma-Aldrich | C3131 |
Referenzen
- Danial, N. N., Korsmeyer, S. J. Cell death: critical control points. Cell. 116, 205-219 (2004).
- Wang, X. The expanding role of mitochondria in apoptosis. Genes Dev. 15, 2922-2933 (2001).
- Hengartner, M. O. The biochemistry of apoptosis. Nature. 407, 770-776 (2000).
- Fuentes-Prior, P., Salvesen, G. S. The protein structures that shape caspase activity, specificity, activation and inhibition. Biochem. J. 384, 201-232 (2004).
- Tait, S. W., Green, D. R. Mitochondria and cell death: outer membrane permeabilization and beyond. Nat Rev Mol Cell Biol. 11, 621-632 (2010).
- Brustugun, O. T., Fladmark, K. E., Doskeland, S. O., Orrenius, S., Zhivotovsky, B. Apoptosis induced by microinjection of cytochrome c is caspase-dependent and is inhibited by Bcl-2. Cell Death Differ. 5, 660-668 (1998).
- Li, F. Cell-specific induction of apoptosis by microinjection of cytochrome c. Bcl-XL has activity independent of cytochrome c release. J. Biol. Chem. 272, 30299-30305 (1997).
- Deshmukh, M., Johnson, E. M. Evidence of a novel event during neuronal death: development of competence-to-die in response to cytoplasmic cytochrome c. Neuron. 21, 695-705 (1998).
- Vaughn, A. E., Deshmukh, M. Glucose metabolism inhibits apoptosis in neurons and cancer cells by redox inactivation of cytochrome c. Nat. Cell Biol. 10, 1477-1483 (2008).
- Yang, J. Prevention of apoptosis by Bcl-2: release of cytochrome c from mitochondria blocked. Science. 275, 1129-1132 (1997).
- Gonzales, D. H., Neupert, W. Biogenesis of mitochondrial c-type cytochromes. J Bioenerg Biomembr. 22, 753-768 (1990).
- Ellerby, H. M. Establishment of a cell-free system of neuronal apoptosis - comparison of premitochondrial, mitochondrial, and postmitochondrial phases. J. Neurosci. 17, 6165-6178 (1997).
- Neame, S. J., Rubin, L. L., Philpott, K. L. Blocking cytochrome c activity within intact neurons inhibits apoptosis. J. Cell Biol. 142, 1583-1593 (1998).
- Potts, P. R., Singh, S., Knezek, M., Thompson, C. B., Deshmukh, M. Critical function of endogenous XIAP in regulating caspase activation during sympathetic neuronal apoptosis. J. Cell Biol. 163, 789-799 (2003).
- Estus, S. Altered gene expression in neurons during programmed cell death: identification of c-jun as necessary for neuronal apoptosis. J. Cell Biol. 127, 1717-1727 (1994).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten