需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
片上的无透镜荧光显微镜
摘要
一个无透镜片上荧光显微镜平台,证明可以超过,如超宽现场,查看荧光图像对象,> 0.6-8平方厘米<4μm的使用压缩采样的解码算法的决议。这种紧凑型和宽视场荧光片上的成像方式,可用于高通量流式细胞仪,罕见的细胞研究和基因芯片分析的价值。
摘要
一般无透镜成像芯片,旨在更简单和更紧凑的设计,以取代笨重的镜头,尤其是对高通量筛选应用光学显微镜,。这个新兴的技术平台,以消除潜在需要的笨重和/或昂贵的光学元件,通过新颖的理论和数字重建算法的帮助。按照同样的思路,在这里我们展示了一个芯片上的荧光显微镜模式,可以实现超过超宽领域的视角(FOV)的4μm的空间分辨率> 0.6-8厘米2例如,没有使用任何镜头,机械扫描或基于薄膜干涉滤光片。在这种技术中,荧光激发是通过由非相干源照明棱镜或半球形玻璃界面。与整个物体的体积相互作用后,这激发光全内反射(TIR)的过程,是发生在样品的微流体芯片的底部被拒绝。从激发对象的荧光是由光纤面板或锥度然后收集和交付作为一个电荷耦合器件(CCD)光电传感器阵列。通过使用压缩采样的解码算法,收购lensfree原料样品的荧光图像,可以迅速处理产量,例如,0.6-8厘米2 <4μm的分辨率超过了视野。此外,垂直堆叠,如分离的微通道,50-100微米,也可以成功地使用相同的lensfree片上显微镜平台,这进一步增加了这种方式的整体吞吐量成像。这个紧凑的芯片上的荧光成像平台,它背后的快速压缩解码器,可用于高通量流式细胞仪,罕见的细胞研究和基因芯片分析是相当宝贵的。
研究方案
在本节中,我们会审查我们的无透镜片上的荧光显微镜平台 1-4实验方法。为了证明这种技术的能力,我们将显示荧光微颗粒和标记的白血细胞片上的成像效果。虽然这里不讨论,也可以在同一lensfree荧光显微镜平台可以用来形象小动物模型,如转基因C 。 线虫样本3。
1。片上的无透镜成像平台的设计
我们的无透镜片上的成像平台,包括光学元件,包括数字传感器阵列(例如,CCD芯片),非相干照明光源,棱镜,吸收过滤器,光纤面板或光纤锥。如图1所示,这些组件被组装在一个芯片上的一个大样本量的荧光成像,微流体装置,以达到不使用任何镜头,机械扫描仪或薄膜为基础的干扰滤波器。
- 数字传感器阵列:我们的无透镜成像配置采用光电传感器阵列记录从目标微型物体的荧光。在这个平台上,检测到的荧光信号,可用于不同类型的传感器阵列,如CCDs(例如,型号:KAF - 8300,KAI - 11002,KAF - 39000,从柯达)和互补金属氧化物半导体成像(CMOS,例如,型号:MT9T031C12STCD,美光科技)。利益的关键参数包括这些传感器阵列的像素大小(例如,5.4微米,9微米,6.8微米和3.2微米为KAF - 8300,KAI - 11002,KAF - 39000和MT9T031C12STCD,分别)和积极的成像区域(例如,2 2.4厘米,8厘米,18厘米和32毫米为KAF - 8300 2,KAI - 11002,KAF - 39000和MT9T031C12STCD,分别)。对于lensfree片上的成像,CCD传感器在一般情况下的首选,以实现更高的吞吐量(更广泛的活动区域)和较好的灵敏度,而CMOS传感器,可用于相对便宜,重量更轻的设计首选(例如,现场使用)。
- 光源:在我们的平台,非相干光源,例如,一个简单的发光二极管(LED,例如,从Thorlabs,M455L2 - C2和LEDD1B),可用于荧光激发。在实验设置如图所示。 1,一个1毫米的核心尺寸多模光纤电缆(Thorlabs,BFH37 - 1000)是对接耦合LED光源(不使用任何镜头或光学耦合)和激发光,然后交付给通过这种纤维的出口光圈的样本量。在这个系统中,荧光激发所需的功率级应围绕〜0.2 - 5毫瓦的照明纤维出口 2> 2-8厘米的视野;然而,指示灯应能输出〜5MW - 1W功率水平的对接耦合方法是大大有损从而降低在光纤输出的励磁电源。为了实现各种染料的激发,不同颜色的发光二极管也可以通过使用一个光纤耦合器复。
除了芯片上的荧光成像,全息lensfree同一样品的传输图像,还可以得到这个平台,利用图A所示的垂直照明光源。 2。不同的是激发荧光纤维,全息图像采集,不同的光纤电缆与一个更小的核心尺寸(例如,〜50-400微米)耦合到另一个LED光源(Mightex,FCS - 0625 - 000)的对接。这种垂直照明灯,退出纤维结束后,开始采集部分空间相干性,因为它向样品传播。这种空间相干区域的直径是成正比的距离,光纤维出口光圈大小成反比。只要这在样品平面的空间相干性的直径比每个样品的衍射传感器平面尺寸较大,每个对象的散射光可以忠实地干扰的背景光,创造一个lensfree线样品的全息图。这些收购的lensfree全息图,然后可以使用迭代相位恢复方法重建传输亮场图像样本量的5-7迅速处理。对于这种全息照明年底,波长更长的LED(即625-700纳米)被选中,由于过滤器是用来阻止激发光的吸收是典型的截止波长,如高通滤波器,500 - 600nm处,它允许行全息图的样品采集传输没有问题。 - 其他光学元件:在这片上的荧光显微镜平台,两个不同的激励方法,过滤并联使用,以创建所需的暗场背景,如图2所示。首先,一个玻璃棱镜(例如,埃德蒙光学,菱形或鸽子棱镜)或玻璃半球是用于创建全内反射(激发光)在微流体芯片的主机感兴趣的样品的底部表面。平行,一种廉价的吸收过滤器(例如,从Roscolux)是用于去除弱散的激发光,国际公路运输过程中不服从。拒绝使用这两种机制的激励的成功后,只对样品的荧光发射是在探测器平面收购。注意,这里发出的荧光信号的某些部分,也经历了相同的接口TIR。然而,这种芯片成像方法〜1.0,这lensfree检测数值孔径的唯一限制,只有如此高的检测数值孔径以上的斜光线仍然被困在微芯片,而其余的荧光射线仍然可以击中了活跃的领域是由它的像素采样的传感器阵列。
尽管这么大的检测数值孔径,在传感器阵列的原始荧光斑点变得相当广泛(例如,〜150-200微米),由于荧光发射是不定向的,因此迅速发散。工程师和更好的控制,这在我们的无透镜平台的荧光信号的空间传播,我们利用平面光学元件,即一个光纤面板(例如,埃德蒙光学,NT55 - 142),这是对象之间的和放置传感器的飞机。一个光纤面板组成的一个二维数组光缆光信号强度的信息从一个侧面设备进行其他。它在我们lensfree的主要功能片上显微镜设置是从样本量的荧光发射的自由空间模式,没有空间蔓延在每根纤维,可以部分缩小lensfree荧光点行驶的引导光波耦合到扩散函数(PSF)的对象和探测器平面之间。这将进一步提高我们的信号噪声比(SNR)以及空间分辨率,可以通过使用我们的无透镜平台。
作为一个普通面板的替代,我们也可以利用一个“锥形”光纤面板,有一个显着密度较大的光纤电缆在其顶部面底部相比,我们的片上的成像平台。这样一个锥形的面板不只是帮助我们达到一个更好的涤纶短纤,但也可以在我们的平台引进放大(例如,> 2 - 3X),从而进一步帮助我们改进我们的无透镜的分辨率,例如,<4微米。我们还应该注意到,现场这样一个锥形设计的观点是至少推出的放大系数的平方相比,一个普通的面板成像系统,可以构成一个如减少时减少,从〜8厘米2视野最初(CCD:启- 11002),<2 厘米 2锥度。
最后,我们还应该注意到,使用一个光纤面板或锥度歪曲的样品,因为各种光学模式的光纤阵列 3 lensfree全息图。探测器阵列lensfree虽然这种扭曲的模式仍然可以是有用的,对某些流式细胞仪的关系应用全息图像传输,光纤阵列(例如,面板或锥形)重建,需要从芯片组装在成本略有降低空间分辨率在荧光灯模式3。 - 微流体芯片:在我们的平台使用的微流体芯片采用PDMS(聚 二甲基硅氧烷)放在墙壁上创建片上的成像所需的微通道的玻璃幻灯片。编造这些微流体通道,我们采取以下配方:
- PDMS的A和B弹性体均匀混合和搅拌体积比1:10。
- 一旦这种异质的解决方案是倾注到培养皿中,它是固化在65 ° C 2小时。
- 使用的X - ACTO刀,从培养皿中提取所需的大小和形状的微流体通道壁上。
- 该设备结合,然后通过使用高频等离子体发生器(电职业技术产品公司,BD - 10AS),这需要公开盖玻片和PDMS粘接面积。
- 这等离子体处理后,该设备是放在烤箱〜40-50分钟,在70℃,以加强粘接。
- 大会和对齐的无透镜片上显微镜平台:
我们lensfree片上的成像平台的组装程序,可以详细为:- 封面的光电传感器阵列的玻璃被删除。
- 薄的吸收过滤器采用真空笔(埃德蒙光学,NT57 - 636),轻轻地放在探测器的有效面积的顶部。
- 这种吸收f的上一个光纤面板或锥度定位ILTER。
- 所制作的微流体芯片,然后直接放在光纤阵列的顶部。
- 玻璃棱镜或半球组装以上的微流体芯片使用折射率匹配油(Cargille,浸油300系列),这样的接口的折射率玻璃的折射率相匹配。
- 照度纤维移近棱镜(或半球),并调整其角度,总内部反射,以确保在发生相应的微流体芯片的底部基板玻璃 - 空气界面。垂直照度(lensfree传输成像)对齐垂直探测器阵列,并为中心所需的视图领域。
- 侧面和垂直的光线来源是按顺序开启/关闭来实现荧光成像和明亮的场传输成像,采用相同的芯片平台。
- Lensfree原始图像,然后使用定制开发的LabVIEW接口通过PC(例如,3.2 GHz处理器,英特尔酷睿)收购。
2。样品制备
我们用荧光微球(例如,Invitrogen公司,Fluospheres)来校正我们的成像平台,通过测量其lensfree系统点扩散函数(PSF)。这个最初的涤纶短纤测量完成后,各种细胞或小动物模型(例如,转基因线虫示例)可以使用相同的芯片平台成像。
下一子节开始,我们将提供我们的样品制备步骤的进一步细节。
- 荧光微珠:
- 原始荧光珠的解决方案相结合,与去离子水,以优化样品的浓度。
- 〜10μL荧光珠的解决方案是与40μL,5毫升,20毫升去离子水为10微米,4微米,直径为2微米的珠子,分别混合。各种珠子(例如,非荧光灯和荧光灯)的异构解决方案,准备根据需要相互混合不同的磁珠解决方案。
- 最后的样品溶液,然后注入微流体芯片从侧面PDMS的墙壁,用锋利的针头(费舍尔科学,BD PrecisionGlide针,14-826系列)
- 白血细胞标记:
- 红细胞裂解缓冲液(eBioscience公司)〜1毫升〜100μL全血的体积混合。
- 孵育〜3分钟后,离心裂解血液的解决方案是在〜200μL的PBS悬浮颗粒层(磷酸盐缓冲液)。
- 标记的核酸荧光染料的细胞,添加5μL1mm的祥发16到200微升的再悬浮,后样品在室温〜30分钟在黑暗孵育。
- 二是应用离心这个标记的样本,除去上清液,以减少背景噪音,由于未结合的染料荧光。
- 白血细胞沉淀层是重悬于PBS中,然后将其转移到一个芯片上的荧光成像lensfree微流体芯片(例如,图7)。
3。所收购的无透镜荧光图像的数字处理
在这个无透镜成像平台,两个不同的算法,用于数字增加系统的决议,即露西理查森去卷积和基于解码压缩采样 。通过使用这些数字处理方法,我们量化的分辨率增强,可以实现解决紧密排列的珠对每一种方法(见图5-6)。 lensfree重建的荧光图像,然后可以 pseudocolored(如果需要)以突出的微观物体的自然色彩,这肯定需要事先了解的荧光信号的波长,除非一种颜色(例如,一个RGB:红绿蓝CCD / CMOS)传感器芯片。对于这些数字处理方法,使用定制开发的算法,只需要一个CPU(例如,一个3.2 GHz处理器,英特尔酷睿)。潜在的下一代图形处理单元(GPU),也可以用于更快的处理速度。此外,影像,如果需要的话,解码后的荧光对象还可以自动计算使用片上流式细胞仪应用定制开发接口(见图8)。
- 测量系统的点扩散函数(PSF):
任何分辨率的提高(如反褶积或压缩解码)的数字化处理之前,语无伦次点扩散片上系统的功能需求估计,可实现平均测量lensfree由孤立的小荧光灯的荧光模式在一定的高度从传感器芯片位于珠。这些个别荧光模式,然后对齐,尊重他们的大规模坐标中心后要适当强度正常化 1,2平均。然后用这个平均lensfree模式可以作为我们的片上显微镜的荧光点扩散功能。 - 露西理查森反褶积1:数字空间分辨率提高我们的平台,我们进入一个加速露西理查森算法8-10饲料原料收购的荧光图像和语无伦次的测量点扩散函数。通过运用贝叶斯定理,露西- Richardson算法使用的测量点扩散函数,反复提炼荧光源分布在 8,9对象平面的最大似然估计。迭代过程终止后出现噪声放大前的几百周期通常,以确保预测和测量lensfree的荧光模式之间的均方误差最小。这个反卷积算法收敛,也加快了由一个向量外推法,缩短了计算时间 10 。为了让一个想法:这个算法〜20微米(例如,〜9μm的像素大小与使用的CCD / CMOS芯片)提供了一个有效的空间分辨率,可deconvolve上几十分钟内〜8 厘米 2的视野在普通PC正在运行的matlab 1。请注意,相同的计算时间下降为如只需几秒钟,〜1mm的2视野,这是一个典型的10X物镜视场相媲美。
- 压缩采样/传感基于稀疏信号的解码 2:进一步解决改善(<4微米)4,可以通过使用压缩传感/抽样的解码算法 11,12实现。压缩采样/传感提供新近出现的理论框架 13-15,旨在恢复稀疏信号从少得多比需要根据采样定理的样本。虽然总的来说,从采样测量信号的恢复是一个病态问题,为特定的类的功能(即稀疏功能),知名的采样定理,其代表性的基础上,最近证明是相当低效的条款号码是必需的,即测量,相同的稀疏信号可以在一般情况下唯一收回很少的样品相比经典抽样理论。
本质上满足我们的片上显微镜记录的无透镜的荧光图像压缩解码的一个重要要求:对这项工作感兴趣的应用程序,如宽视场荧光仪,稀有细胞分析和高通量微阵列成像,利益的荧光对象可以被认为是已经稀疏。因此,在我们的无透镜的荧光显微镜,位于对象平面的荧光发射器的分布和相对优势的解码可以建模为一个大型的L - 1的正则最小二乘问题是可以解决的使用,例如,一个内部点法2,12。这个优化问题可以数学表示为: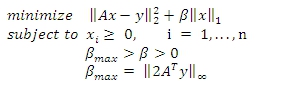
| | U | | K =(ΣI N | U I | K)(1 / K)和| | U | |∞= 最大 I | U I |。因此,我们尽量减少L - 1 -正规化升 2规范记录/测量(Y)和估计(AX)lensfree的图像, 其中X和一个代表源分布进行解码和测量矩阵形成使用之间的区别实验系统,涤纶短纤的。我们还可以使用的约束功能,迫使源对象平面分布为负,。这样的反复压缩解码过程结束时的成本函数值达到预定的公差值。正规化(β)和误差参数的对象稀疏的一般功能和测量噪声水平,并在我们的系统〜βmax/10〜0.01,分别进行了优化。
基于上述概述的数值方法,压缩原料的荧光图像解码,大大提高了我们的平台的能力来解决稀疏对象和展品的处理速度与露西理查森去卷积2。除了 成像单层,设在不同深度的荧光的对象可以解码并相互分离,同时运行相同的算法,使用所有的相应的专业服务公司中不同的层层深入2。 - Pseudocoloring:虽然不能从根本上限制,片上的成像平台大多采用单色光电SEnsor阵列一般提供更好的信号与噪声的生物样品成像的比例。因此,收购原料的荧光图像灰度格式,不包含样品的真实颜色信息。这可以减轻我们lensfree成像体系结构等,在每个lensfree荧光测量获得的3个颜色通道(红,绿,蓝)彩色CCD / CMOS芯片。另一方面,如果标签染料发射特性是已知的,RAW格式的灰度的单色传感器芯片和解码/ deconvoled的版本也可以人为地转换为彩色图像,使用pseudocoloring例如,MATLAB的算法实现的荧光图像。为此,收购灰度的图像可扩展到3维数据立方体,任何利益的颜色可以通过使用适当的权衡因素,在每一个数据立方体的伪通道合成。这种处理的结果,单色lensfree荧光图像可以转换(如果需要)提供已知的一个给定的荧光对象的颜色信息的多通道图像。
- 自动荧光细胞计数:流式细胞仪的应用,我们还开发了一个定制设计的用户界面(见图8),可以自动计数荧光对象/收购他们lensfree的图像与我们的芯片上的显微镜平台为基础的细胞。为了实现这一任务,最初是软阈值是适用于原料lensfree图像缩小荧光对象的潜在地点。然后,一系列的功能(尤其是regionprops),是用来衡量每个分区域的位置,面积,形状和强度等的利息的图像属性。使用这些对象的数据,二进制对象分为亚组中,如细胞,坏点,以及灰尘或后台自动荧光。一旦regionprops函数的最终结果是过滤,只显示感兴趣的细胞,所产生的结构数组的长度可以用在我们lensfree片上的成像的整个视野的细胞计数。
4。代表性的成果:
概述我们的设置如图1所示,与几个用于在其装配的光学元件。片上的显微镜平台的主要特点是在图 2解释,包括荧光激发和检测,全内反射,以及在同一平台上的全息成像传输的部分相干照明。无透镜的异构混合物含有各种微观粒子(绿色4微米和10微米的绿色/红色)荧光片上的成像效果,在图3-4所示。露西理查森去卷积和压缩采样/传感基于解码的比较图5中的数字提高原料的无透镜荧光图像的分辨率。压缩解码功能的空间分辨率(<4μm的) 是在图6量化。无透镜片上荧光标记的白血细胞的显微镜是在图7所示,其中也规定采取比较与传统的荧光显微镜图像。最后,我们的自动荧光物体计数界面如图8所示。

图1:我们的无透镜片上的成像设置概述显示,在其装配的光学元件。

图2。片上lensfree荧光成像平台的示意图(左图所示) 。荧光激发是通过一个菱形棱镜使用语无伦次源方面。设置我们的芯片上的荧光成像平台的实验也显示(右图)。在微流体芯片(尺寸:2.5 × 3.5 × 0.3厘米)的全血样品通过折射率匹配油被用来组装芯片和棱镜的棱镜接口,很兴奋。 TiR和彩色滤光片的激发光后的排斥反应,只有从荧光标记的血细胞,记录我们的CCD传感器芯片(柯达11002)以上〜2.5 × 3.5厘米的视野。

图3说明了宽领域的无透镜荧光片上含4微米和10微米的绿色荧光颗粒的混合物的成像。为了便于比较,还提供了10倍的显微镜物镜的图像,以及同意我们的无透镜的荧光图像。

图4。 宽领域的无透镜包含10微米的绿色和10微米的红色荧光颗粒的混合物的荧光成像表现。我们的无透镜的荧光图像,提供一个体面的比赛到10倍的显微镜下,对同一样品的客观物象。

图5。露西-理查德森(LR)卷积和压缩采样(CS)基于解码算法的性能比较,各10微米珠对成像。顶行显示了无透镜的原始荧光图像。第一行中的插图图像显示,使用10X物镜,获得相同的粒子的显微镜比较。中间一排,说明我们的压缩解码结果,而底部行说明了露西理查森去卷积结果。 CS解码,D,D CS和D LR是指在显微镜图像中心到中心的距离,无透镜的图像和LR deconvolved无透镜的图像,分别为。

图6说明了无透镜的荧光原始图像的数字处理。压缩采样的算法是用于解决紧密排列的直径为2微米的珠对实现<4微米的空间分辨率。插图还显示40X显微镜物镜比较,同意与荧光图像解码非常好。这里D指在显微镜图像中心到中心的距离,而D CS是指在CS解码无透镜的荧光图像中心到中心的距离。

荧光(祥发16)标记的白血细胞的无透镜成像图7所示。使用基于一个CS的解码器,它同意很好地与传统的显微镜图像的同一样品,收购与10X物镜迅速解码原始lensfree图像。
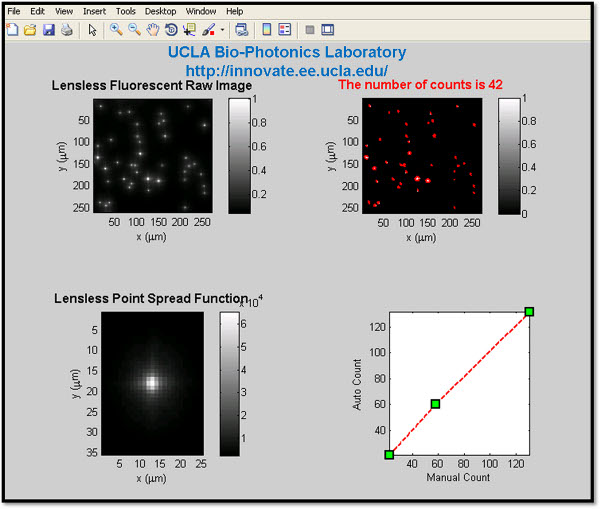
图8。定制设计的自动荧光对象计数接口(在MATLAB)所示。
讨论
我们展示了一个芯片上的荧光显微镜平台,可以实现例如,<4μm的空间分辨率比例如,> 0.6-8厘米2没有使用任何镜头,机械扫描或薄膜干涉滤波器领域的视图。在这种技术中,使用了光纤面板或锥度,从对象的荧光收集,然后传递到如的CCD光电传感器阵列与二维阵列的光纤电缆/ CMOS芯片。这些收购的lensfree图像,然后迅速处理,产生超过4μm的决议> 0.6-8厘米2,使用压缩采样/?...
披露声明
没有利益冲突的声明。
致谢
A.奥兹坎感激地承认了国家科学基金会职业奖,羚羊青年研究者奖2009年和办公室的主任,国立卫生研究院国立卫生研究院主任的新的创新奖DP2OD006427的支持。作者也承认,比尔和梅林达盖茨基金会,沃达丰美洲基金会,和NSF BISH的程序(#0754880和0930501奖)的支持。
材料
| Name | Company | Catalog Number | Comments |
| 材料名称 | 公司 | 目录编号 | |
|---|---|---|---|
| 电荷耦合器件(CCD) | 柯达 | KAF - 8300 | |
| 电荷耦合器件(CCD) | 柯达 | KAF - 11002 | |
| 电荷耦合器件(CCD) | 柯达 | KAF - 39000 | |
| 互补金属氧化物半导体(CMOS) | 美光科技公司 | MT9T031C12STCD | |
| 高功率LED光源 | Thorlabs | M455L2 - C2 | |
| 高功率LED驱动器 | Thorlabs | LEDD1B | |
| 光纤耦合LED光源 | Mightex | FCS - 0625 - 000 | |
| 真空笔 | 埃德蒙光学 | NT57 - 636 | |
| 2,4,10微米Fluospheres | Invitrogen公司 | F - 8826,F - 8859,F - 8836 | |
| RBS裂解液1X | eBioscience公司 | 00-4333 | |
| 祥发16标签试剂 | Invitrogen公司 | S7578 | |
| 光纤面板 | 埃德蒙光学 | NT55 - 142 | |
| 光纤光锥 | 埃德蒙光学 | NT55 - 134 | |
| 棱镜 | 埃德蒙光学 | NT47 - 626,NT45 - 403 | |
| 过滤器 | 埃德蒙光学 | NT39 - 417 | |
| 硅橡胶弹性体 | 道康宁 | Slygard 184 |
参考文献
- Coskun, A. F., Su, T., Ozcan, A. Wide field-of-view lens-free fluorescent imaging on a chip. Lab Chip. 10, 824-824 (2010).
- Coskun, A. F., Sencan, I., Su, T., Ozcan, A. Lensless wide-field fluorescent imaging on a chip using compressive decoding of sparse objects. Opt. Express. 18, 10510-10523 (2010).
- Coskun, A. F., Sencan, I., Su, T., Ozcan, A. Lensfree Fluorescent On-Chip Imaging of Transgenic Caenorhabditis elegans Over an Ultra-Wide Field-of-View. PLoS ONE. 6, e15955-e15955 (2011).
- Coskun, A. F., Sencan, I., Su, T., Ozcan, A. Wide-field lensless fluorescent microscopy using a tapered fiber-optic faceplate on a chip. Analyst. , (2011).
- Seo, S. High-Throughput Lens-Free Blood Analysis on a Chip. Analytical Chemistry. 82, 4621-4627 (2010).
- Mudanyali, O. Compact, light-weight and cost-effective microscope based on lensless incoherent holography for telemedicine applications. Lab Chip. 10, 1417-1417 (2010).
- Tseng, D. Lensfree microscopy on a cellphone. Lab Chip. 10, 1787-1787 (2010).
- Lucy, L. B. An iterative technique for the rectification of observed distributions. The Astronomical Journal. 79, 745-745 (1974).
- Richardson, W. H. Bayesian-Based Iterative Method of Image Restoration. J. Opt. Soc. Am. 62, 55-59 (1972).
- Biggs, D. S. C., Andrews, M. Acceleration of iterative image restoration algorithms. Appl. Opt. 36, 1766-1775 (1997).
- Candes, E., Wakin, M. An Introduction To Compressive Sampling. Signal Processing Magazine, IEEE. 25, 21-30 (2008).
- Kim, S., Koh, K., Lustig, M., Boyd, S., Gorinevsky, D. An Interior-Point Method for Large-Scale L1-Regularized Least Squares. Selected Topics in Signal Processing, IEEE. 1, 606-617 (2007).
- Candes, E. The restricted isometry property and its implications for compressed sensing. Comptes Rendus Mathematique. 346, 589-592 (2008).
- Baraniuk, R. Compressive Sensing [Lecture Notes]. Signal Processing Magazine, IEEE. 24, 118-121 (2007).
- Romberg, J. Imaging via Compressive Sampling. Signal Processing Magazine, IEEE. 25, 14-20 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。