Method Article
基因组编辑与的CompoZr自锌指核酸酶(ZFNs)
摘要
CompoZr自锌指核酸酶(ZFN)服务可在任何生物体或细胞系在由用户定义的任何轨迹的精确的基因组编辑。本文描述的CompoZr定制ZFN服务的设计,制造,验证和实施的过程。
摘要
基因组编辑是一个强大的技术,可以用来阐明基因功能和疾病的遗传基础。传统的基因编辑的方法,如化学突变或DNA序列的随机整合赋予整体低效的方式,不分青红皂白的遗传变化和要求纳入不良合成序列或使用异常的培养条件下,有可能混淆生物学研究。相比之下,在瞬态ZFN表达细胞可以方便准确,可遗传的基因在一个高效的方式编辑,而不需要管理的化学品或合成外源基因的整合。
锌指核酸酶(ZFNs)酶的不同序列的双链DNA(dsDNA)的约束和削减。一个功能CompoZr ZFN单元由两个独立的单体蛋白质结合的DNA“半现场”( 见图1)约15-18个核苷酸的。当两个ZFN单市场汇率“家”到其相邻的靶位点DNA裂解域的二聚体和创建双链断裂(DSB)的DNA。1引言ZFN介导的DNA双链断裂的基因组中奠定了基础,高效的基因组编辑。通过非同源最终连接(NHEJ)DNA修复通路在细胞的DNA双链断裂的不完善修复可能会导致小插入和缺失(INDELS),。一个细胞内的基因编码序列INDELS创作可能导致移和后续功能的一个高效率的基因位点。2淘汰赛,虽然这一协议描述ZFNs使用,以创建一个基因敲除,转基因的整合,也可以进行通过同源定向修复在ZFN切站点。
CompoZr自定义的ZFN服务代表ZFN技术与科学界针对基因编辑一个系统,全面的,良好的特点。西格玛科学家紧密合作,调查1)射孔RM尽职调查分析,包括分析有关的基因结构,生物学和模型系统,根据该项目的目标,2)申请这方面的知识,发展健全的定位策略,3),然后设计,建造和功能验证活动有关ZFNs细胞株。研究者收到阳性对照基因组DNA和引物,并准备使用的两个质粒DNA和体外转录mRNA的格式提供ZFN试剂。这些试剂可交付的瞬时表达,在研究者的细胞株或细胞类型的选择。基因编辑的样品,然后进行测试标准的分子生物学技术,包括PCR扩增,酶消化,电泳利益轨迹。经过基因编辑的积极信号在初始种群中发现,细胞的单细胞克隆和基因的突变克隆/等位基因鉴定。
研究方案
1。定制ZFN设计过程
- 要加快的ZFN设计过程,研究者应提供:
- 靶基因,如基因名称,品种,基因注释/身份证号码的信息。
- 一个明确表示过,所有的目标(例如,基因敲除或敲入实验)
- 的基因目标的任何具体因素,其中包括非典型的基因结构,特殊的生物的基因位点中有牵连的,或任何同源区域的基因组中的其他地方。
- 锌指DNA序列的特定范围内的核酸目标。
- 西格玛生物信息学团队进行开发初期的锌指目标网站在硅片ZFN设计。
- 最初的ZFN目标的网站提供了一个ZFN的科学技术顾问。技术上更复杂的项目,这西格玛科学家合作开发项目战略与调查。 西格玛生物信息学团队的与ZFN算法进行分析,以产生在硅片ZFN设计。这包括全基因组为脱靶的网站,搜索,重复掩蔽,为每个潜在ZFN目标网站和SNP分析。
- 生物信息学提供审查调查的的顶部ZFN目标网站。潜在ZFN目标站点经批准后,此信息提供ZFN生产队开始ZFN生产过程。
2。定制ZFN生产
- 西格玛归档锌指模块用于组装的批准ZFN设计。
- 每个的ZFN设计组装和序列上的高通量克隆平台验证。
- ZFN一旦所有ZFN设计生产完成每发送验证。
3。 7.5.2自ZFNs
- ZFN项目在人类,小鼠,大鼠或CHO种特点以及每个物种的细胞株进行验证,酵母为基础的检测被用于其他生物体或细胞类型。
- ZFN结构传递到适当的细胞株和核转ZFNs表示。
- DNA收获ZFN转染细胞池和地区的利益是PCR扩增。
- CEL-1检测,然后进行PCR产物。 CEL-1试验,以验证ZFN活性凝胶电泳上运行。
- CEL-1的检测证实活性最高ZFN设计,然后提供给客户。 ZFNs交付随着CEL-1的检测和基因组DNA作为阳性对照的PCR引物在mRNA和质粒DNA。
4。验证ZFNs交付核转
- 种子细胞密度2×10 5细胞/ ml核转染前一天。
- 关于核转染的一天,取出细胞株Nucleofector套件V和让温暖的室温。
- 根据制造商的协议,补充添加到核转解V。
- 细胞计数。细胞的密度应该是2.5-5X10 5细胞/ ml之间。
- 填写6孔板,在37°C,至少20分钟前核转中等2毫升在每口井,并在CO 2培养箱预暖。
- 在200xg离心5分钟2X10 6个转染细胞(8x10的共6个 )。
- 汉克的平衡盐溶液(HBSS中)与20毫升洗涤细胞两次。
- 准备实验管:(见表定制ZFN技术公告)
- 删除包含媒体从步骤(6.5)从孵化器的6孔板。
- 在核转染溶液(100微升/反应)400μL重悬细胞五。
- 一次在一个反应,添加100μL的细胞,每个DNA或mRNA的含管。 TRANSFER的混合物,在适当的程序Nucleofector 2毫米电击试管和nucleofect的。
- 紧随每个样本的核转染后,用移液管,添加在步骤6孔板(6.9)〜500μl预热中等的试管。然后,仔细地从试管细胞转移到余下的6孔板预热中等。
- 完成所有的反应,并返回6孔板在37℃的二氧化碳培养箱
5。收获ZFNs交货后基因组DNA
- 6孔板 - 没有收获汇集的所有细胞。重要的是保持文化在以单细胞稀释克隆细胞后,你确认你有CEL-1消化产品。一至三天收集后核转染的细胞,准备使用的GenElute哺乳动物的基因组DNA小量提取试剂盒的染色体DNA。
6。 CEL-1含量
- PCR扩增ZFN转样品和阳性对照基因组DNA试剂盒中提供的基因组DNA,利用提供的引物。 PCR反应设置下列条件:(见表定制ZFN技术公告)。
- 到异源产生的PCR技术homoduplexes 10μLPCR反应,并采取从每个ZFN处理样品加控制在热循环使用下列程序:
95℃,10分钟
95°C至85°C间,-2°C间/秒
85℃至25℃,-0.1°C /秒
4℃,无限期 - 加入1μl的增强和1(Transgenomic目录编号706025),μl核酸小号的每一个反应,并培育在42°20-40分钟Ç。
- 运行适当的标记,如DirectLoad WideRange DNA阶梯(目录号D7058),(定制ZFN技术公告中看到的结果),10%的页面TBE凝胶上的消化。
- 上CE积极的信号已在ZFN治疗的人群中检测CEL-I测定,进行克隆的分离和鉴定。
7。克隆的分离和鉴定
- 单细胞克隆的标准方法包括流式细胞仪和稀释克隆的ZFN处理样品。
- 允许克隆充分扩大,然后细胞分裂的基因组DNA的收获比例,冻结其余作为库存材料。
- 从使用CEL我引物克隆的基因组DNA扩增和分析CEL-I测定(与野生型DNA的飙升)的扩增,或者使用此扩增,直接进行基因分型。
- 基因型确定为候选克隆编辑等位基因的首选方法。
8。代表结果
CompoZr ZFN整个工作流程的一个例子是,在图2。 ZFNs交付他们结合和切割适当的DNA序列,它创建了一个双链断裂(DSB)的细胞。自然修复过程中,非同源末端连接(NHEJ能),维修争端解决机构。在某些情况下,异常NHEJ能在核苷酸的缺失,插入或替代的结果。 PCR扩增收获与野生型和修改扩增异源一步PCR反应的变性/退火后形成的基因组DNA的结果。此外,在任何异源分子的分裂CEL-1酶的结果。 CEL-1 PAGE分析解决确认ZFN乳沟。 图3提供了一个原理的CEL-1的检测和预期的结果。
代表CEL-1的结果载于图4和图5图4包含的ZFNs一双非常活跃(21%)在K562细胞的结果; 图5包含从一个不太活跃的一对的ZFNs(2.4%)的结果。K562细胞。 ZFN活动证实,这两个数字存在两个低于父母的PCR片段的PCR片段。
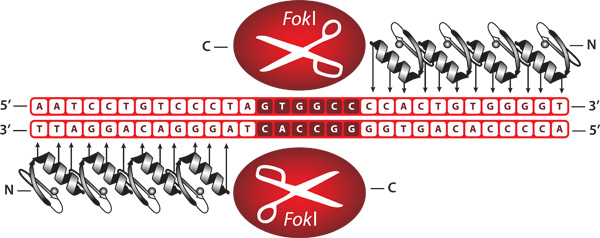
图1。结合锌指核酸酶的代表性。ZFNs设计融合FokI限制性内切酶切割域的锌指DNA结合结构域组成的蛋白质。当异约束,的ZFNs建立在用户指定的DNA序列双链断裂。
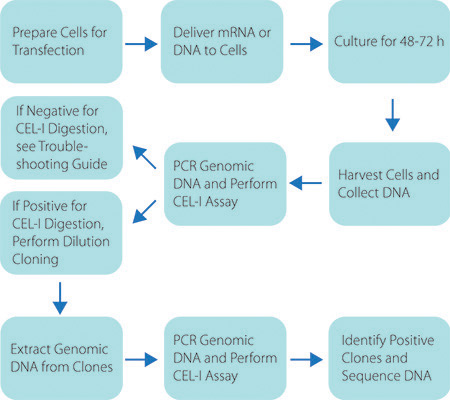
图2。 ZFN自定义服务流程示意图。工作流程的图形表示,以产生一种转基因的细胞株,使用CompoZr ZFNs。
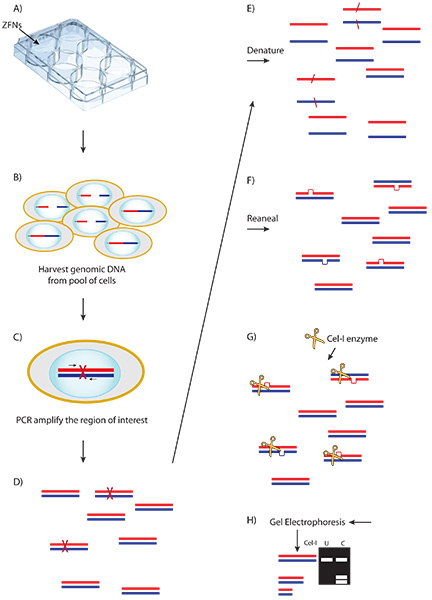
图3。示意图一):ZFN载体ØCEL-1的检测和结果。 R mRNA的被传递到细胞。 b)表示ZFNs绑定和创建双链断裂(DSB)的部分细胞,削减他们的目标序列。 c)DSBs的一些异常修复,非同源末端连接核苷酸插入或缺失的结果。四)基因组DNA的收获从细胞转染池和放大利益的轨迹。英法)PCR产物变性和重新退火创造与野生型和修改扩增异源形成。 G)的CEL-1不匹配的内切酶检测结果,在异源分子的分裂。高)CEL-1酶消化解决的一页。 ImageJ的软件确定,观察到的分解产物比肠外带,表明分数削减和效率的ZFNs。
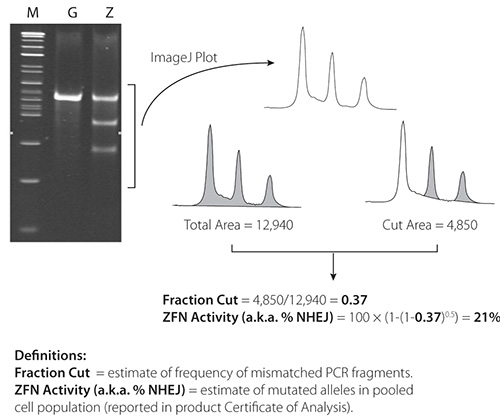
图4。 CEL-1的结果,从21%活跃ZFNs ImageJ的软件是可用的。_blank“> http://rsbweb.nih.gov/ij/。
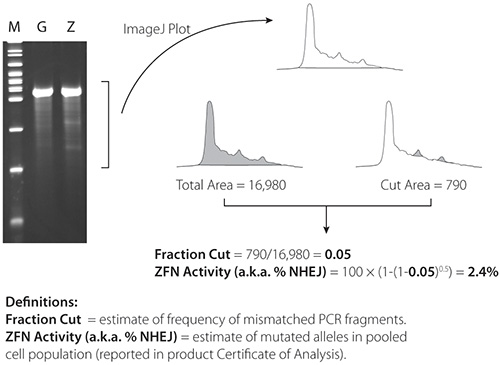
图5。 CEL-1的结果从2.4%积极ZFNs ImageJ的软件可在: http://rsbweb.nih.gov/ij/ 。
讨论
一旦ZFN修饰细胞的分离,他们有永久的和遗传的DNA修改。这样的结果能够产生稳定的修改所需的遗传修饰的细胞株或繁殖动物进行研究。 CompoZr自ZFNs提供了可靠的方法,在多种细胞类型的基因组编辑。 ZFNs编辑出版成功的基因组包括但不限于人类细胞系,小鼠,大鼠,斑马鱼,蛙,猪和CHO细胞的研究模型。3,4,5,6,7,8,9的能力,以创建一个保证在特定的细胞类型所需的目标网站的双链休息时ZFNs是正确传递到一个单元格。它也可能以执行顺序锌手指修改一个单元细胞内多个基因改造,10来选择1的具体目标序列和唯一的修改,特别是轨迹1创建多个主要事业的能力修饰阳离子。
CompoZr定制ZFN分析证书生成工具包,从而保证为客户的成功,该套件的所有组件已被彻底验证提供了非常试剂。从开始到结束的工作流程中的关键步骤介绍如下:
细胞克隆
应隔离和扩大一个给定的细胞株的能力测试开始任何ZFN实验之前。应单细胞分离和扩大,以确保一个无性衍生的人口是可能的。有些细胞株顽抗在这个问题上,如编辑克隆富集,文化或空调媒体的技巧,可以帮助克服这些挑战。
交付的效率
ZFNs交付前交付效率的优化是必须的。许多方法可用于包括脂质体转染,电,并nucleofecti上。理想的传递方法,包括一个可以交付效率和细胞存活的最优化的混合。定量估计这些效率可提供GFP的对照质粒和溶出速率,通过目测或流式细胞仪24-48小时后交付。
CEL-I测定
这是当务之急,CEL-I测定平行,以确保不会干扰的ZFN实验的解释,PCR,消化,电泳参数进行适当的控制。每个套件包括控制基因组DNA,用于创建CEL-我的图像分析证书。 CEL-I测定所提供的引物控制DNA扩增,将允许用户比较与分析证书(COFA)图像所提供的结果,并隔离任何潜在的低效在这方面的实验。一个适当的,如模拟,或GFP阴性对照细胞治疗样品也应列入允许任何非特异性酶切产物澄清。
单细胞克隆的定性/定量分析
经过的ZFN治疗和单细胞克隆,细胞群体利益的轨迹编辑方法可筛选。 CEL-I测定可确定候选克隆,为进一步的基因分型的目的从克隆基因组DNA进行。重要的是穗野生成1:1的比例样本扩增PCR扩增,然后再执行CEL-我消化纯合突变克隆将包含均质分子,从而传达一个负面CEL-I测定的结果。筛选这些候选克隆的另一种方法是设计一个引物降落,直接ZFN目标站点。在控制引物一起使用,一个负的检测结果表明:野生型序列的损失。一个至少包含一个野生型等位基因的杂合性克隆将Ÿield PCR扩增信号,但可能会被隔离的SYBR qPCR的背景下进行的PCR从完全野生克隆的。
一旦候选克隆已按上述方法确定的,它们可能由焦磷酸测序技术标准,深度测序,或其他的测序方法进行基因分型。对于所有的测序方法,创建了一个从克隆基因组DNA扩增,应生成。对于传统的焦磷酸测序等位基因可能被隔离TA克隆的PCR产物,测序的个人殖民地。对于方法,如深度测序这一步是没有必要的。
同源定向修复(HDR)
该协议提供ZFN通过NHEJ能介导的基因敲除的方法。转基因的整合也可能会进行了捐助质粒的同源性武器的引进,侧翼的的ZFN切割网站。在这种情况下,在的ZFN创建双链断裂是由人类发展报告,而不是对NHEJ能修复。预托证券的i转基因ntegration可能在本协议所规定的程序,使用类似的方法得到证实。
故障排除
交付的ZFNs
ZFN传递和表达传递,可控制交付的GFP或其他类似的可视化和/或定量的质粒。交付ZFNs表达格式,可以克服由于低表达与感兴趣的细胞类型的启动子不相容。此外,冷休克法可利用,进一步提高疗效细胞ZFNs 12。如果用于表达,这是当务之急,细胞被冲交付前,以确保所有的血源性核糖核酸酶已被删除。这也是审慎解冻冰表达,并添加到最后一刻的细胞,以尽量减少任何退化的机会。
CEL-I测定
CEL-我ASSA的基础y是具体利益的轨迹和充足的放大。如果观察到了非特异性扩增产物使用标准的PCR技术的故障排除过程,以增加特异性,如模板量,引物浓度,循环参数的优化。执行PAGE分析,而不是标准的琼脂糖凝胶电泳,因为后者的方法不提供足够的分辨率和灵敏度。 CEL-我消化条件下也可以进行优化,如果没有消化的产品或过量涂抹观察。可滴定滴定CEL-1核酸和/或消化时间长,金额,以改善这些方面。
披露声明
研究人员可以提供标准的研究许可协议下ZFN修饰细胞的合作者或动物。在这种情况下,西格玛要求,到位西格玛,ZFN顾客和他们的合作者之间的材料转让协议。研究许可,可以被看作: http://www.sigma.com/zfn 。
如果有一个潜在的商业应用,使用ZFN修饰细胞西格玛然后要求商业牌照到位。
生产和自由地进入本文由Sigma公司赞助
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | |
| 核酸(第CEL-1酶) | transgenomic | 706025 | |
| 展开高保真PCR系统 | 罗氏公司 | 03 300 242 001 | |
| 细胞株Nucleofector套件至五 | 龙沙 | VCA-1003 | |
| GenElute惠普无内毒素 质粒Maxiprep套件 | Sigma-Aldrich公司 | NA0400 |
参考文献
- Kim, Y. G. Hybrid restriction enzymes: zinc finger fusions to FokI cleavage domain. Proc. Natl. Acad. Sci. U.S.A. 93, 1156-1160 (1996).
- Urnov, F. D. Highly efficient endogenous human gene correction using designed zinc-finger nucleases. Nature. 435, 646-651 (2005).
- Moehle, E. A. Targeted gene addition into a specified location in the human genome using designed zinc finger nucleases. Proc. Natl. Acad. Sci. U.S.A. 104, 3055-3060 (2007).
- Meyer, M. Gene targeting by homologous recombination in mouse zygotes mediated by zinc-finger nucleases. Proc. Natl. Acad. Sci. U.S.A. 107, 15022(2010).
- Geurts, A. M. Knockout rats via microinjection of zinc-finger nucleases. Science. 325, 433(2009).
- Meng, X. Targeted gene inactivation in zebrafish using engineered zinc-finger nucleases. Nat. Biotechnol. 26, 695-701 (2008).
- Young, J. J. Efficient targeted gene disruption in the soma and germ line of the frog Xenopus tropicalis using engineered zinc-finger nucleases. Proc. Natl. Acad. Sci. U.S.A. , Forthcoming (2011).
- Wanatabe, M. Knockout of exogenous EGFP gene in porcine somatic cells using zinc-finger nucleases. Biochem. Biophys. Res. Commun. 402, 14-18 (2010).
- Santiago, Y. Targeted gene knockout in mammalian cells by using engineered zinc-finger nucleases. Proc. Natl. Acad. Sci. U.S.A. 105, 5809-5814 (2008).
- Lui, P. Q. Generation of a triple-gene knockout mammalian cell line using engineered zinc-finger nucleases. Biotechnol. Bioeng. 106, 97-105 (2010).
- Moehle, E. A. Targeted gene addition into a specified location in the human genome using designed zinc finger nucleases. Proc. Natl. Acad. Sci. U.S.A. 104, 3055-3060 (2007).
- Doyon, Y. Transient cold shock enhances zinc-finger nuclease mediated gene disruption. Nat. Methods. 7, 459-460 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。