需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
MRI引导下的破坏血脑屏障在大鼠模型经颅聚焦超声
摘要
微泡介导的重点超声破坏血脑屏障(BBB)的是一个很有前途的技术,针对大脑中的非侵入性给药 1-3。该协议概述MRI引导下经颅血脑屏障破坏大鼠模型的实验过程。
摘要
聚焦超声(FUS)破坏的血脑屏障(BBB)的是一个日益调查的技术绕过血脑屏障1-5。血脑屏障脑部疾病的药物治疗是一个重大的障碍,因为它限制从血管进入脑组织分子小于约500大小6大通过分子。引起血脑屏障破坏的FUS(BBBD)是暂时的和可逆的4对化学品的优势意味着,诱导高度本地化BBBD的。的FUS的诱导BBBD提供的治疗药物对大脑,组织足够的浓度,否则不会交付广泛的影响调查的一种手段。而广泛的超声参数已被证明成功的破坏血脑屏障2,5,7,在实验过程中有几个关键的步骤,以确保准确定位成功中断。这protocOL轮廓如何实现诱导的大鼠模型BBBD MRI引导下聚焦超音波,一个关键的动物实验的准备和气泡的处理步骤的重点。
研究方案
1。超声和MRI设置
在这项研究中使用了核磁共振兼容的三轴聚焦超声系统(聚焦超音波仪器公司,多伦多,安大略,加拿大)。使用两种不同的超声换能器:内部构造551.5千赫球为中心的传感器(曲率半径为60毫米,外直径为75毫米,内直径为20毫米),和1.503兆赫,8部门阵列综合作为一个单一的元素球聚焦换能器(FN = 0.8,光圈= 10厘米)驱动压电陶瓷水听器(Imasonic公司,Voray sur-L'Orgnon的,法国)。一个MRI兼容氟碳接收8用来记录声波发射时的551.5千赫传感器使用。如果使用不同的设备,以下建议:
- 选择适当,在中心范围内的0.25兆赫-1.5兆赫频率和F-数小于或等于1(半径曲率/光圈)校准的超声换能器。
- 将水洗澡FIlled与温暖,脱气,去离子水床,一个1.5 T或3个T磁共振。洗澡的水应该有一个顶级板,可容纳动物。超声换能器安装在水箱中的MRI兼容的三轴定位阶段或系统9,面对水面。
- 传感器电缆运行超声波驱动设备通过渗透面板。
- 使用函数发生器和功率放大器产生的换能器驱动信号。使用外部匹配电路,以尽量减少所反映的电力。
- 了解传感器的焦距,在水面上放置传感器的焦点和超声水面产生一个可见的喷泉。步骤1.6和1.7描述了如何注册使用生成的水喷泉的焦点。一个更精确的定位的重点,其中包括超声分散凝胶和成像焦点的温度与MRI海拔热吸收的方法,可以发现在9 </ SUP>。
- 标记使用标记,这将是可见的磁共振图像上的焦点位置。这可以用一盘中心孔放置在重点时,将水补。充水孔将在MRI可见,将提供两架飞机的焦点坐标,而在坐标轴方向的传感器,可以从水面决定。
- 使用3飞机航向序列,图像的焦点标记和记录的重点在MRI坐标系的位置。
- 为了监测声发射,装载磁共振兼容的的听音8,作为一个被动的空蚀探测器在冲着传感器焦点水浴(PCD)的使用,或使用一个集成的水听器的传感器。
- PCD的电缆运行范围卡是足够快的捕捉阵阵高达10毫秒PRFs 2赫兹(如ATS460了AlazarTech,潘特克莱尔,魁北克,加拿大)。电缆必须接地的penetration面板或射频屏蔽以减少噪声。
2。动物的制备
- 麻醉动物isofluorane气体。由于isofluorane BBB级中断10的效果,应采取动物断了气实验开始前10分钟。在麻醉开始,以保护角膜干燥或其他人身伤害的地方每眼眼润滑油膏。
- 使用电动剃须刀刮脸毛皮动物的头部和颈部的上方,然后取出剩下的皮毛,使用脱毛霜(例如奈尔,教会和德怀特有限公司,普林斯顿,新泽西州,美国),并用温和的肥皂冲洗头皮和水。
- 准备与优碘皮肤由bridine洗擦洗尾部。执行酒精的最后wipedown在以可视化的尾静脉。
- 3路阀22压力表导管插入到尾静脉和冲洗用肝素/生理盐水混合液(33 U / ml的),以防止血凝块形成在导管。
- 交付(40-50毫克/公斤氯胺酮,10毫克/公斤甲苯噻嗪)注射麻醉剂,通过肌肉注射和动物从isofluorane删除。
- 将头顶部的联系,通过在顶部板(图)孔水浴超声定位系统对麻醉动物仰卧。少量的超声波凝胶可能应用到动物的头顶部尽量减少被困airbubbles的的机会。
- 腿磁带定位系统。头可在地方举行,使用咬一口吧,如果有的话,或磁带放在整个下巴坚决。
- 涵盖了动物用毛巾和循环水毯,以保持温暖。
3。目标选择
收购基准轴向ţ2加权和T 1加权MR脑图像。如果使用1.5 T的MRI和专用头大小的射频接收表面线圈,适合SC一个参数可能是:
T 2加权FSE,则TE = 60毫秒,TR = 2000毫秒
T 1加权:法兰克福,TE = 10毫秒,TR = 500毫秒- 选择目标从T 2加权扫描,避免脑室和大脑中线,选择中脑的深度。
- 将传感器焦点移动到目标位置。
4。微泡的制备
DEFINITY微气泡(Lantheus医学影像,MA,美国)用于诱导BBBD 2,5,7微泡介导的FUS的几组。其他类型的气泡适当的剂量,可以发现在文献11,12。
- 激活DEFINITY微泡,并慢慢地绘制成使用18号针头注射器1毫升体积小。
- 取出轻轻来回移动柱塞空气被困注射器。不要挖掘注射器,因为这可以打破的气泡。
- 在正常稀释的DEFINITY一个10:1的盐水比例的生理盐水的注射器缓缓注入所需体积的DEFINITY Definty生理盐水。如果输液的交付使用,DEFINITY可以进一步稀释,以50:1或100:1。
- 轻轻倒置注射器彻底混合DEFINITY和生理盐水,直至达到甚至外观。立即注射前注射器轻轻翻转也可能是必要的,如果泡沫已经开始暂停浮动。
- 0.02毫升/的DEFINITY公斤,涨幅为0.2毫升/千克的溶液(10:1稀释)为基础计算出所需的剂量体积。
5。超声交货
- 超声参数设置,使用低占空比阵阵,不连续波超声处理。在0.5兆赫适当的超声参数的原位压力0.23兆帕,10毫秒脉冲重复频率1赫兹,2分钟阵阵。总超声时候。在1.5兆赫适当的原位压力下降约0.45-0.5兆帕。
- 检查动物的头仍然是耦合的水。
- 注入的微气泡,慢慢进入尾静脉导管,并用0.5毫升生理盐水冲洗。开始超声同时开始注射。
6。 MRI评价治疗效果
- 继超声,注入磁共振造影剂(如0.2毫升/公斤的OmniScan,GE医疗)经尾静脉导管由0.5毫升生理盐水冲洗。
- T 1加权成像对比高峰期已过,直到执行。超声已成功地破坏的网站会比周围组织表现出更大的增强。
- 执行T 2加权成像检查水肿。在超声网站的高信号水肿的指标。
7。代表结果
磁共振造影剂,可透过血脑屏障的成功交付使用聚焦超声和循环微泡。图2显示了典型的前和后的FUS T 1 W图象。图2B显示对比度增强(CE)T 1-W四个超声波处理地点不同的焦距开口的形象。超声位置1和2显示特别明亮的增强。在图3位置1和2还可以看出对应的T-W高信号,表明水肿。
2程度的T-W水肿,有时可以更容易地可视化上矢状切片。图4显示了CE-T的1-W和T-W矢状切片通过超声地点1和3。水肿是在位置1,但不是位置3可见。
捕获的声发射数据(图5)频谱分析可能会显示谐波发射和/或子/超稳定蚀发生时的谐波发射。哈蒙ICS也可以组织产生的非线性,而子和高次谐波的排放只能出现泡沫活动14。在更高的压力,也可以检测到表明惯性蚀宽带排放。然而,这些已与红细胞外渗和微损伤较大数额比没有惯性空化的超声处理11。
使用超声波频率更高更本地化的开口,由于较小的焦斑大小的结果。图6显示了更高的频率,可用于创建开放的较小的区域。这使得用较少的近头骨影响大脑中的作用的调查。
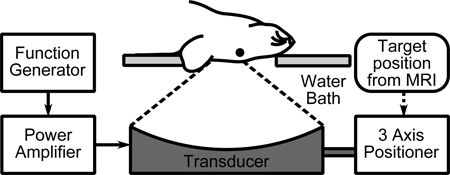
图1实验装置。
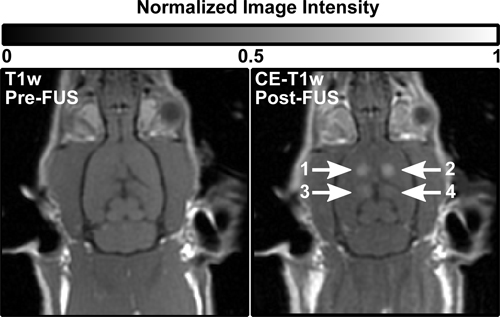
图2。前(左)后(右)治疗T 1-W显示在四个超声波位置增强大鼠脑图像。
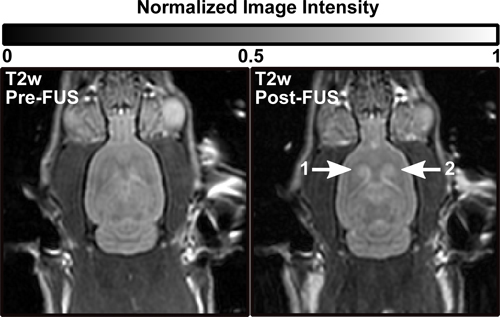
图3。前(左)后(右)治疗T 2-W显示ţ2-W超声位置1和2的水肿(图2相同的动物)老鼠大脑的图像。
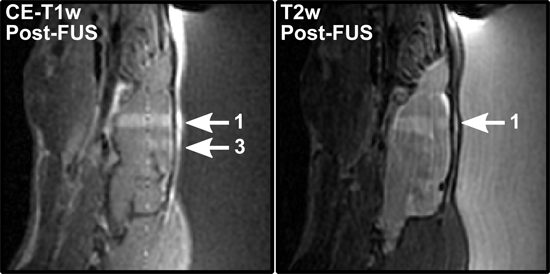
图4。后处理矢状ţ1-W(左)和T-W(右)从相同的大鼠脑影像图。 2和3。在位置1开幕(左)及其与T-W水肿(右)。位置3显示了开幕式(左),但没有T-W水肿。
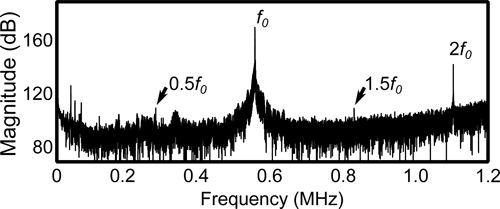
图5。从捕获的数据在一个单一的10毫秒551.5千赫突发的频率频谱。基本频率(F 0)以及谐波(2 F 0)和子/高次谐波(1.5 0.5 F 0,F 0)是可见的。
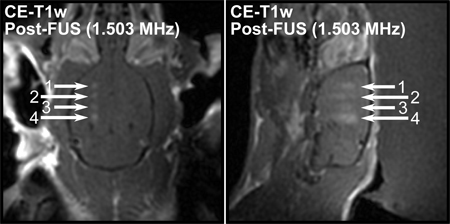
图6。后处理CE-T的1-W轴(左)和矢状(右)从1.503兆赫超声在四个地点在大鼠脑图像。在这个频率BBB开口看到更多的本地化。
讨论
动物和微泡的制备此过程中最关键的环节。必须完全去除头发上的动物的头,以避免衰减的超声波束。血脑屏障可以isofluorane麻醉下打乱,但是,它变得更加难以实现一致的开幕式。
应始终与保健和小计处理的微气泡,大口径的针头必须使用绘图时,为了避免打破他们。同样,可以合理地用在尾静脉最小的压力表导管应采用建议(22号)。如果需要一个较小的导管,以实现妥?...
披露声明
K.许尼宁和普拉河的FUS仪器的联合创始人,公司·乔普拉,A. Waspe和光许尼宁的FUS仪器的股东公司K.许尼宁收到的FUS文书,公司的研究支持
致谢
笔者想感谢他们的帮助与照顾动物肖纳赖德奥特格罗斯和亚历山德拉Garces,平吴为她的技术援助。由国立卫生研究院下,没有为这项工作提供了支持。 EB003268,加拿大研究主席的计划。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | |
| 小动物聚焦超声系统 | 公司的FUS仪器, | RK-100 | |
| DEFINITY | lantheus医学成像 | ||
| OmniScan的 | GE医疗集团 |
参考文献
- Kinoshita, M., McDannold, N., Jolesz, F. A., Hynynen, K. Noninvasive localized delivery of Herceptin to the mouse brain by MRI-guided focused ultrasound-induced blood-brain barrier disruption. Proc. Natl. Acad. Sci. U.S.A. 103, 11719-11723 (2006).
- Jordão, J. F., Ayala-Grosso, C. A., Markham, K., Huang, Y., Chopra, R., McLaurin, J., Hynynen, K., Aubert, I. Antibodies targeted to the brain with image-guided focused ultrasound reduces amyloid-beta plaque load in the TgCRND8 mouse model of Alzheimer's disease. PLoS One. 5 (5), e10549-e10549 (2010).
- Liu, H. -. L., Hua, M. -. Y., Chen, P. -. Y., Chu, P. -. C., Pan, C. -. H., Yang, H. -. W., Huang, C. -. Y., Wang, J. -. J., Yen, T. -. C., Wei, K. -. C. Blood-brain barrier disruption with focused ultrasound enhances delivery of chemotherapeutic drugs for glioblastoma treatment. Radiology. 255, 415-425 (2010).
- Hynynen, K., McDannold, N., Vykhodtseva, N., Jolesz, F. A. Noninvasive MR imaging-guided focal opening of the blood-brain barrier in rabbits. Radiology. 220, 640-646 (2001).
- Choi, J. J., Wang, S., Tung, Y. -. S., Morrison, B., Konofagou, E. E. Molecules of various pharmacologically-relevant sizes can cross the ultrasound-induced blood-brain barrier opening in vivo. Ultrasound Med. Biol. 36, 58-67 (2010).
- Pardridge, W. M. The blood-brain barrier: bottleneck in brain drug development. NeuroRx. 2, 3-14 (2005).
- Bing, K. F., Howles, G. P., Qi, Y., Palmeri, M. L., Nightingale, K. R. Blood-brain barrier (BBB) disruption using a diagnostic ultrasound scanner and Definity in mice. Ultrasound Med. Biol. 35, 1298-1308 (2009).
- O'Reilly, M. A., Hynynen, K. A PVDF receiver for ultrasound monitoring of transcranial focused ultrasound therapy. IEEE Trans. Biomed. Eng. 57, 2286-2294 (2010).
- Chopra, R., Curiel, L., Staruch, R., Morrison, L., Hynynen, K. An MRI-compatible system for focused ultrasound experiments in small animal models. Med. Phys. 36, 1867-1874 (2009).
- McDannold, N., Zhang, Y., Vykhodtseva, N. Blood-Brain Barrier Disruption and Vascular Damage Induced by Ultrasound Bursts Combined with Microbubbles can be Influenced by Choice of Anesthesia Protocol. Ultrasound Med. Biol. , (2011).
- McDannold, N., Vykhodtseva, N., Hynynen, K. Targeted disruption of the blood-brain barrier with focused ultrasound: association with cavitation activity. Phys. Med. Biol. 51, 793-807 (2006).
- Yang, F. -. Y., Liu, S. -. H., Ho, F. -. M., Chang, C. -. H. Effect of ultrasound contrast agent dose on the duration of focused-ultrasound-induced blood-brain barrier disruption. J. Acoust. Soc. Am. 126, 3344-3349 (2009).
- McDannold, N., Vykhodtseva, N., Hynynen, K. Blood-brain barrier disruption induced by focused ultrasound and circulating preformed microbubbles appears to be characterized by the mechanical index. Ultrasound Med. Biol. 34, 834-840 (2008).
- Neppiras, E. A. Acoustic Cavitation. Physics Reports (Review Section of Physics Letters). 61, 159-251 (1980).
- O'Reilly, M. A., Huang, Y., Hynynen, K. The impact of standing wave effects on transcranial focused ultrasound disruption of the blood-brain barrier in a rat model. Phys. Med. Biol. 55, 5251-5267 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。