需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
定向分化诱导性多潜能干细胞向T淋巴细胞
摘要
诱导多能干细胞(iPS)细胞,T淋巴细胞的生成,给出了一个使用基于T细胞免疫治疗的胚胎干细胞的替代方法。该方法表明,利用任在体外或在体内感应系统,iPS细胞能够分化成传统和抗原特异性T淋巴细胞。
摘要
抗原特异性CD8 +细胞毒性T淋巴细胞(CTL)的收养细胞转移(ACT)是一个很有前途的治疗各种恶性肿瘤的1。淋巴细胞可以识别肿瘤抗原与T细胞受体(TCR),释放细胞毒素以及细胞因子的相互作用,以杀死肿瘤细胞的恶性细胞。据了解,少分化和中央内存(称为高活性 )CTL的是为使基于免疫的最佳人口,因为这些淋巴细胞具有较高的增殖潜能,是不易,更分化的细胞凋亡,并有更高的响应能力2-7稳态细胞因子。然而,由于在这种淋巴细胞从患者获得大量的困难,是一个迫切需要找到一种新的方法产生高活性的银特有的成功为基础的ACT疗法的淋巴细胞。
自我再生的干的TCR转导细胞免疫重建具有治疗疾病的治疗8-10潜力。然而,从病人身上获取胚胎干细胞(ESCs)的方法是不可行的。利用造血干细胞(造血干细胞用于治疗目的)虽然已被广泛应用在临床上11-13减少,造血干细胞的分化和增殖能力,造血干细胞难以在体外细胞培养14-16扩大。 iPS细胞技术和基因传递在体外系统的发展能够产生iPS细胞从患者没有任何的手术方法。此外,胚胎干细胞一样,iPS细胞具有无限期的体外增殖能力,已被证明可以分化成造血干细胞。因此,iPS细胞具有更大的潜力,使用胚胎干细胞或造血干细胞相比,在ACT - 基于免疫。
在这里,我们提出了T淋巴细胞的生成方法iPS细胞在体外 cytes,并在促进癌细胞的免疫监视iPS细胞的抗原特异性CTL的体内编程。推动iPS细胞在体外与Notch配体刺激T细胞的分化和TCR基因转导到抗原特异性T细胞分化的iPS细胞在体内 ,从而阻止肿瘤的生长结果。因此,我们证明iPS细胞的抗原特异性T细胞的分化。我们的研究提供了一个潜在的更有效的方法使基于疗法产生抗原特异性CTL和促进疾病的治疗策略的发展。
研究方案
1。细胞培养
- 制备辐照SNL76 / 7(irSNL76 / 7)饲养层细胞培养。
SNL76 / 7细胞一般都保持在10%胎牛血清(FBS),杜尔贝科的改良Eagle培养基(DMEM培养基)媒体。- 培养皿或瓶,将涂有0.1%的明胶溶液在37°C,30分钟孵化器前恢复SNL76 / 7细胞从液氮。
- 达到汇合SNL76 / 7细胞时,细胞就会被胰酶消化,离心5分钟在400Ğ和悬浮在新鲜的媒体。
- 悬浮SNL76 / 7细胞,将在5000拉德的剂量照射钴 -60辐照。
另一种方法,SNL76 / 7细胞可代替小鼠胚胎成纤维细胞(MEF)和丝裂霉素灭活可以取代照射。 - 照射后,细胞将在5分钟的400Ğ离心,并在10%二甲基亚砜(DMSO)胎牛血清冻结缓冲区,分装成悬浮冷冻管,并在将来使用液氮保存。
- OP9-DL1的细胞在体外分化的制备。
OP9-DL1的细胞一般将保持在20%胎牛血清的α-最低限度的基本培养基(α-MEM)的媒体。当他们到达汇合细胞将被分割在1:5稀释。 - 的E.G7胸腺瘤细胞的制备。
E.G7胸腺瘤细胞一般将保持在10%FBS的罗斯韦尔公园纪念研究所培养基(RPMI)-1640媒体。当他们到达汇合,细胞将被分割在1:10稀释。 - IPS和一般维修的TCR转iPS细胞。
- 培养皿,在37℃,30分钟前播种irSNL76 / 7饲养层细胞或iPS细胞恢复分裂提前一天将涂以0.1%的明胶溶液。
- 为iPS细胞分裂,细胞将胰酶消化,离心400Ğ5分钟和15%FBS DMEM培养基悬浮。
- 胰酶消化的iPS细胞将孵育30分钟,上一个新的培养皿在37°C间孵化器前播种新鲜irSNL76 / 7馈线细胞覆膜菜排除分化的细胞及残渣饲养层细胞上。
- 孵化后,将4×10 6细胞接种在一个100mm的培养皿。
(2) 在体外编程
- 在体外培养系统。
- 0天,5X10 4 iPS细胞将一个100mm的文化菜中含有20%胎牛血清的α-MEM的媒体合流OP9-DL1的单层细胞接种。
- 在第3天,文化传媒,将新鲜的改变。
- 在第5天,细胞就会被胰酶消化和400Ğ离心5分钟,前30分钟,在37°C间孵化器孵化上一个新的100毫米培养皿。
- 悬浮细胞,将收集和计算,5×10 5细胞将被转移到一个新的文化菜中含有20%胎牛血清的α-MEM的媒体合流OP9-DL1的细胞单层。细胞因子mFlt-3L(终浓度:5毫微克/毫升)将被添加在文化。
- 在第8天,松散连接的细胞会被轻轻吸取下来。
- 洗OP9-DL1的饲养层,10毫升的PBS更多的时间来得到最大恢复部分分化的iPS细胞。
- 收获后共培养的细胞,将细胞离心5分钟在400Ğ和悬浮于20%胎牛血清的α-MEM的媒体为辅mFlt-3L(5毫微克/毫升)和MIL-7(1毫微克/毫升)。
- 细胞将被转入6孔培养板涂有合流OP9-DL1的细胞。通常从一个100毫米的培养皿中恢复的iPS细胞将被转移到一个6孔板。
- 从第10天,文化传媒将改变隔日(20%FBS的α-MEM的媒体supplemente与mFlt-3L(5毫微克/毫升)和MIL-7(1毫微克/毫升))。
- 培养板涂有接驳OP9-DL1的细胞将在4-6天改变取决于饲养层细胞的生长。
- 在体内的iPS细胞部分分化成熟。
- iPS细胞共培养第22天,将关闭胰酶消化,离心5分钟,在400Ğ在37℃上一个新的培养皿中培养30分钟。
- 将收集悬浮细胞,通过70微米尼龙过滤器通过排除这可能会导致肺栓塞小鼠的细胞团块和冷PBS洗三次。
- 1.5×10 7细胞/毫升的浓度,细胞就会悬浮在PBS。
- 细胞将保持在注射前的冰。
- 四,通过尾静脉注射之前,老鼠将被置于下的红外光,其尾静脉扩张。
- 经过静脉ð转移到4周龄通过尾静脉B6.129S7 RAG1 tm1Mom / J小鼠的ilatation,200μL细胞悬液或3X10 6个细胞,将继。三个星期被允许在部分分化的iPS细胞的体外成熟。
- 评价。
- 分化的细胞和细胞回收率。 图1的形态学变化。
- OP9-DL1的细胞共培养不同天,将采取传统的显微镜下活细胞图片。
- 将细胞复苏率计算的基础上,从文化收获的细胞数量。
- 流式细胞仪分析表面标志的变化。 图2a。
- 在不同天的共培养,细胞将被删除从文化胰蛋白酶,用冷PBS洗,然后进行细胞表面染色。
- 在染色机智不同的荧光标记的抗体,细胞就会被封锁在4℃,20分钟的Fc受体阻滞剂24G2。
- 20分钟后,染色在4°C时,细胞就会被冷PBS洗涤流式细胞仪检查前的三倍。
- iPS细胞在体外分化。 图2b激活。
- 激活检测的前一天,预涂与抗CD3的(终浓度:4μg/ mL的PBS中)24孔板,在4°C过夜。
- 共培养22天,iPS细胞的T细胞将收获从文化,用冷PBS洗前用板涂层的抗CD3和可溶性抗CD28抗体(终浓度为4微克/毫升)刺激。
- 孵化器将进行37℃,5%CO2培养箱40小时,然后Befeldin将被添加到文化,另外4个小时。
- 在年底共培养,细胞就会HAR既得利益,洗净,如上所述的Fc受体阻滞剂阻断。 CD8和TCRVβ链的表面标志,使用荧光标记的抗体将阻止细胞染色。
- 细胞表面染色后,细胞将用4%甲醛固定,并通过使用Biolegend的透套件透。
- 通透性后,将通过使用荧光标记的抗体染色,如IL-2和IFN-γ的细胞内分子。
- 前最后流式细胞仪检测,细胞将在冷PBS洗涤三次,以排除过量的抗体。
- 在RAG-/ -小鼠的成熟。
- 从小鼠,经过三个星期在体内发育,RAG-/ -小鼠会被牺牲,脾和淋巴结肿大,将被删除。
- 将单个细胞通过机械故障处理。将使用ACK裂解液和裂解红细胞mononucleocytes将收集和冷PBS洗两次。
- 洗净后,将被阻止细胞的Fc受体阻滞剂24G2在4℃,20分钟和在阻塞年底,将用不同的荧光标记的抗CD3,抗CD4,抗CD8和反TCRβ抗体染色细胞4°C 20分钟。
- 在染色结束时,细胞就会被冷PBS洗涤,流式细胞仪检查前的三倍。
- 分化的细胞和细胞回收率。 图1的形态学变化。
3。 在体内编程
- 代逆转录病毒结构。
- MSCV-IRES-DsRed的(MiDR)载体MSCV-IRES-GFP载体的基础上,构造代DsRed基因与绿色荧光蛋白基因。
- OT-T细胞受体基因的克隆,使OT-I/MiDR建设到在Midr的载体。
- 逆转录病毒转导和细胞分选。
- 开发平台-E的包装细胞ARE中生成假病毒,将用于以下传导。
- 3X10 6开发平台-E细胞接种于100毫米培养皿转染前一天。
- 第0天,开发平台-E的细胞,将转加时赛,我MiDR使用GeneJamma转染试剂质粒。
- 第1天,1×10 6 iPS细胞将被接种到0.1%的明胶的预涂24孔板。
- 第2天,假病毒含有从开发平台-E的文化上清将被收集并通过0.4微米过滤器,以排除潜在的污染物。
- 将于32°ç离心机的条件下进行转1小时5微克/毫升凝聚胺的存在,在1400转。
- 经过离心机的转导,细胞将被放置在32°C时,晚上5%CO2培养箱。
- 第3天,重复的第2天TRA如上所述nsduction程序。 6孔板将预涂irSNL76 / 7饲养层细胞,以供将来使用。
- 第4天,转iPS细胞将胰酶消化,离心5分钟为400克,播种覆膜irSNL76 / 7饲养层细胞。
- 在汇合,细胞将被胰酶消化,离心5分钟,在400Ğ和细胞分选处理。将GFP和DsRed的双阳性细胞排序由MoFlo细胞分选仪。排序将irSNL76 / 7饲养层细胞培养细胞,以供将来使用。
- 开发平台-E的包装细胞ARE中生成假病毒,将用于以下传导。
- 继转移和肿瘤的挑战。
OT-我的TCR转IPS(OT-I/iPS)细胞通常保持在irSNL76 / 7饲养层细胞,如上所述。- 继转移的一天,OT-I/iPS细胞是胰酶消化,离心5分钟,在400Ğ悬浮在新鲜媒体。
- 30分钟,上一个新的培养皿在37°C间孵化器的孵化需要消除分化的细胞和残馈线细胞。
- 悬浮细胞在培养结束时,将收集的400Ğ离心5分钟。
- 将在冰冷的PBS洗涤细胞沉淀三次,将通过在两个清洗之间的尼龙70微米过滤器,以排除细胞团块(2X过滤)通过细胞。
- 洗净后,将细胞计数,并在冷PBS悬浮浓度在1.5×10 7细胞/ ml。
- 细胞将保持在注射前的冰。
- 继转移,将4-6周龄雌性C57BL/6J小鼠。 四,通过尾静脉注射之前,老鼠将被放置在红外光,其尾静脉扩张。
- 静脉扩张后,将200μL细胞悬液或3X10 6个细胞通过尾静脉继转移。六个星期将被允许在体内成熟OT我的TCR转iPS细胞。
- 静脉注射6周后,将4X10 6 E.G7胸腺瘤细胞腹腔接种。
- 从文化E.G7胸腺瘤细胞会有所收获,并在PBS洗三次。
- 在洗年底,细胞将悬浮在冷PBS浓度在8×10 7细胞/ ml。
- 将50μL细胞悬液或4X10 6个细胞注射到腹腔。
- 评价。
- OT我的TCR特性, 在体外转iPS细胞。
- 红色荧光的荧光显微镜检查,将绿色荧光蛋白双阳性细胞进行常规荧光显微镜下,与不固定的活细胞。
- 将进行PCR和RT-PCR分析基因的整合和表达。
- 将被隔离单独使用QIAGEN的DNA或从样品细胞的DNA或RNARNA分离试剂盒。
- 将进行PCR和RT-PCR引物特异性识别的TCRVβ5链重组VDJ地区使用。
- T细胞的发育和成熟。 图3a。
- 在第2周,4和6细胞移植后,动物将被处死,脾,淋巴结肿大,将会从动物中删除。
- 单细胞悬液,将通过机械故障。红血细胞将裂解使用的ACK裂解液mononucleocytes的,将被收集和冷PBS洗两次。
- 洗净后,将被阻止细胞的Fc受体阻滞剂24G2在4℃20分钟,并在的阻塞年底,细胞将被aliquotted和不同荧光标记的抗体,在4℃染色20分钟。
- 在染色结束时,细胞就会被冷PBS洗涤,流式细胞仪装载前的三倍。
- 肽刺激。 图3b。
- 动物肿瘤的挑战第50天,将被处死,脾,淋巴结肿大,将会从动物中删除。
- 单细胞悬液,将通过机械故障。红血细胞将裂解使用的ACK裂解液mononucleocytes的,将被收集和冷PBS洗两次。
- CD8 + T细胞将通过美天旎生物技术的CD8 + T细胞分离试剂盒分离。孤立的CD8 + T细胞,将混在1:10的比例,从天真的C57BL/6J小鼠小鼠隔离,脉冲和0.5μmol/毫升的卵257-264肽为40个小时的照射脾。此后,布雷菲德菌素A将被添加到文化,另外4个小时。
- 在年底共培养,细胞就会有所收获,洗涤,如上所述的Fc受体阻滞剂阻断。
- 将阻止细胞表面标志染色CD8和TCRVβ5链ERS通过使用荧光标记的抗体。
- 细胞表面染色后,细胞将用4%甲醛固定,并通过细胞通透性套件透。
- 通透性后,将通过使用荧光标记的抗体染色,如IL-2和IFN-γ的细胞内分子。
- 前最后流式细胞仪检测,细胞将在冷PBS洗涤三次,以排除过量的抗体。
- 在体内的杀法。 图3C。
- 从天真的C57BL/6J小鼠的脾细胞将被孤立和羧基琥珀酰亚胺酯(CFSE)标记靶细胞。
- 5μmol/毫升CFSE标记(ConA 您好细胞)将与10微克/毫升卵257-264肽和0.5μmol/毫升CFSE标记(CFSE标记的卤味细胞)将不会进行脉冲标记细胞的脉冲标记细胞。
- 2.5×10 6 CFSE标记的喜细胞加2.5×10 6 CFSE标记劳细胞的混合物将继静脉注射转移到指定的收件人。
- 16小时后,这些小鼠的脾细胞将被孤立和CFSE标记+细胞将通过流式细胞仪分析。
- 腹腔肿瘤细胞计数图4。
小鼠肿瘤的挑战第20天,将被处死,腹腔灌洗,将用冷PBS。腹腔灌洗回收,将肿瘤细胞计数。 - 肿瘤浸润性T细胞识别。 图5。
- 在晚期肿瘤的挑战,将小鼠牺牲,将来自不同群体的腹腔取出肿瘤。
- 肿瘤将切成小块,一块将被放入离心管放在干冰立即,另一半将被固定在空调的RPMI-1640媒体将来使用甲醛和第三条,将被保留。
- 根据从甲醛固定石蜡包裹的样品一般协议,将进行H&E染色。
- 将冷冻样品进行免疫荧光染色。
- 组织在使用前将切片和保存在-20℃。
- 组织切片,将空气中干燥15分钟,15分钟前冷丙酮固定。
- 固定后,该路段将是另一个15分钟前5分钟PBS洗涤干燥的空气。
- 后洗净,在潮湿室的幻灯片,并覆盖30微升3%BSA的PBS 30分钟,以阻断非特异性结合的组织切片。
- 在阻塞年底,涂抹封闭液和50μLPE-抗TCRVα2在3%BSA稀释的抗体和FITC标记的抗卵抗体混合物覆盖切片在PBS。
- 孵育在2个小时的湿室和孵化结束,幻灯片将在冷PBS洗涤三次,并用荧光显微镜检查前一种水性安装媒体上。
- 流式细胞仪分析肿瘤浸润性T细胞。
- 肿瘤会挤压成单细胞悬液,将ACK裂解液裂解红细胞。
- 洗涤和阻断后,细胞将被贴上明确承认CD8 +,TCRVα2和TCR Vβ5分子在细胞表面表达的不同荧光标记的抗体。
- 小鼠的存活率。 图6。
肿瘤的挑战后,小鼠的生存将受到严格监控。
- OT我的TCR特性, 在体外转iPS细胞。
4。代表结果
CD3和TCRβ被用作标记的T细胞。我们评估,以确定是否与Notch配体DL1的iPS细胞的刺激,可促进T细胞分化表达CD3和TCRβ+的 iPS细胞源性细胞,并进一步分析CD4和CD8的表达,对CD3门+和TCRβ+人口。如下所示,在22天的CD3 +TCRβ+,CD4 - CD8 +单阳性(SP)的T细胞产生iPS细胞在体外 。此外,iPS细胞衍生的SP细胞能产生IL-2和γ-干扰素在体外刺激的iPS细胞衍生板涂层的抗CD3和可溶性抗CD28抗体( 图2), T细胞的功能。
继转移到受体小鼠后,大部分的TCR基因转iPS细胞进行分化成CD8 + +淋巴细胞,回应肽刺激体外本身creting IL-2和γ-干扰素( 图3)。最重要的是,继转移TCR转iPS细胞引发OVA反应的淋巴细胞进入肿瘤组织和肿瘤的挑战( 图5-6)保护动物的渗透。因此,TCR基因转导的iPS细胞能够分化为功能性抗原特异性淋巴细胞在体内 。

图1。iPS细胞分化的形态。在不同的日子,小鼠iPS细胞共培养与执行部分第9段,DL1的细胞在α-MEM培养基辅以20%FCS和2.2 g / L的碳酸氢钠存在5毫微克/毫升mFlt3L 1毫微克/毫升MIL-7 。
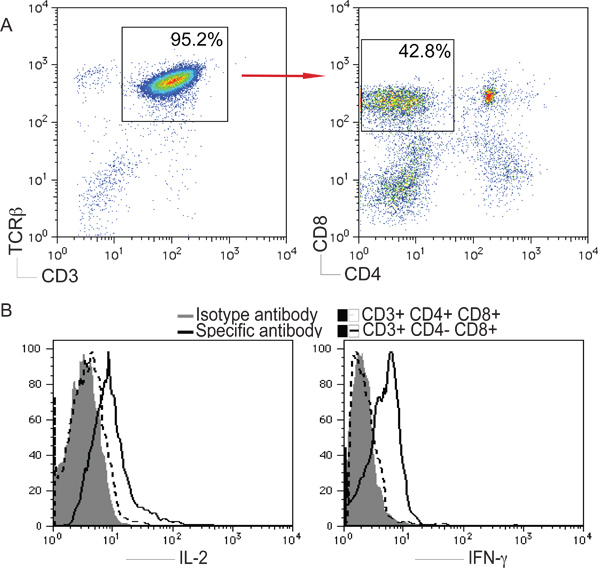
图2 iPS细胞,T细胞的分化。与图1中描述的OP9-DL1的细胞共培养小鼠iPS细胞。对DAY 22,iPS细胞源性细胞的分离和分析。一),CD4 +,CD8 -或CD4 - CD8 +细胞后,门上的CD3 +和TCRβ+人口。 b)细胞在37°C,5%的CO 2刺激板涂层的抗CD3和可溶性抗CD28抗体为5小时。 IL-2和IFN-γ的细胞内染色分析后,门活CD4 - CD8 + T细胞。
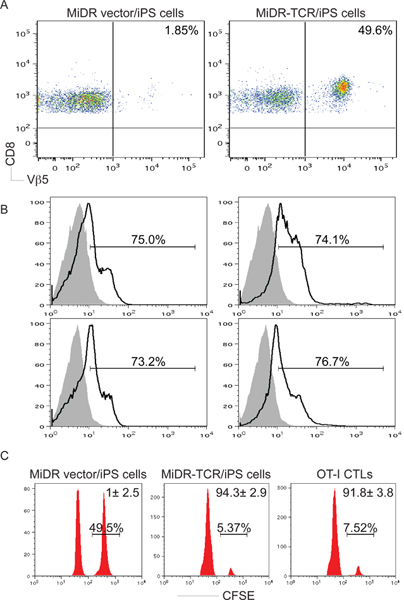
图3。抗原特异性CD8 + T细胞的iPS细胞在体内的发展。 OT-TCR基因转导的iPS细胞注入C57BL / 6小鼠第四 。 6到10周后,OVA特异性CD8 +Vβ5+ T细胞的发育。一),CD8 +Vβ5流式细胞仪门后的C +汇集的淋巴结和脾脏细胞进行了分析,D8 +标准人口。乙)IL-2和γ-干扰素生产(暗线,阴影部分表示同型对照)测定细胞内细胞因子染色,CD8 +Vβ5+人口的门后。 C) 在体内的增殖/细胞毒性实验。 CFSE标记喜 (右峰)和的CFSE 劳 (左峰)靶细胞与卵257-264肽和控制脉冲,分别注入小鼠iPS细胞转移或OT-CTL的转移后,有一天,10周后。

图4。继转移OT我的TCR基因转导的iPS细胞,抑制肿瘤生长。 OT-TCR基因转iPS细胞过继转移到C57BL / 6小鼠。一组小鼠OVA反应CD8 + T细胞注射OT-TCŕ转基因小鼠,一组老鼠没有细胞的转移。小鼠后,无论是六个星期或细胞移植后的翌日,受到挑战E. G7肿瘤细胞。第20天,腹腔中的肿瘤细胞进行了列举。
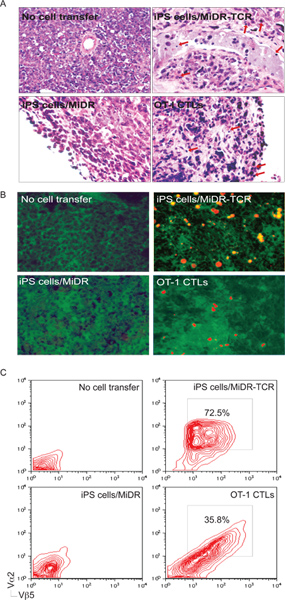
图5。iPS细胞源性抗原特异性CTL渗透到肿瘤组织。肿瘤的挑战后30至35天,肿瘤组织进行了研究,为肿瘤反应T细胞的浸润。一)H&E染色。炎症细胞浸润在肿瘤组织中(↓)。二)免疫组化染色。 OVA特异性Vα2+淋巴细胞(红色)(绿色)卵表达的肿瘤组织中浸润。 c)从肿瘤组织中的单细胞悬液进行了分析Vα2表达+ +通过流式细胞仪,之后的CD8 +人口浇注Vβ5。
图6。继转移的OT-我的TCR基因转导的iPS细胞维持小鼠的存活率。卵TCR基因转导的iPS细胞过继转移到C57BL / 6小鼠受到挑战E.的七国集团肿瘤细胞图所述。 4。 Kaplan-Meier生存曲线(N = 6)50天的小鼠的存活率。
讨论
为使基于疗法, 在体外产生大量高活性银特定的T细胞在体内重新输液是最佳方法。虽然我们在体外培养的方法,给出了iPS细胞,iPS细胞源性细胞的死亡,尤其是在第四个星期,在四个星期内的大量功能性T细胞上升。我们得出这样的结论:从缺口的生存信号的信号介导的DL1的IL-7和FLt3L不足以维持iPS细胞衍生的祖T细胞的生存以及其他存活的因素可能是合作,以调节这些细胞...
披露声明
没有利益冲突的声明。
致谢
我们感谢提供山中伸弥博士(京都大学)IPS-MEF的NG-20D-17细胞系,支持OT1-2A的达里奥Vignali博士(圣裘德儿童研究医院),博士胡安•pMig II结构卡洛斯·祖尼加Pflucker(免疫学系,多伦多大学)支持OP9-DL1的细胞系,博士,肯特,éVrana(宾夕法尼亚州立大学医学院药理学教研室)为帮助本研究设计。该项目资助下,拨款补助人数从国家癌症研究所,Barsumian信托和黑色素瘤研究基金会(J宋)K18CA151798。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | |
| C57BL/6J小鼠 | 杰克逊实验室 | 000664 | |
| B6.129S7 RAG1 tm1Mom / J的 | 杰克逊实验室 | 002216 | |
| 抗CD3抗体(2C11) | 屋宇署Pharmingen公司 | 553058 | |
| 抗CD28(37.51)抗体 | 屋宇署Pharmingen公司 | 553295 | |
| 抗CD3抗体(17A2) | BioLegend | 100202 | |
| 抗CD4(GK1.5)抗体 | BioLegend | 100417 | |
| 抗-CD8(53-6.7)抗体 | BioLegend | 100714 | |
| 抗CD25抗体(3C7) | BioLegend | 101912 | |
| 一个TI-CD44的抗体(1M7) | BioLegend | 103012 | |
| 抗-CD117的抗体(2B8) | BioLegend | 105812 | |
| 抗TCR-β(H57597)抗体 | BioLegend | 109220 | |
| 抗IL-2(JES6-5H4)抗体 | BioLegend | 503810 | |
| 抗γ-干扰素(XMG1.2)抗体 | BioLegend | 505822 | |
| DMEM培养液 | Invitrogen公司 | ABCD1234 | |
| α-MEM中 | Invitrogen公司 | A10490-01 | |
| 胎牛血清 | 胎牛血清 | SH3007.01 | |
| 布雷菲德菌素A | 西格玛 | B7651 | |
| 凝聚胺 | 西格玛 | 107689 | |
| GeneJammer | 综合科学 | 204130 | |
| RNA试剂盒 | Qiagen公司 | 74104 | |
| DNA试剂盒 | Qiagen公司 | 69504 | |
| CD8分离试剂盒 | 美天旎生物技术 | 130-095-236 | |
| ACK裂解液 | 龙沙 | 10-548E | |
| mFlt-3L | PeproTech公司 | 250-31L | |
| MIL-7 | PeproTech公司 | 217-17 | |
| 明胶 | 西格玛 | G9391 | |
| FITC标记的抗卵抗体 | 罗克兰Immunochemicals | 200-4233 | |
| 通透性缓冲区 | Biolegend | 421002 | |
| 牛血清白蛋白 | 西格玛 | A7906 | |
| 甲醛 | 西格玛 | F8775 | |
| 0.4微米过滤器 | Millipore公司 | ||
| Moflo细胞分选仪 | 岳Cytomation | ||
| 刀魂流式细胞仪 | 屋宇署 | ||
| LSR的第二流式细胞仪 | 屋宇署 | ||
| 鼠标限位 | 布伦特里科学 |
参考文献
- Brenner, M. K., Heslop, H. E. Adoptive T cell therapy of cancer. Curr. Opin. Immunol. 22, 251-257 (2010).
- Hataye, J., Moon, J. J., Khoruts, A., Reilly, C., Jenkins, M. K. Naive and memory CD4+ T cell survival controlled by clonal abundance. Science. 312, 114-116 (2006).
- Seki, Y. IL-7/STAT5 cytokine signaling pathway is essential but insufficient for maintenance of naive CD4 T cell survival in peripheral lymphoid organs. J. Immunol. 178, 262-270 (2007).
- Stemberger, C. A single naive CD8+ T cell precursor can develop into diverse effector and memory subsets. Immunity. 27, 985-997 (2007).
- Siewert, C. Experience-driven development: effector/memory-like alphaE+Foxp3+ regulatory T cells originate from both naive T cells and naturally occurring naive-like regulatory T cells. J. Immunol. 180, 146-155 (2008).
- Wang, L. X., Plautz, G. E. Tumor-primed, in vitro-activated CD4+ effector T cells establish long-term memory without exogenous cytokine support or ongoing antigen exposure. J. Immunol. 184, 5612-5618 (2010).
- Hinrichs, C. S. Human effector CD8+ T cells derived from naive rather than memory subsets possess superior traits for adoptive immunotherapy. Blood. 117, 808-814 (2011).
- Alajez, N. M., Schmielau, J., Alter, M. D., Cascio, M., Finn, O. J. Therapeutic potential of a tumor-specific, MHC-unrestricted T-cell receptor expressed on effector cells of the innate and the adaptive immune system through bone marrow transduction and immune reconstitution. Blood. 105, 4583-4589 (2005).
- Yang, L., Baltimore, D. Long-term in vivo provision of antigen-specific T cell immunity by programming hematopoietic stem cells. Proc. Natl. Acad. Sci. U.S.A. 102, 4518-4523 (2005).
- Zhao, Y. Extrathymic generation of tumor-specific T cells from genetically engineered human hematopoietic stem cells via Notch signaling. Cancer Res. 67, 2425-2429 (2007).
- Boztug, K., Med, N. .. E. n. g. l. .. J. .. Stem-cell gene therapy for the Wiskott-Aldrich syndrome. N. Engl. J. Med. 363, 1918-1927 (2010).
- Peerani, R., Zandstra, P. W. Enabling stem cell therapies through synthetic stem cell-niche engineering. J. Clin. Invest. 120, 60-70 (2010).
- Mendez-Ferrer, S. Mesenchymal and haematopoietic stem cells form a unique bone marrow niche. Nature. 466, 829-834 (2010).
- Daley, G. Q. Towards the generation of patient-specific pluripotent stem cells for combined gene and cell therapy of hematologic disorders. Hematology Am. Soc. Hematol. Educ. Program. , 17-22 (2007).
- Boitano, A. E. Aryl hydrocarbon receptor antagonists promote the expansion of human hematopoietic stem cells. Science. 329, 1345-1348 (2010).
- Himburg, H. A. Pleiotrophin regulates the expansion and regeneration of hematopoietic stem cells. Nat. Med. 16, 475-482 (2010).
- Tanigaki, K., Honjo, T. Regulation of lymphocyte development by Notch signaling. Nature immunology. 8, 451-456 (2007).
- Zhao, T., Zhang, Z. N., Rong, Z., Xu, Y. Immunogenicity of induced pluripotent stem cells. Nature. 474, 212-215 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。