Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Gerichtete Differenzierung von induzierten pluripotenten Stammzellen in Richtung T-Lymphozyten
In diesem Artikel
Zusammenfassung
Generierung von T-Lymphozyten aus induzierten pluripotenten Stammzellen (iPS-Zellen) gibt einen alternativen Ansatz der Verwendung von embryonalen Stammzellen für die T-Zell-basierten Immuntherapie. Verfahren zeigt, dass durch Verwendung von entweder In-vitro- Oder In-vivo- Ansaugsystem sind iPS der Lage, in sowohl herkömmliche als auch Antigen-spezifische T-Lymphozyten zu differenzieren.
Zusammenfassung
Der adoptive Transfer Zelle (ACT) von Antigen-spezifischen CD8 + cytotoxischen T-Lymphozyten (CTLs) eine vielversprechende Therapie für eine Vielzahl von malignen Erkrankungen 1. CTLs können maligne Zellen durch Interaktion mit den Tumor-Antigene T-Zell-Rezeptoren (TCR) und Release Zellgifte sowie Zytokine, um maligne Zellen töten zu erkennen. Es ist bekannt, dass weniger differenzierte und zentral-Speicher-like (bezeichnet als hochreaktive) CTLs die optimale Population für ACT-basierten Immuntherapie sind, weil diese CTLs eine hohe proliferative Potential haben, sind weniger anfällig für Apoptose als differenzierter Zellen und haben eine höhere Fähigkeit, sich auf homöostatische Zytokine 2-7 reagieren. Aufgrund von Schwierigkeiten bei der Beschaffung eine hohe Anzahl solcher CTLs von Patienten gibt es eine dringende Notwendigkeit, einen neuen Ansatz für hoch reaktive Ag-spezifischen CTLs für eine erfolgreiche ACT-basierte Therapien zu generieren finden.
TCR Transduktion des Selbst-erneuerbaren StammzellenZellen für die Wiederherstellung des Immunsystems hat ein therapeutisches Potential für die Behandlung von Krankheiten 10.08. Allerdings ist die Herangehensweise an embryonalen Stammzellen (ES-Zellen) von Patienten erhalten, nicht machbar. Obwohl die Verwendung von hämatopoetischen Stammzellen (HSC) für therapeutische Zwecke ist allgemein in der Klinik 11-13 Anwendung gelangt ist, HSK Differenzierung und Proliferation einzusparen und HSK sind schwer zu zeigen in in vitro-Zellkultur 14-16. Aktuelle iPS-Technologie und die Entwicklung eines in vitro-System für den Gentransfer sind geeignet zur Erzeugung von iPS-Zellen Patienten ohne chirurgischen Eingriff. Darüber hinaus, wie WSR besitzen iPS unbestimmte proliferativen Kapazität in vitro, und es wurde gezeigt, in hämatopoetischen Zellen zu differenzieren. So haben iPS-Zellen grösseres Potenzial, um in ACT-basierten Immuntherapie im Vergleich zu üben wollen, oder Blutstammzellen verwendet werden.
Hier stellen wir Methoden für die Generierung von T-LymphozytenMonozyten aus iPS-Zellen in vitro und in vivo Programmierung von Antigen-spezifischen CTLs von IPS-Zellen zur Förderung der Krebs Immunüberwachung. Stimulation in vitro mit einem Notch-Liganden treibt T-Zell-Differenzierung von iPS-Zellen, TCR und Gentransduktion Ergebnisse in iPS-Zellen differenzieren in Antigen-spezifischen T-Zellen in vivo, die das Tumorwachstum verhindert. So zeigen wir, Antigen-spezifischen T-Zell-Differenzierung von iPS. Unsere Studien liefern eine potenziell effizienterer Ansatz zur Erzeugung von Antigen-spezifischen CTLs für ACT-basierten Therapien und erleichtern die Entwicklung von therapeutischen Strategien für Krankheiten.
Protokoll
1. Cell Culture
- Vorbereitung der bestrahlten SNL76 / 7 (irSNL76 / 7) Feeder-Zellen für die Kultur.
SNL76 / 7-Zellen werden im Allgemeinen in 10% fötalem Rinderserum (FBS) Dulbecco modifiziertem Eagle Medium (DMEM) Medien aufrechterhalten.- Inkubator für 30 Minuten vor der Wiederherstellung SNL76 / 7 Zellen von flüssigem Stickstoff ist, A Kulturschale oder Kolben wird mit 0,1% Gelatine-Lösung bei 37 ° C beschichtet werden.
- Wenn SNL76 / 7-Zellen Konfluenz erreichen, werden die Zellen aus trypsiniert werden, zentrifugiert bei 400 g für 5 min gewaschen und in frischem Medium.
- Resuspendiert SNL76 / 7-Zellen werden in einer 60 Co-Strahler mit einer Dosis von 5000 Rads bestrahlt werden.
Alternativen Ansatz SNL76 / 7-Zellen konnten durch embryonale Maus-Fibroblasten (MEF) und Mitomycin-Inaktivierung ersetzt werden könnte ersetzen Bestrahlung. - Nach der Bestrahlung werden die Zellen bei 400 g für 5 min zentrifugiert und resuspendiert in 10% Dimethylsulfoxid (DMSO) FBS Einfrieren Puffer, Aliquot inCryoröhrchen und erhalten in flüssigem Stickstoff für die zukünftige Verwendung.
- Herstellung von OP9-DL1 Zellen in vitro-Differenzierung.
OP9-DL1 Zellen werden im Allgemeinen in 20% FBS α-Minimum Essential Medium (α-MEM) Medien aufrechterhalten werden. Wenn sie Konfluenz erreichen Zellen werden in einer 1:5-Verdünnung aufgeteilt werden. - Herstellung von E.G7 Thymustumorzellen.
E.G7 Thymustumorzellen im Allgemeinen in 10% FBS Roswell Park Memorial Institute (RPMI) -1640 Medien aufrechterhalten werden. Wenn sie Konfluenz erreichen, werden die Zellen in einer 1:10 Verdünnung aufgeteilt werden. - Allgemeine Wartung von iPS-und TCR-iPS-Zellen transduziert.
- Eine Kulturschale wird mit 0,1% Gelatine-Lösung in 37 ° C werden 30 Minuten lang vor der Aussaat irSNL76 / 7 Feeder-Zellen einen Tag vor der Verwertung oder Split von iPS-Zellen beschichtet.
- Für iPS-Zellen geteilt, werden die Zellen trypsiniert werden, zentrifugiert bei 400 g für 5 min gewaschen und in 15% FBS DMEM-Medium.
- Trypsiniert iPSZellen werden auf eine frische Kulturschale für 30 Minuten werden in 37 ° C Inkubator vor der Aussaat auf frische irSNL76 / 7 Feeder-Zellen vorbeschichtete Gericht zu differenzierten Zellen und Rückständen Feeder-Zellen auszuschließen.
- Nach der Inkubation werden 4 × 10 6 Zellen in einer 100 mm Petrischale ausgesät werden.
2. In-vitro-Programmierung
- In-vitro-Kokultur-System.
- Am Tag 0 wird 5x10 4 iPS-Zellen auf einer 100mm Kulturschale mit konfluenten OP9-DL1 Zellmonolayer in 20% FBS α-MEM-Medium ausgesät werden.
- Am Tag 3 wird Kulturmedien mit frisch geerntetem geändert werden.
- Am Tag 5, werden die Zellen aus trypsiniert und zentrifugiert werden bei 400 g für 5 min vor der Inkubation auf einem frischen 100mm Kulturschale für 30 Minuten bei 37 ° C-Inkubator.
- Schwimmende Zellen gesammelt werden und gezählt werden, wird 5x10 5 Zellen auf eine neue Kultur übertragenSchale mit konfluenten OP9-DL1 Zellmonolayer in 20% FBS α-MEM-Medien. Cytokine MFLT-3L (Endkonzentration: 5 ng / ml) wird in der Kultur zugesetzt werden.
- Am Tag 8 wird lose anhaftenden Zellen werden vorsichtig pipettieren nach unten.
- Waschen Sie den OP9-DL1 Fütterung Schicht mit 10 ml PBS ein weiteres Mal, um die maximale Rückgewinnung von teilweise differenzierte iPS-Zellen zu bekommen.
- Nach Ernten der Zellen aus der Co-Kultur werden die Zellen bei 400 g für 5 min zentrifugiert und resuspendiert in 20% FBS α-MEM-Medium mit MFLT-3L (5 ng / ml) und mIL-7 (1 ng / ml) ergänzt.
- Die Zellen werden in eine 6-Well-Kulturplatte mit konfluenten OP9-DL1 Zellen beschichtet übertragen werden. Normalerweise iPS-Zellen aus einer 100 mm Kulturschale wieder werden in eine Vertiefung der 6-Well-Platte übertragen werden.
- Von Tag 10, wird Kulturmedien in jedem anderen Tag geändert werden (20% FBS α-MEM-Medien Supplemented mit MFLT-3L (5 ng / ml) und mIL-7 (1 ng / ml)).
- Kultur mit Feeder-Platten beschichtet OP9 DL1-Zellen in 4-6 Tagen wird je nach dem Wachstum der Feeder-Zellen verändert werden.
- In-vivo-Reifung teilweise differenzierte iPS-Zellen.
- Am Tag 22 der Kokultur, wird iPS aus trypsiniert werden, zentrifugiert bei 400 g für 5 min inkubiert und auf eine frische Kulturschale in 37 ° C für 30 Minuten.
- Schwebende Zellen werden gesammelt, weitergegeben durch 70 um Nylon-Sieb, um Zellklumpen, die Lungenembolie, um Mäuse verursachen könnten, auszuschließen und dreimal in kaltem PBS.
- Die Zellen werden in PBS mit einer Konzentration von 1.5x10 7 Zellen / ml resuspendiert werden.
- Die Zellen werden auf Eis vor der Injektion beibehalten werden.
- Vor iv-Injektion über die Schwanzvene, werden die Mäuse unter einer Infrarot-Licht, um ihre Schwanzvene weiten abgegeben werden.
- Nach Vene dilatation, 200 ul Zellsuspension oder 3x10 6 Zellen wird adoptiv in einen 4 Wochen alten B6.129S7-Rag1 tm1Mom / J-Maus durch ihre Schwanzvene übertragen werden. Drei Wochen sind für die in vivo Reifung der teilweise differenzierte iPS-Zellen erlaubt.
- Bewertung.
- Morphologische Veränderungen von differenzierten Zellen und Zell-Recovery Rates. Abbildung 1.
- An verschiedenen Tagen der Kokultur mit OP9 DL1-Zellen, werden Live-Cell-Bilder unter herkömmlichen Mikroskop genommen werden.
- Handy Verwertungsquoten wird basierend auf der Anzahl von Zellen, die aus der Kultur geerntet berechnet werden.
- Die durchflusszytometrische Analyse der Oberflächenmarker Änderungen. Abbildung 2a.
- Bei verschiedenen Tagen der Co-Kultur werden die Zellen aus der Kultur durch Trypsinbehandlung entfernt und gewaschen mit kaltem PBS, bevor die Zelloberfläche.
- Vor dem Anfärben Witzh unterschiedlichen Fluorochrom konjugierte Antikörper, werden Zellen von Fc-Blocker 24G2 in 4 ° C für 20 Minuten gesperrt.
- Nach 20 Minuten Färbung in 4 ° C, Zellen dreimal in kaltem PBS gewaschen, bevor durchflusszytometrische Untersuchung.
- Die Aktivierung von in vitro differenzierten iPS-Zellen. Abbildung 2b.
- Einen Tag vor Aktivierungsassay, Precoat eine 24-Well-Platte mit Anti-CD3 (Endkonzentration: 4 g / ml, in PBS) bei 4 ° C über Nacht.
- Am Tag 22 der Kokultur, IPS-Zellen abgeleiteten T-Zellen aus der Kultur geerntet werden und mit kaltem PBS gewaschen, bevor Stimulation mit plattenförmigen beschichtete Anti-CD3 und löslichen Anti-CD28-Antikörpern (Endkonzentration: 4 Mikrogramm / Milliliter).
- Die Inkubation erfolgt in 37 ° C durchgeführt werden, 5% CO 2-Inkubator für 40 Stunden und dann Befeldin Eine in Kultur wird für weitere 4 Stunden hinzugefügt werden.
- Am Ende der Co-Kultur werden die Zellen HARausübbaren gewaschen und durch Fc-Blocker wie oben beschrieben. Blockierte Zellen wird für Oberflächenmarker CD8 und TCR als Vß Kette mit Fluorochrom konjugierte Antikörper angefärbt werden.
- Nach Zelloberflächenfärbung, werden die Zellen mit 4% Formaldehyd fixiert und permeabilisiert mit der durchdringbar BioLegend Kit.
- Nach Permeabilisierung wird intrazelluläre Moleküle wie IL-2 und IFN-γ mit Fluorochrom-konjugierten Antikörpern gefärbt werden.
- Vor der endgültigen durchflusszytometrische Untersuchung werden die Zellen dreimal in kaltem PBS gewaschen werden, um übermäßige Antikörper auszuschließen.
- Die Reifung in Rag-/ - Mäusen.
- Nach drei Wochen in vivo Entwicklung, Rag-/ - Mäuse geopfert werden, Milz und Lymphknoten werden von Mäusen entfernt werden.
- Einzelne Zellen werden durch Maschinenschaden verarbeitet werden. Rote Blutkörperchen werden mit ACK-Lysepuffer lysiert werden undmononucleocytes werden gesammelt und zweimal in kaltem PBS gewaschen.
- Nach dem Waschen werden die Zellen mit Fc-Blocker 24G2 in 4 ° C für 20 Minuten blockiert und am Ende der Blockierung Zellen werden mit unterschiedlichen Fluorochrom-konjugierter anti-CD3, Anti-CD4, anti-CD8 und anti-TCRβ Antikörper angefärbt werden 4 ° C für 20 Minuten.
- Am Ende der Färbung werden die Zellen dreimal in kaltem PBS gewaschen werden, bevor die durchflusszytometrische Untersuchung.
- Morphologische Veränderungen von differenzierten Zellen und Zell-Recovery Rates. Abbildung 1.
3. In-vivo-Programmierung
- Erzeugung von retroviralen Konstrukt.
- MSCV-IRES-DsRed (MIDR)-Vektor basiert auf MSCV-IRES-GFP durch Einsetzen des GFP-Gens mit der DsRED-Gen konstruiert.
- OT-I T-Zell-Rezeptor-Gen in den Vektor MIDR um OT-I/MiDR konstruieren subkloniert.
- Retrovirale Transduktion und Zellsortierung.
- Plat-E Verpackungszellen are verwendet werden, um pseudovirus erzeugen das wird für folgende Transduktion verwendet werden.
- 3x10 6 Plat-E-Zellen werden auf einer 100 mm Kulturschale einen Tag vor der Transfektion ausgesät.
- Am Tag 0, Plat-E-Zellen transfiziert werden mit OT-I MIDR Plasmid unter Verwendung GeneJamma Transfektionsreagenz.
- Am Tag 1 werden 1x10 6 iPS-Zellen in eine Vertiefung einer 0,1% Gelatine vorbeschichtete 24-Well-Platte ausgesät werden.
- Am Tag 2 pseudovirus-haltige Überstand von Plat-E Kultur wird gesammelt und durch einen 0,4 um Filter, um mögliche Verunreinigungen auszuschließen weitergegeben werden.
- Transduktion wird unter der Bedingung von 32 ° C Zentrifuge bei 1400 U werden für 1 Stunde durchgeführt in Gegenwart von 5 pg / ml Polybren.
- Nach Zentrifuge-basierte Transduktion, werden Zellen in 32 ° C, 5% CO 2-Inkubator über Nacht zugestellt werden.
- Am 3. Tag, wiederholen Sie den Tag auf zwei transduction wie oben beschrieben. Ein 6-Well-Platte mit irSNL76 / 7 Feeder-Zellen für die zukünftige Verwendung vorbeschichtet sein.
- Am Tag 4 transduzierten iPS-Zellen ausgeschaltet werden trypsiniert werden, zentrifugiert bei 400 g für 5 min und ausgesät auf vorbeschichteten irSNL76 / 7 Feeder-Zellen.
- Bei Konfluenz werden die Zellen aus trypsiniert werden, zentrifugiert bei 400 g für 5 min und verarbeitet Zellsortierung. GFP und DsRed doppelt positiven Zellen wird durch MoFlo Cell Sorter sortiert werden. Die sortierten Zellen auf irSNL76 / 7 Feeder-Zellen für die zukünftige Verwendung kultiviert werden.
- Plat-E Verpackungszellen are verwendet werden, um pseudovirus erzeugen das wird für folgende Transduktion verwendet werden.
- Adoptiven Transfer Tumor und Herausforderung.
OT-I TCR transduzierten iPS (OT-I/iPS) Zellen im Allgemeinen auf irSNL76 / 7 Feeder-Zellen erhalten, wie oben beschrieben.- Am Tag der adoptiven Transfer werden OT-I/iPS Zellen aus, trypsiniert zentrifugiert bei 400 g für 5 min gewaschen und in frischem Medium.
- 30 Minuten Inkubation auf einem frischen Kulturschale in 37 ° C Inkubator benötigt, um differenzierte Zellen zu eliminierenund Rest-Feeder-Zellen.
- Am Ende der Inkubation werden die schwimmenden Zellen gesammelt und bei 400 g zentrifugiert werden für 5 min.
- Zellpellet wird in kaltem PBS dreimal gewaschen werden, und die Zellen durch ein Sieb 70 um Nylon zwischen zwei Waschungen, um Zellklumpen (2X Filtration) auszuschließen übergeben werden.
- Nach dem Waschen werden die Zellen gezählt und erneut in kaltem PBS in einer Konzentration von 1.5x10 7 Zellen / ml.
- Die Zellen werden auf Eis vor der Injektion beibehalten werden.
- Für adoptiven Transfer, wird 4-6 Wochen alten weiblichen C57BL/6J-Mäuse verwendet werden. Vor iv-Injektion über die Schwanzvene, werden die Mäuse unter einer Infrarot-Licht, um ihre Schwanzvenen weiten abgegeben werden.
- Nach Dilatation Vene, werden 200 ul Zellsuspension oder 3x10 6 Zellen adoptiv durch die Schwanzvene übertragen werden. Sechs Wochen wird zugelassen für In-vivo-Reifung von OT-I TCR iPS-Zellen transduziert werden.
- Nach sechs Wochen iv Injektion, werden 4x10 6 E.G7 Thymustumorzellen intraperitoneal eingeimpft werden.
- E.G7 Thymustumorzellen wird aus der Kultur geerntet werden und dreimal in PBS.
- Am Ende der Wäsche werden die Zellen in kaltem PBS in einer Konzentration von 8x10 7 Zellen / ml suspendiert werden.
- 50 ul Zellsuspension oder 4x10 6 Zellen in die Bauchhöhle injiziert werden.
- Bewertung.
- In-vitro-Charakterisierung der OT-I TCR transduzierten iPS-Zellen.
- Fluoreszierende mikroskopische Untersuchung von DsRed, wird GFP doppelt positive Zellen unter konventionellen Fluoreszenzmikroskop mit nicht fixierten lebenden Zellen durchgeführt werden.
- Gene Integration und Expression wird durch PCR und RT-PCR-Analysen analysiert werden.
- Zelluläre DNA oder RNA aus Proben werden gesondert isoliert werden, indem unter Verwendung von Qiagen-DNA oderRNA Isolation Kit.
- PCR und RT-PCR wird unter Verwendung von Primern, die spezifisch das rekombinierte VDJ-Region der TCR Vβ5 Kette durchgeführt werden.
- T-Zell-Entwicklung und Reifung. Abbildung 3a.
- In Woche 2, 4 und 6 wird nach Zellenübertragungsvorrichtung, Tier geopfert und Milz, Lymphknoten wird aus tierischen entfernt werden.
- Einzel-Zell-Suspension wird durch mechanischen Abbau vorgenommen werden. Rote Blutkörperchen werden mit ACK-Lysepuffer und mononucleocytes werden gesammelt und zweimal in kaltem PBS gewaschen, lysiert werden.
- Nach dem Waschen werden die Zellen mit Fc-Blocker 24G2 in 4 ° C für 20 Minuten blockiert und am Ende der Blockierung Zellen aliquotiert und mit unterschiedlichen Fluorochrom-konjugierten Antikörpern in 4 ° C gefärbt werden für 20 Minuten.
- Am Ende der Färbung werden die Zellen dreimal mit kaltem PBS gewaschen vor dem Laden im Durchflusszytometer.
- Peptid-Stimulation. Abbildung 3b.
- Am Tag 50 der erneuten Tumor-Challenge werden die Tiere geopfert und Milz, Lymphknoten vom Tier entfernt werden.
- Einzel-Zell-Suspension wird durch mechanischen Abbau vorgenommen werden. Rote Blutkörperchen werden mit ACK-Lysepuffer und mononucleocytes werden gesammelt und zweimal in kaltem PBS gewaschen, lysiert werden.
- CD8 + T-Zellen wird unter Verwendung Miltenyi Biotec CD8 + T-Zell-Isolation Kit isoliert werden. Getrennt CD8 + T-Zellen werden mit bestrahlten Milzzellen aus naiven C57BL/6J-Mäusen im Verhältnis von 1:10 isoliert und gepulst mit 0,5 mmol / ml OVA 257-264 Peptid für 40 Stunden gemischt werden. Danach Brefeldin A wird in der Kultur für weitere 4 Stunden zugegeben werden.
- Am Ende der Co-Kultur werden die Zellen geerntet, gewaschen und blockiert durch Fc-Blocker wie oben beschrieben.
- Blockierte Zellen wird für Oberflächen-Marke angefärbt werdenERS als CD8 und TCR Vβ5 Kette mit Fluorochrom konjugierte Antikörper.
- Nach Zelloberflächenfärbung, werden die Zellen mit 4% Formaldehyd fixiert und permeabilisiert mit Zellpermeabilisierung Kit.
- Nach Permeabilisierung wird intrazelluläre Moleküle wie IL-2 und IFN-γ mit Fluorochrom-konjugierten Antikörpern gefärbt werden.
- Vor der endgültigen durchflusszytometrische Untersuchung werden die Zellen dreimal in kaltem PBS gewaschen werden, um übermäßige Antikörper auszuschließen.
- In vivo Abtötungsassay. 3C.
- Milzzellen von naiven C57BL/6J-Mäuse wird isoliert und markiert mit Carboxyfluorescein Succinimidylester (CFSE) als Zielzellen.
- Zellen mit 5 mmol / ml CFSE (CFSE hallo Zellen) werden mit 10 pg / ml OVA 257-264 Peptid und Zellen mit 0,5 mmol / ml CFSE (CFSE lo-Zellen) werden nicht gepulst werden beschriftet gepulst werden beschriftet.
- Eine Mischung von 2.5x10 6 CFSE hallo Zellen plus 2.5x10 6 CFSE lo-Zellen wird durch adoptiv iv Injektion in angegebenen Empfänger übertragen.
- Nach 16 Stunden wird Milzzellen aus den Mäusen isoliert und CFSE + Zellen mittels Durchflusszytometrie analysiert werden.
- Intraperitoneale Tumor-Zellzahl. Abbildung 4.
Am Tag 20 der Tumor Herausforderung werden Mäuse getötet und werden Bauchhöhle Lavage wird mit kaltem PBS durchgeführt werden. Peritoneallavage erholt Tumorzellen gezählt werden. - Tumor-infiltrierenden T-Zellen Identifikation. Abbildung 5.
- In der späten Phase der erneuten Tumor-Challenge werden die Mäuse geopfert und Tumor aus Bauchhöhle aus verschiedenen Gruppen entfernt werden.
- Tumor in Stücke geschnitten werden, ein Stück wird in einem Kryoröhrchen gestellt werden und auf Trockeneis sofort, die andere Hälfte in für fixiert werdenmaldehyde und ein drittes Stück wird in konditioniertem RPMI-1640-Medium für die zukünftige Verwendung aufbewahrt werden.
- H & E Färbung wird nach den allgemeinen Protokoll aus Formaldehyd fixiert und in Paraffin umwickelte Proben durchgeführt werden.
- Immunfluoreszenzfärbung auf kryokonservierten Proben durchgeführt werden.
- Tissue wird geschnitten und konserviert in -20 ° C vor dem Gebrauch.
- Gewebeschnitte werden an der Luft getrocknet 15 Minuten vor 15 Minuten kaltem Aceton fixiert.
- Nach der Fixierung werden die Abschnitte Luft für weitere 15 Minuten vor 5 Minuten Waschen mit PBS getrocknet werden.
- Nach dem Waschen, die Objektträger in einer feuchten Kammer und decken den Gewebeschnitt mit 30 ul 3% BSA in PBS für 30 Minuten, um unspezifische Bindung zu blockieren.
- Am Ende der Blockierung abtupfen Blocking-Puffer und decken Gewebeschnitte mit einem Gemisch aus 50 ul PE-Anti-TCR-Vα2 Antikörper und FITC-Anti-OVA-Antikörper in 3% BSA verdünntin PBS.
- Inkubieren in einer feuchten Kammer für 2 Stunden und am Ende der Inkubation werden die Objektträger dreimal in kaltem PBS gewaschen und montiert werden mit einer auf Wasser basierenden Eindeckmittel vor fluoreszierendem mikroskopische Untersuchung.
- Die durchflusszytometrische Analyse von Tumor-infiltrierenden T-Zellen.
- Tumor wird gequetscht in einzelne Zellsuspension und die roten Blutkörperchen durch ACK-Lysepuffer lysiert werden.
- Nach dem Waschen und Blockierung werden die Zellen mit unterschiedlichen Fluorochrom konjugierte Antikörper, die spezifisch erkennen CD8, TCR und TCR-V Vα2 β5 Moleküle, die auf der Zelloberfläche exprimiert gekennzeichnet werden.
- Die Überlebensrate der Mäuse. Abbildung 6.
Nach Tumor-Challenge, wird das Überleben der Mäuse sorgfältig überwacht werden.
- In-vitro-Charakterisierung der OT-I TCR transduzierten iPS-Zellen.
4. Repräsentative Ergebnisse
CD3 und TCRβ als Marker verwendet TZellen. Um zu bestimmen, ob die Stimulation der IPS-Zellen mit dem Notch-Liganden DL1 könnte T-Zell-Differenzierung wirken, untersuchten wir die Expression von CD3 + und TCRβ iPS-Zellen abgeleiteten Zellen, und weiter analysiert Expression von CD4 und CD8, CD3 + Gating und TCRβ + Bevölkerung. CD8 + einzigen positiven (SP) T-Zellen wurden aus iPS-Zellen in vitro erzeugt - wie hier am Tag 22, CD3 + CD4 + TCRβ gezeigt. Darüber hinaus waren die iPS-Zellen abgeleiteten SP-Zellen in der Lage, IL-2 und IFN-γ, wenn sie in vitro durch die Platte beschichtete Anti-CD3 und löslichen Anti-CD28-Antikörpern (2) stimuliert, was darauf hindeutet die iPS-Zellen abgeleiteten T-Zellen funktionell sind.
Nach adoptiven Transfer in Empfängermäuse, die Mehrheit der TCR-Gen-transduzierten iPS unterzogen Differenzierung in CD8 + CTLs, die in vitro Stimulation Peptid reagiert, indem sichBetonieren IL-2 und IFN-γ (Abb. 3). Am wichtigsten ist, adoptiven Transfer von TCR-transduzierten iPS-Zellen ausgelöst Infiltration von OVA-reaktiven CTLs in Tumorgewebe und geschützten Tieren aus Tumor-Herausforderung (Abb. 5-6). Somit TCR-Gen-transduzierten iPS-Zellen in funktionelle Antigen-spezifischen CTLs in vivo zu unterscheiden.

Abbildung 1. Morphologie von iPS-Zell-Differenzierung. An verschiedenen Tagen wurden Zellen mit Maus-iPS OP9-DL1 Zellen in α-MEM-Medium mit 20% FCS und 2,2 g / l Natriumbicarbonat in Gegenwart von 5 ng / ml mFlt3L und 1 ng / ml mIL-7 ergänzt co-kultiviert .
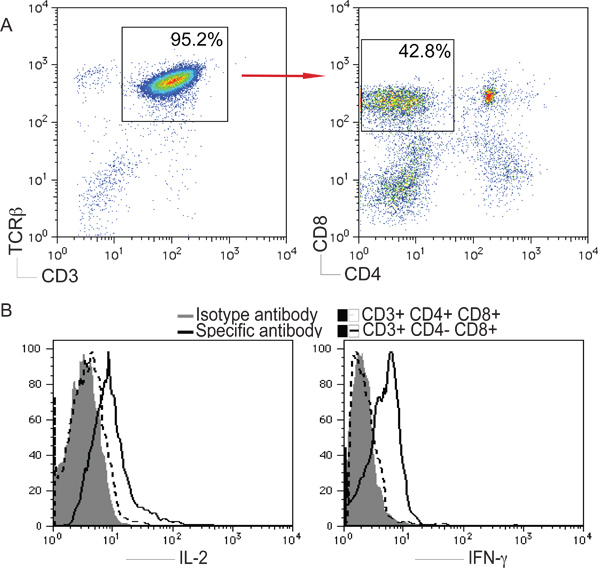
Abbildung 2. T-Zell-Differenzierung von iPS-Zellen. Maus iPS-Zellen wurden mit OP9-DL1 Zellen, wie in 1 beschrieben co-kultiviert. Auf dy 22, wurden iPS-Zellen abgeleiteten Zellen isoliert und analysiert. A) CD4 + CD8 - oder CD4 - CD8 +-Zellen nach Gating auf CD3 + und + TCRβ Populationen. B) Zellen wurden mit Platten-beschichtete Anti-CD3 und löslichen Anti-CD28-Antikörpern für 5 Stunden bei 37 ° C bei 5% CO 2 stimuliert. IL-2 und IFN-γ wurden durch intrazelluläre Färbung analysiert, nach Gating auf Live-CD4 - CD8 + T-Zellen.
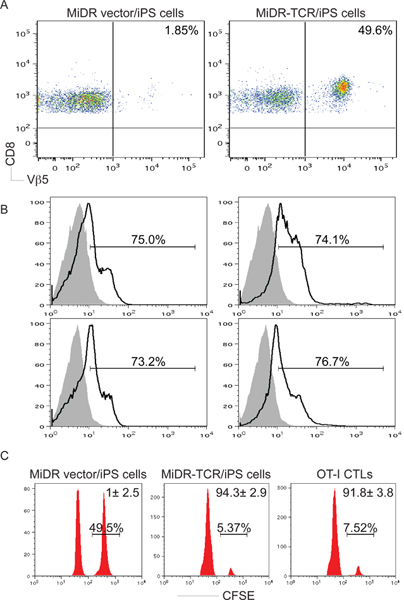
3. Antigen-spezifischen CD8 + T-Zell-Entwicklung von IPS-Zellen in vivo. OT-I TCR-Gen-transduzierte iPS-Zellen wurden iv in C57BL / 6 Mäusen injiziert. Nach sechs bis zehn Wochen, wurde OVA-spezifischen CD8 + Vβ5 + T-Zell-Entwicklung bestimmt. A) CD8 + Vβ5 + T-Zellen aus gepoolten LNs und Milz wurden mittels Durchflusszytometrie analysiert, nachdem Gating CD8 + Populationen. B) IL-2 und IFN-γ Produktion (dunkle Linien; schattierten Bereiche zeigen Isotypkontrollen) wurden durch intrazelluläre Zytokin-Färbung bestimmt nach Gating auf der CD8 + +-Populationen Vβ5. C) In vivo-Proliferation / Cytotoxizitätstest. CFSE hallo (rechts Peaks) und CFSE lo (links Peaks) Zielzellen wurden mit OVA 257-264 Peptid und der gepulste, jeweils, und wurden in Mäuse injiziert zehn Wochen nach iPS Zellenübertragungsvorrichtung oder einen Tag nach OT-I CTL Übertragung.

Abbildung 4. Adoptive Transfer von OT-I TCR-Gen-transduzierte iPS-Zellen unterdrückt Tumorwachstum. OT-I TCR-Gen-transduzierte iPS-Zellen wurden adoptiv in C57BL / 6 Mäusen übertragen. Eine Gruppe von Mäusen wurde mit OVA-CD8 + T-Zellen von OT-I TC injiziertR transgenen Mäusen, und eine Gruppe von Mäusen wurden keine Zelle übertragen. Nach entweder 6 Wochen oder am folgenden Tag nach der Zell-Transfer wurden die Mäuse mit E. unterworfen G7 Tumorzellen herauszufordern. Am Tag 20 wurden die Tumorzellen in der Bauchhöhle aufgezählt.
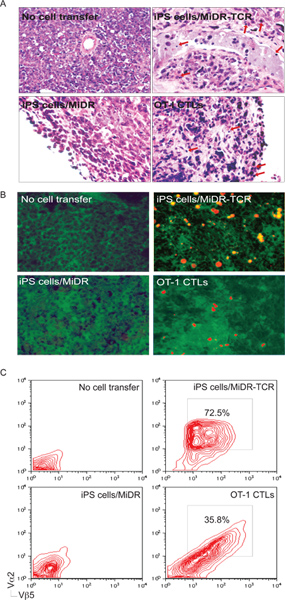
Bild 5. IPS-Zellen abgeleiteten Antigen-spezifischen CTLs in Tumorgeweben zu infiltrieren. Am Tag 30 bis 35 nach der Tumor-Challenge wurden Tumorgewebe für Tumor-reaktiven T-Zell-Infiltration untersucht. A) H & E Färbung. Entzündungszellen infiltriert im Tumorgewebe (↓). B) Immunhistologische Färbung. OVA-spezifische CTLs Vα2 + (rot) in OVA-exprimierenden Tumor Gewebe (grün) infiltriert. C) Einzel-Zell-Suspensionen aus Tumorgewebe wurden für die Expression von Vα2 analysiert und Vβ5 + + mittels Durchflusszytometrie, nach Gating auf der CD8 +-Population.

Abbildung 6. Adoptive Transfer von OT-I TCR-Gen-transduzierte iPS-Zellen der Maus trägt das Überleben. OVA-TCR-Gen-transduzierte iPS-Zellen wurden in adoptiv C57BL / 6 Mäusen, die mit E. unterworfen G7 Tumorzellen herausfordern wurden wie in Abb. übertragen. 4. Die Überlebensrate der Mäuse am Tag 50 wurde von Kaplan-Meier-Überlebenskurven (n = 6) gezeigt.
Access restricted. Please log in or start a trial to view this content.
Diskussion
Für ACT-basierten Therapien ist die in-vitro-Erzeugung einer großen Anzahl von hochreaktiven Ag-spezifischen T-Zellen in vivo Reinfusion eine optimale Ansatz. Obwohl unsere in vitro-Verfahren führt funktioneller T-Zellen aus iPS-Zellen, eine große Anzahl von iPS-Zellen-abgeleiteter Zellen in der ersten vier Wochen, insbesondere in der vierten Woche. Wir schließen daraus, dass die Überlebensrate Signale von Notch durch die DL1 sowie IL-7 und Flt3L nicht ausreichen, um das Überleben...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Wir danken Dr. Shinya Yamanaka (Universität Kyoto) für die Bereitstellung von iPS-MEF-ng-20D-17-Zelllinie, Dr. Dario Vignali (St. Jude Children 's Research Hospital) zur Unterstützung der OT1-2A • pMig II Konstrukt, Dr. Juan Carlos Zuniga-Pflücker (Department of Immunology, University of Toronto) zum Abstützen des OP9 DL1-Zell-Linie, und Dr. Kent Vrana E (Institut für Pharmakologie, Penn State University College of Medicine) für die Unterstützung der Design dieser Studie. Dieses Projekt wird gefördert, unter Zuschüsse mit dem Grant Number K18CA151798 vom National Cancer Institute, der Barsumian Trust und der Melanoma Research Foundation (J. Song).
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | |
| C57BL/6J-Mäusen | Jackson Laboratory | 000664 | |
| B6.129S7-Rag1 tm1Mom / J | Jackson Laboratory | 002216 | |
| Anti-CD3 (2C11) antibody | BD PharMingen | 553058 | |
| Anti-CD28 (37,51) antibody | BD PharMingen | 553295 | |
| Anti-CD3 (17A2) antibody | BioLegend | 100202 | |
| Anti-CD4 (GK1.5) antibody | BioLegend | 100417 | |
| Anti-CD8 (53-6,7) Antikörper | BioLegend | 100714 | |
| Anti-CD25 (3C7) Antikörper | BioLegend | 101912 | |
| Einti-CD44 (1M7) Antikörper | BioLegend | 103012 | |
| Anti-CD117 (2B8) Antikörper | BioLegend | 105812 | |
| Anti-TCR-β (H57597) Antikörper | BioLegend | 109220 | |
| Anti-IL-2 (JES6-5H4) antibody | BioLegend | 503810 | |
| Anti-IFN-γ (XMG1.2) antibody | BioLegend | 505822 | |
| DMEM | Invitrogen | ABCD1234 | |
| α-MEM | Invitrogen | A10490-01 | |
| FBS | HyClone | SH3007.01 | |
| Brefeldin A | Sigma | B7651 | |
| Polybrene | Sigma | 107689 | |
| GeneJammer | Integrierte Wissenschaften | 204130 | |
| RNA-Kit | Qiagen | 74104 | |
| DNA-Kit | Qiagen | 69504 | |
| CD8 Isolation Kit | Miltenyi Biotec | 130-095-236 | |
| ACK-Lysepuffer | Lonza | 10-548E | |
| MFlt-3L | PeproTech | 250-31L | |
| mIL-7 | PeproTech | 217-17 | |
| Gelatine | Sigma | G9391 | |
| FITC-Anti-OVA-Antikörper | Rockland Immunochemikalien | 200-4233 | |
| Permeabilisierung-Puffer | BioLegend | 421002 | |
| BSA | Sigma | A7906 | |
| Formaldehyd | Sigma | F8775 | |
| 0,4 um-Filter | Millipore | ||
| MoFlo Cell Sorter | Dake Cytomation | ||
| Calibur Durchflusszytometer | BD | ||
| LSR II Durchflusszytometer | BD | ||
| Maus Restrainer | Braintree Scientific |
Referenzen
- Brenner, M. K., Heslop, H. E. Adoptive T cell therapy of cancer. Curr. Opin. Immunol. 22, 251-257 (2010).
- Hataye, J., Moon, J. J., Khoruts, A., Reilly, C., Jenkins, M. K. Naive and memory CD4+ T cell survival controlled by clonal abundance. Science. 312, 114-116 (2006).
- Seki, Y. IL-7/STAT5 cytokine signaling pathway is essential but insufficient for maintenance of naive CD4 T cell survival in peripheral lymphoid organs. J. Immunol. 178, 262-270 (2007).
- Stemberger, C. A single naive CD8+ T cell precursor can develop into diverse effector and memory subsets. Immunity. 27, 985-997 (2007).
- Siewert, C. Experience-driven development: effector/memory-like alphaE+Foxp3+ regulatory T cells originate from both naive T cells and naturally occurring naive-like regulatory T cells. J. Immunol. 180, 146-155 (2008).
- Wang, L. X., Plautz, G. E. Tumor-primed, in vitro-activated CD4+ effector T cells establish long-term memory without exogenous cytokine support or ongoing antigen exposure. J. Immunol. 184, 5612-5618 (2010).
- Hinrichs, C. S. Human effector CD8+ T cells derived from naive rather than memory subsets possess superior traits for adoptive immunotherapy. Blood. 117, 808-814 (2011).
- Alajez, N. M., Schmielau, J., Alter, M. D., Cascio, M., Finn, O. J. Therapeutic potential of a tumor-specific, MHC-unrestricted T-cell receptor expressed on effector cells of the innate and the adaptive immune system through bone marrow transduction and immune reconstitution. Blood. 105, 4583-4589 (2005).
- Yang, L., Baltimore, D. Long-term in vivo provision of antigen-specific T cell immunity by programming hematopoietic stem cells. Proc. Natl. Acad. Sci. U.S.A. 102, 4518-4523 (2005).
- Zhao, Y. Extrathymic generation of tumor-specific T cells from genetically engineered human hematopoietic stem cells via Notch signaling. Cancer Res. 67, 2425-2429 (2007).
- Boztug, K. Stem-cell gene therapy for the Wiskott-Aldrich syndrome. N. Engl. J. Med. Med, N. .E. ngl.J. . 363, 1918-1927 (2010).
- Peerani, R., Zandstra, P. W. Enabling stem cell therapies through synthetic stem cell-niche engineering. J. Clin. Invest. 120, 60-70 (2010).
- Mendez-Ferrer, S. Mesenchymal and haematopoietic stem cells form a unique bone marrow niche. Nature. 466, 829-834 (2010).
- Daley, G. Q. Towards the generation of patient-specific pluripotent stem cells for combined gene and cell therapy of hematologic disorders. Hematology Am. Soc. Hematol. Educ. Program. , 17-22 (2007).
- Boitano, A. E. Aryl hydrocarbon receptor antagonists promote the expansion of human hematopoietic stem cells. Science. 329, 1345-1348 (2010).
- Himburg, H. A. Pleiotrophin regulates the expansion and regeneration of hematopoietic stem cells. Nat. Med. 16, 475-482 (2010).
- Tanigaki, K., Honjo, T. Regulation of lymphocyte development by Notch signaling. Nature immunology. 8, 451-456 (2007).
- Zhao, T., Zhang, Z. N., Rong, Z., Xu, Y. Immunogenicity of induced pluripotent stem cells. Nature. 474, 212-215 (2011).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten