Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Différenciation dirigée des cellules souches pluripotentes induites à l'égard des lymphocytes T
Dans cet article
Résumé
Génération des lymphocytes T à partir de cellules souches pluripotentes induites (iPS) donne une approche alternative de l'utilisation de cellules souches embryonnaires à des cellules T à base d'immunothérapie. Procédé montre que, en utilisant soit In vitro Ou In vivo, les cellules iPS peuvent se différencier en lymphocytes T à la fois classiques et spécifiques de l'antigène.
Résumé
Transfert de cellules adoptif (ACT) de lymphocytes T spécifiques de l'antigène CD8 + cytotoxiques (CTL) est un traitement prometteur pour une variété de tumeurs malignes 1. CTL peut reconnaître les cellules malignes en interagissant avec des antigènes tumoraux les récepteurs de cellules T (TCR) et cytotoxines libération ainsi que les cytokines pour tuer les cellules malignes. Il est connu que moins différenciés et du centre-mémoire (appelé comme hautement réactif) CTL sont la population optimale pour l'ACT à base d'immunothérapie, parce que ces CTL ont un potentiel de prolifération élevé, sont moins enclins à l'apoptose que les cellules plus différenciées et ont un une plus grande capacité à répondre à des cytokines homéostatiques 2-7. Toutefois, en raison de difficultés dans l'obtention d'un nombre élevé de CTL ces provenant de patients, il ya un besoin urgent de trouver une nouvelle approche pour générer hautement réactifs Ag-CTL spécifiques pour le succès des thérapies à base ACT-.
Transduction TCR de la tige d'auto-renouvelablecellules de reconstitution immunitaire a un potentiel thérapeutique pour le traitement de maladies 8-10. Toutefois, l'approche pour obtenir des cellules souches embryonnaires (CSE) provenant de patients n'est pas possible. Bien que l'utilisation de cellules souches hématopoïétiques (CSH) à des fins thérapeutiques a été largement appliqué dans la clinique 11-13, CSH ont réduit la différenciation et la prolifération des capacités, et les CSH sont difficiles à développer dans la culture cellulaire in vitro 14-16. Dernières technologies de cellules iPS et le développement d'un système in vitro pour la livraison de gènes sont capables de générer des cellules iPS à partir de patients, sans aucune approche chirurgicale. En outre, comme les CES, les cellules iPS possèdent la capacité de prolifération indéfinie in vitro, et ont été montrés à se différencier en cellules hématopoïétiques. Ainsi, les cellules iPS ont un plus grand potentiel pour être utilisé dans ACT à base d'immunothérapie par rapport aux CES ou CSH.
Ici, nous présentons les méthodes pour la génération de lymphocytes Tcytes à partir de cellules iPS in vitro, in vivo et dans la programmation de l'antigène-CTL spécifiques à partir de cellules iPS pour la promotion de la surveillance du cancer immunitaire. Stimulation in vitro avec un ligand de Notch entraîne la différenciation des cellules T à partir de cellules iPS, et les résultats TCR transduction de gènes dans des cellules iPS se différencier en cellules spécifiques de l'antigène T in vivo, ce qui empêche la croissance tumorale. Ainsi, nous démontrons spécifique de l'antigène différenciation des cellules T à partir de cellules iPS. Nos études fournissent une approche potentiellement plus efficace pour générer des CTL spécifiques de l'antigène de l'ACT à base de thérapies et de faciliter l'élaboration de stratégies thérapeutiques pour les maladies.
Protocole
1. Culture cellulaire
- Préparation de cellules nourricières irradiées SNL76 / 7 (irSNL76 / 7) pour la culture.
SNL76 / 7 cellules sont généralement maintenues dans les 10% de sérum de veau fœtal (FBS) Eagle modifié par Dulbecco (DMEM) des médias.- Un récipient de culture ou le flacon est revêtue d'une solution de gélatine de 0,1% en 37 ° C; incubateur pendant 30 minutes avant la récupération SNL76 / 7 cellules de l'azote liquide.
- Lorsque SNL76 / 7 cellules atteignent la confluence, les cellules seront traitées à la trypsine off, centrifugé à 400 g pendant 5 min et remis en suspension dans un milieu frais.
- Remises en suspension SNL76 / 7 cellules seront irradiées dans un irradiateur 60 Co avec une dose de 5000 rads.
Autre méthode, les cellules SNL76 / 7 pourrait être remplacé par des fibroblastes embryonnaires de souris (MEF) et la mitomycine-inactivation pourrait remplacer l'irradiation. - Après irradiation, les cellules seront centrifugés à 400 g pendant 5 min et remises en suspension dans du diméthylsulfoxyde 10% (DMSO) tampon FBS congélation, en partie aliquotecryotubes et conservés dans l'azote liquide pour une utilisation future.
- Préparation de OP9-DL1 cellules pour la différenciation in vitro.
OP9-DL1 cellules seront généralement maintenues dans 20% de FBS α-milieu essentiel minimum (MEM) α-médias. Quand ils atteignent les cellules confluence sera scindée en une dilution 1:5. - Préparation de cellules de thymome E.G7.
E.G7 cellules thymome sera généralement maintenue dans 10% de FBS Roswell Park Memorial Institute moyennes (RPMI) -1640 médias. Quand ils atteignent jusqu'à la confluence, les cellules seront répartis dans une dilution de 1:10. - L'entretien général d'iPS et TCR-transduites cellules iPS.
- Une boîte de culture devront être revêtus d'une solution de gélatine à 0,1% à 37 ° C pendant 30 minutes avant l'ensemencement des cellules nourricières irSNL76 / 7 un jour d'avance de récupération ou de scission de cellules iPS.
- Pour cellules iPS scission, les cellules seront traitées à la trypsine off, centrifugé à 400 g pendant 5 min et remises en suspension dans 15% de FBS DMEM médias.
- IPS trypsiniséescellules seront incubées sur un plat de culture frais pendant 30 minutes à 37 ° C incubateur avant de semer sur le plat de cellules fraîches irSNL76 / 7 chargeur prérevêtue d'exclure des cellules différenciées et des cellules de desserte de résidus.
- Après incubation, 4 × 10 6 cellules seront ensemencées dans une boîte de culture 100mm.
2. Dans la programmation in vitro
- Dans le système de co-culture in vitro.
- Au jour 0, les cellules iPS 5x10 4 seront ensemencées sur une boîte de culture contenant 100mm monocouche cellulaire confluente OP9-DL1 dans 20% de FBS α-MEM médias.
- Au jour 3, les milieux de culture sera changé par des neuves.
- Au jour 5, les cellules seront traitées à la trypsine et hors centrifugé à 400 g pendant 5 min avant d'incuber sur une boîte de culture 100mm frais pendant 30 minutes à 37 ° C incubateur.
- Cellules flottantes seront recueillis et comptés, 5x10 5 cellules seront transférées à une nouvelle cultureplat contenant monocouche cellulaire confluente OP9-DL1 dans 20% de FBS α-MEM médias. Cytokine mFlt-3L (concentration finale: 5 ng / ml) sera ajoutée dans la culture.
- Au jour 8, les cellules faiblement attachées sera doucement pipeter vers le bas.
- Laver la couche d'alimentation OP9-DL1 avec 10 ml de PBS une fois de plus pour obtenir la récupération maximale des cellules iPS partiellement différenciés.
- Après la récolte des cellules de la coculture, les cellules seront centrifugés à 400 g pendant 5 min et remises en suspension dans 20% de FBS a-MEM milieux supplémentés avec du mFlt-3L (5 ng / mL) et MIL-7 (1 ng / mL).
- Les cellules seront transférés dans une plaque de culture à 6 puits recouvert d'confluentes OP9-DL1 cellules. Habituellement les cellules iPS récupérés d'une boîte de culture 100 mm sera transféré dans un puits de la plaque à 6 puits.
- Dès le premier jour 10, des milieux de culture sera changé dans tous les autres jours (20% de FBS α-MEM Supplemente médiasd avec mFlt-3L (5 ng / mL) et MIL-7 (1 ng / ml)).
- Les plaques de culture revêtues d'alimentation OP9-DL1 cellules sera changé en 4-6 jours en fonction de la croissance des cellules nourricières.
- Dans la maturation in vivo des cellules iPS partiellement différenciés.
- Le Jour 22 de coculture, les cellules iPS sera trypsinisées off, centrifugé à 400 g pendant 5 min et incubé sur un plat de culture frais à 37 ° C pendant 30 minutes.
- Cellules flottantes seront recueillis, passé à 70 en nylon filtre um à exclure amas de cellules qui pourraient causer une embolie pulmonaire chez la souris et lavé trois fois dans du PBS froid.
- Les cellules seront remises en suspension dans du PBS à une concentration de 1,5.10 7 cellules / ml.
- Les cellules seront maintenus sur la glace avant l'injection.
- Avant l'injection iv dans la veine de queue, les souris sera placé sous une lumière infrarouge pour dilater leur veine de la queue.
- Après la veine dilatation, 200 pi de suspension cellulaire ou de 3x10 6 cellules sera adoptive transféré dans une semaine 4 ans B6.129S7-RAG1 tm1Mom / J-souris grâce à son veine de la queue. Trois semaines sont autorisés pour la maturation in vivo des cellules iPS partiellement différenciés.
- Évaluation.
- Les modifications morphologiques des cellules différenciées et des taux de récupération des cellules Figure 1.
- À différents jours de coculture avec OP9-DL1 cellules, images de cellules vivantes seront prises au microscope classique.
- Taux de récupération des cellules sera calculé sur la base du nombre de cellules qui récoltées à partir de la culture.
- L'analyse par cytométrie en flux de l'évolution des marqueurs de surface. Figure 2a.
- À différents jours de coculture, les cellules seront retirés de la culture par trypsinisation et lavées avec du PBS froid avant de procéder à une coloration de surface cellulaire.
- Avant de colorer l'esprith fluorochromes différents anticorps conjugués, les cellules seront bloqués par bloqueur Fc 24G2 dans le 4 ° C pendant 20 minutes.
- Après 20 minutes de coloration dans le 4 ° C, les cellules seront lavées trois fois dans du PBS froid avant l'examen par cytométrie en flux.
- L'activation de cellules in vitro iPS différenciés Figure 2b..
- Un jour avant le dosage d'activation, précouche une plaque de 24 puits avec des anticorps anti-CD3 (concentration finale: 4 pg / ml, dans du PBS) à 4 ° C pendant la nuit.
- Le jour 22 de coculture, les cellules iPS dérivées des cellules T seront récoltées à partir de la culture et lavé avec du PBS froid avant de stimuler avec plaque à revêtement anti-CD3 et soluble dans l'anticorps anti-CD28 (concentration finale: 4 pg / mL).
- L'incubation sera effectué à 37 ° C, 5% de CO 2 incubateur pendant 40 heures puis Befeldin A sera ajouté dans la culture pendant encore 4 heures.
- À la fin de coculture, les cellules seront hardirect, lavé et bloqué par bloqueur Fc comme décrit ci-dessus. Cellules bloqués seront colorées pour des marqueurs de surface comme la chaîne Vß CD8 et TCR en utilisant des anticorps conjugués au fluorochrome.
- Après coloration de la surface cellulaire, des cellules sera fixée à l'aide de formaldéhyde à 4% et perméabilisées par l'aide du kit de perméabilisation Biolegend de.
- Après perméabilisation, molécules intracellulaires comme l'IL-2 et l'IFN-γ seront colorés en utilisant des anticorps conjugués au fluorochrome.
- Avant l'examen par cytométrie en flux de finale, les cellules seront lavées trois fois dans du PBS froid à exclure anticorps excessives.
- L'élevage en Rag-/ - souris.
- Après trois semaines de développement in vivo, Rag-/ - souris seront sacrifiées, de la rate et les ganglions lymphatiques seront retirés de la souris.
- Les cellules individuelles seront traitées par une panne mécanique. Les globules rouges seront lysées en utilisant un tampon de lyse ACK etmononucleocytes seront collectées et lavées deux fois dans du PBS froid.
- Après lavage, les cellules sont bloquées avec bloqueur Fc 24G2 à 4 ° C pendant 20 minutes et à la fin de blocage, les cellules sont colorées avec différents fluorochromes conjugués anti-CD3, anti-CD4, anti-CD8 et anti-anticorps dans TCRβ 4 ° C pendant 20 minutes.
- A la fin de la coloration, les cellules seront lavées trois fois dans du PBS froid avant l'examen par cytométrie en flux.
- Les modifications morphologiques des cellules différenciées et des taux de récupération des cellules Figure 1.
3. Dans la programmation in vivo
- Génération de construction rétrovirale.
- MSCV-IRES-dsRED (MIDR) vecteur est construit sur la base de MSCV-IRES-GFP vecteur par la substitution du gène de la GFP avec le gène dsRED.
- OT-je gène récepteur de cellules T est sous-cloné dans le vecteur MIDR de faire OT-I/MiDR construire.
- Transduction rétrovirale et tri cellulaire.
- Plat-E emballage cellules are utilisé pour générer pseudovirus qui sera utilisé pour la transduction suivant.
- 3x10 6 Plat-E cellules sont ensemencées sur un plat de 100 mm de la culture un jour avant la transfection.
- Au jour 0, Plat-E cellules transfectées avec sera OT-je MIDR plasmide en utilisant un réactif de transfection GeneJamma.
- Au jour 1, 1x10 6 cellules iPS seront ensemencés dans un puits d'un 0,1% de gélatine préalablement revêtue de 24 puits de plaque.
- Le jour 2, pseudovirus surnageant contenant du Plat-E de la culture seront rassemblées et transmises à travers un filtre 0,4 um à exclure les contaminants potentiels.
- Transduction sera effectuée sous la condition de 32 ° C centrifugeuse à 1400 rpm pendant 1 heure en présence de 5 pg / ml de polybrène.
- Après centrifugation à base de transduction, les cellules seront placés dans 32 ° C, 5% de CO 2 incubateur pendant la nuit.
- Au jour 3, répéter le jour 2 traProcédure nsduction que décrit ci-dessus. Une plaque à 6 puits seront pré-revêtu avec des cellules irSNL76 / 7 d'alimentation pour une utilisation future.
- Au jour 4, les cellules transduites iPS sera trypsinisées off, centrifugé à 400 g pendant 5 min et ensemencées sur prérevêtues cellules nourricières irSNL76 / 7.
- A la confluence, les cellules seront traitées à la trypsine off, centrifugé à 400 g pendant 5 min et traitées pour le tri cellulaire. GFP et DsRed cellules doubles positives seront triés par trieur de cellules MoFlo. Les cellules triées seront cultivés sur des cellules nourricières irSNL76 / 7 pour une utilisation future.
- Plat-E emballage cellules are utilisé pour générer pseudovirus qui sera utilisé pour la transduction suivant.
- Le transfert adoptif et le défi tumeur.
OT-je TCR transduites iPS (OT-I/iPS) cellules sont généralement maintenues sur des cellules nourricières irSNL76 / 7 tel que décrit ci-dessus.- Le jour de transfert adoptif, les cellules sont traitées à la trypsine OT-I/iPS off, centrifugé à 400 g pendant 5 min et remis en suspension dans un milieu frais.
- 30 minutes d'incubation sur un plat de culture frais à 37 ° C incubateur est nécessaire pour éliminer cellule différenciéeet des cellules nourricières résiduelles.
- A la fin de l'incubation, les cellules flottantes seront collectées et centrifugé à 400 g pendant 5 min.
- Culot cellulaire est lavé dans du PBS froid pour trois fois, et les cellules seront transmis à travers une passoire en nylon 70 microns entre les deux lavages à exclure amas de cellules (2X de filtration).
- Après le lavage, les cellules seront comptées et remises en suspension dans du PBS froid à une concentration de 1,5.10 7 cellules / ml.
- Les cellules seront maintenus sur la glace avant l'injection.
- Pour le transfert adoptif, 4-6 semaines vieilles souris femelles C57BL/6J sera utilisé. Avant l'injection iv dans la veine de queue, les souris sera placé sous une lumière infrarouge pour dilater les veines de la queue.
- Après dilatation veineuse, 200 pi de suspension cellulaire ou de 3x10 6 cellules sera adoptive transférée à travers la veine de la queue. Six semaines seront autorisés dans la maturation in vivo des OT-je TCR transduit les cellules iPS.
- Après six semaines après l'injection iv, 4x10 6 cellules E.G7 thymome sera inoculé par voie intrapéritonéale.
- E.G7 cellules thymome seront récoltées à partir de la culture et lavé trois fois dans du PBS.
- À la fin du lavage, les cellules seront en suspension dans du PBS froid à une concentration de 8x10 7 cellules / ml.
- 50 suspension cellulaire pi ou 4x10 6 cellules sera injecté dans la cavité péritonéale.
- Évaluation.
- In vitro caractérisation des OT-je TCR transduit les cellules iPS.
- Fluorescent examen microscopique des DsRed, la GFP doubles cellules positives seront effectuées sous microscope à fluorescence conventionnelle avec des cellules vivantes non fixées.
- L'intégration et expression des gènes sera analysée à la fois par PCR et RT-PCR analyses.
- Cellulaire ADN ou d'ARN seront isolés séparément à partir d'échantillons d'ADN en utilisant Qiagen ouKit d'isolement d'ARN.
- PCR et RT-PCR sera effectuée en utilisant des amorces qui reconnaissent spécifiquement la région VDJ recombiné de TCR Vβ5 chaîne.
- Le développement des cellules T et de la maturation. La figure 3a.
- A la semaine 2, 4 et 6 cellules de transfert de poste, des animaux seront sacrifiés et les nœuds de la rate, ganglions seront enlevés de l'animal.
- Suspension cellulaire unique sera effectué par une panne mécanique. Les globules rouges seront lysées en utilisant un tampon de lyse ACK et mononucleocytes seront collectées et lavées deux fois dans du PBS froid.
- Après lavage, les cellules sont bloquées avec bloqueur Fc 24G2 à 4 ° C pendant 20 minutes et à la fin de blocage, les cellules sont aliquotes et colorées avec différents fluorochromes des anticorps conjugués dans 4 ° C pendant 20 minutes.
- A la fin de la coloration, les cellules seront lavées trois fois dans du PBS froid avant le chargement sur cytomètre de flux.
- Stimulation peptidique. Figure 3b.
- Le jour 50 de défi tumeur, les animaux seront sacrifiés et les nœuds de la rate, ganglions seront enlevés d'animaux.
- Suspension cellulaire unique sera effectué par une panne mécanique. Les globules rouges seront lysées en utilisant un tampon de lyse ACK et mononucleocytes seront collectées et lavées deux fois dans du PBS froid.
- Lymphocytes T CD8 + seront isolés à l'aide de CD8 Miltenyi Biotec + kit T isolement cellulaire. Isolés cellules T CD8 + sera mélangé avec des splénocytes irradiés isolées de souris C57BL/6J naïfs dans le rapport de 1:10 et pulsé avec 0,5 mol / OVA 257-264 ml peptide pendant 40 heures. Par la suite, Brefeldine A sera ajouté dans la culture pendant encore 4 heures.
- À la fin de coculture, les cellules seront récoltées, lavées et bloquées par bloqueur Fc tel que décrit ci-dessus.
- Cellules bloqués seront colorés pour la marque de surfaceERS que CD8 et TCR Vβ5 chaîne en utilisant des anticorps conjugués au fluorochrome.
- Après coloration de la surface cellulaire, des cellules sera fixée à l'aide de formaldéhyde à 4% et perméabilisées par l'aide du kit de perméabilisation cellulaire.
- Après perméabilisation, molécules intracellulaires comme l'IL-2 et l'IFN-γ seront colorés en utilisant des anticorps conjugués au fluorochrome.
- Avant l'examen par cytométrie en flux de finale, les cellules seront lavées trois fois dans du PBS froid à exclure anticorps excessives.
- In vivo tuer dosage. Figure 3C.
- Splénocytes provenant de souris C57BL/6J naïfs seront isolés et marqués avec carboxyfluorescéine succinimidyl ester (CFSE) que les cellules cibles.
- Cellules marquées avec 5 mol / ml CFSE (hi cellules CFSE) sera pulsée avec 10 pg / ml OVA 257-264 peptide et les cellules marquées avec 0,5 mol / ml CFSE (CFSE cellules lo) ne sera pas pulsée.
- Un mélange de 2,5.10 6 cellules CFSE hi, plus 2,5.10 6 cellules CFSE lo sera transférée adoptive par injection iv en destinataire indiqué.
- Après 16 heures, les splénocytes de ces souris seront isolés et des cellules CFSE + de seront analysées par cytométrie de flux.
- Intrapéritonéale comptage des cellules tumorales. Figure 4.
Au jour 20 de défi tumeur, souris seront sacrifiées et un lavage cavité péritonéale sera réalisée en utilisant du PBS froid. Le lavage péritonéal récupéré les cellules tumorales sera compté. - Infiltrant les tumeurs des cellules T d'identification. Figure 5.
- Au stade tardif de la tumeur défi, souris seront sacrifiées et la tumeur sera retirée de la cavité péritonéale de différents groupes.
- Tumeur sera coupé en morceaux; une seule pièce sera mis dans un cryotube et placé sur la glace sèche immédiatement, l'autre moitié sera fixé dans desformaldehyde et une troisième pièce sera conservée dans climatisées RPMI-1640 pour une utilisation future.
- Coloration H & E sera effectuée selon le protocole général de formaldéhyde et fixe des échantillons enveloppés de paraffine.
- La coloration par immunofluorescence seront effectuées sur des échantillons cryoconservés.
- Tissulaire sera sectionné et conservé dans -20 ° C avant utilisation.
- Les coupes de tissus sera séché à l'air 15 minutes avant 15 minutes de fixation acétone froide.
- Après fixation, les sections seront séchés à l'air pendant 15 minutes avant 5 minutes de lavage PBS.
- Après lavage, le lieu des diapositives dans une chambre humide et couvrir la coupe de tissu avec 30 ul de 3% de BSA dans du PBS pendant 30 minutes pour bloquer la liaison non spécifique.
- A la fin du blocage, éponger le tampon de blocage et de couvrir les coupes de tissus avec un mélange 50 pi de PE-anti-TCR Vα2 anticorps et FITC-anticorps anti-OVA dilué dans BSA 3%dans du PBS.
- Incuber dans une chambre humide pendant 2 heures et à la fin de l'incubation, les lames seront lavées trois fois dans du PBS froid et monté avec un support de montage à base d'eau avant l'examen microscopique fluorescente.
- Cytométrie de flux d'infiltration tumorale des cellules T.
- Tumeur sera écrasé en suspension seule cellule et les globules rouges seront lysées par un tampon de lyse ACK.
- Après le lavage et le blocage, les cellules seront étiquetés avec différents fluorochromes anticorps conjugués qui reconnaissent spécifiquement CD8, TCR et Vα2 TCR V ß5 molécules qui ont exprimé à la surface cellulaire.
- La survie des souris. Figure 6.
Après défi tumeur, la survie des souris sera surveillée de près.
- In vitro caractérisation des OT-je TCR transduit les cellules iPS.
4. Les résultats représentatifs
CD3 et TCRβ sont utilisés comme marqueurs de Tcellules. Pour déterminer si la stimulation des cellules iPS avec le DL1 Notch ligand pourrait contribuer à la différenciation des cellules T, nous avons évalué l'expression de CD3 et + TCRβ sur iPS dérivées de cellules des cellules, et d'expression une analyse plus poussée des CD4 et CD8, ouverture de porte sur le CD3 + et + TCRβ de la population. Comme le montre ici, au jour 22, CD3 + + de TCRβ CD4 - CD8 + simples positifs (SP) des cellules T ont été générés à partir de cellules iPS in vitro. En outre, les dérivés de cellules iPS cellules SP ont pu produire de l'IL-2 et l'IFN-γ lorsqu'ils sont stimulés in vitro par une plaque revêtue de l'anti-CD3 et solubles anticorps anti-CD28 (Fig. 2), suggérant que les iPS dérivées de cellules Les cellules T sont fonctionnels.
Après le transfert adoptif à des souris bénéficiaires, la majorité des TCR gène transduit les cellules iPS ont subi la différenciation en cellules CD8 + CTL, qui ont répondu à la stimulation in vitro des peptides par soicreting IL-2 et l'IFN-γ (fig. 3). Plus important encore, le transfert adoptif de cellules transduites TCR-iPS déclenché l'infiltration de l'OVA réactifs CTL dans les tissus tumoraux et les animaux protégés de défi tumeur (fig. 5-6). Ainsi, TCR gène-transduites cellules iPS peuvent se différencier en fonctionnelles spécifiques de l'antigène CTL in vivo.

Figure 1. Morphologie de la différenciation de cellules iPS. À plusieurs jours, iPS de souris des cellules ont été co-cultivées avec des cellules OP9-DL1 en α-MEM supplémenté avec 20% de FCS et 2,2 g de bicarbonate de sodium / L en présence de 5 ng / ml mFlt3L et 1 ng / ml mIL-7 .
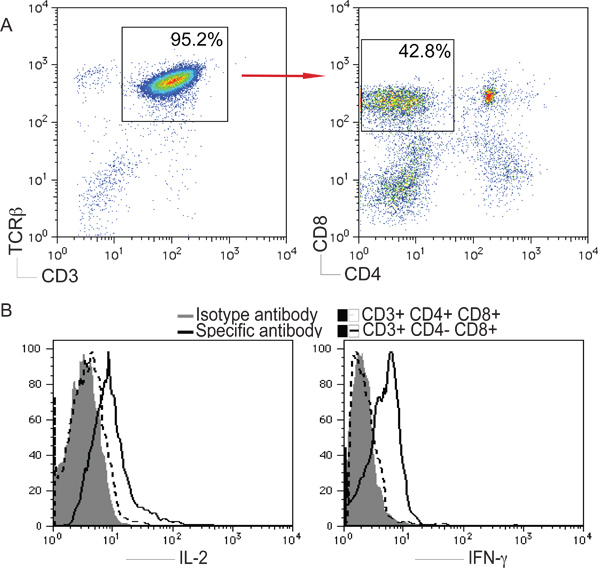
Figure 2. La différenciation des cellules T à partir de cellules iPS. Souris cellules iPS ont été co-cultivées avec des cellules OP9-DL1, comme décrit dans la figure 1. Le day 22, dérivés de cellules iPS cellules ont été isolées et analysées. A) CD4 + CD8 - ou CD4 - CD8 + après déclenchement sur CD3 + et + de TCRβ populations. B) Les cellules ont été stimulées avec plaque de revêtement anti-CD3 et soluble dans l'anticorps anti-CD28 pour 5 heures à 37 ° C à 5% de CO 2. IL-2 et IFN-γ ont été analysés par coloration intracellulaire, après déclenchement sur CD4 en direct - lymphocytes T CD8 +.
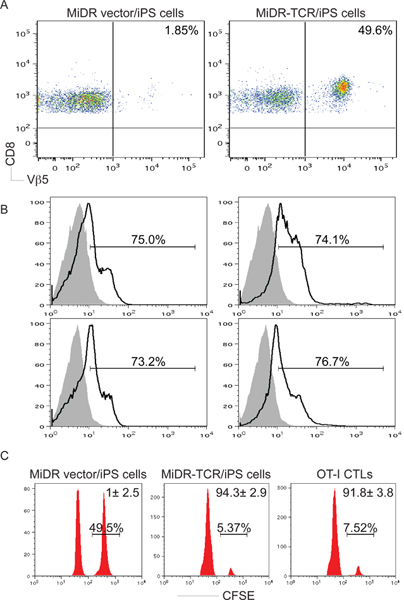
Figure 3. Antigène CD8 + spécifiques des cellules T à partir de cellules iPS de développement in vivo. OT-je TCR gène-transduites cellules iPS ont été injectés en iv à C57BL / 6. Après six à dix semaines, OVA-CD8 + spécifiques de développement Vβ5 + cellules T a été déterminée. A) CD8 + + de Vβ5 cellules T de ganglions mis en commun et de la rate ont été analysés par cytométrie en flux, après déclenchement sur CD8 populations +. B) IL-2 et IFN-γ de production (lignes sombres, les zones ombrées indiquent les contrôles isotypiques) ont été déterminées par la coloration des cytokines intracellulaires, après déclenchement sur les CD8 + + de Vβ5 populations. C) In vivo la prolifération / cytotoxicité dosage. CFSE salut (pics à droite) et lo CFSE (pics à gauche), les cellules cibles ont été puisées avec OVA 257-264 peptide et le contrôle, respectivement, et ont été injectées dans des souris dix semaines après le transfert de cellules iPS ou un jour après OT-je transfert CTL.

Transfert Figure 4. Adoptif d'OT-je TCR gène transduit les cellules iPS supprime la croissance tumorale. OT-je TCR gène-transduites cellules iPS ont été adoptive transférées chez des souris C57BL / 6. Un groupe de souris a été injecté avec de l'OVA-réactive cellules T CD8 + à partir OT-I TCR souris transgéniques, et un groupe de souris n'a pas eu de transfert de cellule. Après, soit six semaines ou le jour suivant après le transfert de cellules, les souris ont été soumises à remettre en question avec des cellules tumorales E. G7. Au jour 20, les cellules tumorales dans la cavité péritonéale ont été dénombrées.
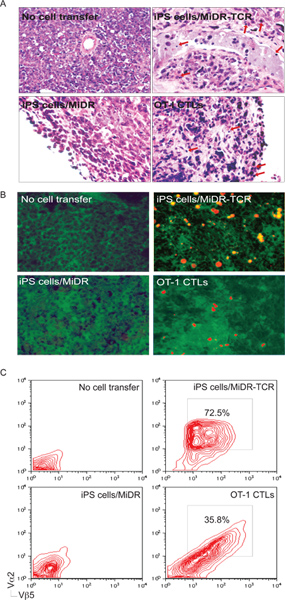
IPS Figure 5. Dérivé des cellules spécifiques de l'antigène CTL s'infiltrer dans les tissus tumoraux. Le jour de 30 à 35 après l'épreuve de tumeur, les tissus tumoraux ont été examinés pour une tumeur réactive infiltration de cellules T. A) H & E coloration. Les cellules inflammatoires infiltrées dans les tissus tumoraux (↓). B) la coloration immunohistologique. Spécifiques de l'OVA Vα2 + CTL (rouge) infiltré dans l'OVA exprimant les tissus tumoraux (vert). C) unique suspensions de cellules de tissus tumoraux ont été analysés pour l'expression de Vα2 + et + Vβ5 par cytométrie en flux, après déclenchement de la population CD8 +.

Figure 6. Le transfert adoptif d'OT-je TCR gène transduit les cellules iPS soutient la survie des souris. OVA TCR gène transduit les cellules iPS ont été adoptive transférées chez des souris C57BL / 6 qui ont été soumis à contester avec E. G7 cellules tumorales tel que décrit dans la figure. 4. La survie des souris au jour 50 a été montré par les courbes de survie de Kaplan-Meier (n = 6).
Access restricted. Please log in or start a trial to view this content.
Discussion
Pour ACT-thérapies basées sur la production in vitro d'un grand nombre de très réactifs Ag des cellules T spécifiques in vivo pour re-perfusion est une approche optimale. Bien que notre méthode in vitro donne lieu de fonctionnelles des cellules T à partir de cellules iPS, un grand nombre de cellules iPS dérivées des cellules meurent en quatre semaines, en particulier dans la quatrième semaine. Nous concluons que les signaux de survie de signalisation Notch médié ...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Nous remercions le Dr Shinya Yamanaka (Université de Kyoto) pour fournir iPS-MEF-Ng-20D-17 lignée cellulaire, le Dr Dario Vignali (recherche de l'Hôpital pour enfants St. Jude) pour supporter le OT1-2A • pMig II construction, le Dr Juan Carlos Zuniga-Pflücker (Département d'immunologie, Université de Toronto) pour supporter la lignée cellulaire OP9-DL1, et le Dr Kent Vrana E (Département de pharmacologie, Université de Penn State College of Medicine) pour aider à la conception de cette étude. Ce projet est financé, au titre des subventions avec le numéro de subvention K18CA151798 de l'Institut national du cancer, la Fiducie et de la recherche Barsumian mélanome Fondation (Song J.).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | |
| Souris C57BL/6J | Jackson Laboratory | 000664 | |
| B6.129S7-RAG1 tm1Mom / J | Jackson Laboratory | 002216 | |
| Anti-CD3 (2C11) antibody | BD PharMingen | 553058 | |
| Anti-CD28 (37,51) antibody | BD PharMingen | 553295 | |
| Anti-CD3 (17A2) antibody | BioLegend | 100202 | |
| Anti-CD4 (GK1.5) antibody | BioLegend | 100417 | |
| Anti-CD8 (53 à 6,7) antibody | BioLegend | 100714 | |
| Anti-CD25 (3C7) antibody | BioLegend | 101912 | |
| Unti-CD44 (1M7) antibody | BioLegend | 103012 | |
| Anti-CD117 (2B8) antibody | BioLegend | 105812 | |
| Anti-TCR-β (H57597) antibody | BioLegend | 109220 | |
| Anti-IL-2 (JES6-5H4) antibody | BioLegend | 503810 | |
| Anti-IFN-γ (XMG1.2) antibody | BioLegend | 505822 | |
| DMEM | Invitrogen | ABCD1234 | |
| α-MEM | Invitrogen | A10490-01 | |
| FBS | HyClone | SH3007.01 | |
| Un brefeldine | Sigma | B7651 | |
| Polybrene | Sigma | 107689 | |
| GeneJammer | Sciences intégrées | 204130 | |
| ARN kit | Qiagen | 74104 | |
| L'ADN kit | Qiagen | 69504 | |
| CD8 Kit d'isolation | Miltenyi Biotec | 130-095-236 | |
| Un tampon de lyse ACK | Lonza | 10-548E | |
| mFlt-3L | PeproTech | 250-31L | |
| mIL-7 | PeproTech | 217-17 | |
| Gélatine | Sigma | G9391 | |
| FITC anti-OVA anticorps | Immunochemicals Rockland | 200-4233 | |
| Tampon de perméabilisation | Biolegend | 421002 | |
| BSA | Sigma | A7906 | |
| Formaldéhyde | Sigma | F8775 | |
| 0,4 um filtre | Millipore | ||
| Trieur de cellules MoFlo | Cytomation Dake | ||
| Cytomètre en flux Calibur | BD | ||
| Cytomètre LSR débit II | BD | ||
| Souris de contention | Braintree scientifique |
Références
- Brenner, M. K., Heslop, H. E. Adoptive T cell therapy of cancer. Curr. Opin. Immunol. 22, 251-257 (2010).
- Hataye, J., Moon, J. J., Khoruts, A., Reilly, C., Jenkins, M. K. Naive and memory CD4+ T cell survival controlled by clonal abundance. Science. 312, 114-116 (2006).
- Seki, Y. IL-7/STAT5 cytokine signaling pathway is essential but insufficient for maintenance of naive CD4 T cell survival in peripheral lymphoid organs. J. Immunol. 178, 262-270 (2007).
- Stemberger, C. A single naive CD8+ T cell precursor can develop into diverse effector and memory subsets. Immunity. 27, 985-997 (2007).
- Siewert, C. Experience-driven development: effector/memory-like alphaE+Foxp3+ regulatory T cells originate from both naive T cells and naturally occurring naive-like regulatory T cells. J. Immunol. 180, 146-155 (2008).
- Wang, L. X., Plautz, G. E. Tumor-primed, in vitro-activated CD4+ effector T cells establish long-term memory without exogenous cytokine support or ongoing antigen exposure. J. Immunol. 184, 5612-5618 (2010).
- Hinrichs, C. S. Human effector CD8+ T cells derived from naive rather than memory subsets possess superior traits for adoptive immunotherapy. Blood. 117, 808-814 (2011).
- Alajez, N. M., Schmielau, J., Alter, M. D., Cascio, M., Finn, O. J. Therapeutic potential of a tumor-specific, MHC-unrestricted T-cell receptor expressed on effector cells of the innate and the adaptive immune system through bone marrow transduction and immune reconstitution. Blood. 105, 4583-4589 (2005).
- Yang, L., Baltimore, D. Long-term in vivo provision of antigen-specific T cell immunity by programming hematopoietic stem cells. Proc. Natl. Acad. Sci. U.S.A. 102, 4518-4523 (2005).
- Zhao, Y. Extrathymic generation of tumor-specific T cells from genetically engineered human hematopoietic stem cells via Notch signaling. Cancer Res. 67, 2425-2429 (2007).
- Boztug, K. Stem-cell gene therapy for the Wiskott-Aldrich syndrome. N. Engl. J. Med. Med, N. .E. ngl.J. . 363, 1918-1927 (2010).
- Peerani, R., Zandstra, P. W. Enabling stem cell therapies through synthetic stem cell-niche engineering. J. Clin. Invest. 120, 60-70 (2010).
- Mendez-Ferrer, S. Mesenchymal and haematopoietic stem cells form a unique bone marrow niche. Nature. 466, 829-834 (2010).
- Daley, G. Q. Towards the generation of patient-specific pluripotent stem cells for combined gene and cell therapy of hematologic disorders. Hematology Am. Soc. Hematol. Educ. Program. , 17-22 (2007).
- Boitano, A. E. Aryl hydrocarbon receptor antagonists promote the expansion of human hematopoietic stem cells. Science. 329, 1345-1348 (2010).
- Himburg, H. A. Pleiotrophin regulates the expansion and regeneration of hematopoietic stem cells. Nat. Med. 16, 475-482 (2010).
- Tanigaki, K., Honjo, T. Regulation of lymphocyte development by Notch signaling. Nature immunology. 8, 451-456 (2007).
- Zhao, T., Zhang, Z. N., Rong, Z., Xu, Y. Immunogenicity of induced pluripotent stem cells. Nature. 474, 212-215 (2011).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon