需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
制作生物功能纳米纤维的过程
摘要
准备与能力,特别是与蛋白质相互作用的官能团纤维装饰的一种有效的方法。该方法首先需要编制适当的官能团与聚合物的官能。利用电纺丝的纳米纤维制成的官能聚合物。通过共聚焦显微镜的纳米纤维与蛋白质的结合的有效性研究。
摘要
准备装饰带官能团的纳米纤维静电纺丝是一种有效的处理方法。装饰有官能团的纳米纤维可被用来研究材料的生物标志物的相互作用,即作为生物传感器与潜在的作为单分子探测器。我们已经开发出一种有效的方法制备功能性聚合物的功能模型蛋白特异性结合的能力。在我们的模型系统中,所述官能团是2,4 - 二硝基苯基(DNP),该蛋白质是抗DNP IgE(免疫球蛋白E)。的官能团的聚合物,α,ω-双[2,4 - 二硝基苯基己] [聚(环氧乙烷)-b-聚(2 - 甲氧基苯乙烯)-b-聚(环氧乙烷)](长春大成日研-PEO-P2MS-PEO-长春大成日研),是用阴离子活性聚合。在聚合中使用的双官能引发剂制备的电子转移反应的α-甲基苯乙烯和钾(镜像)的金属。 2 - 甲氧基苯乙烯单体溶液中加入第一引发剂,然后通过加入的第二单体,环氧乙烷,和最后用甲醇终止活性聚合物。的α,ω-二羟基聚合物[HO-PEO-P2MS-PEO-OH]的反应与N-2 ,4-DNP-∈ - 氨基己酸,用DCC耦合,从而导致在形成的α,ω-双[ 2,4 - dinitrophenylcaproic] [聚(环氧乙烷)-b-聚(2 - 甲氧基苯乙烯)-b-聚(环氧乙烷)](长春大成日研-PEO-P2MS-PEO-长春大成日研)。其特征在于该聚合物是通过FT-IR,1 H NMR和凝胶渗透色谱(GPC)测定。该聚合物的分子量分布窄的(1.1-1.2)和分子量大于50,000的聚合物,在本研究中使用。该聚合物为黄色粉末,可溶于四氢呋喃。一种水溶性长春大成日研-PEO-P2MS-PEO-长春大成日研/ DMEG(dimethoxyethylene乙二醇)复合物结合,并在几秒钟内达到稳态绑定与溶液中的IgE。较高分子量(不溶于水, 即约50,000)CDNP-PEO-P2MS-PEO-长春大成日研聚合物,含1%的单壁碳纳米管(SWCNT)的被加工成电活性纳米纤维(100纳米至500纳米的直径),在硅衬底上。荧光光谱表明,抗DNP IgE结合的官能团与DNP装饰纤维与纳米纤维的相互作用。这些结果表明,适当的功能化纳米纤维有希望发展生物标志物检测设备。
研究方案
1。合成α,ω-二羟基聚合物[HO-PEO-P2MS-PEO-OH]
- 组装在图1中所示的聚合反应器中。在这个实验中的反应器组成的100毫升的2 - 颈圆底烧瓶中,具有一个标准的锥形外侧接头(Chemglass),两个流量控制适配器与旋塞(Chemglass),和一个特氟隆搅拌棒。适配器A( 图1)是用来保持超高纯度(UHP)的氮气流过该系统,以防止空气和水分进入的惰性系统。适配器B( 图1),用于注入的溶剂,单体和引发剂加入反应烧瓶中。
- 作为指示剂,使用二苯甲酮,为至少6小时,在干燥的氮气下干燥200毫升的四氢呋喃(THF),在Na金属。
- 10毫升2 - 甲氧基苯乙烯,超过24小时的氢化钙干燥。
- 准备一个冷温度的浴中保持在-78℃下使用的浆料的异丙醇一个第二液态氮。
- 到聚合反应烧瓶中(参见图1)在氮气下加入25毫升的THF中,并保持反应器在氮气下,通过聚合。
- 将100毫升圆底烧瓶中制成浆料。
- 加入2毫升(0.27毫摩尔/毫升)的引发剂溶液加入反应烧瓶中。
- 注入的第一单体,2 - 甲氧基苯乙烯(4毫升)加入到反应烧瓶中。
- 使反应继续进行40分钟。
- 加入1毫升的第二单体,环氧乙烷。
- 允许聚合反应继续在室温下两天。
- 终止聚合物与盐酸(6M)/甲醇(1/20,体积/体积)。
- 净化聚合物沉淀成己烷和在真空烘箱中干燥聚合物。
- 使用NMR表征聚合物。
2。官能化的α,ω-二羟基聚合物与N-2 ,4-DNP-Ε-氨基己酸,获取功能的高分子呃,长春大成日研-PEO-P2MS-PEO-长春大成日研
- 在三颈烧瓶中,将α,ω-二羟基聚合物(0.05毫摩尔),N-2 ,4-DNP-ε-氨基己酸(0.25毫摩尔),DCC(0.15毫摩尔)和DMAP(0.005毫摩尔)和上干燥4小时的真空线。
- 提取干燥的二氯甲烷(10毫升)加入该烧瓶中。
- 释放真空在氮气下,搅拌在室温下反应12小时。
- 过滤器的反应混合物中,并通过沉淀两次到己烷和甲醇回收的聚合物。
- 干沉淀的聚合物在真空烘箱中在40℃下
- 通过FT-IR和1 H NMR确定的聚合物的结构和功能。
3。对于电纺丝制备的CDNP-PEO-P2MS-PEO-CDNP/SWCNT解决方案
- 溶解在20 w%的长春大成日研-PEO-P2MS-PEO-长春大成日研氯苯。
- 20 w%的溶解和40 w%的聚苯乙烯(MW 800,000),氯苯准备两个解决方案。较高分子量的聚苯乙烯用于越来越E聚合物链的链缠结,并获得最佳的粘度所需的静电。
- 混合制备的聚合物溶液,在3.1和3.2在一起以形成1:1和1:2比率的聚合物和1瓦特%的单壁碳纳米管(SWCNT)添加到该混合物中,并搅拌过夜均匀分布的碳纳米管。
4。静电纺丝聚合物-CNT复合材料
- 组装建立,如在图2中所示的静电纺丝。在该图的右手侧的是格拉斯曼高的电压源。它的旁边是一个铁支架上的硅晶片连接。左边是另一个铁支架上安装的注射器和它背后的是灯的可视化的程序,因为它的进展。
- 使用的皮下注射器,撤回的CDNP-PEO-P2MS-PEO-CDNP/polystyrene/SWCNT混合物少量(约1ml),并装入的铁支架上的皮下注射器。
- 硅晶片安装编对面从注射器固定在10厘米的距离,和接地的高电压源的剪辑被连接到它。
- 轴承的高电压被施加到注射器上的针的夹子连接,压下柱塞一点点(暂停的针尖上的下降),并在这一点上,静电是准备。
- 电源的高电压源上,并调整至10 kV的电压表。根据在复合材料中的聚合物的性质,可以更高的电压必需的,特别是如果期望的纳米纤维的直径在几百纳米下。
- 的卸载硅晶片和干燥器中过夜,完全干燥的地方。
5。表征纳米纤维
- 初始成像的纳米纤维,是用光学显微镜观察该纤维的整体立体。
- 利用扫描电子显微镜观察更精细的细节,如形态,直径,平均孔径等
- 携带出进一步的影像,用原子力显微镜观察的3-D的纤维,等地形
6。纳米纤维与抗-DNP IgE的蛋白质结合的特异性
- 准备4微克/升荧光标记,FITC-荧光素异硫氰酸酯的免疫球蛋白E(IgE抗体)的溶液在PBS-BSA(磷酸盐缓冲液,牛血清白蛋白)溶液。
- 将一小片硅晶片上有一个MatTek以及盖玻片的纳米纤维。孵育1小时在该溶液中的纳米纤维。到硅晶片上,轻轻移液,10微升的IgE溶液孵育过程。
- 培养结束后,除去未结合的IgE与PBS-BSA缓冲液洗涤样品三次。被分配的PBS溶液轻轻地放在的壁的MatTek培养皿,以避免喷到的纳米纤维直接在缓冲。用手轻轻的涡流盘,分配缓冲溶液的纳米纤维。用吸管小心地取出缓冲和重新泥炭这2次以上。
- 有关的控制,在相同条件下孵育荧光标记的IgG(非特异性为DNP)的纳米纤维在。
- 可视化的结合纤维与IgE结合激光共聚焦显微镜观察。我们的研究中,显微镜用的是徕卡与63X镜头聚焦TCS SP2。
7。电流 - 电压行为的纳米纤维
- 将两个微型定位敏感吉时利6430数字源表像一个非常低的电流源。在图3中示出的设定的确定的当前电压行为。此图显示了探针台,用于确定初始的纳米纤维的IV特性。它是由Bausch和Lomb公司MicroZoom显微镜,真空夹头阶段,和四个Micropositioners用于探测。在右上方使用的Agilent 34405A数字万用表测量电压,下面是吉时利6430亚fA程控源表用于输入到纤维的低电流源。
- 微定位的探针臂安装在纤维垫的两侧接触纤维的提示。
- 另外两个微定位连接到数字万用表,安装探头武器之间的其他两个和土地纤维毡的提示。确保了四点建议,尽可能共线。
- 输入不同量的电流从吉时利(通常在纳安范围)。
- 测量两端的电压降的外提示,为每一个源的电流的大小。
- 绘制这些值将指示的设备的类型,纤维薄毡的作用类似。
8。代表性的成果
功能高分子
“>方法合成α,ω-双[2,4 - 二硝基苯基己] [聚(环氧乙烷)-b-聚(2 - 甲氧基苯乙烯)-b-聚(环氧乙烷)](长春大成日研-PEO- P2MS-PEO-长春大成日研)示出在图4中。1的官能团的聚合物的结构,通过FT-IR( 图5)和500 MHz 1 H-NMR光谱( 图6)确认。红外光谱(FT-IR),示出的完全消失的-OH的宽吸收约3,500 cm -1处表示定量官能与长春大成日研组。这也证实了由图6中所示的NMR谱。使用的集成的NMR谱中的峰,它被确定在长春大成日研-PEO定量P2MS-PEO-长春大成日研聚合物的官能化。纳米纤维
在图7中,通过静电长春大成日研-PEO-P2MS-PEO-长春大成日研/聚苯乙烯/氯苯的SWCNT从获得的导电性纳米纤维毡是sh自己的。共聚焦显微镜获得的图像表明,蛋白质的IgE结合在纤维表面上与DNP。3这是一个指示的特异性结合的静电DNP-IgE抗体聚合物朝向。的光的强度是作为荧光标记的蛋白质的纳米纤维上的IgE的存在的一个指标。
图8a是一个通过该方法获得的纳米纤维和图8b示出了这个特定的纳米纤维的尺寸大约是150 nm直径的AFM(原子力显微镜)图像。通过这一过程,在100-700纳米之间的纤维得到。在这时间,它是具有挑战性的,准备纤维与一个特定的空间。这是与由其他组所观察到的相一致。4 图9示出了 SEM图像长春大成日研-PEO-P2MS-PEO-长春大成日研/聚苯乙烯/ SWCNT的纳米纤维,纳米纤维的直径为200至300毫微米之间。有三个SEM图像nanofibeRS在不同的放大倍数。研究的三个图像示出的纤维的形态是直链和串珠。总体目标是准备的纤维大多是线性的。 图10显示了长春大成日研-PEO-P2MS-PEO-长春大成日研/聚苯乙烯/单壁碳纳米管制备的纳米纤维地垫的IV曲线。图中显示的电阻(欧姆)的行为。当抗原结合的纳米纤维,这种电阻变化的一个特点,这表明功能性纤维的单分子检测传感器中的活性成分具有潜在的应用,我们希望看到的纤维毡的IV特性的变化。
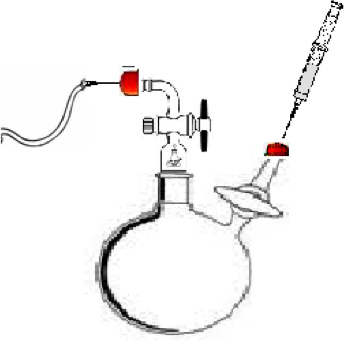
图1合成的α,ω-二羟基聚合物的聚合反应器中进行。 A)的注入点的流动UHP气体氮。 B)的溶剂,单体和引发剂的注射点。 C)将反应容器。

图2。设置用于电使用的格拉斯曼高电压源。

图3。设置用于测量IV地块使用亚fA程控源表(吉时利)。
图4的A)。制备OH-PEO-P2MS的PEO-OH的聚合物的合成方法。 B)的官能化的α,ω-二羟基[聚(环氧乙烷)-b-聚(2 - 甲氧基苯乙烯)-b-聚(环氧乙烷)]。
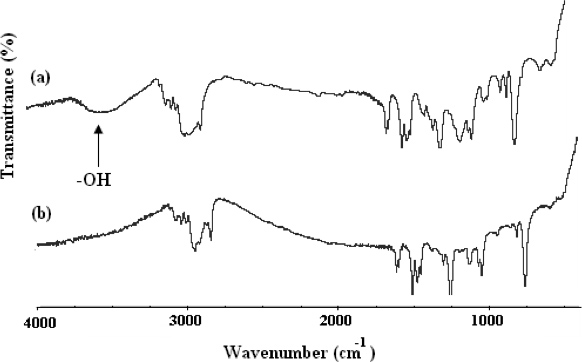
图5的 FT-IR光谱(A)的OH-PEO-P2MS-PEO-OH,长春大成日研-PEO-P2MS-PEO-长春大成日研和(B)的长春大成日研-PEO-P2MS-PEO-长春大成日研的前体。
图6,500 MHz的质子NMR长春大成日研-PEO-P2MS-PEO-长春大成日研。
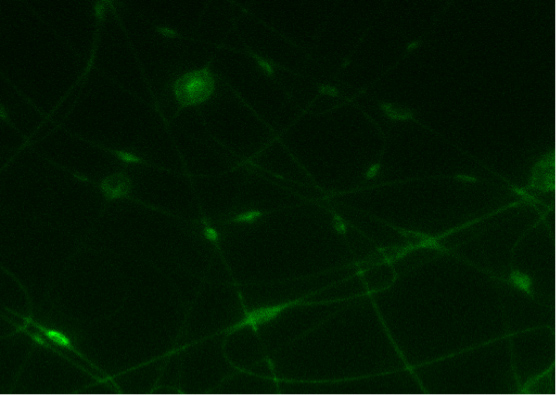
图7。A)结合FITC-IgE的形象与长春大成日研-PEO-P2MS-PEO-长春大成日研纤维静电从氯苯。 B)的控制(与IgG的纳米纤维)的共聚焦显微镜图像。

图8 A)的AFM图像,长春大成日研-PEO-P2MS-PEO-长春大成日研纤维静电从氯苯和B)AFM更新即在图5a所示的一个光纤尺寸。

图9。长春大成日研-PEO-P2MS-PEO-长春大成日研/聚苯乙烯/单壁碳纳米管的纳米纤维的SEM图像。
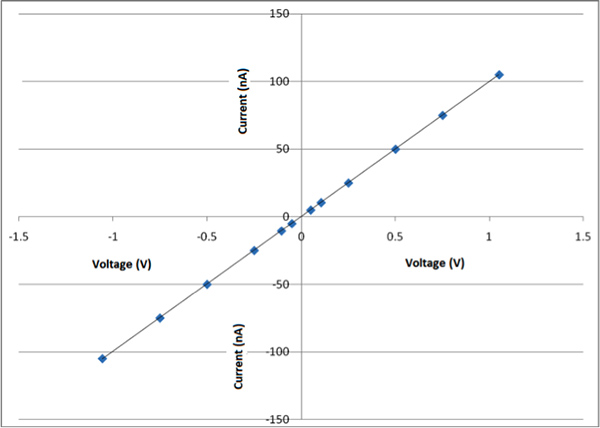
图10。长春大成日研-PEO-P2MS-PEO-长春大成日研/聚苯乙烯/单壁碳纳米管制备的纳米纤维垫情节。
讨论
在这份报告中,我们提出了一个强大的生物功能性纳米纤维的制备方法。的纳米级纤维的装饰的官能团,这是特定的模型蛋白。的过程和方法,在这个通信报告是一般性质,可用于制备装饰与任何所需的官能团的纳米纤维。的阴离子活性聚合是强大的方法来合成控制的聚合物结构,共价键连接到任何数目的有趣的功能或官能团,这是特定于特定的生物标志物的兴趣。阴离子活性聚合以及建立的单?...
披露声明
没有利益冲突的声明。
致谢
这项工作是由美国国家科学基金会HRD-0630456,NSF CREST计划和美国国家科学基金会是DMR-0934142。
材料
| Name | Company | Catalog Number | Comments |
| 的试剂的名称 | 公司 | 目录编号 | |
| 金属钠 | Sigma-Aldrich公司 | 282065 | |
| 二苯甲酮 | Sigma-Aldrich公司 | 239852 | |
| 2 - 甲氧基 | Sigma-Aldrich公司 | 563064 | |
| 四氢呋喃 | Sigma-Aldrich公司 | 178810 | |
| 氯苯 | Sigma-Aldrich公司 | 319996 | |
| 单壁碳纳米管 | Sigma-Aldrich公司 | 704113 | |
| 聚苯乙烯 | Sigma-Aldrich公司 | 81416 | |
| 硅片 | 硅任务国际 | 720200 | |
| 蔡司FESEM | 卡尔·蔡司公司 | 超60 | |
| Probestation二博士伦MicroZoom的高性能显微镜 | 博士伦罗MB | ||
| 徕卡扫描共聚焦系统 | 徕卡显微系统 | TCS SP2 | |
| 亚fA程控源 | 吉时利仪器公司 | 6430 | |
| 自动量程数字万用表 | 吉时利仪器公司 | 175A | |
| 注射泵 | Chemyx公司 | 融合200 | |
| 蔡司光学显微镜 | 卡尔·蔡司公司 | 蔡司/ Axiotech |
参考文献
- Sannigrahi, B., Sil, D. Synthesis and Characterization of α,ω-bi[2,4-dinitrophenyl (DNP)] poly(2-methoxystyrene) Functional Polymers. Preliminary Evaluation of the Interaction of the Functional Polymers with RBL Mast Cells. Journal of Macromolecular Science, Part A. 45, 664-671 (2008).
- Gordon, K., Sannigrahi, B. Synthesis of Optically Active Helical Poly(2-methoxystyrene). Enhancement of HeLa and Osteoblast Cell Growth on Optically Active Helical Poly(2-methoxystyrene) Surfaces. Journal of Biomaterials Science. 2, 2055-2072 (2009).
- Baird, E. J., Holowka, D. Highly Effective Poly(Ethylene Glycol) Architectures for Specific Inhibition of Immune Receptor Activation. Biochemistry. 2, 12739-12748 (2003).
- Ramakrisna, S., Fugihara, K., Lim, W. -. E., Ma, Z. . Introductions to Electrospinning and Nanofibers. , (2005).
- Kameoka, J., Craighead, H. G. Fabrication of Oriented Polymeric Nanofibers on Planar Surfaces by Electrospinning. Applied Physics Letters. 83, 371-3773 (2003).
- Ramakrishna, S., Lala, N. L. Polymer Nanofibers for Biosensor Applications. Topics in Applied Physics. 109, 377-392 (2007).
- Reuven, D., Sil, D. Archetypical Conductive Polymer Structure for Specific Interaction with Proteins. Journal of Macromolecular Science Part A: Pure and Applied Chemistry. , (2012).
- Ogunro, O., Karunwi, K. Chiral Asymmetry of Helical Polymer Nanowire. The Journal of Physical Chemistry Letters. 1, 704-707 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。