需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
的斑马鱼胚胎神经上皮通透性的测定
摘要
我们描述了现场的整个动物的胚胎斑马鱼脑通透性的定量测量。该技术分析神经管的管腔内保留脑脊液和不同分子量的分子的能力,和它们的运动量化满分心室。此方法是非常有用的用于确定在上皮通透性和成熟发展和疾病过程中的差异。
摘要
脑脑室系统脊椎动物之间是保守的,并且是由一系列互连的空腔称为脑脑室,大脑发育的早期阶段期间形成的,并保持整个动物的生命。被发现在脊椎动物脑脑室系统和心室神经管形成后,当中央管腔内充满脑脊液(CSF)1,2。 CSF是一种富含蛋白质的液体,是必不可少的正常的大脑发育和功能3-6。
在斑马鱼中,脑室通胀开始于受精后约18小时(HPF),神经管闭合后。多个进程相关联的,与脑室形成,包括一个神经上皮形成,形成紧密连接,调节渗透性和脑脊液生产。我们发现,中Na,K-ATP酶活性,影响所有这些过程所需的脑室通胀ES 7.8,而紧密连接蛋白5A是必要的紧密连接形成9。此外,我们发现,“放松”的胚胎神经上皮,通过抑制肌球蛋白,与脑室通胀。
探讨在斑马鱼脑室通胀调节的透气性,我们开发了一个心室染料保持试验。此方法使用在活的斑马鱼胚胎,在我们的实验室10以前开发的技术,以荧光标记的脑脊液脑室注射。作为荧光染料穿过脑室和神经上皮胚胎,然后随着时间的推移成像。染料前端的距离移动远离基底(非管腔)侧,随着时间的推移的神经上皮被量化和是神经上皮渗透性的量度( 图1)。我们观察到,70 kDa的和更小的染料会移动通过神经上皮和可detecte的D 24高倍视野( 图2)以外的胚胎斑马鱼脑。
该染料保留检测可以用于分析在各种不同的遗传背景中的神经上皮通透性,在开发过程中在不同的时间,和环境扰动后。这也可能是有用的检查病理积累的CSF。总体而言,这种技术可以让调查人员分析的作用和调节的透气性,在开发过程中和疾病。
研究方案
1。准备显微注射
- 准备显微注射针拉毛细管萨特仪器针拔出器。
- 负载微量注射针用荧光染料(FITC-葡聚糖)。
- 显微操作显微注射设备上安装针。
- 使用产钳,宽度约2微米,小心地打破显微注射针,但是,这将取决于你的微量注射器设置。对于我们的显微注射针,这对应于从不会弯曲的前端的针的第一区域。
- 测量在油中的液滴大小,调整喷射时间和压力,从而使每次注射提供1 NL。哈佛设备微量注射器的示例设置为:P余额= 1.4,P出= 1.4磅磅,P = 22.9的PSI,P清晰= 67.8磅注入与注射时间为0.4到0.7秒。我们使用这些设置的针的直径大约是2微米。不过,设置特定的微量注射器,并改变一个ccording针直径。
2。准备胚胎
- 外套2菜肴与在水中的1%琼脂糖的每个条件,用1-200微升的移液管尖端到琼脂糖戳孔,和除去琼脂糖插头。填写菜与胚胎媒体。
- 使用钳,dechorionate的胚胎,在立体显微镜下为18 HPF或以上。胚胎都在上演金梅尔等。11。
- dechorionated胚胎转移到第一琼脂糖凝胶涂层的菜。
- 若要麻醉胚胎,三卡因(0.1毫克/毫升)添加到培养皿中,直到胚胎停止移动(韦斯特12根据)。
3。脑室注射
- 东方胚胎,所以你看他们的背侧把尾部的胚胎成孔。如果你的微操作机器人是在右边,然后将胚胎,使前脑的左侧和后脑的权利。
- 在无线定位针目标点的后脑心室。
- 小心刺破屋顶板的后脑心室的蛋黄( 图1A),千万不要去通过深入的大脑。
- 确保染料填充的整个长度的脑室入脑室注射1-2 NL的荧光染料。
- 第二琼脂糖凝胶涂层菜充满胚胎媒体的移植胚胎,重新麻醉在2.4。
- 立刻开始,如在第4所述的成像,以获得时间零点图像。
4。成像
- 东方胚胎的尾巴孔与3.1。
- 在解剖显微镜使用一个明场背图像传输和荧光灯。不同的胚胎成像之间的放大倍率保持恒定。这样就可以直接使用图像J(5.2-6)进行分析比较。
- 不动,胚胎,显微镜或菜,取相应的荧光图像。
- 重复为每个胚胎在期望的时间点。
5。量化染料运动
- 合并明场和荧光图像在Photoshop如前所述由Gutzman和西伯10。
- 测量距离的染料Image J软件可在http://rsbweb.nih.gov/ij/前移动。
- 打开合并后的文件图像J和使用直线工具绘制一条线从的前脑铰链点,染前在10〜20°角从神经上( 图1A)。这一区域被选择,因为它是第一和最引人注目的站点的染料泄漏出来的野生型神经上皮。
- 选择测量工具来计算线路长度。
- 每个时间点重复上述步骤。
- 计算净距离动议染料前端减去从其他时间点t = 0时的距离随着时间的推移。
- 剧情上图。
6。代表性的成果
在的的神经上皮渗透性测定使用野生型胚胎获得的结果的一个例子示于图1B-D。为了准确区分磁导率,它是有用的,以测试染料与不同分子weightsto识别的尺寸,是在野生型或控制胚胎( 图2),只是稍微漏。这允许鉴定遗传突变体或环境条件下,无论是增加或减少的磁导率( 图1D,分别为绿色和红色线)。对于24 HPF斑马鱼神经上皮,70 kDa的FITC葡聚糖泄漏慢慢超过2小时,而2000 kDa的不和10kDa几乎立刻泄漏出来。因此,70 kDa的分子量是理想的,以确定条件,增加和减少神经上皮通透性。
,如果针想念的心腔,荧光瓦特外脑病出现在t = 0(一个例子Gutzman和西伯,2009年10月 )。由于注入的染料没有最初载大脑内的,并没有明确作出结论有关运动的染料和渗透率的neuropeithelium的,应该被丢弃这些胚胎。
最后,如果的胚胎有小的脑室或非膨胀的脑室,预喷射之前可以先完成荧光染料注射用生理盐水溶液的心室。这膨胀心室发出后续的可视化时更容易与荧光染料注入脑室。必须进行适当的控制,以确定是否注射生理盐水,扰乱了正常的神经管发育。
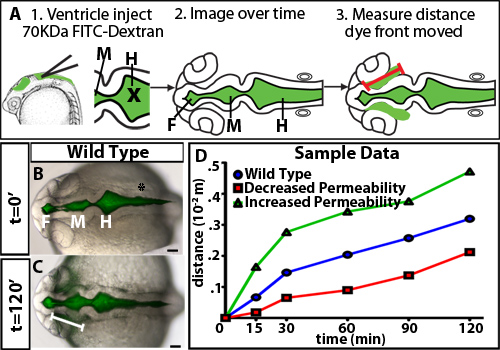
图1。时间过程的不同分子量的染料 (A)的实验图。第一,荧光染料注入脑室。 X =用于注射针的位置。下一步的背拍摄的图像随着时间的推移。最后,移动的距离测量铰接点(由一个红色的线)表示的染料从前方的前脑。 (BC)22 HPF(T = 0分,B)和24 HPF(T = 120分钟,C)明场和荧光背的影像合并。白线表示的染料前脑脑室前部的距离。 (D)假设的样品渗透率数据。蓝=野生型或控制的,红色样品的渗透率下降的相对控制,绿色=采样与通透性增加,相对控制。
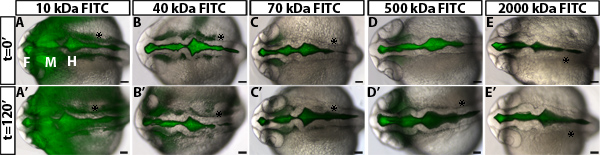
图2。测量神经上皮渗透性不同分子量的染料 (AE)背合并的明视野图像和荧光图像22高倍视野野生型胚胎在t = 0分钟后,用FITC-D注射EXTRAN以下分子量:10 kDa的(A),(B)40 kDa的,70 kDa的(C),500 kDa的(D)和2,000 kDa的(E)。 (A'-E')同胚(AE),在t = 120分钟,24 hpf时。前方左。 F =前脑,M =中脑,:H =后脑的。 Asterisk的耳朵。
讨论
我们证明了量化的活体胚胎斑马鱼脑作为给定的分子量的确定注入的染料的渗透性的能力。我们的观察斑马鱼胚胎神经上皮差异透性的染料不同的分子量,表明了染料的移动经由间通透性。但是,我们不能排除的可能性的跨细胞所观察到的磁导率的贡献。这种技术可以应用于任何其他的管状结构,只要管的内侧和外侧的,可以看出,可以注射和管腔。然而,确定了理想的分子量为其他器官将需要?...
披露声明
没有利益冲突的声明。
致谢
这项工作是由美国国家精神卫生研究所和美国国家科学基金会的支持。许多有益的讨论和建设性的批评,的Olivier Paugois的专家鱼的饲养的西伯实验室成员的特别感谢。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | |
| 葡聚糖,荧光素,阴离子,赖氨酸绝不破裂 | Invitrogen公司 | D7136,D7137,D1822,D1820,D1845 | |
| 三卡因粉 | 西格玛 | A5040 | |
| 毛细管 | FHC公司 | 30-30-1 |
参考文献
- Harrington, M. J., Hong, E., Brewster, R. Comparative analysis of neurulation: first impressions do not count. Mol. Reprod. Dev. 76, 954-965 (2009).
- Lowery, L. A., Sive, H. Strategies of vertebrate neurulation and a re-evaluation of teleost neural tube formation. Mech. Dev. 121, 1189-1197 (2004).
- Salehi, Z., Mashayekhi, F. The role of cerebrospinal fluid on neural cell survival in the developing chick cerebral cortex: an in vivo study. Eur. J. Neurol. 13, 760-764 (2006).
- Martin, C. Early embryonic brain development in rats requires the trophic influence of cerebrospinal fluid. Int. J. Dev. Neurosci. 27, 733-740 (2009).
- Lehtinen, M. K. The cerebrospinal fluid provides a proliferative niche for neural progenitor cells. Neuron. 69, 893-905 (2011).
- Gato, A. Embryonic cerebrospinal fluid regulates neuroepithelial survival, proliferation, and neurogenesis in chick embryos. Anat. Rec. A. Discov. Mol. Cell Evol. Biol. 284, 475-484 (2005).
- Lowery, L. A., Sive, H. Totally tubular: the mystery behind function and origin of the brain ventricular system. Bioessays. 31, 446-458 (2009).
- Lowery, L. A., Sive, H. Initial formation of zebrafish brain ventricles occurs independently of circulation and requires the nagie oko and snakehead/atp1a1a.1 gene products. Development. 132, 2057-2067 (2005).
- Zhang, J. Establishment of a neuroepithelial barrier by Claudin5a is essential for zebrafish brain ventricular lumen expansion. Proc. Natl. Acad. Sci. U.S.A. 107, 1425-1430 (2010).
- Gutzman, J. H., Sive, H. Zebrafish brain ventricle injection. J. Vis. Exp. , (2009).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev. Dyn. 203, 253-310 (1995).
- Westerfield, M., Sprague, J., Doerry, E., Douglas, S., Grp, Z. The Zebrafish Information Network (ZFIN): a resource for genetic, genomic and developmental research. Nucleic Acids Research. 29, 87-90 (2001).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。