Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ein Assay zur Durchlässigkeit des Zebrafisch-Embryos Neuroepithel
In diesem Artikel
Zusammenfassung
Wir beschreiben eine Live ganze Tier quantitative Messung für die Durchlässigkeit des embryonalen Zebrafischgehirn. Die Technik analysiert die Fähigkeit, Zerebrospinalflüssigkeit und Moleküle unterschiedlichen Molekulargewichts in den neuronalen Schlauchlumen behalten und quantifiziert ihre Bewegung aus der Ventrikel. Diese Methode ist nützlich zur Bestimmung von Unterschieden in epithelialen Permeabilität und Reifung in der Entwicklung und Krankheit.
Zusammenfassung
Das Gehirn ventrikuläre System unter den Wirbeltieren konserviert und besteht aus einer Reihe von miteinander verbundenen Hohlräumen Hirnkammern genannt, die in den frühesten Stadien der Entwicklung des Gehirns bilden und während der gesamten Lebensdauer des Tieres aufrechterhalten zusammengesetzt. Das Gehirn ventrikuläre System ist in Wirbeltieren, und die Ventrikel zu entwickeln, nachdem Neuralrohr Formation, wenn das zentrale Lumen mit Zerebrospinalflüssigkeit (CSF) 1,2 ausfüllt. CSF ist eine proteinreiche Flüssigkeit, die wichtig für die normale Entwicklung des Gehirns und Funktion 3-6 ist.
Im Zebrafisch, beginnt Hirnventrikel Inflation bei etwa 18 Stunden nach der Befruchtung (HPF), nachdem das Neuralrohr ist geschlossen. Mehrere Prozesse sind mit Hirnventrikel Bildung, einschließlich Bildung einer Neuroepithels, tight junction Formation, die Durchlässigkeit und CSF-Produktion reguliert verbunden. Wir haben gezeigt, dass die Na, K-ATPase für Hirnventrikel Inflation erforderlich ist, beeinflussen alle diese Verfahrenes 7,8, während Claudin 5a notwendig tight junction Bildung 9 ist. Darüber hinaus haben wir gezeigt, dass "Entspannung" der embryonalen Neuroepithels, über eine Hemmung der Myosin, ist mit Hirnventrikel Inflation verbunden.
Um die Regulation der Permeabilität im Zebrafisch Hirnventrikel Inflation zu untersuchen, entwickelten wir eine ventrikuläre Farbstoffretention Assay. Diese Methode verwendet Hirnventrikel Injektion in einem lebenden Zebrafisch-Embryos, eine Technik zuvor in unserem Labor 10 entwickelt, um Fluoreszenz-Markierung der Liquor. Embryonen werden dann im Laufe der Zeit den fluoreszierenden Farbstoff bewegt sich durch die Hirnkammern und Neuroepithel abgebildet. Der Abstand der Farbstoff vorne bewegt sich weg von der basalen (nicht-luminalen) Seite des Neuroepithel über die Zeit quantifiziert und ist ein Maß für neuroepithelialen Permeabilität (Abbildung 1). Wir beobachten, dass Farbstoffe 70 kDa und kleiner wird durch die Neuroepithel bewegen und kann detected außerhalb des embryonalen Zebrafischgehirn bei 24 hpf (Abbildung 2).
Dieser Farbstoff Retention Assay kann verwendet werden, um neuroepithelialen Permeabilität in einer Vielzahl von unterschiedlichen genetischen Hintergründen zu analysieren, zu verschiedenen Zeiten während der Entwicklung, und nach ökologischen Störungen. Es kann auch nützlich sein bei der Prüfung pathologischen Anhäufung von CSF. Insgesamt ermöglicht diese Technik die Ermittler, um die Rolle und Regulierung der Durchlässigkeit während der Entwicklung und Krankheit zu analysieren.
Protokoll
Ein. Vorbereitung für Mikroinjektion
- Bereiten Mikroinjektion Nadeln durch Ziehen Kapillarrohre mit Sutter Instrumente Nadel abziehen.
- Last Mikroinjektionsnadel mit fluoreszierenden Farbstoff (FITC-Dextran).
- Montieren Nadel auf Mikromanipulator und Mikroinjektionsvorrichtung.
- Vorsichtig brechen Mikroinjektionsnadel mit einer Pinzette auf ungefähr 2 um in der Breite, wird dies jedoch abhängig von Ihren Mikroinjektor Setup. Für unsere Mikroinjektion Nadeln, entspricht dies dem ersten Bereich der Nadel von der Spitze, die sich nicht verbiegt.
- Messen Tropfengröße in Öl, Einstellen Einspritzzeit und Druck, so daß jeder Injektion 1 nl liefert. Beispiel Einstellungen für Harvard Apparatus Mikroinjektor sind: P balance = 1,4 psi, P out = 1,4 psi, injizieren P = 22,9 psi, P clear = 67,8 psi mit einer Einspritzzeit von 0,4 bis 0,7 sec. Der Durchmesser unserer Nadel mit diesen Einstellungen ist etwa 2 um. Allerdings werden die Einstellungen Mikroinjektor spezifisch sein, und variieren einach Nadel Durchmesser.
2. Vorbereitung der Embryonen
- Coat 2 Gerichte mit 1% Agarose in Wasser für jede Bedingung, poke Löcher in Agarose mit einer 1-200 ul Pipettenspitze und entfernen Agarose Stecker. Füllen Sie Gerichte mit Embryo Medien.
- Mit einer Pinzette, dechorionate Embryonen 18 hpf oder älter unter einem Stereomikroskop sind. Embryonen werden nach Kimmel et al inszeniert. 11.
- Übertragen dechorionated Embryonen in erster Agarose-beschichteten Gericht.
- Embryonen zu betäuben, fügen Tricain (0,1 mg / ml) in die Schale, bis Embryonen bewegen Anschlag (hergestellt nach Westerfield 12).
3. Einspritzen der Hirnkammern
- Orient Embryonen, so dass Sie werden mit ihrem dorsalen Seite suchen, indem Sie den Schwanz des Embryos in das Loch. Wenn Ihr Mikromanipulator ist auf der rechten, dann den Embryo, so dass das Vorderhirn auf der linken Seite und Hinterhirn nach rechts.
- Position Nadel widest Punkt Hinterhirn Ventrikels.
- Sorgfältig durchbohren Dachblech Rautenhirn Ventrikel sicher zu sein, um nicht durch die Tiefe des Gehirns in den Dotter (1A) zu gehen.
- Injizieren 1-2 nl der Fluoreszenzfarbstoff in die Ventrikel sicherstellen der Farbstoff erfüllt die ganze Länge der Hirnkammern.
- Übertragen Embryonen in die zweite Agarose-beschichtete Schale mit Embryo Medien befüllt und wieder zu betäuben wie in 2.4 beschrieben.
- SOFORT starten Bildgebung, wie in Abschnitt 4 beschrieben, um einen Zeitpunkt Null Bild zu bekommen.
4. Imaging
- Orient Embryonen mit ihren Schwanz im Loch wie in 3.1 beschrieben.
- Verwenden Sie ein Binokular mit beiden gesendeten und Fluoreszenzlicht eine Hellfeld dorsalen Bild aufzunehmen. Halten Sie die Vergrößerung konstant zwischen Bildgebung von verschiedenen Embryonen. Dies ermöglicht den direkten Vergleich von Analysen mit Bild J (5,2-6).
- Ohne Bewegung des Embryos, Mikroskop oder Teller, nehmen einentsprechendes Fluoreszenzbild.
- Wiederholen Sie dies für jeden Embryo gewünschten Zeitpunkten.
5. Quantifizierung von Dye Movement
- Merge Hellfeld und Fluoreszenz-Bilder in Photoshop wie zuvor von Gutzman und Sive 10 beschrieben.
- Messen Sie den Abstand der Farbstoff vor bewegt sich in Image J Software verfügbar http://rsbweb.nih.gov/ij/ .
- Offene zusammengeführte Datei in Image J und verwenden Tool, um eine Zeile aus dem Vorderhirn Scharnier-Punkt nach vorne zu einem 10-20 °-Winkel vom Neuroepithel (Abbildung 1A) färben ziehen. Diese Region wurde ausgewählt, weil es das erste und auffälligste Website des Farbstoffs Auslaufen des Wildtyp Neuroepithel ist.
- Wählen Messwerkzeug zur Länge der Leitung berechnen.
- Wiederholen Sie für jede Zeit-Punkt.
- Berechnen net Abstand der Farbstoff vor der Zeit bewegt durch Subtrahieren Abstand zum Zeitpunkt t = 0 von anderen Zeitpunkten.
- Plot aufgraph.
6. Repräsentative Ergebnisse
Ein Beispiel der Ergebnisse in einem Test unter Verwendung neuroepithelialen Permeabilität Wildtyp Embryos gewonnen ist in 1B-D gezeigt. Um genau zu unterscheiden Permeabilität, ist es nützlich, Farbstoffe mit unterschiedlichen molekularen weightsto testen identifizieren eine Größe, die nur geringfügig undicht in Wildtyp oder Kontrolle Embryonen (Abbildung 2). Dies ermöglicht die Identifizierung von genetischen Mutanten oder Umweltbedingungen, dass entweder Anstieg oder Abnahme Permeabilität (Figur 1D, grünen und roten Linien jeweils). Für den 24 hpf Zebrafisch Neuroepithel, 70 kDa FITC Dextran Lecks langsam über 2 Stunden, während 2.000 kDa nicht und 10 kDa fast sofort austreten. Deshalb 70 kDa ist die ideale Molekulargewicht Bedingungen, dass sowohl steigen als auch neuroepithelialen Durchlässigkeit zu verringern identifizieren.
Wenn die Nadel verfehlt das ventrikuläre Lumen, Fluoreszenz wKranke außerhalb des Gehirns erscheinen t = 0 (für ein Beispiel siehe Gutzman und Sive 2009 10). Diese Embryonen zu verwerfen, da der injizierte Farbstoff wurde zunächst nicht innerhalb des Gehirns enthalten und keine klare Aussage zur Bewegung des Farbstoffs und Permeabilität des neuropeithelium vorgenommen werden können.
Schließlich, wenn Embryonen haben kleine Ventrikeln oder nicht aufgeblasenen Hirnkammern, Voreinspritzung von Ventrikel mit einer Salzlösung kann vor der Injektion des Fluoreszenzfarbstoffs durchgeführt werden. Dieser bläst die Ventrikel Herstellung anschließender Visualisierung der Ventrikel leichter beim Injizieren mit dem Fluoreszenzfarbstoff. Geeigneten Kontrollen muss durchgeführt werden, um festzustellen, ob Injektion von Kochsalzlösung normale Entwicklung stört Neuralrohr werden.
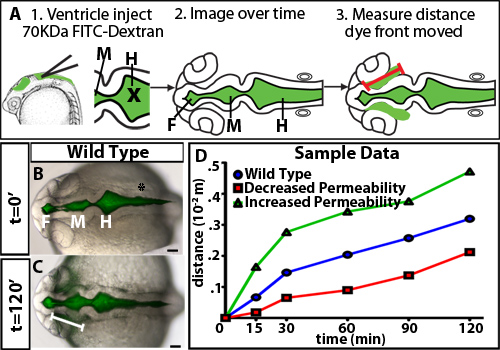
Abbildung 1. Zeitverlauf unterschiedlichen Molekulargewichts Farbstoffe. (A) Experimentelle Diagramm. ErsteWird Fluoreszenzfarbstoff in die Ventrikel injiziert. X = Position der Nadel für die Injektion. Weiter dorsal Bilder werden im Laufe der Zeit erfasst. Schließlich zog der Abstand durch den Farbstoff vor dem Vorderhirn Scharnier-Punkt gemessen (dargestellt durch eine rote Linie) ist. (BC) verschmolzen Hellfeld und Fluoreszenz dorsalen Bildern bei 22 hpf (t = 0 min, B) und 24 hpf (t = 120 min, C). Weiße Linie zeigt Abstand von dem Farbstoff Front von Vorderhirn Ventrikels. (D) Hypothetische Probe Durchlässigkeit Daten. Blau = Wildtyp oder Kontrollen, rot = Probe mit verminderte Permeabilität im Vergleich zur Kontrolle und grün = Probe mit erhöhten Permeabilität im Vergleich zur Kontrolle.
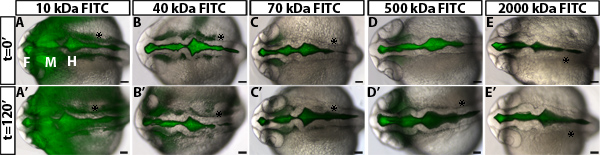
Abbildung 2. Messung der Durchlässigkeit für neuroepithelialen unterschiedlichem Molekulargewicht Farbstoffe. (AE) Dorsal fusionierten Hellfeld und Fluoreszenzbilder von 22 hpf Wildtyp Embryonen bei t = 0 min nach Injektion mit FITC-dExtran der folgenden Molekulargewichte: 10 kDa (A), 40 kDa (B), 70 kDa (C), 500 kDa (D) und 2000 kDa (E). (A'-E ') Gleiches Embryo wie in (AE) bei t = 120 min bei 24 hpf. Anterior nach links. F = Vorderhirn, M = Mittelhirn, H = Hinterhirn. Asterisk = Ohr.
Diskussion
Wir zeigen die Fähigkeit, die Durchlässigkeit des lebendigen embryonalen Zebrafischgehirn quantifizieren, da für eine injiziert Farbstoff einem bestimmten Molekulargewicht bestimmt. Unsere Beobachtung, dass die embryonale Zebrafisch Neuroepithel differentiell durchlässig Farbstoffe mit unterschiedlichen Molekulargewichten ist nahe, dass der Farbstoff über die parazelluläre Permeabilität zu bewegen. Wir können jedoch nicht ausschließen, die Möglichkeit einer transzellulären Beitrag zur beobachteten Durchlässi...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Arbeit wurde von der National Institute for Mental Health und der National Science Foundation unterstützt. Besonderer Dank geht an Sive lab Mitglieder für viele hilfreiche Diskussionen und konstruktive Kritik, und Olivier Paugois für Experten Fische Tierhaltung.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenz | Firma | Katalog-Nummer | |
| Dextran, Fluorescein, anionische, Lysin Fixierbarer | Invitrogen | D7136, D7137, D1822, D1820, D1845 | |
| Tricaine Pulver | Sigma | A5040 | |
| Kapillarrohre | FHC Inc. | 30-30-1 |
Referenzen
- Harrington, M. J., Hong, E., Brewster, R. Comparative analysis of neurulation: first impressions do not count. Mol. Reprod. Dev. 76, 954-965 (2009).
- Lowery, L. A., Sive, H. Strategies of vertebrate neurulation and a re-evaluation of teleost neural tube formation. Mech. Dev. 121, 1189-1197 (2004).
- Salehi, Z., Mashayekhi, F. The role of cerebrospinal fluid on neural cell survival in the developing chick cerebral cortex: an in vivo study. Eur. J. Neurol. 13, 760-764 (2006).
- Martin, C. Early embryonic brain development in rats requires the trophic influence of cerebrospinal fluid. Int. J. Dev. Neurosci. 27, 733-740 (2009).
- Lehtinen, M. K. The cerebrospinal fluid provides a proliferative niche for neural progenitor cells. Neuron. 69, 893-905 (2011).
- Gato, A. Embryonic cerebrospinal fluid regulates neuroepithelial survival, proliferation, and neurogenesis in chick embryos. Anat. Rec. A. Discov. Mol. Cell Evol. Biol. 284, 475-484 (2005).
- Lowery, L. A., Sive, H. Totally tubular: the mystery behind function and origin of the brain ventricular system. Bioessays. 31, 446-458 (2009).
- Lowery, L. A., Sive, H. Initial formation of zebrafish brain ventricles occurs independently of circulation and requires the nagie oko and snakehead/atp1a1a.1 gene products. Development. 132, 2057-2067 (2005).
- Zhang, J. Establishment of a neuroepithelial barrier by Claudin5a is essential for zebrafish brain ventricular lumen expansion. Proc. Natl. Acad. Sci. U.S.A. 107, 1425-1430 (2010).
- Gutzman, J. H., Sive, H. Zebrafish brain ventricle injection. J. Vis. Exp. , (2009).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev. Dyn. 203, 253-310 (1995).
- Westerfield, M., Sprague, J., Doerry, E., Douglas, S., Grp, Z. The Zebrafish Information Network (ZFIN): a resource for genetic, genomic and developmental research. Nucleic Acids Research. 29, 87-90 (2001).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten