需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
相移窄粒度分布的纳米乳液的合成声波液滴蒸发和泡增强的超声介导消融
摘要
使用高强度聚焦超声增强局部加热和改善热消融在肿瘤相移纳米乳剂(PSNE)的可以被汽化。在这份报告中,描述的窄粒度分布PSNE稳定的编制。此外,超声介导消融汽化PSNE的影响表现在组织模仿幻影。
摘要
高强度聚焦超声(HIFU)是临床上常用的热消融肿瘤。为了提高局部加热和提高热消融在肿瘤中,已经开发了脂质包衣的全氟化碳的液滴可以汽化HIFU。在许多肿瘤的血管由于其快速增长是不正常的漏水,纳米粒子能够渗透开窗和被动积聚在肿瘤。因此,控制液滴的大小,可以导致更好的肿瘤内积累。在这份报告中,稳定的液滴在与窄粒度分布的相移纳米乳(PSNE)的编制说明。 PSNE合成了在全氟化碳液体的存在下,通过超声处理的脂质溶液。一种窄的粒度分布,得到挤出PSNE多次使用与100或200 nm的孔径的过滤器。超过一个7天的期间,使用动态光散射的粒度分布测定。 Polyac在体外实验中,制备含PSNE的rylamide水凝胶。 PSNE的水凝胶中的液滴汽化与超声和增强局部加热产生的气泡。汽化PSNE使更多的快速加热,也减少了所需的热消融的超声波强度。因此,PSNE,预计将提高肿瘤热消融治疗中,有可能改善的高强度聚焦超声介导的热消融治疗的治疗效果。
研究方案
1。制备纳米乳剂相移(PSNE)
- DPPC将11毫克和1.68毫克DSPE-PEG2000在氯仿
- 蒸除有机溶剂中的玻璃圆底烧瓶中,以形成干燥的脂质膜
- Dessicate的脂质膜过夜
- 用5.5毫升的磷酸盐缓冲盐水(PBS)再水合的脂质膜
- 热解决方案,在45℃水浴中,直到脂膜溶解,涡旋式定期
- 转移脂解到7毫升小瓶
- 超声脂质溶液,持续2分钟,在20%的振幅
- 划分的解决方案分为两小瓶2.5毫升每(丢弃其余0.5毫升)
- 加入2.5毫升PBS每小瓶
- 放置每个小瓶中的0℃的冰水浴中
- 添加50微升DDFP的每小瓶
- 超声每个小瓶在冰 - 水浴中,使用以下的设置:25%的幅度,脉冲模式(10秒,50秒关),60秒的总时间
- 风帆ansfer PSNE的解决方案,以20毫升闪烁瓶中
- 加入5毫升PBS中,每个小瓶中,得到的在10毫升的最终体积
- 组装挤出机制造商提供的以下几个方向
- 用去离子水冲洗每个部分
- 不锈钢支承盘放置在中心的过滤器支撑基地
- 不锈钢支承盘的顶部上放置不锈钢丝网
- 使用镊子,将挤出机漏极光盘膜(有光泽的一面朝上)的不锈钢丝网
- 使用镊子,将在挤出机上的漏盘膜过滤器(闪亮的一面朝上)
- 小心地将小O形环的过滤器的支持基础之上,将thermobarrel机,挤出机顶
- 翼螺母拧紧每一个部分第一,然后完全拧紧翼螺母的手在交替的方式
- 挤出机连接到氮气线
- 进入前采样口至最优惠的挤出机,移取10 mL去离子水,上限开放,并拧紧排气阀
- 慢慢地打开氮气线,以增加压力,迫使样品通过膜,并收集样品出口管
- 使用后,以相反的顺序拆卸,冲洗用去离子水在挤出机的部分,并丢弃的膜过滤器和膜漏极光盘
- 仅适用于100纳米液滴,先决条件PSNE的挤出10倍至200纳米过滤器
- 挤出PSNE 16倍到100 nm或200 nm的过滤器,以获得较窄的粒径分布
2。的含PSNE聚丙烯酰胺水凝胶的制备
- 准备24%BSA溶液稀释1.2克BSA粉末在5毫升去离子水
- 准备10%的APS溶液,稀0.1克APS粉1 mL去离子水疗设备ŕ
- 按以下顺序,混合丙烯酰胺溶液2.1毫升Tris缓冲液,1.2毫升,0.1毫升10%的APS,4.5毫升24%的BSA溶液,和3.6毫升的去离子水的塑料腔室
- 加热至40℃,并置于真空中1小时
- 加入480μl的PSNE,并充分混合,轻轻摇动的塑料腔。
- 加入12μLTEMED和室放置在12℃水浴2小时
3。代表性的成果
甲的组织模仿水凝胶幻影超声实验设置的示意图在图1中所示。这协议导致脂质涂层具有窄的粒径分布的液滴,全氟化碳,在溶液中保持稳定的至少一个星期。用动态光散射(90Plus粒度分析仪,Brookhaven仪器,州Holtsville,NY)测得的粒度分布,在图2中所示的PSNE使用100和200的挤压纳米过滤器。有效直径的PSNE随着时间的推移,使用动态光散射测量,在表1中列出,表明PSNE是稳定的,至少一个星期。 B模式图像PSNE在聚丙烯酰胺水凝胶的蒸发之前和之后的图3中所示。此外,形成的病变HIFU-介导的加热15秒,在聚丙烯酰胺水凝胶,含有白蛋白和PSNE 如图4所示。的非对称形状的病变是一个结果的发生是由于气泡云的存在下,在上述超声波路径prefocal加热。通过减少所发送的声功率可以被最小化,重要的是要注意,prefocal加热和病灶的形成,由于气泡的散射。
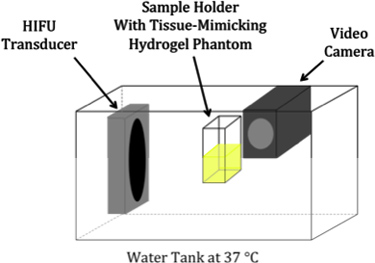
组织MIM超声实验的实验装置示意图图1。舔舐水凝胶。
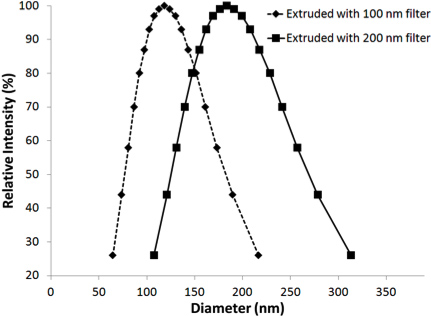
图2。大小分布PSNE挤压通过100nm或200nm的过滤器,使用动态光散射测量。的纵坐标轴的单位是从一定的大小,相对于从该样本的总的散射光强度的粒子的散射光的强度的基础上。
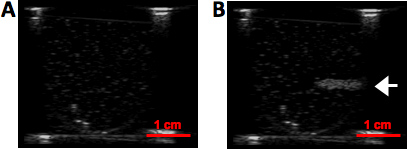
图3,B模式图像(a)在与(b)在PSNE在聚丙烯酰胺水凝胶的汽化。箭头表示震源区的PSNE汽化形成的泡沫云。
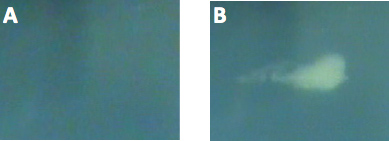
图4。的polyacr图像基酰胺水凝胶含白蛋白及PSNE(一)之前和(b)在与高强度聚焦超声汽化和超声波处理,展示作为超声波感应加热的结果的病变的形成。的超声波中心频率为3.3兆赫。的超声波信号包括一个初始的30个循环的,6.4 W脉冲,以蒸发PSNE,紧接着由15秒的连续的超声波在0.77 W.
| 之后的日子里挤出 | 挤压与200纳米过滤器 | 挤压与100纳米过滤器 | ||
| 平均直径。 (nm)的 | 标准。开发。 (nm)的 | 平均直径。 (nm)的 | 标准。开发。 (nm)的 | |
| 1 | 182.9 | 4.9 | 118.0 | 0.9 |
| 7 | 177.7 | 2.5 | 124.8 | 3.1 |
表1在挤出用100 nm和200nm的过滤器的一个和后七天的平均直径和标准偏差PSNE。
讨论
临床使用高强度聚焦超声(HIFU)热消融肿瘤1为了提高局部加热,并提高热消融在肿瘤中,已经开发了脂质包衣的全氟化碳的液滴可以汽化HIFU。在许多肿瘤的血管异常漏由于其快速增长。2因此,纳米粒子能够穿透窗孔和被动肿瘤内积聚,这个过程被称为增强的渗透性和保持率(EPR)的效果。3它已被证明是在70和200nm之间的纳米粒子最有效地积累在肿瘤。4本报告中?...
披露声明
没有利益冲突的声明。
致谢
这项工作是由一个BU / CIMIT应用医疗保健工程博士前奖学金,扩大参与科研启动资助工程(桥接器)美国国家科学基金会,美国国立卫生研究院(R21EB0094930)。
材料
| Name | Company | Catalog Number | Comments |
| 通用名 | 生产厂家 | 猫。数 | 姓名/说明 |
| DPPC | 阿凡提血脂,雪花石膏,AL,USA | 850355P | 1,2 - 二棕榈酰-sn-甘油-3 - 磷酸胆碱 |
| DSPE-PEG2000 | 阿凡提血脂,雪花石膏,AL,USA | 880120P | 1,2 - 二硬脂酰-sn-甘油-3 - 磷酸乙醇胺-N-[甲氧基(聚乙二醇)-2000](铵盐) |
| DDFP | Fluoromed的Round Rock,TX,USA | CAS号:138495-42-8 | Dodecafluoropentane(C 5 F 12) |
| PBS | Sigma-Aldrich公司,圣路易斯,MO,USA | P2194 | 磷酸盐缓冲盐水 |
| 氯仿 | Sigma-Aldrich公司,圣。路易斯,MO,USA | 372978 | 氯仿 |
| 丙烯酰胺 | Sigma-Aldrich公司,圣路易斯,MO,USA | A9926 | 40%,19:1的丙烯酰胺/双丙烯酰胺 - 丙烯酰胺 |
| Tris缓冲液 | Sigma-Aldrich公司,圣路易斯,MO,USA | T2694 | 1M,pH为8,TRIZMA盐酸盐和Trizma碱 |
| BSA | Sigma-Aldrich公司,圣路易斯,MO,USA | A3059 | 牛血清白蛋白 |
| APS | Sigma-Aldrich公司,圣路易斯,MO,USA | A3678 | 过硫酸铵水溶液 |
| TEMED | Sigma-Aldrich公司,圣路易斯,MO,USA | 87689 | N,N,N',N'-四甲基乙二胺 |
| 设备 | |||
| 超声发生器(3毫米尖) | 超音速材料公司,新城,CT,USA | 振动细胞 | |
| 水浴 | 赛默飞世尔科技,美国马萨诸塞州沃尔瑟姆, | NESLAB EX-7 | |
| 挤出机 | 北血脂,伯纳比,不列颠哥伦比亚省,加拿大 | LIPEX | |
| 挤出机过滤器 | 美国Whatman公司,新泽西州皮斯卡塔韦, | 核孔#110605和#110606 | |
| 挤出机漏光盘 | Sterlitech公司,肯特,WA,USA | #PETEDD25100 | |
| 塑胶室 | 美国塑胶工业股份有限公司,利马,OH,USA | #55288,1 3/16“×1 3/16”×2 7/16“的 |
参考文献
- Hynynen, K., Darkazanli, A., Unger, E., Schenck, J. F. MRI-guided noninvasive ultrasound surgery. Med. Phys. 20, 107-115 (1993).
- Baban, D. F., Seymour, L. W. Control of tumour vascular permeability. Adv. Drug Deliv. Rev. 34, 109-119 (1998).
- Maeda, H., Wu, J., Sawa, T., Matsumura, Y., Hori, K. Tumor vascular permeability and the EPR effect in macromolecular therapeutics: a review. J. Control. Release. 65, 271-284 (2000).
- Schadlich, A. Tumor accumulation of NIR fluorescent PEG-PLA nanoparticles: impact of particle size and human xenograft tumor model. ACS Nano. 5, 8710-8720 (2011).
- Williams, R. Convertible perfluorocarbon droplets for cancer detection and therapy. 2010 IEEE Ultrasonics Symposium. , (2010).
- Martz, T. D., Sheeran, P. S., Bardin, D., Lee, A. P., Dayton, P. A. Precision manufacture of phase-change perfluorocarbon droplets using microfluidics. Ultrasound Med. Biol. 37, 1952-1957 (2011).
- Giesecke, T., Hynynen, K. Ultrasound-mediated cavitation thresholds of liquid perfluorocarbon droplets in vitro. Ultrasound Med. Biol. 29, 1359-1365 (2003).
- Sheeran, P. S., Luois, S., Dayton, P. A., Matsunaga, T. O. Formulation and Acoustic Studies of a New Phase-Shift Agent for Diagnostic and Therapeutic Ultrasound. Langmuir. 27, 10412-10420 (2011).
- Sheeran, P. S. Decafluorobutane as a phase-change contrast agent for low-energy extravascular ultrasonic imaging. Ultrasound Med. Biol. 37, 1518-1530 (2011).
- Zhang, P. . The Application of Phase-Shift Nanoemulsion in High Intensity Focused Ultrasound: An In Vitro Study [Doctoral Dissertation]. , (2011).
- Allen, T. M., Hansen, C., Martin, F., Redemann, C., Yau-Young, A. Liposomes containing synthetic lipid derivatives of poly(ethylene glycol) show prolonged circulation half-lives in vivo. Biochim. Biophys. Acta. 1066, 29-36 (1991).
- Klibanov, A. L., Maruyama, K., Beckerleg, A. M., Torchilin, V. P., Huang, L. Activity of amphipathic poly(ethylene glycol) 5000 to prolong the circulation time of liposomes depends on the liposome size and is unfavorable for immunoliposome binding to target. Biochim. Biophys. Acta. 1062, 142-148 (1991).
- Klibanov, A. L., Maryama, K., Torchilin, V. P., Huang, L. Amphipathic polyethyleneglycols effectively prolong the circulation time of liposomes. FEBS Lett. 268, 235-237 (1990).
- Gabizon, A. Prolonged circulation time and enhanced accumulation in malignant exudates of Doxorubicin encapsulated in polyethylene-glycol coated liposomes. Cancer Res. 54, 987-992 (1994).
- Awasthi, V. D., Garcia, D., Goins, B. A., Philips, W. T. Circulation and biodistribution profiles of long-circulating PEG-liposomes of various sizes in rabbits. Int. J. Pharm. 253, 121-132 (2003).
- Zhang, P., Porter, T. An in vitro study of a phase-shift nanoemulsion: a potential nucleation agent for bubble-enhanced HIFU tumor ablation. Ultrasound Med. Biol. 36, 1856-1866 (2010).
- Lafon, C. Gel phantom for use in high-intensity focused ultrasound dosimetry. Ultrasound Med. Biol. 31, 1383-1389 (2005).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。