需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
测量细胞内Ca
摘要
细胞内Ca +动力学是非常重要的,在精子生理学和Ca +敏感的荧光染料构成一个多功能的工具来研究它们。人口实验(荧光和停流荧光)和单细胞实验(流式细胞仪和单细胞成像)是用来跟踪时空的[Ca +]在人类精子细胞中的变化。
摘要
精子是男性生殖细胞特别设计,以达到与卵子结合,识别和融合。要执行这些任务,精子细胞必须准备好面对不断变化的环境和来克服一些物理障碍。在本质上转录和翻译默默的,这些运动细胞的深刻依赖不同的信号机制,将自己定位和定向的方式游泳,具有挑战性的环境条件,在旅途中找到鸡蛋抗衡。特别的Ca 2 +介导的信号是关键的几个精子功能:激活的运动,获能和顶体反应(胞吐的事件,使精卵融合)(一个复杂的过程,精子顶体反应准备)。使用荧光染料来跟踪该离子的细胞内波动是由于它们易于应用,灵敏度显着的重要性,和多功能性DET挠度。使用单一染料加载协议,我们使用四种不同的荧光技术监测精子的Ca 2 +的动态。每种技术都提供了不同的信息,使空间和/或时间分辨率,在单细胞和细胞种群水平产生数据。
引言
的Ca 2 +是一种通用的第二信使,在真核细胞中的信号转导通路。细胞内钙离子(Ca 2 +的一)参与许多基本的生理过程的调节兴奋和非兴奋性细胞。的重要性和普遍性的Ca 2 +作为第二信使的信号转导过程中的事件是来自于细胞内的信息在传输及其时空通用性。虽然的Ca 2 +可以不被合成的新生或退化内的细胞,其细胞内浓度([钙2 +] i 的 )是保持非常严格的限制内通过不同的细胞机制,不断缓冲,死骨,区域化,和/或累积的Ca 2 +。在该离子的浓度的变化可以发生在高度局部化区域内的电池1,解密这种波动是必不可少的获得解EPER(1)中的作用中的信令机制,(2)的生理意义,和(3)一般的细胞信号转导机制的理解。的Ca 2 +介导的信号转导是在第2精子生理特别重要的。精子活力受精成功的最重要的功能之一,而事实上,一些精子活动力缺陷可导致不育3-5。中的Ca 2 +鞭毛运动的重要性已确认6,但是如何的Ca 2 +鞭毛弯曲控制的具体形式,该机制尚不完全清楚。
在融合与卵子结合之前,精子必须经过获能,精子内居住的女性道依赖于一个复杂的过程。能过程中,精子膜的脂质结构和组织被修改,主要是由于从细胞膜的胆固醇去除。此外,一些蛋白质酪氨酸磷7 ylated 2。重要的是,能过程,增加细胞内pH值(pH值)的[Ca 2 +] i的,并在一些物种2的超极化膜电位。能的只需在亚精子(20-40%),在所有这些细胞的变化所涉及的机制远未清楚。人们普遍接受的,只有亚能精子发生顶体反应(AR),当暴露在生理电感。也是AR的Ca 2 +施肥在所有物种中具有专门的顶体(细胞器外层和内层膜)所需的受规管活动。在此过程中的外顶体膜与精子的质膜融合,释放的水解酶,使精子细胞渗透到周围的卵透明带(ZP)的糖蛋白质的基质。 AR还公开了一个新的膜融合与精子细胞表面为最后的两个配子融合蛋质膜。有几种细胞的配体诱导的AR,孕激素之一,其中研究最多的。
在这项工作中,我们提出了四种不同的技术涉及使用的Ca 2 +敏感的荧光染料来衡量的[Ca 2 +] i的变化,孕激素引发的人精子(除了流式细胞仪,我们测量了的[Ca 2 + ] i的增加诱导在体外获能过程)。在这种特殊情况下,我们用荧光凌晨3点(生命科技,大岛,NY),膜渗透性染料的K D = 325纳米, 在体外监测荧光变化作为时间的函数有三个方法,第四技术,我们测量了在一个单一的给定时间点的荧光值。这些不同的方法,相得益彰,因为他们完全提供了空间和时间的水库辨率在单细胞和细胞种群水平。
细胞群体或散装实验
散装技术被广泛使用,不仅因为他们所需要的工具都一应俱全,而且还因为他们是简单,完善,并允许平均百万计的细胞进行测量,在一次实验中的信息。
技术#1。传统的荧光
这种技术监测的荧光变化作为时间的函数的样品体积范围从200到1,000μl的玻璃比色皿中进行实验。加入试剂时,需要适当的混合磁力搅拌,因此,获得的时间分辨率是在以秒计。典型的细胞所分析的样品的浓度范围是10 5 -10 8个细胞/ ml。
技术#2。停流荧光
Ť他的技术还监测作为时间的函数的荧光的变化,但迅速混合在一起,此试剂包含一个非常小的样品体积(从25-100微升)到记录比色皿(使用压力)。因此,均质化试剂是瞬时的,能够在毫秒级的时间分辨率高。分析所得到的荧光随时间的痕迹是适合用于确定反应速率,阐明反应机理的复杂性,常见的细胞所分析的样品的浓度范围内获得上短命的反应中间体等的信息是10 5 -10 7细胞/ ml。
单细胞实验
批量实验报告了大量的单元格的平均行为,但是,人口可能经常表现出这种类型的测量过程中不受干扰的异构属性。因此,单细胞技术用于补充日E信息的细胞群体的实验获得。
技术#3。流式细胞仪
尽管从单细胞测量的重要性,所产生的信息,重要的是要分析大量的单元格,以防止错误的推断小区固有属性的整个人口。出于这个原因,高通量技术的青睐和最常用的方法是流式细胞仪,其中10,000个细胞常规分析每个条件。此方法使不同的人群多参数分析细胞分类根据它们的大小(前向散射(FSC)),粒度(侧向散射光(SSC))和荧光强度(与抗体的特异性标记,生存能力的盯防,等) ,从而提供了参数的分布的信息的一组单元格。流式细胞仪提供即时的,而不是随时间变化的信息8。正向和侧向散射光值ARE也可用于选择一个栅极,包括细胞,但对于测量荧光,阴性和阳性荧光控制判别的细胞碎片,灰尘等也必须被包括在内。如果使用一个以上的荧光通道,这个过程被称为补偿必须执行(详见http://www.bdbiosciences.com/resources/protocols/setting_compensation.jsp )。补偿允许为光谱重叠荧光团之间的歧视。流式细胞术还允许歧视的死细胞,一般通过碘化丙啶(PI)染色。
技术#4。单细胞成像
显微镜是另一种常见的方法,研究单细胞的行为,它非常适合于随时间变化的研究,而且还提供了空间分辨率。一个主要缺点是高通量分析仅处于起步阶段,在目前的时间
研究方案
在本文中,我们报道了使用上述四个技术来衡量的[Ca 2 +] i的变化在人类精子细胞。我们用孕激素引发的Ca 2 +响应,因为它是公认的,这种类固醇产生一个短暂的[的Ca 2 +] i的增加精子。特别是,在人精子,孕激素直接激活的Ca 2 +通道(即CatSper)表达于精子细胞的质膜10,11。我们还测量了休息的[Ca 2 +] i的前,后获能,它也被广泛接受,增加的[Ca 2 +] i的出现能过程。对于阳性对照的技术要求中,我们使用的Ca 2 +离子载体离子霉素诱导最大的Ca 2 +摄取进入细胞内,从而,最大荧光响应,最小荧光值,我们使用了锰2 +淬灭荧光。
1。精子样品制备水池方法(见图1)
仅使用射精样本(通过自慰获得),其特征履行世界卫生组织实验室手册(在http://whqlibdoc.who.int/publications/2010/9789241547789_eng.pdf )建立了其最新版本的参数,考试和处理人的精液。
- 取得精液样本在37℃,CO 2 5%/空气的95%,在30分钟期间内的孵化器内的无菌容器中,然后将其松开帽。此步骤是样品液化。
- 将500μl的等分干净的玻璃试管(1.0×7.5厘米)的底部上的液化精液样本。需要约8个试管的样品(4ml)中的平均尺寸。
- 小心层1毫升联队的F-10培养基(SU与2毫pplemented的CaCl 2和5毫克/毫升牛血清清蛋白,以促进在体外获能)上每个精液等分试样的顶部(参见图1)中的提示:触摸管壁与微管 的尖端,并轻轻分配在样品上面的介质。关键的是要为这两个层混合(样本和介质)中慢慢地做到这一点,必须避免。
- 仔细瘦管约30°角。这将增加两种液体之间的表面面积,从而提高了位移(水池)从样品中人体细胞在培养基中,在温育过程中。
- 靠在试管中的组内的孵化器放置在37℃,CO 2 5%/空气95%1小时。
- 使用微量小心地取出上层700联队的F-10中型(现在包含运动精子)微升到一个干净的玻璃管(1.0 x 7.5厘米体积较大,使用15毫升每管池中的所有收集到的样本猎鹰管),避免形成气泡。将10微升样本的MAKLER计数室基本的光学平板玻璃,然后将玻璃盖(盖一次到位,避免起吊或覆盖再维持精子样品的均匀扩散)。请一定要避免形成泡沫箱内,因为这会导致不准确的细胞计数。
- (建议使用20倍的目标)的复合显微镜下观察。玻璃盖计数MAKLER室有一个大广场,由100个小方格( 即 10 10格)。计数细胞,在任何条带的10平方。这个数字代表了他们的数百万个细胞/ ml浓度。两个额外的10万条重复计数,并计算出平均的三项注意:如果一个MAKLER计数板(它是特别设计来计数精子细胞)不可用,可用于任何血细胞计数器室。
- 调整样品的国际泳联升浓度为1×10 7个细胞/ ml的补充火腿的F-10培养基。当需要时,孵育样品在37℃,CO 2 5%/ 95%空气,5小时,以促进获能。
2。荧光染料加载的Ca 2 +测量
有一些可用来测量细胞内Ca 2 +的荧光染料,根据其K d的,必须选择适当的一个,它的激发和发射波长(用于定性和定量测量,单,双的激发和发射波长分别,必须是使用)更多信息)。对于目前的定性应用程序,我们使用萤光-3 AM用K = 325纳米,细胞透性的染料,和单一发射和激发波长为506/526 nm处,分别为12。
- 制备50微升1mM的氟-3 AM贮备液溶解的一个50微克染料小瓶的内容(MW = 1130克/摩尔)44微升无水DMSO中。
- 使用1.5毫升微量离心管中混合精子悬浮液(见下面的技术为每个特定的所需量)将所需体积的足够用1mM的氟-3 AM储备液,得到最终浓度为2μM氟-3 AM( 即 1μl的每500微升的精子悬液)加入股票氟-3 AM。
- 在37°C孵育30分钟,避光。
- 750 XG 5分钟,使用微量离心管,吸弃上清,悬浮颗粒在人类精子中合适的音量(见下面为每个特定的技术要求的浓度)(HSM; MM:120氯化钠,15 碳酸氢钠 ,氯化钾,1.8 4 10 1 的 CaCl 2,MgCl 2的HEPES,10钠,乳酸,D-葡萄糖,丙酮酸钠,pH值= 7.4)。 注:一个云的形成,而不是颗粒表明细胞在良好的条件。
- 细胞正在加载与染料的,它们保持活力(保持在37℃和避光)约2小时,并可能被用来在任何下列技术。
3。技术#1。传统的荧光(大细胞人口的平均信息)
设备:对于我们的精子人口的[Ca 2 +] i的测量,我们使用Olis提供软件(博加特,GA,USA),磁力搅拌器控制(SIM AMINCO),加上蓝色LED(SLM AMINCO分光光度计丽讯星LXHL LB3C LUMILEDS)和465-505 nm的带通滤波器(色度科技股份有限公司)萤光-3 AM激发。 LED控制通过一个定制的电源(700毫安)。排放测量光通过设置发射波长525 nm的分光光度计的单色(λEM)。
- 将570μl的HSM和精子细胞悬浮液加入30μl(与氟上午03点以前加载的,并重新悬浮在HSM获得1×10 8个细胞/ ml)在平坦的底部玻璃管(ID 8×50毫米)。在管内放置一个磁力搅拌棒,管子插入荧光分光光度计(预热至37°C)的阅读室,搅动样品,在所有的收购时间。
- 开始实验,使用在设备的软件(Olis提供软件,在这种情况下),并进行获得荧光值在0.5赫兹的频率下,在300秒期间。应用所需的试验化合物(一般100X集中比所要求的最终浓度)的储备液,使用如下的一个Hamilton微注射器通过注射适当的音量:
- 收购基础荧光,持续30秒。 添加4的μM孕酮(PG)。
- 在100秒内加入20μM离子霉素(作为阳性对照,以取得最大的荧光值)。
- 通过重复步骤3.1 3.2.3以上,但添加代替了Pg所用的溶剂,用0.01%的无水DMSO)溶解(HSM运行的阴性对照。
- 原始荧光强度值导出到Microsoft Excel和规范使用下列公式:(F/F0) - 1。其中F是在任何给定的时间(t)测得的荧光强度,F0是在最初的30秒期间的平均基底荧光。绘制的总串联(F/F0) - 1值与时间的关系( 图2A)。测量之前和之后的另外的试验化合物(ΔF)的荧光强度值之间的差异,在条形图上绘制和处理的数据,应用适当的统计分析方法( 图2B)。
4。技术#2。停止弗洛瓦特荧光(信息与高时间分辨率从大细胞群)
装备:细胞内的[Ca 2 +]的变化测量具有高时间分辨率使用一个SFM-20停流混频器耦合的MOS-200快速反应动力学的光学系统,无论是从生物科学仪器(法国格勒诺布尔)。所有的数据进行分析与生物Kine32从同一家公司的软件。
- 设置在设备中的适当的条件下,照明源应打开在实验开始前至少15分钟;调整激发和发射滤光片的光电倍增管,调整停流制造者确定的范围内的电压值,并设置将浴温在37℃下
- 填写仪器的注射器的一个,无论是HSM(阴性对照),用1毫升氟-3 AM加载精子细胞(1×10 7细胞/ ml),并进行测试的化合物用1毫升的第二注射器10μM离子霉素(阳性对照),或10μMPG溶解在HSM。 注:在这一步,关键的是要避免泡沫的形成,同时吸取液体进入注射器。
- 抬起两个仪器活塞,直到碰到注射器的柱塞顶端。
- 将流量设置到最低值,将提供一个可测量的响应,以便最大限度地减少细胞的损伤。我们在SFM-20系统中使用的流量为1毫升/秒13。
- 设置的频率(在这种情况下10毫秒)和总的采样时间(在这种情况下,50秒)。
- 触发的混合试剂。 注意:虽然可以由手动单触发一次,一组连续的自动触发器可以是预编程。
- 原始荧光(任意单位)与时间的关系的轨迹显示在计算机屏幕上。
- 本身的试剂的混合,将产生一个跟踪是不在一条直线上。因此,为了取得实际的[Ca2 +]变化是来自于刺激,从混合细胞与培养基(阴性对照)得到的跟踪控制,必须从每一个实验的痕迹减去。分析数据,根据需要,一些动力学参数也可以得到与生物Kine32的采集软件。用于比较的补充图1中所示的减法上游的痕迹没有。
- 要改变试剂在测试化合物注射器,用蒸馏水彻底清理出来。然后填充到其最大体积的注射器用蒸馏水,将其放置在相应的活塞的停流荧光计和推水(冲洗水必须向废液容器)的内部机构。重复此步骤两次以上。
- 重复步骤4.2至4.9,第二注射器灌装与未来所需的测试化合物。
- 在实验结束时,整个设备用蒸馏水冲洗,完全排干水从内部的软管。
5。技术#3。流式细胞术(单细胞获得的信息从大量细胞)
设备:这种技术允许在一个单一的时间点同时测量几个参数,但与以前的技 术不同的是,它不测量随时间变化的,而是提供了测量时的参数值。因此,代替添加PG触发的响应,在这种情况下,我们测得细胞内Ca 2 +的水平,在精子细胞中诱导获能之前和之后。我们使用了FACSCanto流式细胞仪(Becton Dickinson公司)和数据进行了分析与FlowJo软件(树星9.3.3)。
- 准备在流式细胞仪管的实验样品,每个要测试的条件(在这种情况下,10个条件下,通过将每管500μl的细胞悬浮液(4×10 6个细胞/ ml), 见表1)。收集荧光数据来回米10,000每个样品的事件。
- 要建立一个实验使用的设备软件:
- 创建一个新的文件夹,试验,试件和管数。
- 选择适当的流式细胞仪设置萤光凌晨3点(使用FITC-异硫氰酸荧光素过滤器)和PI(使用PI碘化丙啶过滤器)。
- 运行在流式细胞仪中未染色的对照管1和2。收集FSC和SSC数据验证阈值设置是适当的,并创建相应的门,为了区分细胞碎片。
- 要建立补偿控制,运行下面的对照样品,收集汽车和最大荧光数据(PI和FITC通道)的( 注:这个任务通常是由设备的技术员):
- 未染色细胞(管1和2)。
- 氟-3 AM(2微米)(管3和4)细胞加载。
- 死细胞(精子悬浮于0.1%的Triton X-100在HSM在室温下10分钟)与PI(1.2μM的PI, 即 0.25微升2.4 mM的PI被添加到500μl的精子悬液)染色30分钟,在37℃,从光(管5和6)保护期间。- 查看记录的数据,并选择所需的人口的大门。
- 调整门,并选择“应用”所有补偿控制。
- 选择实验>补偿设置>计算赔偿。
- 重命名补偿设置和链接及保存。
- 运行所有实验管(在这种情况下,管7至10)。年底,所有数据导出软件可用于分析(见5.6)。
- 分析每一个实验的结果,使用在设备的软件,市售的的FlowJo软件或Cytobank免费软件( http://www.cytobank.org/ )。
6。技术#4。单细胞成像(单细胞具有高空间分辨率的信息)
我们的成像设备:定制成像设置。设置是由一个倒置的尼康DIAPHOT 300配备温度控制器(医疗系统股份有限公司,格林韦尔,NY),一个,尼康PlanApo 60X(1.4 NA油浸显微镜)目标。荧光照明提供一个LUXEON V星朗伯青色LED的一部分#LXHL-LE5C的(Lumileds照明有限责任公司,圣何塞,加利福尼亚州)连接到一个定制的频闪控制箱。在LED被安装成FlashCube40组件与二向色反射镜M40-DC400(拉普光电,汉堡,德国)(带宽:激发450-490纳米,分色镜505纳米,和发射520-560纳米)。 LED输出同步输出信号酷捕捉CCD相机通过控制箱产生一个单一的闪光持续时间为2毫秒每个曝光的曝光。相机的曝光时间设置相当于闪光持续时间(毫秒)。图像收集每250毫秒(或可根据需要调节所需的时间分辨率)使用IQ软件(安道尔生物成像,北卡罗来纳州威尔明顿)。
- 准备圆形盖玻片(直径为25毫米)通过施加5微升的颗粒的聚-L-赖氨酸溶液(0.01%w / v的)上的中心。让静置至少1小时(干)。使用喷瓶使用前用水冲洗治疗区域。此过程将允许精子细胞坚持以盖玻片从他们的头上,而他们的鞭毛仍然可以移动。
- 准备的待测化合物溶解在HSM根据表2。化合物中依次加入到相同的录音室,确保总是添加相同的体积,并同时考虑到稀释的原液中的浓度调节,将混合时的体积已经存在于所述腔室(如在表2)。所有的测试解决方案,保持在37°C,直到它们被用来洗澡。
- 组装盖玻片内的REC奥尔丁室和地方10μl的萤光-3 AM-加载 的细胞(1×10 7细胞/ ml)的中心。用200μl预热的HSM覆盖细胞。
- 将腔在舞台上的显微镜预先加热到37°C,查看电池(使用相衬),并选择一个区域进行成像。重要的是要选择一个地方是适当的细胞密度( 见图5A),太多的细胞进行分析困难的,因为重叠信号。 注意:细胞应牢固地附着盖玻片他们的头,但具有鞭毛的运动,这证实生存能力。
- 在现场模式下获取荧光图像调整对焦和亮度。
- 激活的时间序列图像采集软件的(IQ在这种情况下,),开始实验。通常情况下,4个图像每秒采集与2毫秒每幅图像的照明。
- 使用微量小心加入(逐滴)测试化合物(在这种情况下,PG),继续IMAGë键采集的要求,并执行到相同的腔室中的两个顺序控制添加:(1)20μM离子霉素,以获得最大的荧光和(2)5mM的MNCL 2取得 最小荧光。或者,化合物可以使用灌注室,它提供了优点,使刺激去除,并且能够均匀地沐浴细胞与化合物添加。在同一时间,它有缺点,需要更大量的溶液,使温度控制的更多的问题。
- 在一个新的重复采集室每一个所需的测试化合物。
- 执行使用在设备的软件,或脱机使用“IQ软件或图像J免费在线图像分析。绘制每个细胞(或细胞的一部分)和周围地区的利益(投资回报),也可以选择无细胞区(由软件自动背景减法)。然后将获得的投资回报率,这些数据MA为每个时间荧光强度系列可以导出到Microsoft Excel作进一步分析。我们使用下列公式:(F/F0) - 1归一化荧光强度值。其中F是在任何给定的时间(t)测得的荧光强度,F0是在最初的30秒期间的平均荧光。绘制的总串联(F/F0) - 1与时间的关系( 图5B)。的值也可以使用的荧光离子霉素加成后得到的值作为100%归一。
- 可能交替使用的Image J软件进行图像分析。
技术#1。传统的荧光
黄体酮是已知的AR诱导剂之一,正如所料,确实挑起瞬态[的Ca 2 +] i的增加人类精子( 如图2所示)。另外,钙离子载体(离子霉素)引起的最大的[Ca 2 +] i的增加,这不返回到基础水平。
技术#2。 Ş平顶流荧光
孕激素诱导的[Ca 2 +] i升高前(常规荧光光度法)测定,但具有更高的时间分辨率,在这种情况下,这一次收购的频率为0.1赫兹。 如图3所示,孕酮(瞬态,红色线)和伊屋诺霉素(持续,蓝线)导致一个非常快的[Ca 2 +] i的增加。孕酮诱导的[Ca 2 +] i的增加延迟的情况下直接表明孕激素激活的Ca 2 +通道CatSper,无中间信号10,14与以前的报告是一致的。
技术#3。流式细胞仪
的[Ca 2 +] i的测定人类精子产能和非产能。据此前报道,我们也观察到在小鼠15 16,牛精子与人类精子17增加[C2 +] i的产能相比,非人类精子获能。巴尔迪等人 (1991)17日报道,较高的基础的[Ca 2 +] i的产能比非人类精子获能使用传统的荧光。在这项工作中,我们用流式细胞仪测量的[Ca 2 +] i的体外获能前后。流式细胞仪,使我们看到了分布的荧光值能精子( 图4D,蓝色曲线)被转移到更高的价值相比,非能精子( 图4D,红色轨迹)。为每个单独的单元格, 如图4G中所示的二维点图中可以观察到荧光值,重要的是,可以消除产生的死细胞(约15%)的信号( 图4G,上部象限)。
技术#4。单细胞成像
孕酮诱导D [Ca 2 +的í变化是衡量在单个精子细胞。孕激素除了导致的增量中的[Ca 2 +] i的无论是在精子的头部和鞭毛。正如人口的实验中观察到,单细胞分析,揭示了瞬态和持续增加的孕激素和离子霉素。
结果
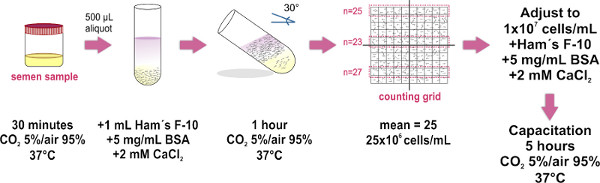
图1。示意图实验的协议精子样品制备游泳方法。活动精子分离,并调整其浓度的主要步骤进行了说明。最后孵化步骤只获能需要时执行。
讨论
细胞内的信号是至关重要的大多数细胞活动的Ca 2 +是一个无处不在的使者,伴随着哺乳动物细胞在其整个生命周期,从他们的起源在受精时,其生命周期结束。针对不同的刺激的[Ca 2 +] i的增加,振荡和录时空编纂;因此,多元化的进程被激活,调制或终止的Ca 2 +编码的消息。细胞内Ca 2 +动力学精子生理学是非常重要的,因为这涉及离子的信号转导过程中在一个复杂...
披露声明
我们什么都没有透露。
致谢
作者感谢何塞·路易斯·德德拉维加,埃里卡Melchy和木村拓哉西垣博士的技术援助。这项工作得到全国理事会全国西恩西亚ŸTECNOLOGIA(国家科学技术委员会墨西哥)(99333和128566 CT);局一般事务德尔个人Académico/国立大学自治墨西哥(IN202212-CT)。
材料
| Name | Company | Catalog Number | Comments |
| Ham's F-10 | Sigma-Aldrich | N-6013 | |
| Bovine Serum Albumin | Sigma-Aldrich | A-7906 | |
| Calcium Chloride Dihydrate approx. 99% | Sigma-Aldrich | C-3881 | |
| Makler Counting Chamber | SEFI Medical Insruments LTD | SEF-MAKL | |
| Fluo-3 AM | Invitrogen | F-1242 | 20 vials/50 μg each |
| Ionomycin | Alomone | I-700 | |
| Progesterone | Sigma-Aldrich | P0130 | |
| Sodium chloride | Sigma-Aldrich | S-9888 | Reagents for human sperm medium (HSM) |
| Potassium chloride | Sigma-Aldrich | P-3911 | Reagents for human sperm medium (HSM) |
| Sodium bicarbonate | JT Baker | 3506 | Reagents for human sperm medium (HSM) |
| Magnesium chloride | Sigma-Aldrich | M-2670 | Reagents for human sperm medium (HSM) |
| Calcium chloride anhydrous | Sigma-Aldrich | C-1016 | Reagents for human sperm medium (HSM) |
| HEPES | Sigma-Aldrich | H-3125 | Reagents for human sperm medium (HSM) |
| D-Glucose | JT Baker | 1906-01 | Reagents for human sperm medium (HSM) |
| Sodium pyruvate | Sigma-Aldrich | P-2256 | Reagents for human sperm medium (HSM) |
| Sodium L-lactate (aprox. 99%) | Sigma-Aldrich | L- 7022 | Reagents for human sperm medium (HSM) |
| Propidium Iodide | Invitrogen | L-7011 | Component B |
| Triton X-100 (t-Octylphenoxypolyethoxyethanol) | Sigma- Aldrich | X-100 | 2.4 mM solution in water |
| Round coverslip | VWR | 48380 080 | 25 mm diameter |
| Poly-L-lysine solution | Sigma-Aldrich | P8920 | |
| Manganese chloride | Sigma-Aldrich | M-3634 | |
| Attofluor; Cell Chamber, for microscopy | Life technologies | A-7816 | |
| Dimethyl Sulphoxide | Sigma-Aldrich | D2650 | 5x5 ml |
参考文献
- Bouschet, T., Henley, J. M. Calcium as an extracellular signalling molecule: perspectives on the Calcium Sensing Receptor in the brain. Comptes Rendus Biologies. 328, 691-700 (2005).
- Darszon, A., Nishigaki, T., Beltran, C., Trevino, C. L. Calcium channels in the development, maturation, and function of spermatozoa. Physiol. Rev. 91, 1305-1355 (2011).
- Esposito, G., et al. Mice deficient for soluble adenylyl cyclase are infertile because of a severe sperm-motility defect. Proc. Natl. Acad. Sci. U.S.A. 101, 2993-2998 (2004).
- Avenarius, M. R., et al. Human male infertility caused by mutations in the CATSPER1 channel protein. American Journal of Human Genetics. 84, 505-510 (2009).
- Carlson, A. E., et al. Pharmacological targeting of native CatSper channels reveals a required role in maintenance of sperm hyperactivation. PLoS ONE. 4, e6844 (2009).
- Brokaw, C. J. Calcium and flagellar response during the chemotaxis of bracken spermatozoids. J. Cell. Physiol. 83, 151-158 (1974).
- Visconti, P. E., et al. Capacitation of mouse spermatozoa. II. Protein tyrosine phosphorylation and capacitation are regulated by a cAMP-dependent pathway. Development. 121, 1139-1150 (1995).
- Svahn, H. A., van den Berg, A. Single cells or large populations. Lab on a chip. 7, 544-546 (2007).
- Pepperkok, R., Ellenberg, J. High-throughput fluorescence microscopy for systems biology. Nat. Rev. Mol. Cell Biol. 7, 690-696 (2006).
- Strunker, T., et al. The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm. Nature. 471, 382-386 (2011).
- Lishko, P., et al. The Control of Male Fertility by Spermatozoan Ion Channels. Annu. Rev. Physiol. , (2011).
- Kao, J. P., Harootunian, A. T., Tsien, R. Y. Photochemically generated cytosolic calcium pulses and their detection by fluo-3. J. Biol. Chem. 264, 8179-8184 (1989).
- Kilic, F., et al. Caged progesterone: a new tool for studying rapid nongenomic actions of progesterone. Journal of the American Chemical Society. 131, 4027-4030 (2009).
- Lishko, P. V., Botchkina, I. L., Kirichok, Y. Progesterone activates the principal Ca2+ channel of human sperm. Nature. 471, 387-391 (2011).
- Xia, J., Ren, D. The BSA-induced Ca2+ influx during sperm capacitation is CATSPER channel-dependent. Reprod. Biol. Endocrinol. 7, 119 (2009).
- Galantino-Homer, H. L., Florman, H. M., Storey, B. T., Dobrinski, I., Kopf, G. S. Bovine sperm capacitation: assessment of phosphodiesterase activity and intracellular alkalinization on capacitation-associated protein tyrosine phosphorylation. Mol. Reprod. Dev. 67, 487-500 (2004).
- Baldi, E., et al. Intracellular calcium accumulation and responsiveness to progesterone in capacitating human spermatozoa. J. Androl. 12, 323-330 (1991).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。