Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Hücre içi Ca Ölçme
Bu Makalede
Özet
Hücre içi Ca 2 + Dinamikleri Sperm fizyolojisi ve Ca çok önemlidir 2 + Duyarlı floresan boyalar onları incelemek için çok yönlü bir araç oluşturmaktadır. Nüfus deneyleri (fluorometri ve akış fluorometri durdu) ve tek bir hücre deneyleri (akım sitometri ve tek hücre görüntüleme) uzay-zamansal [Ca izlemek için kullanılır 2 +] değişir.
Özet
Sperm, özellikle ulaşmak tanımak ve yumurta ile kaynaştırmak için tasarlanmış erkek üreme hücreleridir. Bu görevleri gerçekleştirmek için, sperm hücreleri sürekli değişen bir ortamda yüz ve birkaç fiziksel engelleri aşmak için hazır olmalıdır. Transkripsiyonel ve translationally sessiz özünde olan bu hareketli hücreler kendilerini yönlendirmek için çeşitli sinyal mekanizmaları derinden güveniyor ve yönlendirilmiş bir şekilde yüzmek ve yumurta bulmak için yolculuk sırasında çevre koşulları zorlu mücadele etmek. Özellikle, Ca 2 +-aracılı sinyal birkaç sperm fonksiyonları için çok önemlidir: motilite, kapasitasyonu (akrozom reaksiyonu için sperm hazırlayan karmaşık bir süreç) ve akrozom reaksiyonu (sperm-yumurta füzyon sağlayan bir eksositotik olay) aktivasyonu. Bu iyonun, hücre içi dalgalanmaları izlemek için flüoresan boyaların kullanım uygulaması duyarlılık kolaylığı nedeniyle önem arzetmektedir ve det yönlülükection. Tek boya yükleme protokolü kullanarak biz sperm Ca 2 + dinamikleri izlemek için dört farklı florometrik teknikleri kullanmaktadır. Her teknik hem tek bir hücre ve hücre popülasyonu düzeyde veri üreten, mekansal ve / veya zamansal çözünürlük sağlayan farklı bilgi sağlar.
Giriş
Ca 2 + ökaryotik hücrelerde sinyal iletim yollarının evrensel bir ikinci elçisidir. Hücre içi Ca 2 + (Ca 2 + i) heyecanlı ve olmayan heyecanlı hem hücrelerinde birçok temel fizyolojik süreçlerin düzenlenmesinde katılır. Ca 2 önemi ve evrenselliği + ikinci haberci olarak sinyal iletimi olaylar sırasında hücre içinde bilgi iletimi kendi uzay-zamansal çok yönlülük türetilmiştir. Ca 2 + de novo veya hücre, onun hücre içi konsantrasyonu ([Ca 2 +] i) içinde bozulmuş sentez edilemez farklı hücresel sürekli tampon, Sequester, bölümlere bu mekanizmaları ve / yoluyla çok sıkı sınırlar içinde tutulan veya Ca 2 birikir iken +. Bu iyon konsantrasyonu değişiklikler hücre 1 içinde son derece lokalize bölgelerde ortaya çıkar ve bu dalgalanmalar deşifre bir de kazanmak için gereklidir olabilirsinyal mekanizması (1) rolleri, (2), fizyolojik önemi, hücre sinyal iletimi ve (3) genel mekanizmaları eper anlaşılması. Ca2 +-aracılı sinyal sperm fizyolojisi 2'de özel bir önem taşımaktadır. Sperm hareketliliği döllenme başarı için en önemli işlevlerinden biridir ve aslında, birkaç sperm hareketliliğini kusurları kısırlığa 3-5 neden olabilir. + Flagellar hareket Ca 2 önemi uzun 6 kabul edilmiştir, ancak, Ca 2 + flagellar bükme, belirli bir formu nasıl kontrol mekanizması tam olarak anlaşılamamıştır.
Yumurta eritme önce, sperm kapasitasyonu, kadın sistemi içinde sperm ikamet bağımlı karmaşık bir süreç geçmesi gerekir. Kapasitasyonu sırasında sperm membranın lipid mimarisi ve organizasyonu esas olarak plazma zarının kolesterol çıkarılmasının bir sonucu olarak, modifiye edilmiştir. Buna ek olarak, birçok protein tirozin-fosfor vardır7 ylated. Önemli olarak, kapasitasyonu sırasında hücre içi pH'ın artmasına (pH i) ve [Ca2 +] i, ve membran potansiyeli bazı türler 2 hiperpolarizasyona. Kapasitasyonu sadece sperm (% 20-40) bir alt grubunda yer alır ve tüm bu hücresel değişiklikler yer alan mekanizma tam olarak uzaktır. Genellikle fizyolojik bobin maruz kaldığında kapasitan sperm sadece bir alt akrozom reaksiyonu (AR) tabi olduğu kabul edilmektedir. AR da (dış ve iç zarları ile özel organel) bir akrozom sahip tüm türlerde döllenme için gerekli bir Ca 2 +-düzenlenmiş bir olaydır. Bu işlem sırasında spermin plazma zarı ile dış akrozomal membran sigortalar, sperm hücresi yumurta (zona pellucida veya ZP) çevreleyen gliko-protein matris nüfuz izin hidrolitik enzimler serbest. AR da etkileşim yeni füzyojenik sperm hücresi yüzey ortayaHer iki gamet son füzyon için yumurta plazma zarı. AR, progesteron en aralarında çalışılan biri olmak neden çeşitli hücresel ligandlar vardır.
Bu çalışmada biz ölçmek için bir Ca 2 + duyarlı floresan boya kullanımını içeren dört farklı tekniklerini [Ca 2 +] i progesteron tetiklediği insan sperm değişiklikler (biz [Ca 2 ölçülen hangi akım sitometri hariç + ] i) in vitro kapasitasyonu sürecinde sırasında neden artar. Bu özel durumda biz kullanılan Fluo-3 AM (Life Technologies, Grand Island, NY), bir membran geçirgen bir boya Kd = 325 nM. In vitro metodolojiler biz üç ile zamanın bir fonksiyonu olarak izlenir floresan değişiklikler, ve dördüncü tekniği ile zaman içinde tek bir noktada floresan değerleri ölçülmüştür. Tamamen onlar mekansal ve zamansal res sağlarlar bu farklı yaklaşımlar, birbirini tamamlayıcıtek hücre ve hücre nüfus düzeyleri hem de olution.
Hücre Nüfus veya Toplu Deneyler
Onlar iyi kurulmuş, basit ve tek bir deneyde hücre milyonlarca üzerinde yapılan ölçümlerden bilgilerin ortalama için izin çünkü ihtiyaç duydukları araçları da hazır, ancak çünkü toplu teknikleri yaygın olarak sadece kullanılır.
Teknik 1.. Geleneksel Florometre
Bu teknik, bir zaman fonksiyonu olarak floresans değişiklikleri izler; deneyler 200 ile 1,000 arasında değişen ul numune hacmi ile cam küvet içinde gerçekleştirilir. Ilave reaktiflerin uygun karıştırma Manyetik bir karıştırma gerektirir ve bu nedenle elde edilen zamansal çözünürlüğü saniye seviyesindedir. Analiz edilen örnekler arasında tipik bir hücre konsantrasyon aralığı, 10 5 8 -10 hücre / ml 'dir.
Teknik 2.. Durduruldu Akış Florometre
Ttekniğini de zamanın bir fonksiyonu olarak floresans değişiklikleri izler, ancak reaktifler hızlı bir şekilde çok küçük bir numune hacmi (25-100 ul kadar) ihtiva eden bir kaydın küvet içinde (basınç kullanarak) birlikte karıştırılır. Bu nedenle, reaktif homojenizasyon milisaniye için yüksek temporal çözünürlük sağlayan, anlıktır. Ortaya çıkan floresan karşı zaman izleri analizi analiz örneklerin ortak bir hücre konsantrasyonu aralığı kısa süreli bir tepkime ara maddeler, vs hakkında bilgi elde edilmesi, reaksiyon mekanizması karmaşıklığı açıklık, tepkime hızını belirlemek için uygun olan 10 5 -10 7 hücre / ml.
Tek Hücre Deneyler
Toplu deneyler hücrelerin büyük bir sayısının ortalama davranışı rapor, ancak, bir popülasyon sıklıkla bu tip ölçümler sırasında göz ardı edilir heterojen özellikler sergileyebilirler. Tek hücre teknikleri böylece inci tamamlamak için kullanılıre bilgi hücre popülasyonu deneylerle elde.
Teknik 3.. Sitometrisi
Tek bir hücre ölçümlerinin kaynaklanan bilgiyi önemine rağmen, bütün bir nüfus hücreye spesifik özelliklerinin hatalı ekstrapolasyon önlemek amacıyla hücreleri, çok sayıda analiz etmek önemlidir. Bu nedenle, yüksek verimli teknikleri tercih edilmektedir ve en popüler yöntem durumda 10.000 hücreleri geleneksel olarak analiz edildiği, akım sitometri olduğunu. Onların boyutu (ileri dağılım (FSC)), boyu (yan dağılım (SSC)) ve floresan yoğunluğu (bir antikor ile özel etiketleme, canlılığı işaretleyici, vb) göre hücreleri sınıflandırır Bu yöntem heterojen nüfus çok-parametrik analiz sağlar , böylece bir hücre grubu için parametreleri 'dağıtım hakkında bilgi veren. Flow sitometri oldukça zaman bağımlı bilgi 8'den anlık sağlar. Ileri ve yan dağılım değerleri arhücreleri içerir, ancak floresan ölçümleri, negatif ve pozitif floresan kontroller için hücresel enkaz, toz, vb ayrımcılık bir kapı seçmek için de yararlıdır e de dahil edilmelidir. Birden fazla flüoresan kanalı kullanıldığında, dengeleme olarak bilinen bir işlem (ayrıntılar için bkz gerçekleştirilmelidir http://www.bdbiosciences.com/resources/protocols/setting_compensation.jsp ). Tazminat fluorophores arasında spektral örtüşme ayrımcılık sağlar. Akış sitometri de propidyum iyodür boyaması yolu ile, genellikle, ölü hücreler arasında ayrım sağlar.
Teknik 4.. Tek Hücre Görüntüleme
Mikroskopi tek hücre davranışlarını incelemek için başka bir yaygın yöntem değil, iyi zamana bağlı çalışmaları için uygun ve aynı zamanda uzaysal çözünürlüğü sağlar. Bir büyük dezavantajı yüksek verimlilik analizi şu anda emekleme döneminde sadece olmasıdır kadar.
Protokol
Bu yazıda ölçmek için, dört bahsi geçen tekniklerin kullanımı rapor [Ca 2 +] i insan sperm hücreleri değişiklikler. Iyi bu steroid geçici bir [Ca 2 +] i sperm artış ürettiği kurulmuştur Biz, bir Ca 2 + cevabı tetiklemek için progesteron kullanılır. Özellikle, insan sperm, progesteron doğrudan sperm hücreleri 10,11 plazma membranında özel olarak ifade edilen bir Ca2 + kanal (yani CatSper) harekete geçirir. Ayrıca ölçülen dinlenme [Ca 2 +] i de yaygın bir artış [Ca 2 +] i kapasitasyonu sırasında meydana geldiği kabul olduğu göz önüne alındığında kapasitasyonu öncesi ve sonrası. Minimum floresans değer için, floresans gidermek için Mn + 2 kullanılan, bir pozitif kontrol gerektiren teknikleri için biz iyonoforu-ionomycin-, hücre içine maksimal Ca2 + alımı meydana ve bu nedenle, maksimum floresan tepkisi, Ca 2 el.
1. Swim-up yöntemi ile sperm Numune Hazırlama (Şekil 1)
Yalnızca atılır (mastürbasyon ile elde) örnekleri olan özellikleri Dünya Sağlık Örgütü laboratuvar manuel (mevcut en son sürümü tarafından belirlenen parametreler yerine http://whqlibdoc.who.int/publications/2010/9789241547789_eng.pdf muayene için) insan semen ve işleme.
- 37 küvöz içine steril bir kap ve yerine o (gevşetti kapaklı) içinde sperm örneği almak ° C ve CO 30 dakika boyunca 2% 5 /% 95 hava. Bu adım, örnek sıvılaştırma içindir.
- Temiz bir cam test tüpleri (1.0 x 7.5 cm) altındaki sıvılaştırılmış meni örneği yerine 500 ul hacimde. Yaklaşık sekiz test tüpleri bir ortalama boyutu örneği (4 mi) için gereklidir.
- Ham F-10 orta dikkatlice tabakası 1 ml (su. 2 mM pplemented (Bakınız Şekil 1) Her meni kısım üstüne in vitro kapasitasyonu) teşvik etmek albümin CaCl 2 ve 5 mg / ml sığır serumu İPUCU: mikropipet ucu ile tüpün duvarı dokunun ve hafifçe dağıtmak Yukarıdaki örnek ortamı. Bu (örnek ve orta) her iki katmanları karıştırma olarak kaçınılmalıdır yavaş yavaş bunu yapmak için çok önemlidir.
- Dikkatlice yaklaşık 30 ° açıya tüpler yalın. Bu, böylece kuluçka sırasında numuneden orta insan hücrelerinin yer değiştirmesi (yüzmeye kadar) artırılması, iki sıvı arasındaki yüzey alanı artacaktır.
- 1 saat için 37 ° C ve% 5 CO2 / hava% 95 bir inkübatör içine eğildi test tüpleri grubu yerleştirin.
- Geniş hacimli bir 15 ml kullanmak için, bir mikropipet kullanarak dikkatli bir tek temiz bir cam tüp (1.0 x 7.5 cm her bir tüp ve havuz tüm toplanan örneklerden HAM F-10 orta (şimdi hareketli sperm içeren) üst 700 ul çıkarınFalcon tüp), kabarcık oluşumunu önlemek. Sonra Sıra 10 bir Makler Sayma Odası tabanının optik düz cam üzerinde toplanmış örnek ul ve cam kapak (Kapağı bir kere yerde, kaldırma ya da sperm örneği tek tip yayılmasını korumak için tekrar kapsayan kaçının) yerleştirin. Bu yanlış bir hücre sayısı üzerinde neden gibi oda içinde kabarcık oluşumunu önlemek için emin olun.
- Bir bileşik mikroskop (bir 20X objektif kullanılması tavsiye edilir) altında gözlemleyin. Makler Sayma Odası cam kapak 100 küçük kareler (yani 10 grid tarafından 10) oluşan büyük bir kare vardır. 10 kareler herhangi şerit hücreleri saymak. Bu sayı, hücre / ml 'lik milyonlarca kendi konsantrasyonunu temsil eder. Iki ek 10-kare şerit sayısı tekrarlayın ve üç adet ortalama NOT hesaplamak:. Bir Makler Sayma odası (ki özellikle sperm hücreleri saymak için tasarlanmıştır) mevcut değilse, herhangi bir hemasitometre odası kullanılabilir.
- Numunenin fina ayarlayın1x10 7 hücre / ml 'ye l' lik konsantrasyonda Ham F-10 ortamı eklenmiştir. Gerektiğinde, 37 örnek ° C'de inkübe edin ve CO kapasitasyonu teşvik etmek için, 5 saat boyunca 2% 5 /% 95 hava.
2. Ca 2 için Floresan Boya Yükleniyor + Ölçümler
Hücre içi Ca 2 + ölçmek için kullanılabilecek birkaç floresan boyalar vardır; uygun olanı kendi Kd göre seçilmelidir, ve emisyon ve uyarma dalga boyları (sırasıyla kalitatif ve kantitatif ölçümler, tek ve çift emisyon ve uyarma dalga boyları için, olmalıdır el) Daha fazla bilgi). Bu niteliksel uygulama için Fluo kullanılan-3, Bir bir K d = 325 nM hücre geçirgen boya ve sırasıyla tek emisyon ve uyarma 506/526 nm dalga boylarında 12 var.
- 50, 1 mM ul Fluo-3-on 50 mg boya flakonun içeriği eriterek stok çözeltisi AM (MW = 1130 g / mol) susuz DMSO 44 ul. Hazırlayın
- 1.5 ml mikrofüj tüpü kullanılarak yeterince 1 mM spermin süspansiyonu gerekli hacmi (aşağıda her bir teknik için gereken miktar bakınız) karışımı Fluo-3 2 uM Fluo-3 AM (örneğin, 1 ul bir son konsantrasyon elde etmek için stok solüsyonu AM stok Fluo-03:00 sperm süspansiyonu her 500 ul) için eklenir.
- 37 ° C'de 30 dakika boyunca inkübe edilir ve ışıktan korunur.
- Bir mikrosantrifüj kullanarak 5 dakika boyunca 750 x g tüp santrifüj, aspire ve supernatant atın ve İnsan Sperm Orta uygun hacmi (aşağıda her bir teknik için gerekli konsantrasyonu bakınız) (HSM en pelet tekrar süspansiyon; mM: 120 NaCl, 15 NaHCO3 4 KCI, 1.8 CaCl2, 1 MgCl2, 10 HEPES, 10 Na laktat, 5 D-glikoz, 1 Na piruvat, pH = 7.4) Not: bulutu oluşumu yerine bir pelet hücreleri olduğunu gösterir iyi durumda.
- Hücreler artık boya ile yüklenir, yani bunların yaklaşık iki saat boyunca (37 ° C 'de tutulur ve ışıktan korunmuş olarak) canlı kalır ve aşağıdaki tekniklerden herhangi birinde kullanılabilir.
3. Teknik 1.. Geleneksel Florometre (bir Büyük Hücreli Nüfus gelen Ortalama Bilgiler)
Donanım: Bizim sperm nüfus için [Ca 2 +] biz manyetik karıştırıcı kontrolü Olis yazılımı (Bogart, GA, ABD) (SIM Aminco), tarafından işletilen ve bir Mavi LED (akuple bir SLM Aminco spectrofluorometer kullanmak i ölçümleri Luxeon Yıldız LXHL- LUMILEDS gelen LB3C,) ve Fluo-3 için 465-505 nm bant geçiren filtre (Chroma Technology Corp) uyarma var. LED bir özel yapılmış güç kaynağı (7 tarafından kontrol edilir00 mA). Emisyon ışık spectrofluorometer en monokromatör üzerinde 525 nm emisyon dalga boyu (λ Em) ayarlayarak ölçülür.
- Yer HSM 570 ul ve düz dipli cam tüp içinde sperm hücresi süspansiyonu 30 ul (daha önce Fluo-3 AM yüklendi ve 8 1x10 hücre / ml elde etmek için HSM yeniden süspansiyona alınmıştır) (numarası 8 x 50 mm). Tüp içinde manyetik bir karıştırma çubuğu yerleştirin ve spectrofluorometer ait okuma odasına (37 ° C'ye kadar ısıtılmış) içine tüpü, her toplama süresi sırasında örnek ilave edin.
- Donanım yazılım (bu durumda Olis yazılımı) kullanarak deney başlayın ve 300 saniye boyunca 0.5 Hz'lik bir frekansta floresan değerleri elde etmek için devam edin. Aşağıdaki gibi, bir Hamilton mikro şırınga kullanılarak bir stok çözelti (arzu edilen son konsantrasyona göre genellikle daha konsantre 100X) uygun hacim enjeksiyon ile arzu edilen test bileşikleri uygulanır:
- 30 saniye için bazal floresan edinin.
- 4 mcM progesteron (Pg) ekleyin.
- 100 saniye (bir pozitif kontrol olarak, maksimum flüoresans değeri elde etmek için) 20 uM ionomycin ekleyin.
- Yukarıdaki 3.2.3 adımları 3.1 tekrarlayarak, ancak bunun yerine Sf sadece bir çözücü (% 0.01 susuz DMSO ile YH) eritmek için kullanılan ekleyerek, bir negatif kontrol çalıştırın.
- Microsoft Excel'e ham floresan değerleri İhracat ve aşağıdaki denklemi kullanarak bunları normalleştirmek: (F/F0) - 1. F, herhangi bir zamanda (t) 'de ölçülen floresans yoğunluğu, ve F0 ilk 30 saniye sırasında alınan ortalama bazal floresan olduğu. 1 değerleri vs zaman (Şekil 2A) - toplam serisi (F/F0) çizilir. Test bileşikleri (kadar taşınmış) ve buna ek olarak önce ve sonra floresan yoğunluk değerleri arasındaki fark ölçün, bir çubuk grafik çizmek ve bunları uygun istatistiksel analiz yöntemleri (Şekil 2B) kullanılarak veri işlem.
4. Teknik 2.. Flo Durdurulduw Florometre (bir Büyük Hücreli Nüfus gelen Yüksek Geçici Çözünürlük Bilgi)
Donanım: Hücre içi [Ca 2 +] değişiklikler biyolojik bilim aletleri (Grenoble, Fransa) bir MOS-200 hızlı kinetik optik sistemine bağlı bir SFM-20 durdu-akış mikser, iki kullanarak yüksek temporal çözünürlük ile ölçülür. Tüm veriler aynı şirketten Bio-Kine32 yazılımı ile analiz edilir.
- Ekipman uygun koşulları ayarlayın; aydınlatma kaynağı deney başlamadan önce en az 15 dakika açık olmalıdır;, uyarma ve emisyon filtreleri ayarlayın durdu akış üretici tarafından kurulan aralığında voltaj değeri için photomultiplier ayarlamak ve ayarlamak 37 ° C banyo sıcaklığı
- HSM ya da (negatif kontrol), 1 Fluo-3 AM-yüklü sperm hücreleri (1x10 7 hücre / ml) ilave edildi ve test edilecek olan bileşik, 1 ml ile ikinci şırınga ile aletin şırınga birini doldurun10 mcM ionomycin (pozitif kontrol) veya HSM çözünmüş 10 mcM Pg Not:. Bu adımda bu şırınga içine sıvı çizerken kabarcık oluşumunu önlemek için çok önemlidir.
- Onlar şırınga pistonları ucuna dokunmak kadar her iki alet pistonlar kaldırın.
- Hücre hasarı en aza indirmek için bir ölçülebilir bir tepki sağlayacak minimum değere akış hızını ayarlayın. Biz, SFM-20 sistemde kullanmak akış hızı 1 ml / sn 13'tür.
- Frekans (bu durumda 10 milisaniye olarak) ve toplam örnekleme zaman (bu durumda 50 sn) ayarlayın.
- . Reaktiflerin karıştırma NOT Tetik: Bir seferde tek bir tetik elle yapılabilir olsa da, otomatik ardışık tetikleyen bir dizi de önceden programlanmış olabilir.
- Ham floresan (keyfi adet) vs zaman iz bilgisayar ekranında görüntülenir.
- Başına reaktiflerin karıştırma düz bir çizgi olan bir iz oluşturur. Böylece, sırayla gerçek [Ca elde etmek için2 + uyarıcı türetilen] değiştirmek, orta (negatif kontrol) ile karıştırma hücrelerinden elde edilen kontrol izleme deney izleri her birinden çıkarılabilir olmalıdır. Gerektiği gibi veri analiz, bazı kinetik parametreler de Bio-Kine32 toplama yazılımı ile elde edilebilir. Çıkarma işlenmemiş izleri karşılaştırması için ilave Şekil 1 'de gösterilmiştir.
- Test bileşiği şırınga reaktif değiştirmek için, distile su ile iyice temizlemek. Daha sonra distile su ile maksimum ses için şırınga doldurun, durdu akış flüorometre karşılık gelen piston yerleştirin ve iç mekanizması (su atık kabını yönelik olmalıdır durulama) yoluyla su itin. Iki kez daha bu adımı yineleyin.
- Bir sonraki arzu edilen test bileşiği ile bir ikinci şırınga doldurma, adım 4,2-4,9 tekrarlayın.
- Deney sonunda tamamen suyun drenaj, distile su ile tüm ekipman durulamaiç hortumlar.
5. Teknik 3.. Sitometrisi (Hücre Büyük Bir sayısı Elde Edilen Tek Hücre Bilgi)
Donanım: Bu teknik zaman içinde bir anda birkaç parametre aynı anda ölçüm sağlar, ancak önceki teknikleri aksine, zaman içinde değişiklikleri ölçmek değildir, daha çok ölçüm sırasında parametre değerlerini sağlar. Bu nedenle, bunun yerine, bu durumda, bir yanıt tetiklemek için Sf ekleme sperma hücrelerinde + seviyesi önce ve kapasitasyonu uyaran sonra, hücre içi Ca2 ölçülür. Biz bir FACSCanto Sitometre (Becton Dickinson) kullanılan ve veri FlowJo yazılım (Ağaç Yıldız 9.3.3) ile analiz edilmiştir.
- Test edilecek her koşul altında tüp başına hücre süspansiyonu 500 ul (4x10 6 hücre / ml) yerleştirilerek sitometresi tüplerinde deneysel numunelerin hazırlanması (bu durumda, on koşulları, Tablo 1 'e bakınız). Sağa sola floresan veri toplamakÖrnek başına m 10.000 olaylar.
- Bir deney için ekipman yazılımı kullanmak ayarlamak için:
- Yeni oluşturun: klasör, deney, örnek ve tüpler sayısı.
- Için uygun sitometresiyle ayarları seçin Fluo-3 AM (izotiyosiyanat-filtre FITC-Floresein kullanın) ve PI (iyodür-filtre PI-Propidium kullanın).
- Sitometresinde boyanmamış kontrol tüpleri 1 ve 2 çalıştırın. Eşik ayarları uygun olduğunu doğrulamak için ve hücrelerden enkaz ayrımcılık için ilgili kapısı oluşturmak için FSC ve SSC veri toplamak.
- Tazminat kontrolleri oluşturmak için, aşağıdaki kontrol numunelerinin çalışılabilmesi, otomatik ve maksimum floresan verileri (PI ve FITC kanal) (Not: Bu görevi genellikle cihazlarının teknisyen tarafından gerçekleştirilir) toplama:
- Boyanmamış hücreler (boru 1 ve 2).
- Hücreler Fluo-3 AM (2 mcM) (tüpler 3 ve 4) ile yüklendi.
- Ölü hücreler (sperm, oda sıcaklığında 10 dakika boyunca HSM içinde% 0.1 Triton X-100, asılı)37 ışığı (tüpler 5 ve 6) korunmaktadır ° C, 30 dakika boyunca, PI (örneğin, 2.4 mm PI 0.25 ul Sperm süspansiyonu 500 ul eklenir 1.2 uM PI) ile boyandı.- Kaydedilen verileri görüntülemek ve istenen nüfus için kapı seçin.
- Kapıyı ayarlayın ve Tüm Tazminat Kontroller için "Uygula" seçeneğini seçin.
- Deneme> tazminat kurulum> tazminat hesaplamak seçin.
- Tazminat kurulum ve bağlantı ve kaydetmek yeniden adlandırın.
- Tüm deneysel tüpleri (Bu durumda, tüpler 7-10) çalıştırın. Sonunda, (adım 5.6) analizi için mevcut yazılım tüm verileri.
- Donanım yazılımı, ticari FlowJo yazılım veya Cytobank özgür yazılım (kullanarak her deney sonuçlarını analiz http://www.cytobank.org/ ).
6. Teknik 4.. Tek Hücre Görüntüleme (Yüksek Uzaysal Çözünürlük Tek Hücre Bilgi)
Donanım:. Ismarlama Görüntüleme kurulum Bizim görüntüleme set-up bir sıcaklık kontrolörü (Medical System Corp, Greenvale, NY), bir Nikon PlanApo 60X (1.4 NA immersiyon yağı) ile donatılmış bir ters Nikon Diaphot 300 mikroskop oluşmaktadır objektif. Floresan aydınlatma bir Luxeon V Yıldız Lambertian Mavi LED kısmı özel yapılmış stroboskopik kontrol kutusuna bağlı # LXHL-LE5C (Lumileds Aydınlatma LLC, San Jose, CA) tarafından sağlanır. LED dikroik ayna M40-DC400 (Rapp Opto Elektronik, Hamburg, Almanya) (: uyarma 450-490 nm, dikroik ayna 505 nm ve emisyon 520-560 nm bant genişliği) ile bir FlashCube40 derleme monte edilmiştir. LED çıkış tek maruz başına 2 msn süresince tek bir flaş üretmek için kontrol kutusu ile bir Cool Yapış CCD kamera sinyal Out Pozlama için senkronize edildi. Kamera poz süresi, flaş süresi (2 msn) eşdeğer kurulmuştur. Görüntüler her 250 msn (toplanır ya göre ayarlanabilirIQ yazılımı (Andor biyogörüntüleme, Wilmington, NC) kullanarak istenen zamansal çözünürlük).
- Merkezi poli-L-lizin solüsyonu, 5 ul damla (0.01% w / v) uygulanarak yuvarlak kapak slipleri (çap = 25 mm) hazırlayın. En az 1 saat (bu kuruyabilir) bekletin. Bir püskürtme şişesi kullanarak kullanımdan önce su ile tedavi alanı yıkayın. Kendi kamçı hala taşıyabilirsiniz yaparken bu işlemi, sperm hücrelerinin kendi kafasından kapak kayma bağlı sağlayacaktır.
- Tablo 2'ye göre HSM içinde eritmek suretiyle test edilecek bileşiklerin hazırlayın. Bileşikler (içerisinde gösterildiği gibi bölme içinde zaten mevcut hacmi ile karıştırıldığında olacak her zaman aynı hacim eklemek için, ve dikkate alınarak seyreltme stok solüsyonun konsantrasyonu ayarlamak için emin, aynı kayıt odasına art arda ilave edilir Tablo 2). Kullanıldıkları ° C kadar 37 banyo tüm test çözümleri tutun.
- Rec içindeki kapak kayma montearasında ording odası ve bir yer 10 ul Fluo-3 AM-merkezinde yüklü hücreler (1 x 10 7 hücre / ml). Önceden ısıtılmış HSM 200 ul hücreleri kapsar.
- 37 önceden ısıtılmış mikroskop sahnede odasına yerleştirin ° C, hücreler (faz kontrast kullanarak) görüntülemek ve görüntüleme için bir alan seçin. Bu hücre yoğunluğu (Şekil 5A bakınız) uygun bir alan seçmek önemlidir; çok fazla hücre nedeniyle örtüşen sinyalleri analiz zorlaştırır NOT: Hücreler sıkıca başkanı tarafından kapak kayma takılı ama teyit flagellar hareket, sergilenmesi gerekmektedir. canlılığı.
- Odak ve parlaklık ayarlamak için canlı modda floresan görüntüler elde.
- Zaman serisi görüntü elde etme yazılımı (bu durumda IQ) aktive ederek deney başlayın. Genellikle dört resim resim başına 2 msn aydınlatma ile saniyede elde edilir.
- (Damla damla) dikkatle eklemek için bir mikropipet kullanarak test bileşiği (bu durumda Pg), imag devamE elde gereklidir ve aynı hücre, iki sıralı kontrol ekleme yerine olarak: (1) 20 uM ionomycin maksimum flüoresans elde etmek için, (2) 2, 5 mM MnCl az floresan elde edildi. Alternatif olarak, bileşikler, uyarıcı kaldırılması, ve muntazam bileşik ile hücrelerin yıkanmak yeteneğini sağlayan avantajları sunan bir perfüzyon odası kullanılarak ilave edilebilir. Aynı zamanda, bu çözeltinin büyük miktarlarda gerektiren dezavantajları vardır ve sıcaklık kontrolü daha da sorunlu hale gelmez.
- Istenilen her test bileşiği ile, yeni bir toplama odasına tekrarlayın.
- IQ Yazılım veya Resmi J freeware kullanarak donanım yazılım, veya çevrimdışı kullanarak görüntü analizi çevrimiçi gerçekleştirin. Her hücrenin (veya hücre parçası) çevresinde ilgi (ROI) bölgeleri çizin ve aynı zamanda hücre-serbest bölge (otomatik arka plan çıkarma için yazılım tarafından) seçin. Bir zaman floresan serisi sonra her yatırım getirisi ve bu verilerin ma için elde ediliry daha fazla analiz için Microsoft Excel ihraç edilebilir. - 1 (F/F0): Biz şu denklem kullanılarak floresan değerleri normalleştirmek. F herhangi bir zamanda (t) ölçülen floresan ve F0 ilk 30 saniye boyunca alınan ortalama floresan nerede. 1 vs zaman (Şekil 5B) - toplam serisi (F/F0) çizilir. Değerler aynı zamanda% 100 olduğu gibi ilave edilmesinden sonra elde edilen ionomycin floresans değer kullanılarak normalize olabilir.
- Görüntü Analizi alternatif Resim J ücretsiz yazılımı kullanılarak yapılabilir.
Teknik 1.. Geleneksel Florometre
Progesteron beklendiği gibi, bir geçici tahrik yapan, bilinen bir AR indükleyici biridir ve [Ca2 +] i insan sperm (Şekil 2'de gösterildiği gibi) artar. Bir kalsiyum iyonofor (ionomycin) ilavesi maksimum neden olur [Ca 2 +] bazal düzeylere geri dönmez i artış,.
Teknik 2.. Stepesinde Akış Florometre
Progesteron bağlı [Ca 2 +] i artış (konvansiyonel fluorometri) daha önce olduğu gibi ölçülen, ama daha zamansal çözünürlüğe sahip bu kez oldu, bu durumda satın alma sıklığı 0.1 Hz oldu. Şekil 3 'de gösterildiği üzere her iki progesteron (geçici, kırmızı çizgi) ve ionomycin (sürekli, mavi çizgi) çok hızlı bir [Ca2 +] i artışa neden olmuştur. Progesteron bağlı [Ca 2 +] i artış bir gecikme olmaması bu progesteron doğrudan ara sinyal 10,14 olmadan Ca 2 + kanal CatSper, aktive düşündüren önceki raporlar ile uyumludur.
Teknik 3.. Akım Sitometri
[Ca 2 +] i kapasitan ve olmayan kapasitan insan sperm ölçüldü. Daha önce fare 15, sığır sperm 16 ve insan sperm 17 bildirildiği gibi, biz de artış [C gözlenen2 + olmayan kapasitan insan sperm göre kapasitan in] i. Baldi ve ark. (1991) 17 yüksek rapor bazal [Ca2 +] geleneksel bir fluorometre kullanılarak olmayan kapasiteye sahip olan insan sperm daha kapasiteye sahip olan i. Bu çalışmada biz i öncesi ve in vitro kapasitasyonu de sonra [+ Ca 2] ölçmek için akım sitometri kullanılır. Flow sitometri kapasitan sperm (Şekil 4D, mavi iz) için floresan değerlerinin dağılımı olmayan kapasitan sperm (Şekil 4D, kırmızı iz) göre daha yüksek değerlere kaymıştır olduğunu görmek için bize sağlar. Her bir hücre için floresans değerleri Şekil 4G gösterilen iki-boyutlu nokta parsellerde gözlemlenebilir; önemlisi, ölü hücreler (yaklaşık% 15) kaynaklanan sinyal (Şekil 4G, üst çeyrek) elimine edilebilir.
Teknik 4.. Tek Hücre Görüntüleme
Progesteron-nedenD [Ca2 +] i değiştirmek tek sperm hücreleri içinde ölçüldü. Progesteron ek olarak bir artış neden olur [Ca 2 +] sperm baş ve kamçı hem i. Nüfus deneylerde görüldüğü gibi, tek bir hücre analizi sırasıyla, bir geçici ve progesteron ve ionomycin için sürekli artış saptandı.
Sonuçlar
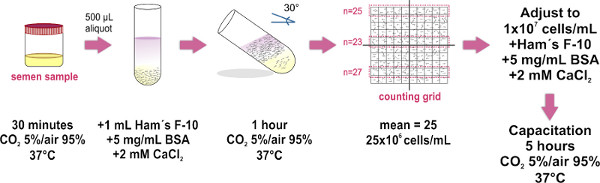
1 Şekil. Havuz yöntemi ile sperm örneği hazırlanması için deney protokolünde. Hareketli sperm ayrılması için ve konsantrasyon ayarı için önemli adımlar şematik diyagramı gösterilmiştir. Kapasitasyonu gerekli olduğu zaman, son adım yalnızca inkübasyon gerçekleştirilir.
Tartışmalar
Hücre içi sinyal en hücresel faaliyetleri için hayati önem taşımaktadır, Ca 2 + yaşam döngüsünün sonuna kadar, gübreleme kendi kökenli, onların bütün ömrü boyunca memeli hücrelerinde eşlik her yerde bulunan bir elçisidir. Farklı uyaranlara yanıt olarak, [Ca 2 +] i artar, salınır ve uzay-zamansal kodlama ile azalır, buna göre, çeşitli süreçler aktive, modüle veya Ca 2 +-kodlanmış mesajları ile sonlandırıldı. Hücre içi Ca2 + iyon Bu siny...
Açıklamalar
Biz ifşa hiçbir şey yok.
Teşekkürler
Yazarlar teknik yardım için Jose Luis De la Vega, Erika Melchy ve Dr Takuya Nishigaki teşekkür ederim. Dirección General de asuntos del Kişisel Académico / Universidad Nacional Autonoma de México (CT IN202212-3); Bu çalışma Consejo Nacional de Ciencia y Tecnología (CONACyT-Meksika) (BT için 99.333 ve 128.566) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Ham's F-10 | Sigma-Aldrich | N-6013 | |
| Bovine Serum Albumin | Sigma-Aldrich | A-7906 | |
| Calcium Chloride Dihydrate approx. 99% | Sigma-Aldrich | C-3881 | |
| Makler Counting Chamber | SEFI Medical Insruments LTD | SEF-MAKL | |
| Fluo-3 AM | Invitrogen | F-1242 | 20 vials/50 μg each |
| Ionomycin | Alomone | I-700 | |
| Progesterone | Sigma-Aldrich | P0130 | |
| Sodium chloride | Sigma-Aldrich | S-9888 | Reagents for human sperm medium (HSM) |
| Potassium chloride | Sigma-Aldrich | P-3911 | Reagents for human sperm medium (HSM) |
| Sodium bicarbonate | JT Baker | 3506 | Reagents for human sperm medium (HSM) |
| Magnesium chloride | Sigma-Aldrich | M-2670 | Reagents for human sperm medium (HSM) |
| Calcium chloride anhydrous | Sigma-Aldrich | C-1016 | Reagents for human sperm medium (HSM) |
| HEPES | Sigma-Aldrich | H-3125 | Reagents for human sperm medium (HSM) |
| D-Glucose | JT Baker | 1906-01 | Reagents for human sperm medium (HSM) |
| Sodium pyruvate | Sigma-Aldrich | P-2256 | Reagents for human sperm medium (HSM) |
| Sodium L-lactate (aprox. 99%) | Sigma-Aldrich | L- 7022 | Reagents for human sperm medium (HSM) |
| Propidium Iodide | Invitrogen | L-7011 | Component B |
| Triton X-100 (t-Octylphenoxypolyethoxyethanol) | Sigma- Aldrich | X-100 | 2.4 mM solution in water |
| Round coverslip | VWR | 48380 080 | 25 mm diameter |
| Poly-L-lysine solution | Sigma-Aldrich | P8920 | |
| Manganese chloride | Sigma-Aldrich | M-3634 | |
| Attofluor; Cell Chamber, for microscopy | Life technologies | A-7816 | |
| Dimethyl Sulphoxide | Sigma-Aldrich | D2650 | 5x5 ml |
Referanslar
- Bouschet, T., Henley, J. M. Calcium as an extracellular signalling molecule: perspectives on the Calcium Sensing Receptor in the brain. Comptes Rendus Biologies. 328, 691-700 (2005).
- Darszon, A., Nishigaki, T., Beltran, C., Trevino, C. L. Calcium channels in the development, maturation, and function of spermatozoa. Physiol. Rev. 91, 1305-1355 (2011).
- Esposito, G., et al. Mice deficient for soluble adenylyl cyclase are infertile because of a severe sperm-motility defect. Proc. Natl. Acad. Sci. U.S.A. 101, 2993-2998 (2004).
- Avenarius, M. R., et al. Human male infertility caused by mutations in the CATSPER1 channel protein. American Journal of Human Genetics. 84, 505-510 (2009).
- Carlson, A. E., et al. Pharmacological targeting of native CatSper channels reveals a required role in maintenance of sperm hyperactivation. PLoS ONE. 4, e6844 (2009).
- Brokaw, C. J. Calcium and flagellar response during the chemotaxis of bracken spermatozoids. J. Cell. Physiol. 83, 151-158 (1974).
- Visconti, P. E., et al. Capacitation of mouse spermatozoa. II. Protein tyrosine phosphorylation and capacitation are regulated by a cAMP-dependent pathway. Development. 121, 1139-1150 (1995).
- Svahn, H. A., van den Berg, A. Single cells or large populations. Lab on a chip. 7, 544-546 (2007).
- Pepperkok, R., Ellenberg, J. High-throughput fluorescence microscopy for systems biology. Nat. Rev. Mol. Cell Biol. 7, 690-696 (2006).
- Strunker, T., et al. The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm. Nature. 471, 382-386 (2011).
- Lishko, P., et al. The Control of Male Fertility by Spermatozoan Ion Channels. Annu. Rev. Physiol. , (2011).
- Kao, J. P., Harootunian, A. T., Tsien, R. Y. Photochemically generated cytosolic calcium pulses and their detection by fluo-3. J. Biol. Chem. 264, 8179-8184 (1989).
- Kilic, F., et al. Caged progesterone: a new tool for studying rapid nongenomic actions of progesterone. Journal of the American Chemical Society. 131, 4027-4030 (2009).
- Lishko, P. V., Botchkina, I. L., Kirichok, Y. Progesterone activates the principal Ca2+ channel of human sperm. Nature. 471, 387-391 (2011).
- Xia, J., Ren, D. The BSA-induced Ca2+ influx during sperm capacitation is CATSPER channel-dependent. Reprod. Biol. Endocrinol. 7, 119 (2009).
- Galantino-Homer, H. L., Florman, H. M., Storey, B. T., Dobrinski, I., Kopf, G. S. Bovine sperm capacitation: assessment of phosphodiesterase activity and intracellular alkalinization on capacitation-associated protein tyrosine phosphorylation. Mol. Reprod. Dev. 67, 487-500 (2004).
- Baldi, E., et al. Intracellular calcium accumulation and responsiveness to progesterone in capacitating human spermatozoa. J. Androl. 12, 323-330 (1991).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır