Method Article
3D-神经导航
* 这些作者具有相同的贡献
摘要
在这项研究中,作者报告,第一次一个新颖的3D拟真互动神经导航(3D-IIN)通过体内病人的大脑μ-阿片系统自发的偏头痛发作的影响。
摘要
越来越多的研究机构,主要由基于MRI研究产生显示,偏头痛出现发生,并可能忍受,由于在中枢神经系统特定神经过程的改变。但是,目前还缺乏有关这些变化的分子影响,特别是对在偏头痛的内源性阿片系统,并通过这些改变神经导航从来没有做过。本研究旨在探讨,采用了新颖的3D沉浸式和交互式的神经导航(3D-IIN)的方法, 在体内偏头痛发作时大脑中的内源性阿片μ传输。这无疑是与疼痛调节相关的最中央neuromechanisms之一,影响的痛苦经历和镇痛的多个元素。一名36岁的女性,谁一直患有偏头痛10年,被扫描的典型头痛(发作),并使用正电子EMISS nonheadache(间期)分期偏头痛离子体层摄影术(PET)与选择性示踪剂[11 C] carfentanil,这使我们能够在大脑中(非移动的结合潜力- μORBP ND)测量μ-阿片受体的可用性。短寿命放射性示踪剂由校园回旋加速器和化学合成装置位于靠近成像设施生产。这两种PET扫描,发作间期和发作期,在此期间患者的月经周期的不同的中晚期滤泡相定。在发作期的PET会话她自发头痛发作严重的达到强度等级;发展到恶心和呕吐在扫描会话结束。有在发作期减少μORBP ND中的内源性μ-阿片系统的疼痛调节区域,包括扣带回皮质,伏隔核(NACC),丘脑(沙利度胺),和导水管周围灰质(PAG);这表明μORs已经占领了释放的内源性阿片类药物响应于持续的疼痛。据我们所知,这是第一次在偏头痛发作时改变了μORBP ND使用一种新的三维方法已neuronavigated。这种方法允许在实际的病人的脑成像数据集偏头痛发作的互动研究和教育的探索。
引言
偏头痛是一种慢性三叉苦疾病,影响近16%的女性和男性在美国的6%,和世界各地的1-3。重复偏头痛发作对患者的生存有很大一部分产生影响,影响寿命和性能质量,耗资数十亿美元的错过了上学/上班日及医疗利用4。在衰弱的头痛发作,其患者要有毒(痛觉过敏)有显着的敏感性增加,甚至nonnoxious刺激(痛觉超敏)5。
μ-阿片类神经递质系统是在我们的大脑中主要的内源性疼痛调节机制之一。它参与的实验和临床疼痛知觉的调节,以及在阿片类药物6-9已与偏头痛发作的10的慢性化相关联的镇痛作用。在正电子发射托莫的新进展摄影术(PET)的分子成像允许的重要分子机制,慢性疼痛患者体内 11大脑的研究。在这项研究中,尽管同步偶然的和衰弱的与PET /示踪剂会话建立的复杂的偶发攻击性质的具有挑战性的物流,三维神经导航用于在第一时间在患者的关键疼痛矩阵的区域,调查μOR可用在一个自发的偏头痛的大脑。
病例报告
一名36岁的亚裔女子被纳入研究。她提出了一个10年的历史偏头痛的视觉先兆。右侧偏头痛发生的平均每月12天,中度至重度疼痛的强度,通常会持续72小时(如果不及时治疗或治疗失败)。有头痛发作在她的月经周期,频率增加而有整个研究一个规律。伴随症状包括:恶心,呕吐,畏光,畏声和。在常规头痛发作,她没有提出任何植物神经症状。至于治疗,她只用药物流产的治疗,这是基于非甾体抗炎药管理她的症状,而且没有迹象表明药物过度使用或阿片类药物的摄入量。筛查访问期间,临床检查无异常,无异常,系统回顾了在正常范围内。她是单身,没有孩子,没有使用避孕药物。
研究方案
这项研究应该由当地的机构审查委员会的批准,并经放射性药物研究委员会。该研究课题提供了书面的知情同意参与这项研究。该协议被分成三个时间顺序的步骤:
- MRI检查会话
- 在偏头痛的发作阶段(头痛)的PET会话
- 在偏头痛的发作间期阶段(无头痛)的PET会话
病人负责填写一份头痛日记,并与研究小组证实在成像会议当天偏头痛发作的发生。两者间期和发作期,PET扫描应在病人(月经出血的第一天后5〜10天)之独立中晚期滤泡期,在这种情况下被跟踪和计算事先由具有专门知识的妇科医生安排在实地(YRS)。
1,MRI会议
- 预配对的实验
- 在此之前准备的主题为扫描,就必须遵循正确的安全注意事项,由于MR扫描仪的磁场。所有的研究人员必须无金属进入MR手术室之前。
- 提供知情同意书的复印件,初步筛选过程中通过研究志愿者先前签署的,到MR技师。
- 准备科目的扫描
- 在MRI检查的当天,要求研究对象填写一份安全的MRI筛查表。此表适用于需要在密歇根大学所采取的任何核磁共振 - 功能磁共振成像实验。问卷强化了主体也无金属,没有医疗条件,需要仔细和特别的考虑( 例如 ,金属异物碎片,植入机械/电气设备)。
- 放心的参与者理解的MR程序,风险和利益。
- DELIV呃完成筛查表到MR技师谁将会协助的程序。
- 在一间期阶段在3特斯拉的扫描仪的病人获取T1加权解剖MRI扫描。
- 使用下面的序列参数MRI收购:
- A.轴向宠坏梯度回忆(SPGR)3D采集
- B.带宽= 15.63
- C.重复时间[TR] = 9.2毫秒
- D.回声时间[TE] = 1.9毫秒
- E.反转恢复准备500毫秒
- F.翻转角= 15°
- G. 25/26视场
- 激励的H.号码[NEX] = 1
- 一,144连续切片
- J.1.0毫米层厚
- K. 256×256矩阵
- 使用下面的序列参数MRI收购:
2,发作期的PET会话
- 准备实验
- 在此之前确认在大学医院的扫描,联系主体,以验证其pH值在在月经周期的酶她将在扫描的一天。建议在执行过程中晚期卵泡期(5〜10天以下的月经出血,发病时间)PET扫描。
- 提交一个请求到医院生产的[11 C] carfentanil,短寿命放射性示踪剂与μ-阿片受体的选择性亲和力,在扫描附近使用回旋加速器。示踪剂必须产生在扫描前2小时。
- 就势发作的PET扫描的当天,请与主体2小时预约前进行确认一个自发的偏头痛发作的存在。如果偏头痛发作的存在,验证了偏头痛的诊断以下头痛疾病国际分类。经诊断,确保参与者能够安全到达医院接受扫描。提供运输,如果这个问题不舒适的驾驶,或者如果没有指定驱动程序可用。
- 准备苏bject用于扫描
- 当参与者到达医院,护送她到PET套件诊断依据头痛疾病国际分类重新验证。前向扫描中,执行一个尿液药物测试,以确认该主题没有摄入可能与对示踪剂[11 C] carfentanil,后跟一个尿妊娠试验相互作用的任何物质。
- 重申参与者理解的PET过程,风险和收益。
- 提供知情同意书的复印件,初步筛选过程中通过研究志愿者先前签署的,以核医学技师。
- 随着核医学技师的指导下,协助个案解决放入扫描仪。
- 有课题经过1 90分钟的PET扫描使用的是西门子的HR +扫描仪在3D模式下(重构图像有全宽半高(FWHM)号决议〜5.5毫米的平面和5.0毫米轴向)。
- 对于每一个[(11)C] carfentanil剂量(555活度≤0.03微克/千克),辖50%,因其余药丸连续输注扫描的过程中示踪剂给药后约35分钟,以达到稳态示踪水平。
- 发作间期PET会话。
- 在非头痛期2.6 - 重复步骤2.2。
3,PET数据重建
- 使用交互式算法到在视场(FOV)28.8厘米直径的领域的128×128像素矩阵重建PET图像。
- 获得21图像帧和共同寄存器彼此在扫描过程中,以校正运动。
- 获得6分钟传输(68Ge的源)扫描前的PET扫描进行衰减校正的目的。
- 转换的动态图像数据上的体素逐体素基准分为两组参数图像的每个扫描中(10 - 40分钟):
- 用示踪交通措施(K1慧慧O)的配准和标准化程序;和
- 使用受体相关措施,BP ND,成正比的Bmax(受体浓度)由KD(受体的亲和力)来划分。
- 通过使用参考区域为基础的洛根图形分析与枕叶皮质作为参考区12估计这些措施。
4,PET数据分析
注意:使用统计参数图(SPM8)软件按照下面的顺序解剖学标准化图像转换成模板的空间。
- 共同注册的MR扫描和K1扫描。
- 正常化的MR扫描使用DARTEL蒙特利尔神经学研究所(MNI)模板的大脑。
- 应用所产生的变形矩阵的PET图像。
- 通过比较变换后的MR和PET图像的MNI图谱模板确认共同注册和规范化的准确性。
- 感兴趣区域(ROI)分析。
检查正在疼痛的处理过程中从事一些双边的地区,包括的活动:
- 答:前/中间/后扣带回
- B.绝缘筒
- C.海马
- D.杏仁核
- E.尾状头/体
- F.伏隔核
- G.壳核
- H.横向/内侧苍白球
- 一,丘脑核(腹前,腹后外侧/内侧,外侧后,中线,侧/背内侧)
- J.导水管周围灰质(PAG)
- 定义MarsBaR(在每个该等地区的标准化空间,唯一的例外是PAG中放置3毫米的球面坐标生成PAG投资回报率:右:4,-28,-6,和左:-2,-28 ,-6,这PAG位置先前显示为健康对照组相比13,14具有扩散和连通性的改变在偏头痛的患者。
注:带[11 C测试-再测试研究[carfentanil显示的以及小于10%的BP ND措施的再现性,与大多数皮层区域为3 - 5%15。变化(COV = Std.Dev。/平均数)的最大系数,通常观察到在各区域具有最低的结合,但是,即使在皮层区域具有最低的结合BP ND冠状病毒的分别为〜0.5。因此,在投资回报率μORBP ND扫描之间的百分比变化只考虑时,10%以上为显著。
5,三维神经导航
- 准备一个3D-IIN经验
- 组织作为堆栈定义为16位,且密度和活化水平的图像设置在NIfTI容积数据格式的数据。
- 穿主动液晶快门眼镜,以使时间序列立体3D效果。快门眼镜,通过一只眼睛的阻塞操作,而对另一只眼睛的图像显示在屏幕上。然后,该过程重复用于另一只眼睛。这shutteri纳克效应发生在110赫兹。
- 被指示在其使用后,使用操纵杆用于与模拟相互作用。
- 装备快门眼镜和操纵杆反光标记通过威康动作捕捉系统,使太空中的物体进行精确的六自由度跟踪。
- 显示Aubject激活数据
- 使用XML配置文件来定义密度和活化水平颜色映射,应用程序开始时,被加载并与集群中的每一台计算机共享。
- 从由颈的内部装载功能的方式和“Niftilib”开源软件库设置提供NIfTIdata获得3维体积的细胞。
- 分享导致细胞体积与集群以提高速度中的每台计算机。
- 由一个OpenGL着色器(GLSL)的进行光线跟踪和体素具有不同的颜色和透明胶片定义的解释显示细胞体积以前共享的颜色映射的XML配置文件。
- 通过威康系统获取的位置,并以此来更新每个屏幕上的容积数据绘制的观点。
- 记录的交互,并使用它们来动态调整,并通过数据切平面内,以便在虚拟空间中进行导航。
6,三维沉浸式互动神经导航(3D-IIN)
- 在NIfTI数据格式,即使用Niftilib库解释的容积数据类型存储受激活数据。
- 取得的相互作用,并通过威康跟踪系统的位置,操纵杆装置和手势输入。使用此信息,以确保所显示的图像代表了正确的制高点,从而为数据集的实时探测,并启用动态控制使用熟悉的运动和控制方案( 图1),最多3个任意的切割面。
结果
患者向医院与右颞部和枕部搏动性头痛,与6日0-10疼痛量表强度。她有她的典型的偏头痛,但无先兆。它已经觉醒后5小时的(发作)的PET会话发起之前,她设法忍受它没有任何药物流产。据她所知,头痛不是由任何触发因素( 如酒精,睡眠不足)引起。无自主神经症状的报道,但畏光和畏声出席了会议。继发作的PET会话发起的头痛强度不断升级,达到严重水平(在0-10疼痛量表9)60分钟投入到学习中;发展到恶心和呕吐在扫描会话结束。减少μORBP ND被自发偏头痛(发作期)时注意到,在患者的大脑中,相比于基线(间期阶段)( 图2)。在那里,我们重新专利削减μORBP ND中内源性阿片μ系统的主要痛苦矩阵区域,包括以下丘脑核:右背外侧(11,-19,-16:10.2%),右背内侧(6, -17,-8:11.1%),右中线(8,-19,-16:27%),以及腹前(9,-9,-12:12.0%)。此外,变化中发现了右前(8,35,14:13.7%)和左后扣带回皮层(-5,-44,23:11.8%),左尾状体(-11,6,15:12.0 %),内侧苍白球(右:16,-4,-3:16.2%;左:-14,-4,-3:22.6%),左伏隔核(-9,-11,-7:10.5% ),与海马(右:30,-22,-14:12.6%;左:-30,-22,-14:11.5%)。有只在左侧杏仁核(-23,-4,-19:11.7%)增加μORBP 请求 。在脑干的显著发作减少μORBP ND距吻端延长至尾鳍脑导水管周围灰质(PAG)(右:4,-28,-6:15.1%;左:-2,-28,-6:14.6 %)( 图由图3)。然而,在μORBP ND偏头痛发作期间全球半球百分比变化是温和的(右:8.5%;左:8.29%),这表明在μORBP ND的下降所特有的疼痛矩阵结构在大脑。
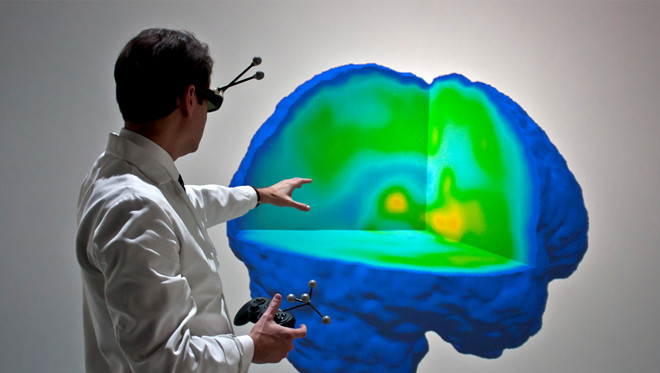
图1。全虚拟现实一个偏头痛脑的三维数据导航 。第一次实际偏头痛的神经影像数据进行了探讨在完全逼真的3D虚拟现实,其中包括关于μ-阿片受体(μORBP ND)期间在大脑可用通过数据无限制导航(学生,临床医生和研究人员)偏头痛发作的体内 。
。图2μ-阿片脑偏头痛在体内的个人资料的发作期(下排) -头痛阶段-显示在μ-阿片受体的可用性下降(μORBP ND)在疼痛矩阵区域(阈值, DV = 4.50)。这个结果可能是指偏头痛发作期间的增加内源性μ-阿片释放,作为正在进行的严重头痛的调节应答。关键词:丘脑(塔尔),伏隔核(NAC),以及Cingular的前皮层(ACC)。
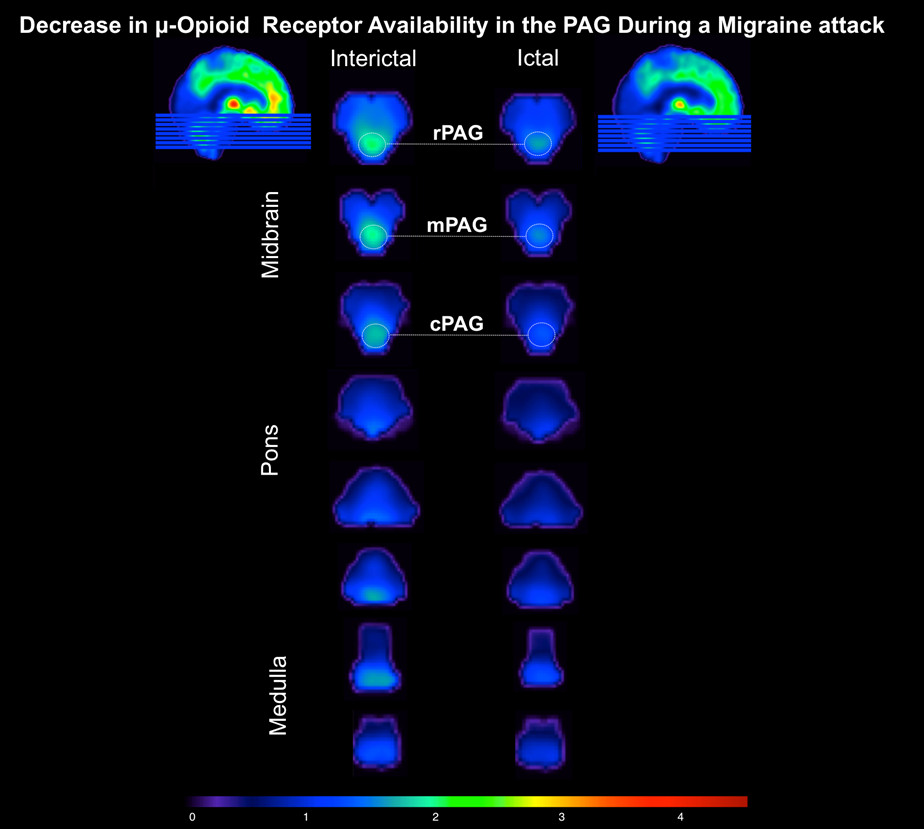
图3中脑/脑桥/延髓μ-阿片受体可在偏头痛发作在体内的发作阶段(右列) - 头痛相 - 显示了在沿脑导水管周围灰质(PAG)(阈值,DV = 4.50)相比,在间期阶段(左栏)μ-阿片受体的可用性下降 - 非头痛相。关键词:PAG:R - 喙;米 - 内侧; C - 尾。
讨论
在这种情况下,报告中,实际偏头痛的神经影像数据进行了探讨,第一次,在一个完全沉浸式虚拟现实的三维,这表明在μ-阿片受体的可用性(μORBP ND)的减少。在μORBP ND减少意味着有较高的入住率和/或μ-阿片受体在中枢神经系统的损失。在发作期扫描相比,发作间期扫描在急性减少μORBP ND疼痛矩阵区域,预计将发生的内源性阿片类药物与μORs互动作为正在进行的疼痛调节反应,使较少μORs释放的结果访问的放射性示踪剂。
我们的发作性偏头痛的神经影像学研究的新颖之处在于新的3D神经导航的方法来研究虚拟现实病人的大脑实际数据。 PET放射性示踪剂技术是用来衡量变化μORs可用性[11 C] carfentanil。当头痛事件期间检查,偏头痛患者的大脑中,通常扫描下一个攻击的触发( 例如 ,,三硝酸甘油酯,光刺激)16,17,或在一个特定的诱发刺激( 例如 ,疼痛,刷子,光的技术需求和气味),18-20。所有这些研究证实,这种疾病是在头痛相皮层和皮层下过度兴奋相关的知识。然而,这样的大量的神经影像学的协议刺激引入了云我们的中枢神经系统急性偏头痛发作的唯一影响的认识多重因素。从没有外源性刺激的存在的一些以前的功能研究,有增加局部脑流中,如扣带回皮质,下丘脑,脑干和21,即使在急性治疗22能坚持区域的指示。至今,施加的神经成像技术已经不允许参与到偏头痛发作,如内源μ-阿片机制,在大脑中最重要的镇痛资源之一的神经递质/受体过程的分子表征。而且,我们的方法允许这些过程使用三维神经导航在虚拟环境中进行探索。
下行疼痛调节系统是通过μ-阿片受体的整个大脑,包括脊以超脊柱区域调节疼痛的处理在很大的程度的复杂网络。这些区域被称为是涉及内源性抗伤害感受,应激诱导的镇痛作用,并在阿片类药物的作用常用于慢性疼痛和偏头痛的治疗。事实上,与偏头痛有关的神经性硬膜血管扩张可以通过吗啡来抑制和随后由阿片样物质拮抗剂纳洛酮逆转,表明吗啡对神经性的影响炎症是通过激活μ-阿片受体特异性23介导。有趣的是,在人类内源性阿片/μORs激活区域的大小是关系到个人的能力来抑制疼痛经验24的感官和情感的元素。
在我们的研究中,在发作期呈减少的μ-阿片受体可用性的大脑区域负责的偏头痛的经验和调制两个元素。它们是在ACC,丘脑,基底节( 例如 ,,NACC),海马和PAG。除了致敏因异常三叉神经传入流量,一个坚实的假说偏头痛病理生理的调节系统的功能障碍。在这种情况下,预测从/到脑干结构,如PAG,其中有一个高表达阿片受体,将不能有效产生其上ASCE抗感受伤害作用nding感觉神经元。此外,其他高级皮层结构参与在偏头痛这个故障的疼痛调节机制。最近发作间期静息状态的研究报告中腹外侧PAG变化偏头痛患者的连通性与健康对照组,而大部分(子)的皮层结构的调节痛觉系统,并与头痛发作13的频 率相关的这些。在这项研究中发现连通性变化的区域是相同的变化μORBP ND在我们自己的研究发现。同样的PAG位置最初报道为包括显微神经可塑性偏头痛患者中14,这里曾在μORBP ND大幅下降的攻击期间。
具有较大的同伙有必要进一步研究,以确认和延长在这种情况下,报告中提出的结论。例如,它是目前未知的原因,系统的响应不正确在长期使用中常见的处方偏头痛诊所外源性阿片类药物。然而,我们的研究提供了重要的机械信息,在μ-阿片系统偏头痛的影响,并采用了新的3D身临其境的首次互动神经导航(3D-IIN)的方法。在未来,这种探索性的三维方法可以用于检查的患者在研究和临床的大脑提供一个更加身临其境的互动观点。
披露声明
作者什么都没有透露。
致谢
- 神经疾病研究所和中风 - K23 NS062946,达纳基金会的大脑和免疫显像奖和偏头痛研究基金会的研究基金奖国立卫生研究院:这项工作是由以下补助(DASILVA AF)的支持。作者承认的PET中心核医学技师(吉尔M.罗特莱,爱德华J.麦肯纳,安德鲁·R·维登,保健臣和凯特琳·亨德里克斯)和功能磁共振成像实验室(斯科特·佩尔蒂埃和基思·纽纳姆)的人员。亚历山大DASILVA博士,首席研究员,不得不完全访问研究中的所有数据,并采取了数据的完整性和数据分析的准确性承担责任。作者申报利益与本研究没有冲突。
参考文献
- Stewart, W. F., Shechter, A., Rasmussen, B. K. Migraine prevalence. A review of population-based studies. Neurology. 44, (1994).
- Lipton, R. B., Silberstein, S. D., Stewart, W. F. An update on the epidemiology of migraine. Headache. 34, 319-328 (1994).
- Lipton, R. B., Bigal, M. E. Migraine: epidemiology, impact, and risk factors for progression. Headache. , (2005).
- Hu, X. H., Markson, L. E., Lipton, R. B., Stewart, W. F., Berger, M. L. Burden of migraine in the United States: disability and economic costs. Arch Intern Med. Arch Intern Med. 159, 813-818 (1999).
- Lipton, R. B. Cutaneous allodynia in the migraine population. Ann Neurol. 63, 148-158 (2008).
- Fields, H. L. Understanding how opioids contribute to reward and analgesia. Reg Anesth Pain Med. 32, 242-246 (2007).
- . Opioid Therapy for Migraine. Headache: The Journal of Head and Face Pain. 47, 1371-1372 (2007).
- Menon, S., et al. The human mu-opioid receptor gene polymorphism (A118G) is associated with head pain severity in a clinical cohort of female migraine with aura patients. The journal of headache and pain. 13, 513-519 (2012).
- Drinovac, V., Bach-Rojecky, L., Matak, I., Lackovic, Z. Involvement of mu-opioid receptors in antinociceptive action of botulinum toxin type A. Neuropharmacology. 70, 331-337 (2013).
- Lipton, R. B., Bigal, M. E. Opioid therapy and headache: a cause and a cure. Neurology. 62, 1662-1663 (2004).
- Harris, R. E., et al. Decreased central mu-opioid receptor availability in fibromyalgia. J Neurosci. 27, 10000-10006 (2007).
- Logan, J., et al. Distribution volume ratios without blood sampling from graphical analysis of PET data. J Cereb Blood Flow Metab. 16, 834-840 (1996).
- Mainero, C., Boshyan, J., Hadjikhani, N. Altered functional magnetic resonance imaging resting-state connectivity in periaqueductal gray networks in migraine. Ann Neurol. 70, 838-845 (2011).
- DaSilva, A. F., et al. Interictal alterations of the trigeminal somatosensory pathway and periaqueductal gray matter in migraine. Neuroreport. 18, 301-305 (2007).
- Hirvonen, J., et al. Measurement of central mu-opioid receptor binding in vivo with PET and [11C]carfentanil: a test-retest study in healthy subjects. European journal of nuclear medicine and molecular imaging. 36, 275-286 (2009).
- Cao, Y., Aurora, S. K., Nagesh, V., Patel, S. C., Welch, K. M. Functional MRI-BOLD of brainstem structures during visually triggered migraine. Neurology. 59, 72-78 (2002).
- Afridi, S. K., et al. A PET study exploring the laterality of brainstem activation in migraine using glyceryl trinitrate. Brain. 128, 932-939 (2005).
- Moulton, E. A., et al. Painful heat reveals hyperexcitability of the temporal pole in interictal and ictal migraine States. Cereb Cortex. 21, 435-448 (2011).
- Burstein, R., et al. Thalamic sensitization transforms localized pain into widespread allodynia. Ann Neurol. 68, 81-91 (2010).
- Denuelle, M., et al. A PET study of photophobia during spontaneous migraine attacks. Neurology. 76, 213-218 (2011).
- Denuelle, M., Fabre, N., Payoux, P., Chollet, F., Geraud, G. Hypothalamic activation in spontaneous migraine attacks. Headache. 47, 1418-1426 (2007).
- Weiller, C., et al. Brain stem activation in spontaneous human migraine attacks. Nat Med. 1, 658-660 (1995).
- Williamson, D. J., et al. Role of opioid receptors in neurogenic dural vasodilation and sensitization of trigeminal neurones in anaesthetized rats. Br J Pharmacol. 133, 807-814 (2001).
- Zubieta, J. K., et al. Regional mu opioid receptor regulation of sensory and affective dimensions of pain. Science. 293, 311-315 (2001).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。