Method Article
3D-ニューロ
* これらの著者は同等に貢献しました
要約
本研究では、著者らは、 生体内での患者の脳のμ-オピオイド系における自発的な片頭痛発作の影響を通じて、初めて小説3D-没入&インタラクティブニューロ(3D-IIN)を報告。
要約
MRIベースの研究から主に生成された研究の成長体は、片頭痛の原因は、中枢神経系内の特定の神経プロセスの変更に、発生し、場合によっては耐えなければ表示されていることを示しています。しかし、情報は、片頭痛の間、特に内因性オピオイドシステム上で、これらの変化の分子の影響に欠けており、これらの変更を通じてニューロが行われたことがない。小説3D没入型と対話型ニューロ(3D-IIN)アプローチ、in vivoでの片頭痛発作中の脳における内因性μ-オピオイド伝送を使用して、調査することを目的とした。これは痛みの経験と鎮痛の複数の要素に影響を与え、間違いなく痛みの調節に関連する最も中心neuromechanismsの一つです。 10年前から片頭痛に悩まされています36歳の女性は、典型的な頭痛(発作)および陽電子Emissを使用してnonheadache(発作)片頭痛の段階に分けてスキャンした私たちは、脳( - μORBP ND非変位結合能)にμ-オピオイド受容体の可用性を測定することができ、選択的放射性トレーサー[11 C]フェンタニルとイオン断層撮影法(PET)。短寿命の放射性トレーサーは、撮像施設に近接して配置キャンパスのサイクロトロンおよび化学合成装置により製造した。両方のPETスキャン、発作と発作は、患者の月経周期の個別の半ばから後半の卵胞の段階で予定されていた。発作PETセッション中に彼女の自発的な頭痛発作、重度の強度レベルに達した。スキャンセッションの終了時に吐き気や嘔吐に進む。帯状皮質、側坐核(NACC)、視床(サール)、および水道周囲灰白質(PAG)を含む発作期の間、内因性μ-オピオイド系の痛み調節領域のμORBPのダコタの減少がありました; μORsがすでにリリースされ内因性オピオイドによって占有されたことを示す継続的な痛みに応じて。我々の知る限りでは、これは、新規の3Dアプローチを使用してneuronavigatedされた片頭痛発作時にμORBP を購入して変化するのは初めてだ。この方法は、実際の患者の神経画像データセットの片頭痛発作の対話的な研究·教育の探査が可能になります。
概要
片頭痛は、女性の約16%、米国では男性の6%に影響を与え、世界的に1-3慢性三叉疼痛性障害である。反復的な片頭痛発作は逃した学校/作業日およ び医療の利用率4で数十億ドルの原価計算、寿命と性能の質を損なうこと、患者の存在の大 部分に影響を与えます。衰弱頭痛発作時には、その患者は有害(痛覚過敏)への著しい増大した感度を持っているとさえnonnoxious刺激(異痛症)5。
μ-オピオイド神経伝達物質系は、私たちの脳における主要な内因性の痛みの調節メカニズムの1つです。これは、実験的および臨床的疼痛知覚の調節に関与するだけでなく、片頭痛発作10の慢性化に関連していたオピオイド薬6-9の鎮痛作用である。陽電子放射トモの最近の進歩グラフィー(PET)分子イメージングは、 生体 11 の慢性疼痛患者の脳における重要な分子メカニズムの研究を可能にします。本研究では、偶然を同期およびPET /放射性トレーサーのセッションのセットアップの複雑さとエピソードの攻撃の性質を衰弱させるの挑戦的な物流にもかかわらず、3次元ニューロは、患者のの主要な痛みマトリクス領域においてμORの可用性を調査するために初めて使用された自発的な片頭痛時の脳。
症例提示
36歳のアジア系の女性は、試験に登録されました。彼女は視覚的な前兆を伴う片頭痛の10年の歴史を提示。右側片頭痛は、通常72時間(未処理または失敗した治療の場合)のために持続させる激しい痛みの強さに穏健派で、月あたり12日の平均を発生しました。彼女の月経周期、周りの頭痛発作の頻度の増加は認められている研究を通して規則的なパターンを持っていた。関連する症状が含まれる:吐き気、嘔吐、羞明、および音声恐怖症を。定期的な頭痛発作の間に彼女はどんな自律神経症状を示さなかった。治療として、彼女は、非ステロイド性抗炎症薬に基づいていた唯一の薬理学的な失敗に終わった治療、彼女の症状を管理していたし、薬物乱用またはオピオイド摂取の兆候はなかった。スクリーニング来院時の臨床検査は、平凡と異常がなかった、とシステムの見直しは、正常範囲内であった。彼女は子を持たないシングルで、避妊薬を使用していませんでした。
プロトコル
研究では、地元の治験審査委員会によって、放射性医薬品研究委員会の承認を得なければならない。調査対象は、研究に参加するために書面によるインフォームドコンセントを与えます。プロトコルは3時間順のステップに分かれています。
- MRIのセッション
- 片頭痛の発作期(頭痛)の間にPETセッション
- 片頭痛の発作期(NO頭痛)の間にPETセッション
患者は頭痛日記を記入するため、研究グループとイメージングセッションの日に片頭痛発作の発生を確認する責任があります。両方、発作と発作、PETスキャンは、この場合、専門知識を持つ婦人科医によって事前に追跡され、計算された患者の個別の半ばから後半卵胞相(5〜10日月経出血の初日後)、中にスケジュールする必要がありますフィールドに(何歳から何歳まで)。
1。のMRIセッション
- 前実験のためのペアリング
- スキャンの対象を準備する前に、それが原因MRスキャナの磁場に適切な安全手順に従ってすることが必要である。すべての調査担当者は、MR処置室に入る前に無金属である必要があります。
- MR技師に以前に最初のスクリーニングの際に、研究のボランティアによって署名されたインフォームドコンセントフォームのコピーを提供します。
- スキャンの件名を準備
- MRIの日に、MRIの安全スクリーニングフォームに記入する研究課題を尋ねる。 fMRIの研究室 - この形式は、ミシガン大学で取られたMRIのために必要です。アンケート対象はまた、金属を含まないで、慎重かつ特別な配慮( 例えば 、金属異物の断片、移植された電気/機械的装置)を必要とする病状を持っていないことを強調している。
- 参加者は、MR手順、リスクと利点を理解していることを安心させる。
- に配送ERの手順で支援されるのMR技術者にスクリーニングフォームを完了した。
- 3テスラスキャナの患者のための発作期の間にT1強調解剖学的MRIスキャンを獲得。
- MRIの取得のため、次のシーケンスパラメータを使用します。
- A.アキシャル甘やかさ勾配リコール(SPGR)3D取得
- B.れた帯域幅= 15.63
- C.繰り返し時間[TR] = 9.2ミリ秒
- D.エコー時間[TE] = 1.9ミリ秒
- E.反転回復の準備500ミリ
- F·フリップ角= 15°
- G. 26分の25 FOV
- 励起のH.番号[NEX] = 1
- I. 144の連続したスライス
- J. 1.0ミリメートルのスライス厚
- K. 256×256の行列
- MRIの取得のため、次のシーケンスパラメータを使用します。
2。発作時PETセッション
- 実験の準備
- 大学病院でのスキャンを確認する前に、そのpHの検証する対象に連絡月経周期のASEは、彼女は、スキャンの日になります。これは、中期卵胞期後期(月経出血の発症後5〜10日)の間、PETスキャンを実行することをお勧めします。
- スキャンの近くにサイクロトロンを使用して、[11 C]フェンタニル、μ-オピオイド受容体に対する選択的親和性を有する短寿命の放射性トレーサーを製造するために病院に要求を送信します。トレーサーはスキャンの前に2時間を製造しなければならない。
- 潜在的な発作PETスキャンの日に、自発的な片頭痛発作の存在を確認するために任命する前に、対象を2時間にお問い合わせください。片頭痛発作が存在する場合には、国際頭痛分類以下の片頭痛の診断を検証する。診断後、参加者は安全にスキャンを受けるために病院に行くことができることを保証します。被写体が快適な運転ではない場合、または全く指定されたドライバが利用できない場合の輸送を提供しています。
- 蘇の準備スキャンにbject
- 参加者が病院へ到着した時点で、国際頭痛分類に基づく診断の再検証のためのPETのスイートに彼女をエスコート。スキャンする前に、被験者が摂取尿妊娠検査に続いて、トレーサー[11 C]フェンタニル、と相互作用し得る任意の物質をしなかったことを確認するために、尿薬物検査を行う。
- 参加者はペットの手順、リスク、ベネフィットを理解していることを再確認する。
- 核医学技師に以前に最初のスクリーニングの際に、研究のボランティアによって署名されたインフォームドコンセントフォームのコピーを、提供する。
- 核医学技師の指導の後、被験者はスキャナに落ち着くのに役立ちます。
- 被写体が3DモードでシーメンスHR +スキャナを使用して1 90分PETスキャンを受けたことがあります(再構成された画像は、約5.5面内MM-及び軸方向に5.0ミリメートルの半値(FWHM)の分解能で全角を持っている)。 <各[11 C]フェンタニル投与用リチウム>は(0.03μgの/キロ≤555 MBqで)、連続して約35分のトレーサ投与後の定常状態のトレーサーレベルを達成するために、スキャンの過程で注入され、残りはボーラスとして五十%の管理。
- 発作ペットセッション。
- 非頭痛フェーズの間に2.6 - 手順2.2を繰り返します。
3。PETデータ再構築
- 視野(FOV)28.8センチ、直径フィールドに128×128ピクセルマトリックスに対話的なアルゴリズムを使用したPET画像を再構成する。
- 21画像フレームを取得し、スキャン中に動きを補正するために、互いに共レジスタ。
- 6分送信(68Ge元)を取得減衰補正の目的のためにスキャンする前にペットにスキャンします。
- パラメトリック画像の2つのセットにボクセル単位でスキャンごとに動画像データに変換する(10から40分)。
- トレーサーの輸送手段を使用してください(K1 RATIcoregistration正規化手順については、O);と
- KD(受容体親和性)によって分割するのB max(受容体濃度)に比例する受容体関連指標、BP を購入し 、使用してください。
- 参照領域12と後頭皮質と基準領域ベースのローガングラフ解析を使用して、これらの施策を推定する。
4。PETデータ解析
注:解剖学的に、以下の順序以下の統計パラメトリックマッピング(SPM8)ソフトウェアを使用してテンプレート空間に画像を標準化する。
- MRスキャンとK1スキャンを共同登録してください。
- DARTELを使用し、モントリオール神経学研究所(MNI)テンプレート脳にMRスキャンを正常化する。
- PET画像に生じた変形行列を適用します。
- MNIアトラステンプレートに変換し、MRとPETの画像を比較することによって、共同登録と正規化の精度を確認してください。
- 関心領域(ROI)分析。
を含む疼痛の処理中に従事しているいくつかの二国間の地域の活性を調べます。
- A.前方/中間/後部帯状
- B.島
- C.海馬
- D.扁桃体
- E.尾状ヘッド/ボディ
- F.側坐核
- G.被殻
- H.内側/外側淡蒼球
- I.視床核(腹側前部、後部の腹内側/外側、外側後部、正中線、内側/外側背側)
- J·水道周囲灰白質(PAG)
- PAGを除いて、これらの領域のそれぞれについて、標準化された空間で(MarsBaRを定義する座標に3ミリメートルの球を配置することにより、PAGのROIを生成します。右:4、-28、-6、および左:-2、-28 、-6。このPAGの場所は、以前に健常対照13,14と比較して、片頭痛患者の拡散と接続性の変化を有することが示された。
注:[11 Cと検査-再検査の研究5%15 - ]ほとんどの皮質領域が3であることを、十分に10%未満のBP を購入する対策の再現性を示しているカル。バリエーション(CoVの= Std.Dev。/平均)の最大の係数は、通常、最低束縛のBP を購入 CoVの者との皮質領域が約0.5であったとしてもでは、しかし、最も低い結合と地域で観察される。そのため、スキャンの間のROIμORBP ダコタ州にある割合の変更は、ときにのみ10パーセント以上のように有意であると考えている。
5。3D-ニューロ
- 3D-IIN経験のための準備
- 16ビットと定義され、密度と活性化レベルを持つ画像のスタックとしてNIfTIボリュームデータフォーマットで提供されたデータを整理。
- 時間の連続した立体的な3D効果を可能にするために、アクティブ液晶シャッターメガネを着用してください。他の眼用の画像が画面に表示されている間、シャッタ眼鏡は片目の遮断を介して動作する。プロセスは、他の眼のために繰り返されます。このshutteriNG効果は110 Hzで発生します。
- その使用に指示された後、シミュレーションとの相互作用のためのジョイスティックを使用してください。
- Viconのモーションキャプチャシステムを介して空間内の物体の正確な6DOFトラッキングを可能にするために反射マーカとシャッターグラスとジョイスティックを衣装。
- Aubjectアクティベーションデータを表示
- アプリケーションの開始時にロードされ、クラスタ内の各コンピュータで共有されている密度と活性化レベルのカラーマッピングを定義するXML構成ファイルを使用します。
- 頚の内部のローディング機能を経由して「Niftilib「オープンソースソフトウェア·ライブラリで設定された提供NIfTIdataから3次元ボリュームのセルを取得する。
- 速度を向上させるクラスタ内の各コンピュータとの体積の細胞を生じた共有しています。
- レイマーチングを行い、によって定義された様々な色や透明度をボクセルの表示がOpenGLのシェーダ(GLSL)の体積の細胞を解釈する以前にカラーマッピングのXML設定ファイルを共有した。
- Viconのシステムを介して位置を取得し、各画面上のボリュームデータの延伸視点を更新するためにこれを使います。
- 記録的な相互作用を動的仮想空間内を移動するために、データを通して平面を調整し、カットするためにそれらを使用。
6。3D-没入&インタラクティブニューロ(3D-IIN)
- NIfTIデータ形式のストア対象の活性化データ、Niftilibライブラリを使用して解釈されているボリュームデータ型です。
- 相互作用とViconの追跡システム、ジョイスティックデバイス、およびジェスチャー入力によって位置を得る。表示された画像データセットのリアルタイムの探査を可能に正しい視点を表し、おなじみの動きや制御方式を使用して、最大3任意の切断面のための動的制御( 図1)を有効にするには、この情報を使用してください。
結果
患者は0-10痛みのスケールの6の強さと、右側頭部と後頭部の脈動頭痛で病院に提示した。彼女はしかし、前兆のない、彼女の代表的な片頭痛を抱えていた。それは、(発作)ペットセッションの前に5時間を目覚めさせる時に開始していた、と彼女はどんな失敗に終わった薬物療法なしでそれを容認することができた。彼女の知る限りでは、頭痛は、任意のトリガ要因( 例えば 、アルコール、睡眠不足)によって誘発されなかった。いいえ自律神経症状は報告されなかったが、羞明と音恐怖症は存在していたし。発作PETセッション開始後の頭痛強度試験に深刻なレベル(0〜10の痛みスケールで9)60分に達し、エスカレート;スキャンセッションの終了時に吐き気や嘔吐に進む。 μORBP ダコタの減少はベースライン(発作期)( 図2)と比較して、自発的な片頭痛(発作期)の間に患者の脳内に認められた。そこに我々右横背側(11、-19、-16:10.2%)は、次の視床核を含む内因性μ-オピオイド系の主要な痛みマトリックス地域でμORBP ダコタにおける特許削減RE、右内側背側(6、 -17、-8:11.1%)、右正中線(8、-19、-16:27%)、および腹側前部(9、-9、-12:12.0%)。また、変更が右前で発見された(8、35、14:13.7%)と、左後部帯状皮質(-5、-44、23:11.8%)が、左尾状体(-11、6、15:12.0 %)、内側淡蒼球(右:16、-4、-3:16.2%;左:-14、-4、-3:22.6%)、左側坐核(-9、-11、-7:10.5% )、および海馬(右:30、-22、-14:12.6%;左:-30、-22、-14:11.5%)。唯一の左扁桃体(:11.7%-23、-4、-19)でのμORBPのダコタの増加がありました。 4、-28、-6:脳幹では、μORBP ダコタの大幅な発作の減少は水道周囲灰白質(PAG)(右尾する吻側から伸び15.1%を、左:-2、-28、-6:14.6 %)( 図URE 3)。 (:8.5%;左:右8.29パーセント)が、片頭痛発作時にμORBP ダコタ州にある世界的な半球の割合の変化は控えめだった、μORBP ダコタの減少は、脳内の痛みマトリックス構造に特異的であったことを示している。
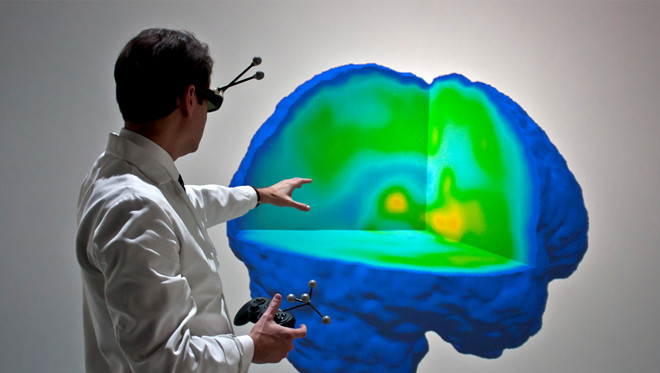
図1。フルバーチャルリアリティ片頭痛脳の3Dデータナビゲーション 。 μ-オピオイド受容体(μORBP ND)の利用可能性について、実際の片頭痛の神経画像データは(学生、臨床医、研究者による)データを通して無制限のナビゲーションを含む完全没入型3D仮想現実に調査された初めての脳内の中にin vivoでの片頭痛発作。

図2 in vivoでの片頭痛のμ-オピオイド脳プロフィール発作相(下段) -頭痛段階は-痛みマトリックス領域におけるμ-オピオイド受容体の可用性(μORBP ND)の減少(閾値を示していますDV = 4.50)。この結果は、おそらく継続的な激しい頭痛に規制応答として、片頭痛発作時の内因性μ-オピオイド放出の増加を表しています。キーワード:視床(サール)、側坐核(NAC)、および前のシンギュラー皮質(ACC)。
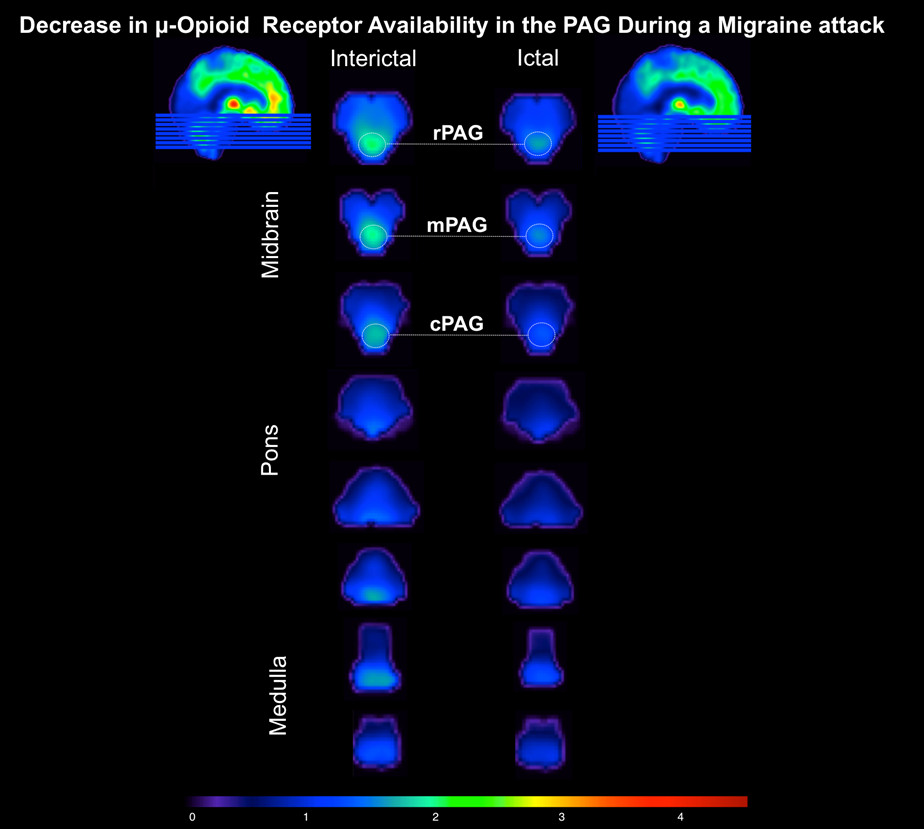
図3。 生体内での片頭痛発作時には中脳/ポンス/髄質μ-オピオイド受容体の可用性。発作相(右列) - 頭痛段階 - は非頭痛相 - 発作相(左列)と比較して、水道周囲灰白質(PAG)(しきい値は、DV = 4.50)に沿って、μ-オピオイド受容体の可用性の低下を示しています。キーワード:PAG:R - 吻側; M - 内側; C - 尾。
ディスカッション
この場合、報告書では、実際の片頭痛の神経画像データは、μ-オピオイド受容体の可用性(μORBP ND)の減少を示し、完全没入型バーチャル3D現実に、初めて調査した。 μORBP ダコタの減少は、より高い占有率および/ または中枢神経系におけるμ-オピオイド受容体の損失があることを示唆している。発作スキャンと比較して、発作時スキャン中に痛みマトリックス領域のμORBP ダコタにおける急性減少は、より少ないμORsを作り、継続的な痛みに対する規制の応答としてμORsと対話する内因性オピオイドの放出の結果として起こることが予想される放射性トレーサーにアクセス可能。
私たちの発作片頭痛神経画像研究の新規性は、仮想現実の中で患者の実際の脳のデータを調査するために新しい3Dニューロ·アプローチにある。 PET放射性トレーサー技術はμORsの変化を測定するために使用された[11 C]フェンタニルと可用性。頭痛イベント中に検討すると、片頭痛患者の脳は通常攻撃のトリガー( 例えば 、ニトログリセリン、光刺激)16,17次のスキャンされたり、特定の技術的な需要の下での刺激( 例えば 、痛み、ブラシ、光を誘発、および臭気)18〜20。すべてのこれらの研究は、障害が頭痛フェーズの間に皮質と皮質下の過剰興奮に関連しているという知識を裏付ける。しかし、神経画像プロトコルにおける刺激のような過剰は、中枢神経系に急性片頭痛発作の唯一のインパクトの理解を曇らせる複数の要因が導入されています。外因性の刺激が存在しないいくつかの以前の機能の研究から、このような場合でも、急性治療22後も持続することができ帯状皮質、視床下部、脳幹21、などの分野で増加した局所脳フローの表示があります。これまで、適用される神経画像技術は、内因性μ-オピオイドメカニズム、脳の中で最も重要な鎮痛資源の一つとして、片頭痛発作に関与する神経伝達物質/受容過程の分子特性のために許可されていません。また、私たちの方法は、これらのプロセスは、仮想環境での3Dニューロを使用して調べることができました。
下行性疼痛調節システムは、上記脊髄領域への脊髄を含む脳全体で、μ-オピオイド受容体を介して大幅に痛みの処理を制御する複雑なネットワークである。これらの領域は、内因性の抗侵害受容、ストレス誘発鎮痛に関与することが知られており、オピオイド薬物の作用に一般に慢性疼痛および片頭痛の治療のために使用される。実際には、片頭痛に関連する神経原性硬膜血管拡張は、モルヒネによって阻害することができ、その後、オピオイド拮抗薬ナロキソンで反転、神経上のモルヒネの作用を示す炎症は、μ-オピオイド受容体23の活性化を介して、具体的に媒介される。興味深いことに、ヒトにおいて内因性オピオイド/μORs地域活性化の大きさは、痛みの経験24の感覚と感情の要素を抑制するために、個々の能力に関連しています。
我々の研究では、発作段階の間に、μ-オピオイド受容体の可用性の低下を示した脳領域は、片頭痛の経験とその変調の両方の要素を担当している。彼らは、ACC、視床、基底核( 例えば 。、NACC)、海馬、およびPAGである。異常三叉神経求心トラフィックへの感作に加えて、片頭痛の病態生理のための1固体の仮説は、調節系の機能不全である。この場合には、/からのそのようなオピオイド受容体の高い発現が存在するPAGとして脳幹構造体への投影は、非効率的にASCEでそれらの抗侵害受容効果を生じるであろう感覚ニューロンをnding。さらに、他の高次脳の構造は、片頭痛は、この障害のある痛み調節メカニズムに参加しています。最近の発作安静状態の研究では、腹のPAGにおける健常対照に対する片頭痛患者の接続の変更や調節痛みのシステム(サブ)のほとんどの皮質の構造を報告し、頭痛発作13の周波数と、これらの相関を示した。本研究で見いだされた接続の変更を有する領域は、我々自身の研究で見いだされたμORBP ダコタの変化にしたものと同じである。同じPAGの場所は、もともと片頭痛患者14に微細構造の神経可塑性を包含するものとして報告され、ここで攻撃中にμORBP を購入するにはかなりの減少を有していた。
大きな集団とのさらなる研究は、この症例報告で提示調査結果を確認し、拡張する必要があります。システムが適切に応答しない理由、例えば、現在不明であるしばしば片頭痛クリニックに規定する外因性オピオイドの長期使用に関する。それにもかかわらず、我々の研究は、μ-オピオイド系における片頭痛の影響で、重要な機械論的な情報を提供し、新たな没入型3Dと初めて対話型のニューロ(3D-IIN)アプローチを使用しています。将来的には、この探索的な3D方式は、研究と診療所での患者の脳を調べるためのはるかに没入し、インタラクティブな視点を提供することができます。
開示事項
著者らは、開示することは何もありません。
謝辞
- 神経疾患研究所およびストローク - K23 NS062946、ダナ財団の脳と免疫イメージング賞、および片頭痛研究財団研究助成賞国立衛生研究所:この作品は、以下の補助金(ダシルバAF)によってサポートされていました。著者らは、PETセンター核医学技師(ジル·M·ザロ、エドワード·J·マッケナ、アンドリュー·R·ウィーデン、ポールKison、そしてケイトリンヘンドリックス)と機能的MRI研究所(スコット·ペルティエとキースニューナム)の人員を認める。博士アレクサンドルダシルバ、主任研究者は、研究のすべてのデータへのフルアクセスを持っていたし、データの整合性とデータ解析の正確性に責任を取る。著者らは、この研究に関連する利害の衝突を宣言していません。
参考文献
- Stewart, W. F., Shechter, A., Rasmussen, B. K. Migraine prevalence. A review of population-based studies. Neurology. 44, (1994).
- Lipton, R. B., Silberstein, S. D., Stewart, W. F. An update on the epidemiology of migraine. Headache. 34, 319-328 (1994).
- Lipton, R. B., Bigal, M. E. Migraine: epidemiology, impact, and risk factors for progression. Headache. , (2005).
- Hu, X. H., Markson, L. E., Lipton, R. B., Stewart, W. F., Berger, M. L. Burden of migraine in the United States: disability and economic costs. Arch Intern Med. Arch Intern Med. 159, 813-818 (1999).
- Lipton, R. B. Cutaneous allodynia in the migraine population. Ann Neurol. 63, 148-158 (2008).
- Fields, H. L. Understanding how opioids contribute to reward and analgesia. Reg Anesth Pain Med. 32, 242-246 (2007).
- . Opioid Therapy for Migraine. Headache: The Journal of Head and Face Pain. 47, 1371-1372 (2007).
- Menon, S., et al. The human mu-opioid receptor gene polymorphism (A118G) is associated with head pain severity in a clinical cohort of female migraine with aura patients. The journal of headache and pain. 13, 513-519 (2012).
- Drinovac, V., Bach-Rojecky, L., Matak, I., Lackovic, Z. Involvement of mu-opioid receptors in antinociceptive action of botulinum toxin type A. Neuropharmacology. 70, 331-337 (2013).
- Lipton, R. B., Bigal, M. E. Opioid therapy and headache: a cause and a cure. Neurology. 62, 1662-1663 (2004).
- Harris, R. E., et al. Decreased central mu-opioid receptor availability in fibromyalgia. J Neurosci. 27, 10000-10006 (2007).
- Logan, J., et al. Distribution volume ratios without blood sampling from graphical analysis of PET data. J Cereb Blood Flow Metab. 16, 834-840 (1996).
- Mainero, C., Boshyan, J., Hadjikhani, N. Altered functional magnetic resonance imaging resting-state connectivity in periaqueductal gray networks in migraine. Ann Neurol. 70, 838-845 (2011).
- DaSilva, A. F., et al. Interictal alterations of the trigeminal somatosensory pathway and periaqueductal gray matter in migraine. Neuroreport. 18, 301-305 (2007).
- Hirvonen, J., et al. Measurement of central mu-opioid receptor binding in vivo with PET and [11C]carfentanil: a test-retest study in healthy subjects. European journal of nuclear medicine and molecular imaging. 36, 275-286 (2009).
- Cao, Y., Aurora, S. K., Nagesh, V., Patel, S. C., Welch, K. M. Functional MRI-BOLD of brainstem structures during visually triggered migraine. Neurology. 59, 72-78 (2002).
- Afridi, S. K., et al. A PET study exploring the laterality of brainstem activation in migraine using glyceryl trinitrate. Brain. 128, 932-939 (2005).
- Moulton, E. A., et al. Painful heat reveals hyperexcitability of the temporal pole in interictal and ictal migraine States. Cereb Cortex. 21, 435-448 (2011).
- Burstein, R., et al. Thalamic sensitization transforms localized pain into widespread allodynia. Ann Neurol. 68, 81-91 (2010).
- Denuelle, M., et al. A PET study of photophobia during spontaneous migraine attacks. Neurology. 76, 213-218 (2011).
- Denuelle, M., Fabre, N., Payoux, P., Chollet, F., Geraud, G. Hypothalamic activation in spontaneous migraine attacks. Headache. 47, 1418-1426 (2007).
- Weiller, C., et al. Brain stem activation in spontaneous human migraine attacks. Nat Med. 1, 658-660 (1995).
- Williamson, D. J., et al. Role of opioid receptors in neurogenic dural vasodilation and sensitization of trigeminal neurones in anaesthetized rats. Br J Pharmacol. 133, 807-814 (2001).
- Zubieta, J. K., et al. Regional mu opioid receptor regulation of sensory and affective dimensions of pain. Science. 293, 311-315 (2001).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved