Method Article
微创建立小鼠原位膀胱移植瘤的
摘要
所建立的方法接种初级原位浸润性膀胱癌移植瘤需要剖腹探查和动员膀胱。此过程对其造成对小鼠显著发病率,在技术上是挑战性的和费时的。因此,我们开发了一种高精度,经皮穿刺的方法利用超声引导。
摘要
原位膀胱癌移植瘤的金标准,研究分子细胞操作和新的治疗药物在体内 。合适的细胞系是由膀胱灌注(非肌肉的浸润性生长模型)或肌壁间注射到膀胱壁(浸润性生长的模型)两种接种。这两个过程是复杂的,高度耗时。另外,表面模型有其缺点是由于缺乏细胞系是致瘤以下滴入。壁间喷射,另一方面,通过该过程的侵袭和宿主小鼠的发病率相关联的毁损。
有了这些缺点在心中,我们修改以前的方法来开发,用于创建原位膀胱癌移植瘤微创的方法。使用超声引导我们已经成功地完成经皮接种膀胱癌细胞系UM-UC1,UM-UC3和UM-的UC13到50无胸腺裸鼠。我们已经能够证明,这种做法是一次高效,精确和安全。利用这种技术,最初的空间下膀胱粘膜用PBS创建,然后肿瘤细胞被注射到该空间中的第二步骤。肿瘤生长定期与生物发光成像和超声进行监测。平均肿瘤体积稳步增长,但在所有我们的50只小鼠在研究期间之一。
在我们的机构,这种新方法,它允许异种移植膀胱癌在接种微创,快速和高度精确的方式,取代了传统的模式。
引言
癌症研究是依赖于人类癌症的使用,以源自患者的肿瘤细胞系,以加深我们对肿瘤生物学的理解动物模型。根据不同的治疗策略体内生长分析小鼠原位膀胱癌模型仍然是参考标准1,2。接种人类膀胱癌细胞的免疫功能低下小鼠(异种移植模型)的依赖于膀胱灌注(“膀胱模式”)3,4,5或直接注射入膀胱壁(“壁间模式”)6,7。这两种技术,也可在大鼠8,9执行。
膀胱内灌注诱导肿瘤膀胱,然后是服从的新的治疗剂随后膀胱灌注的膀胱上皮表面的形成。然而,细胞系,当通过该方法递送它们是可靠的致瘤性的数量是有限的ð那些细胞系,KU7之一,最近已被证明是HeLa细胞4,10。膀胱灌注也是耗时由于必要的停留时间,并且经常导致肿瘤生长在泌尿道的相邻元素,包括尿道,输尿管,和肾盂11。此外,膀胱灌注常常导致肿瘤生长于其中输尿管进入膀胱的膀胱的地板上,并且这可引起上呼吸道梗阻和伴随肾功能衰竭。
原发性浸润性膀胱癌异种移植物,适合用于全身治疗是通过直接注射肿瘤细胞的建立到膀胱壁12。虽然众多的细胞系在这个模型中充分成长,它的局限性是涉及到需要腹部切口13模型的侵袭。该模型也极具挑战性的学习,由于注射的细胞精确到肌壁的技术难度的膀胱。
一种新颖的方法来建立原位原发性浸润性膀胱癌移植瘤小鼠已经制定了本部门,以解决“壁间模式”存在的不足。我们能够经皮的,超声引导注射膀胱癌细胞优化到前膀胱壁造成这种新颖的技术成功地取代已建立的侵袭模型。此外,我们已经潜在地提高了“壁间模式”的准确性和可重复性。
研究方案
所有动物的程序是按照加拿大动物保护协会(CCAC)的指导方针进行。该方案经英属哥伦比亚大学的动物保护委员会(协议编号:A10-0192)。
1。细胞系的制备
- 确认各自的人膀胱癌细胞系中由DNA指纹7的身份。
- 对于异种移植肿瘤通过生物 发光增长分析,转染细胞系的慢病毒构建携带萤火虫荧光素酶基因3。
- 解冻并用10%胎牛血清(FBS)中于37℃下在湿润的5%CO 2的气氛中展开的Dulbecco改进的Eagle培养基中存在的细胞系中(DMEM)。通过细胞至少3倍,但要避免文化时期超过3个月。
2。细胞悬液的制备
- 解冻基底膜。保持温度低于4℃,以避免凝胶的粘度增加。
- 胰蛋白酶消化细胞以70%汇合,并暂停在正常生长介质。
- 计数细胞数与血球或自动细胞计数器。
- 旋转细胞悬浮液中5分钟,在200×g下。除去上清液。
- 添加的DMEM(10%FBS)和基质胶(1:1)的适当量,以达到所需的细胞浓度是依赖于所利用的细胞系和所期望的生长动力学(8-15×10 6个/毫升)中。肿瘤细胞悬液注入量为40微升。
- 移液器向上和向下(P1000)拌匀,避免在悬挂产生气泡。
3。动物的准备
注意:由于在步骤4.7经尿道导尿的潜在需求,雌性小鼠在这个动物模型的首选性别。
- 家鼠根据机构和国家动物保护区idelines。获得伦理委员会批准涉及小鼠的所有实验。
- 麻醉小鼠,用3%异氟烷/氧混合物。确认动物的适当麻醉( 如反应迟钝到脚趾捏)。
4。实验装置
- 从任何一种扁平的硬质塑料材料[ 图2 I]切开膀胱稳定。仔细检查背带和应用到小鼠前删除任何尖锐的边缘。
- 装载动物的热成像表上[ 图1我 ]小动物成像平台,持续监测生命体征。修复下肢用橡皮筋[ 图1三 ]。
- 消毒腹部有2%葡萄糖酸氯己定擦拭用无菌棉签在皮肤上。
- 固定膀胱与膀胱稳定带[ 图2二 ]。因此,回避壁间注射在步骤5.6中的膀胱将被避免。
- 应用无菌超声凝胶小腹。
- 慢慢接近超声扫描头(频率40兆赫)[ 图1 IV]在皮肤上(纵向以45-70度的颅角)和可视化超声屏幕上的膀胱[ 图3我 ]。
- 如果膀胱是空的,以通过经尿道24政angiocatheter 50微升无菌的,温热的磷酸盐缓冲盐水(PBS)填充。
5。膀胱壁分离层
- 附上1.0毫升注射器填充有PBS,并连接到一个30 G,¾在针(斜面导向前方)到针筒夹持。
- 位置朝向皮肤的正上方耻骨在30-45°角的针(80-90℃相对于超声扫描探头的纵向轴线[ 图1])。
- 探测针在超声屏幕。
- 慢慢地穿透皮肤和腹壁肌肉[ 图3Ⅱ]。
- 转动针180°(现定向向后)的斜面。
- 将针头插入膀胱壁的顶端而不穿透黏膜[ 图3三 ]
- 慢慢地注入50微升PBS的肌层和粘膜之间,以创造一种人造空间[ 图3Ⅳ]。
注意:如果黏膜在步骤5.6意外穿孔,慢慢拉回针注入50微升PBS后粘膜层已经翻转回过针尖。 - 拔出针头。
6。膀胱癌细胞校内接种
- 附加第二1.0毫升注射器(充满癌细胞悬浮于基质胶)用30 G,¾在针注射器钳。
- 针的针尖引导到相同的这是在步骤5.7中创建的PBS填充的空间。
- 注射40微升的细胞悬液到这个空间[ 图3Ⅴ和Ⅵ]。
- 拔出针头。
7。后期介入支持治疗
- 从成像平台卸载鼠标。
- 保持在一个温暖,舒适的环境下动物的连续监测,从麻醉药中恢复过来。
- 苏醒并恢复正常行走后,将动物放回笼子。
结果
在50只在超声引导下连续三天校内注射三种不同的肿瘤细胞株(UM-UC1 LUC,UM-UC3 LUC和UM-UC13 LUC)。进行有效的接种(平均时间5.7分钟/动物),并没有与任何内部或后介入并发症。
由超声成像和生物发光进行肿瘤的生长监测。在一天#3肿瘤可以通过超声在所有50个动物的膀胱前壁[ 图4 I]进行检测。 98%的小鼠表现出恒定的肿瘤生长过程中的随访期[ 图4和图5]。随着接种UM-UC3吕克,一个鼠标开发的腹腔肿瘤的传播和在第二个动物[ 表1]后一天#7渐开的肿瘤。这是接种了这种新技术的小鼠的第一个基。
NT“>小鼠处死一天#24,#28和#37接种UM-UC3 LUC,UM-UC1 LUC和UM-UC13 LUC分别后异种移植肿瘤收获并审查了苏木精伊红(H&E节)。所有的肿瘤是肌层浸润性和一些渗透到perivesical脂肪,但没有侵犯到邻近器官观察[ 图6 1]。60%小鼠UM-UC13 LUC肿瘤的小鼠UM-UC3 LUC的20%肿瘤发展这是由H&E染色证实[ 图6 II]腹膜后淋巴结转移。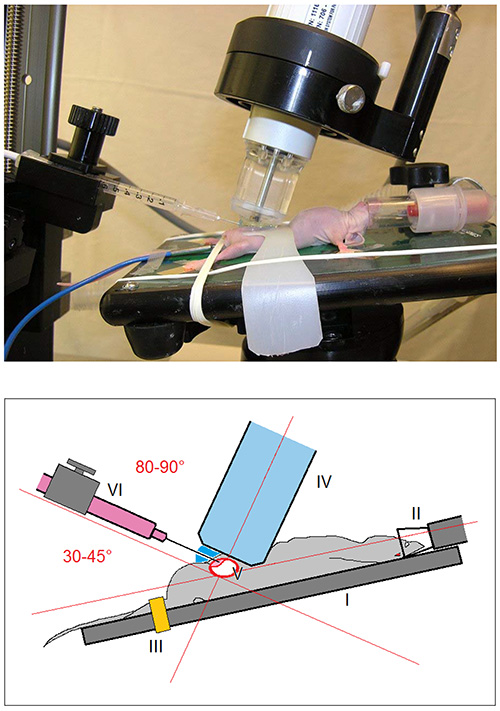
图1。图像和实验装置的示意图。鼠标安装在加热操作表(I)和麻醉下举行(Ⅱ)与3%异氟醚/氧气混合物。下肢固定用橡胶带(Ⅲ)。接近超声扫描头(Ⅳ)对皮肤(具有45-70°的颅骨角度纵向对齐)后的膀胱(V)的可视化的超声屏幕上。用30号针头(Ⅵ)的注射器,被引导到皮肤中的30-45°的角(80-90°相对的超声扫描探头的纵向轴线)。

图2。固定膀胱。尺寸和图示,构建膀胱稳定带( 我 )表带连接到下腹部并且固定膀胱( 二 )。的这样一种逃避避免肌壁间注射过程中膀胱。
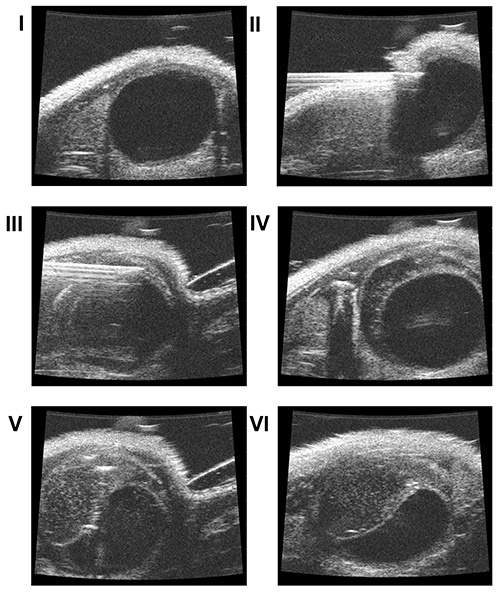
图3。校内接种肿瘤细胞。可视化超声屏幕( 我 )对膀胱的。皮肤和腹壁肌肉的穿孔(II)。针插入膀胱壁无粘膜渗透( 三 )。肌层和缓慢注射后粘膜之间的PBS(50微升)( 四 )。肿瘤细胞悬浮在基质胶在校内人工创造的空间( 五,六 )。
1123fig4.jpg“/>
图4。 。随访超声连续随访超声显示肿瘤体积显著增加( 我 :一天#3, 二 :一天#7, 三 :一天#13)。
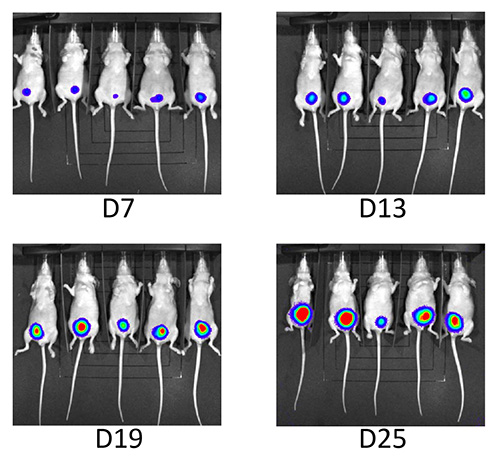
图5。后续通过生物 发光。连续的后续生物发光显示,发光在研究期间不断增加。

图6。裸鼠移植瘤和淋巴结转移组织学。 在一个有代表性异种移植涂TOTO H&E节铁道部证实浸润性生长到肌肉没有侵犯到邻近器官( 一)。 60%的小鼠UM-UC13 LUC肿瘤的小鼠UM-UC3吕克肿瘤出现腹膜后淋巴结转移(II)的20%。
| 接种细胞系 | UM-UC1 LUC | UM-UC3 LUC | UM-UC13 LUC | |
| 小鼠的数目 | 20 | 15 | 15 | |
| 注射量,μL | 40 | 50 | 50 | |
| 细胞计数,绝对 | 3.6×10 5 | 6×10 5个 | 5.5×10 5 | |
| 每只动物的时间,分钟 | 3.4(±1.6) | 7.7(±3.7) | 6.8(±2.9) | |
| 肿瘤发生率 | 49(98%) | |||
| 20(100%) | 14(93%) | 15(100%) | ||
| 淋巴结转移 | 0 | 3(20%) | 9(60%) | |
| 跟进(天) | 28 | 22 [治疗前] | 28 [治疗前] | |
| 肿瘤体积(μL)的 | 4天 | 11.6(±1.3) | 12.5(±1.7) | 14.4(±1.3) |
| 结束 | 394.6(±72.4) | 288.7(±66.1) | 78.3(±13.4) | |
| 后续 | ||||
| 肿瘤发光(光子/秒) | 4天 | 4.6×10 8个 | 2.0×10 8个 | 5.8×10 8个 |
| (±9.4×10 7个) | (±3.7×10 7) | (±1.3×10 8) | ||
| 结束 | 1.9×10 10 | 1.4×10 10 | 1.5×10 10 | |
| 后续 | (±4.0×10 9) | (±2.3×10 9) | (±1.9×10 9) | |
表1中。超声引导下肿瘤细胞注射-过程和结果。
讨论
在肿瘤治疗中几乎所有的重大进展,将需要测试的动物模型开始临床试验之前。癌症的动物模型是必不可少的工具,使研究人员研究肿瘤生物体内 。原位移植瘤模型仍然是黄金标准1,2和继续提供最大的灵活性(在选择的细胞系而言),并有最实用的工具。
图示的程序是预先由Dinney 等 12所描述的原位模型我们建立异种移植肿瘤的超声引导经皮注射三种不同的细胞系用100%的技术成功率的一种微创修饰。在连续随访中,98%的小鼠表现出肿瘤体积不断增加。
通过执行微创技术,我们能够解决壁间模型的现有限制。除了respecting动物福利,本程序的削减侵袭还通过减少手术并发症的数量有助于体内实验的再现性。这是非常有效的时间,以避免腹部开腹手术和伤口愈合相关的需求。我们能够每只动物的手术时间显著下降至3.4分钟(±1.6)。然而,我们的新方法的主要优点是它的准确性。高分辨率超声使我们能够通过可视化盐水注射下的膀胱壁的粘膜产生的空间。这第一步注入有利于肿瘤细胞注射在第二步骤中,减少肿瘤细胞溢出的风险。与此相反,以壁间喷射的技术剖腹手术后,在这里它是不可能想象针的位置和总有不确定性有关注射的准确深度的元素。此外,作为我们接种肿瘤细胞严格分为前膀胱壁,肿瘤的growt避免H于后膀胱壁。随后由于肿瘤生长在输尿管口附近的阻塞性并发症的发生率是非常罕见的。此伴随的效果允许更长的生长和治疗期。
超声引导下肿瘤接种的主要限制是需要有足够的技术设备。因此,本程序的性能可能会被限制于专门在人类癌症的动物模型中的中心。这应该鼓励研究团体之间的合作,这些机构和团体,在这种新颖的动物造型的专业知识之外。
虽然依赖于熟悉超声成像和一些手巧,这种模式很容易在合资格的指导学习。此过程中的关键步骤是建立在膀胱壁用生理盐水人工空间粘膜下的。一旦没有穿孔Ø创造了这个空间F中的粘膜层,它仍然稳定几分钟。第二针插入此空间以便接种肿瘤细胞的指导是相对简单的。创建粘膜下空间的过程中,主要的并发症是针入膀胱腔穿孔。的粘膜下空间的创造,但是,仍然是可行的。针已被慢慢取出到膀胱壁和盐水注入刚刚当粘膜层的翻转针的尖端。这个动作之后的粘膜下空间是较不稳定的(盐水会逃逸到内30-60秒膀胱内腔)和注射肿瘤细胞,必须迅速地进行。溢出的肿瘤细胞进入膀胱内腔可以发生在这些情况下,与粘膜穿孔。虽然肿瘤细胞从肌壁间空间的损失可能导致在随访过程中降低肿瘤体积,我们从来没有观察到任何膀胱肿瘤摄取。
另一个电位Complication是肿瘤细胞通过注射通道的泄漏到腹腔。我们观察到只有一个腹腔肿瘤细胞传播50只,而这发生在我们的第一次尝试之一。我们认为这是注射过大的肿瘤细胞悬液的体积。这是由一个事实,即减少从50-40微升的体积导致没有进一步腹膜内溢出的支持。
这种微创接种的小鼠原位膀胱癌异种移植指现有的“校内模式”的创新改造,惠及双方的研究者和动物一样。这种模式的优点在于鼓励其适应其他器官如肾脏,前列腺和肝脏,以建立原位移植瘤的微创方式。
披露声明
这个视频文章开放获取是由富士胶片VisualSonics公司赞助
致谢
作者要感谢埃利安娜Beraldi为他上使用的小动物超声成像平台的指令进行的肿瘤细胞系和Ben Deeley病毒转导。
该项目是由德国基金会支持系统(DFG; JA 2117/1-1:1),加拿大癌症协会研究所和一个医生指导式科学家奖由温哥华沿岸卫生研究所。超声成像平台是由加拿大创新基金会。
材料
| Name | Company | Catalog Number | Comments |
| Chlorhexidine gluconate (2%) | Aplicare | 82-319 | |
| Dulbecco’s Modified Eagle’s Medium (DMEM) | Thermo Scientific | SH3008101 | |
| Fetal bovine serum (FBS) | Thermo Scientific | SH3007103 | |
| Isoflurane | Baxter Corporation | 402-069-02 | |
| Trypsin (0.25%) | Thermo Scientific | SH3004202 | |
| Syringe (1 ml) | BD Bioscience | 309659 | |
| Hypodermic needle (30 G; ¾ in) | Kendall | 830340 | |
| Angiocatheter (24 G) | BD Bioscience | 381112 | |
| Vevo 770 small animal imaging platform | VisualSonics | ||
| RMV 706 ultrasound scanhead | VisualSonics | ||
| IVIS Lumina III | Caliper Life Science |
参考文献
- Chan, E., Patel, A., Heston, W., Larchian, W. Mouse orthotopic models for bladder cancer research. BJU Int. 104, 1286-1291 (2009).
- Kubota, T. Metastatic models of human cancer xenografted in the nude mouse: the importance of orthotopic transplantation. J. Cell. Biochem. 56, 4-8 (1994).
- Hadaschik, B. A., et al. A validated mouse model for orthotopic bladder cancer using transurethral tumour inoculation and bioluminescence imaging. BJU Int. 100, 1377-1384 (2007).
- Kang, M. R., et al. An Orthotopic Bladder Tumor Model and the Evaluation of Intravesical saRNA Treatment. J. Vis. Exp. (65), (2012).
- Dobek, G. L., Godbey, W. T. An Orthotopic Model of Murine Bladder Cancer. J. Vis. Exp. (48), (2011).
- Dinney, C. P., et al. Isolation and characterization of metastatic variants from human transitional cell carcinoma passaged by orthotopic implantation in athymic nude mice. J. Urol. 154, 1532-1538 (1995).
- Fu, C., Apelo, C. A., Torres, B., Thai, K. H., Hsieh, M. H. Mouse Bladder Wall Injection. J. Vis. Exp. (53), (2011).
- Xiao, Z., et al. Characterization of a novel transplantable orthotopic rat bladder transitional cell tumour model. Br. J. Cancer. 81, 638-646 (1999).
- Iinuma, S., Bachor, R., Flotte, T., Hasan, T. Biodistribution and phototoxicity of 5-aminolevulinic acid-induced PpIX in an orthotopic rat bladder tumor model. J. Urol. 153, 802-806 (1995).
- Jäger, W., et al. Hiding in plain view: Genetic profiling reveals decades old cross-contamination of bladder cancer cell line KU7 with HeLa. J. Urol. (13), (2013).
- Horiguchi, Y., Larchian, W. A., Kaplinsky, R., Fair, W. R., Heston, W. D. Intravesical liposome-mediated interleukin-2 gene therapy in orthotopic murine bladder cancer model. Gene Ther. 7, 844-851 (2000).
- Dinney, C. P., et al. Isolation and characterization of metastatic variants from human transitional cell carcinoma passaged by orthotopic implantation in athymic nude mice. J. Urol. 154, 1532-1538 (1995).
- Black, P. C., et al. Validating bladder cancer xenograft bioluminescence with magnetic resonance imaging: the significance of hypoxia and necrosis. BJU Int. 106, 1799-1804 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。