Method Article
マウス同所性膀胱異種移植片の最小侵襲性の確立
要約
主な侵襲的同所性膀胱癌異種移植片を接種するために確立された技術は、開腹手術と膀胱の動員を必要とします。この手順では、マウスに有意な病的状態を負わせる技術的に困難であり、時間がかかる。したがって、我々は、経皮的アプローチは、超音波誘導を利用して、高精度を開発した。
要約
同所膀胱癌異種移植片は、 生体内分子、細胞操作および新規治療剤を研究するためのゴールドスタンダードです。適切な細胞系はどちら膀胱内注入(非筋肉浸潤性増殖のモデル)、または壁内注入による膀胱壁(浸潤性増殖のモデル)に接種する。両方の手順は、複雑で高度に時間がかかる。さらに、表面的なモデルは、点眼後腫瘍形成性である細胞株が不足しているため、その欠点を持っています。壁内注射は、一方では、処置の侵襲性および宿主マウス用の関連する罹患率によって損なわれている。
念頭に置いてこれらの欠点により、我々は同所膀胱癌異種移植片を作成するための低侵襲なアプローチを開発する従来の方法を変更しました。我々は正常膀胱癌細胞株UM-UC1の経皮接種を行った超音波誘導を使用して、UM-UC3とUM-50胸腺ヌードにUC13。我々は、このアプローチは、効率的で正確かつ安全な時間であることを実証することができた。この技術では、最初に空間をPBSで膀胱粘膜下に作成され、腫瘍細胞は、次いで、第二工程において、この空間に注入される。腫瘍増殖は生物発光イメージング及び超音波で定期的に監視される。平均腫瘍体積は、すべてにおいて着実に増加したが、試験期間にわたる私たちの50匹のマウスの1。
我々の施設では、低侵襲、迅速かつ高精度な方法で膀胱癌異種移植片の接種を可能にするこの新しいアプローチは、従来のモデルに取って代わっている。
概要
がん研究は、腫瘍生物学の理解を深めるために患者の腫瘍由来の細胞株を用いたヒト癌の動物モデルに依存している。異なる治療戦略の下でのin vivo増殖分析のために、マウス同所性膀胱癌モデルは、参照標準1,2残る。免疫不全マウスでのヒト膀胱癌細胞の接種(異種移植モデル)が膀胱内注入(「膀胱モデル」)膀胱壁(「学内モデル」)6,7に3,4,5または直接注入に依存しています。両方の技術はまた、ラット8,9で行うことができる。
膀胱内注入はその後新たな治療薬のその後の膀胱内注入に適している膀胱の尿路上皮表面の腫瘍の形成を誘導する。しかし、この方法を介して送達された場合、確実に腫瘍形成性細胞株の数が制限されるdは、これらの細胞株のいずれか、KU7は、最近のHeLa 4,10であることが実証されている。膀胱内注入はまた、必要な時間の滞留時間に起因するがかかり、それが頻繁に尿道、尿管および腎盂11を含む尿路の隣接する要素における腫瘍増殖を誘導する。さらに、膀胱内注入は、多くの場合、尿管、膀胱に入り、膀胱の床に腫瘍の成長につながり、これは、上気道閉塞および付随する腎不全を引き起こす可能性があります。
全身治療に適している一次侵襲的な膀胱癌の異種移植片を膀胱壁12に、腫瘍細胞を直接注射することによって作成される。多数の細胞株は、このモデルにおいて十分に成長するが、その制限は、腹部切開13の必要性に関連するモデルの侵襲性である。モデルはまた、正確に筋肉壁に細胞を注入する技術的な難しさを学ぶために挑戦している膀胱の。
マウスでは同所原発浸潤性膀胱癌異種移植片を確立するための新しいアプローチは、「学内モデル」の既存の欠点に対処するために、当科で開発された。我々は、正常に確立侵襲モデルを置き換えるためにこの新規な手法をもたらす前方膀胱壁への膀胱癌細胞の経皮的超音波ガイド下注射を最適化することができた。また、我々は潜在的に「学内モデル」の精度と再現性を強化している。
プロトコル
すべての動物の手順は、動物管理カナダ評議会(CCAC)のガイドラインに従って行った。プロトコルは、ブリティッシュ·コロンビア大学の動物管理委員会(:A10-0192プロトコル番号)によって承認された。
1。細胞株の調製
- DNAフィンガープリンティング7により、それぞれのヒト膀胱癌細胞株の同一性を確認する。
- 生物発光による異種移植腫瘍の増殖分析のために、ホタルルシフェラーゼ遺伝子3を運搬するレンチウイルス構築物で細胞株をトランスフェクトする。
- 加湿した5%CO 2雰囲気中、37℃で10%ウシ胎児血清(FBS)を含むダルベッコ改変イーグル培地(DMEM)中に存在する細胞株を解凍し、展開します。継代細胞は、少なくとも3倍が、3ヶ月を超える培養時間を避ける。
2。細胞懸濁液の調製
- マトリゲルを解凍する。以下に温度を保つゲルの粘度の増加を避けるために4℃。
- 70%の合流で細胞をトリプシン処理し、通常の増殖培地に懸濁。
- 血球計または自動セルカウンターで細胞数をカウントします。
- 200×gで5分間細胞懸濁液をスピン。上清を取り除きます。
- (8-15×10 6 / ml)を利用して細胞株に依存し、所望の成長速度で、所望の細胞濃度に到達するために、DMEM(10%FBS)およびマトリゲル(1:1の比)の適切な容積を追加する。腫瘍細胞懸濁液の注入量は40μlのであろう。
- 懸濁液中に気泡を作成しないよう、ピペッティング(P1000)でよく混ぜる。
3。動物の作製
注:ためのステップ4.7での経尿道カテーテル挿入のための潜在的な必要性のために、雌マウスは、この動物モデルにおいて好ましい性別です。
- ハウスマウス制度と国家の動物管理区によるとidelines。マウスを含むすべての実験のための倫理委員会の承認を受けなければならない。
- 3%イソフルラン/酸素混合物でマウスを麻酔。動物の適切な麻酔(つま先ピンチに例えば非応答性)を確認してください。
4。実験セットアップ
- フラット硬質プラスチック材料のいずれかの種類から膀胱の安定化[ 図2 I]をカット。慎重にストラップを検査し、マウスへの適用の前に、シャープなエッジを削除します。
- バイタルサインを継続的に監視した小動物イメージングプラットフォームの[ 図1 I〕加熱撮影台上の動物をマウントします。 [ 図1 III〕輪ゴムで下肢を固定します。
- 2%のグルコン酸クロルヘキシジンで腹部を消毒し、滅菌綿棒で皮膚を拭いてください。
- 膀胱安定ストラップ[ 図2 II]で膀胱を固定。このように、脱税ステップ5.6における学内注入時膀胱の回避される。
- 下腹部に無菌超音波ゲルを適用します。
- ゆっくりと超音波走査ヘッド(周波数40 MHz)で、皮膚への[ 図1 IV](45〜70°の頭蓋角度で縦)に近づくと、超音波画面で膀胱[ 図3 I]を可視化する。
- 膀胱が空である場合、経尿道24 Gの血管カテーテルを介して50μlの滅菌、暖かいリン酸緩衝食塩水(PBS)でそれを埋める。
5。膀胱壁層の分離
- PBSで満たし、30 Gに接続1.0ミリリットル注射器を取り付け、¾針にシリンジクランプに(前方に向けられベベル)。
- 位置だけで30〜45°の角度の恥骨の上の皮膚に向けた針(超音波走査ヘッドの縦軸に対して80〜90 [ 図1])。
- 針を検出超音波画面で。
- ゆっくりと皮膚や腹壁の筋肉[ 図3 II]を穿孔する。
- (現在は後方監督)針180°の斜面をオンにします。
- 粘膜を貫通することなく、膀胱壁に針の先端を挿入する[ 図3 III]
- ゆっくりと人工の空間[ 図3 IV]を作成するために、筋層と粘膜の間に50μlのPBSを注入。
注意:粘膜が誤ってステップ5.6の間に穿孔されている場合は、ゆっくりと針を引き戻すと、粘膜層は、針の先端の上に戻って反転した後に、50μlのPBSを注入。 - 針を撤回。
6。膀胱癌細胞の壁内接種
- シリンジクランプに針で30 G、¾と(マトリゲルに懸濁した癌細胞で満たされた)第1.0ミリリットル注射器を取り付けます。
- 同様に針の先端を案内するステップ5.7で作成されたPBSで満たされた空間を。
- [ 図3 VおよびVI]この空間に細胞懸濁液40μLを注入。
- 針を撤回。
7。ポストインターベン支持療法
- イメージングプラットフォームからマウスのマウントを解除します。
- 麻酔から回復している間、連続監視下に暖かく、快適な環境で動物を保管してください。
- 意識を取り戻し、通常の歩行を再開した後、そのホームケージに戻って動物を配置します。
結果
三つの異なる腫瘍細胞株(UM-UC1のLUC、UM-UC3のLUCとUM-UC13のLUC)の学内注射は3日間連続で超音波の指導の下で50匹で実施した。接種は、効果的に実施された(時間5.7分/動物を意味する)と、任意の内やポスト介入的合併症と関連していなかった。
腫瘍増殖のモニタリングは、超音波イメージング及び生物発光により行った。日中、第3位に腫瘍は、すべての50の動物[ 図4 I]の前膀胱内に超音波によって検出することができた。マウスの98%が[ 図4および図5]フォローアップ期間中に一定の腫瘍増殖を示した。 UM-UC3のLUCの接種後、1マウスの腹腔内腫瘍の普及と第二の動物[ 表1]に日#7の後に退縮した腫瘍を開発しました。これは、この新しい技術を接種したマウスの最初のグループだった。
NT ">日目にマウス#24、#28、およびそれぞれのUM-UC3のLUCの接種後#37、UM-UC1のLUCとUM-UC13のLUC、目に屠殺した。異種移植腫瘍は、ヘマトキシリンおよびエオシンで採取し、検査した(H&E )のセクションでは、すべての腫瘍は、筋肉浸潤性といくつかの膀胱周囲脂肪に浸透したが、隣接臓器へのない侵入が認められなかった[ 図6 I]でした。UM-UC13のLUC腫瘍を有するマウスの60%とUM-UC3 LUCを有するマウスの20%腫瘍は[ 図6 II]のH&E染色により確認された後腹膜リンパ節転移を開発しました。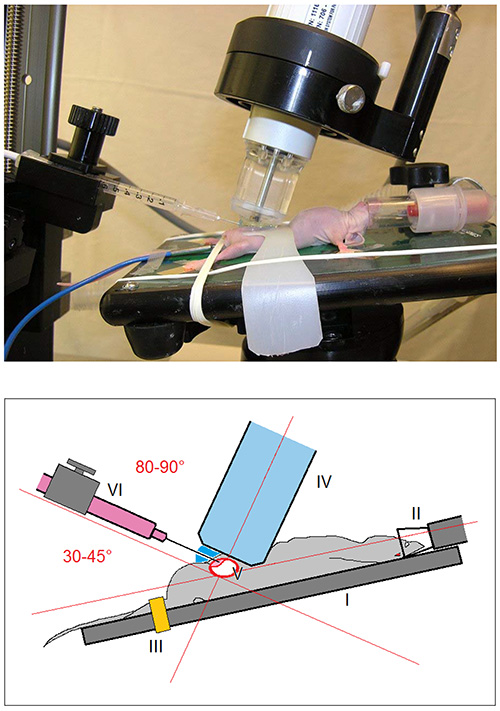
図1。画像及び実験装置の概略図。マウスは、加熱された作動表(I)に搭載され、<(麻酔下に保持され3%イソフルラン/酸素混合物と強い> II)。下肢は輪ゴム(III)で固定されている。皮膚(45〜70°の頭蓋角度で長手方向に整列)に超音波走査ヘッド(IV)を近づいた後、膀胱(V)は 、超音波の画面上で可視化されている。 30 G針(VI)を有するシリンジを、30〜45°(超音波スキャンヘッドの長手方向軸に対して80〜90°)の角度で皮膚に案内される。

図2。膀胱の固定化。寸法と膀胱安定ストラップ(I)を構築するための図はストラップが下腹部に装着し、膀胱(II)に固定化されている。このための回避学内注入時膀胱が回避される。
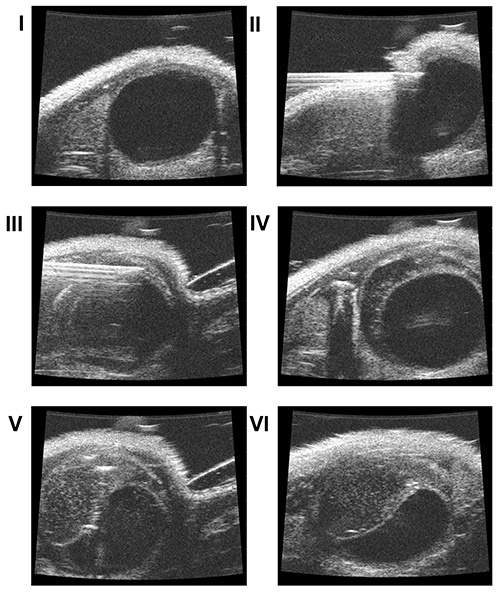
図3。超音波画面(I)に膀胱の腫瘍細胞の壁内接種。可視化。皮膚および腹壁筋の穿孔(II)。粘膜の浸透せずに膀胱壁への針の挿入(III)。遅い注入後の筋層と粘膜(IV)との間に、PBS(50μL)。腫瘍細胞は、人工的に作成された壁内空間(V、VI)でマトリゲルに懸濁した。
1123fig4.jpg "/>
図4。 (:1日に#3、II:1日に第7、 第III:1日に#13 I)超音波による超音波によるフォローアップを継続的フォローアップは、腫瘍体積の有意な増加を示した。
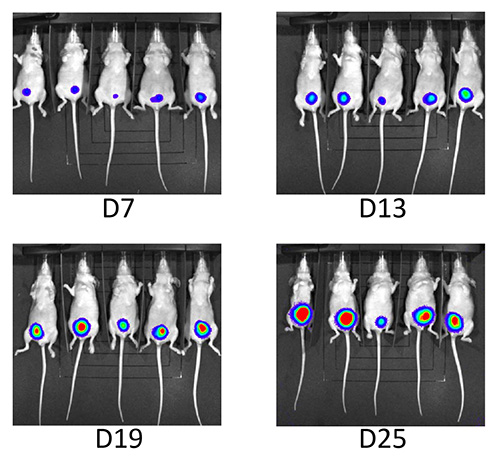
図5。生物発光によるフォローアップ生物発光による連続フォローアップ調査期間にわたって発光の一定の増加を示した。

図6。異種移植腫瘍とリンパ節転移の組織学。代表異種移植TUのTOTOのH&Eセクションで MOR隣接臓器(I)への侵入することなく、筋肉に浸潤性増殖を示した。 UM-UC13のLUC腫瘍を有するマウスの60%とUM-UC3のLUC腫瘍を有するマウスの20%が後腹膜リンパ節転移(II)を発表した。
| 接種した細胞株 | UM-UC1 LUC | UM-UC3 LUC | UM-UC13 LUC | |
| マウスの数 | 20 | 15 | 15 | |
| ボリュームを注射、μL | 40 | 50 | 50 | |
| 絶対細胞数、 | 3.6×10 5 | 6×10 5 | 5.5×10 5 | |
| 動物当たりの時間、分 | 3.4(1.6±) | 7.7(3.7±) | 6.8(2.9±) | |
| 腫瘍発生 | 49(98%) | |||
| 20(100%) | 14(93%) | 15(100%) | ||
| リンパ節転移 | 0 | 3(20%) | 9(60%) | |
| (日)フォローアップ | 28 | 22 [処理の前に] | 28 [処理の前に] | |
| 腫瘍体積(μL) | 4日目 | 11.6(±1.3) | 12.5(±1.7) | 14.4(±1.3) |
| の終わり | 394.6(72.4±) | 288.7(66.1±) | 78.3(13.4±) | |
| 追跡調査 | ||||
| 腫瘍ルミネッセンス(光子/秒) | 4日目 | 4.6×10 8 | 2.0×10 8 | 5.8×10 8 |
| (9.4×10 7±) | (3.7×10 7±) | (1.3×10 8、±) | ||
| の終わり | 1.9×10 10 | 1.4×10 10 | 1.5×10 10 | |
| 追跡調査 | (4.0×10 9、±) | (2.3×10 9、±) | (1.9×10 9、±) | |
表1。超音波ガイド下腫瘍細胞注入-手順および結果。
ディスカッション
癌治療におけるほぼすべての主要な進歩は、臨床試験を開始する前に、動物モデルでの試験を必要とする。癌の動物モデルは、 インビボで腫瘍生物学を研究する研究者を可能にする重要なツールである。同所異種移植モデルでは、1,2の金は、標準のままで、(細胞株の選択の点で)最大限の柔軟性を提供し、最も実用的な有用性を持ち続ける。
図示の手順は、我々は、100%の技術的成功率つの異なる細胞株の超音波ガイド経皮注射によって異種移植腫瘍を確立し、以前Dinney ら 12によって記載同所性モデルの最小侵襲変形例である。連続的なフォローアップ中、マウスの98%が腫瘍体積の一定の増加を示した。
低侵襲技術を実施することにより、我々は学内モデルの既存の制限に対処することができました。 respeほかに動物福祉をcting、この手順の減少侵襲性はまた、外科合併症の数を減少させることにより、in vivo実験の再現性に貢献しています。それは非常に腹部開腹および創傷閉鎖のための関連する必要性を回避するのに有効な時間である。私たちは、3.4分(±1.6)に大きく動物あたり手続き時間を短縮することができました。しかし、我々の新しいアプローチの主な利点は、その精度です。高解像度の超音波は、私たちは膀胱壁の粘膜下に生理食塩水注射によって作成された領域を可視化することができます。この第一段階の注入は第二段階で腫瘍細胞注入を促進し、腫瘍細胞の流出の危険性を最小にする。これは、針の配置を視覚化することは不可能であり、注入の正確な深さに関する不確実性の要素が常にある開腹手術の後壁内注射の技術に対照的である。また、我々は厳密に前方膀胱壁への腫瘍細胞を接種されると、腫瘍growt後部膀胱壁上のHが回避される。その後、尿管口付近の腫瘍の成長に起因する閉塞性合併症の割合は極めてまれである。これに伴い効果が長く成長し、治療期間を可能にします。
超音波ガイド下腫瘍接種の主な制限は、十分な技術的な装置の必要性である。したがって、この手順の性能はおそらくヒト癌の動物モデルに特化してセンターに制限される。これは、新たな動物モデルでの専門知識を持つこれらの機関やグループ外の研究グループ間の連携を奨励すべきである。
超音波画像化といくつかの手先の器用さと親しみやすさに依存していますが、このモデルでは、有能な指導のもと簡単に習得することができます。手順の重要なステップは、生理食塩水で膀胱壁内の人工的な宇宙粘膜下の作成です。このスペースは、穿孔Oなしで作成されると粘膜層fは、それは数分間安定したままである。腫瘍細胞を接種するために、このスペース内に第2の針の指導のは比較的簡単です。粘膜下スペースの作成中に主な合併症は、膀胱内腔に針の穿孔である。粘膜下空間の作成は、しかしながら、実現可能なままである。針は、膀胱壁に徐々に引き抜かれなければならず、生理食塩水は、粘膜層は針の先端の上に反転したときだけで注射した。この手技の後、粘膜下空間が少なく安定している(生理食塩水は30〜60秒以内に、膀胱内腔に逃げる)および腫瘍細胞の注入は迅速に行われなければならない。膀胱内腔への腫瘍細胞のこぼれは、粘膜の穿孔と、これらの場合に発生する可能性があります。学内宇宙からの腫瘍細胞の損失が追跡期間中に減少し、腫瘍体積につながるかもしれないが、我々はすべての膀胱腫瘍の取り込みを観察したことがありません。
別の潜在的なComplicationは、注入チャネルを介して腹膜腔への腫瘍細胞の流出である。私たちは、50匹で唯一の腹腔内腫瘍細胞播種を認められ、これが私たちの最初の試みの1で発生した。我々は、大きすぎる腫瘍細胞懸濁液体積の注入には、この属性。これは50-40μLからボリュームを減らすことが、それ以上の腹腔こぼれをもたらしたという事実によってサポートされていました。
マウス同所膀胱癌異種移植のこの最小限の侵襲接種も同様に研究者と動物の両方に利益をもたらす、既存の「学内モデル」の革新的な変更を表しています。このモデルの利点は、低侵襲な方法で同所異種移植腫瘍を確立するために、腎臓、前立腺や肝臓など他の臓器への適応を促進する。
開示事項
このビデオの記事のためのオープンアクセスは富士フイルムVisualsonicsの社が主催している
謝辞
著者らは小動物の超音波イメージング·プラットフォームを使用することで彼の命令に腫瘍細胞株とベンディーリーのウイルス形質導入を行うためのElianaのBeraldiを承認したいと思います。
このプロジェクトは、ドイツFoundationのシステムによってサポートされていました(DFG、JA 2117/1-1:1)、カナダの癌協会研究所、バンクーバー沿岸保健研究所からのメンター医師科学者賞。超音波イメージング·プラットフォームは、イノベーションのためのカナダの財団によって資金を供給された。
資料
| Name | Company | Catalog Number | Comments |
| Chlorhexidine gluconate (2%) | Aplicare | 82-319 | |
| Dulbecco’s Modified Eagle’s Medium (DMEM) | Thermo Scientific | SH3008101 | |
| Fetal bovine serum (FBS) | Thermo Scientific | SH3007103 | |
| Isoflurane | Baxter Corporation | 402-069-02 | |
| Trypsin (0.25%) | Thermo Scientific | SH3004202 | |
| Syringe (1 ml) | BD Bioscience | 309659 | |
| Hypodermic needle (30 G; ¾ in) | Kendall | 830340 | |
| Angiocatheter (24 G) | BD Bioscience | 381112 | |
| Vevo 770 small animal imaging platform | VisualSonics | ||
| RMV 706 ultrasound scanhead | VisualSonics | ||
| IVIS Lumina III | Caliper Life Science |
参考文献
- Chan, E., Patel, A., Heston, W., Larchian, W. Mouse orthotopic models for bladder cancer research. BJU Int. 104, 1286-1291 (2009).
- Kubota, T. Metastatic models of human cancer xenografted in the nude mouse: the importance of orthotopic transplantation. J. Cell. Biochem. 56, 4-8 (1994).
- Hadaschik, B. A., et al. A validated mouse model for orthotopic bladder cancer using transurethral tumour inoculation and bioluminescence imaging. BJU Int. 100, 1377-1384 (2007).
- Kang, M. R., et al. An Orthotopic Bladder Tumor Model and the Evaluation of Intravesical saRNA Treatment. J. Vis. Exp. (65), (2012).
- Dobek, G. L., Godbey, W. T. An Orthotopic Model of Murine Bladder Cancer. J. Vis. Exp. (48), (2011).
- Dinney, C. P., et al. Isolation and characterization of metastatic variants from human transitional cell carcinoma passaged by orthotopic implantation in athymic nude mice. J. Urol. 154, 1532-1538 (1995).
- Fu, C., Apelo, C. A., Torres, B., Thai, K. H., Hsieh, M. H. Mouse Bladder Wall Injection. J. Vis. Exp. (53), (2011).
- Xiao, Z., et al. Characterization of a novel transplantable orthotopic rat bladder transitional cell tumour model. Br. J. Cancer. 81, 638-646 (1999).
- Iinuma, S., Bachor, R., Flotte, T., Hasan, T. Biodistribution and phototoxicity of 5-aminolevulinic acid-induced PpIX in an orthotopic rat bladder tumor model. J. Urol. 153, 802-806 (1995).
- Jäger, W., et al. Hiding in plain view: Genetic profiling reveals decades old cross-contamination of bladder cancer cell line KU7 with HeLa. J. Urol. (13), (2013).
- Horiguchi, Y., Larchian, W. A., Kaplinsky, R., Fair, W. R., Heston, W. D. Intravesical liposome-mediated interleukin-2 gene therapy in orthotopic murine bladder cancer model. Gene Ther. 7, 844-851 (2000).
- Dinney, C. P., et al. Isolation and characterization of metastatic variants from human transitional cell carcinoma passaged by orthotopic implantation in athymic nude mice. J. Urol. 154, 1532-1538 (1995).
- Black, P. C., et al. Validating bladder cancer xenograft bioluminescence with magnetic resonance imaging: the significance of hypoxia and necrosis. BJU Int. 106, 1799-1804 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved