Method Article
重组蛋白表达的结构生物学在HEK 293F悬浮细胞:一种新的和可访问方法
摘要
The expression of recombinant proteins by mammalian systems is becoming an attractive method for producing protein complexes for structural biology. Here we present a simple yet highly efficient expression system using suspension grown mammalian cells to purify protein complexes for structural studies.
摘要
The expression and purification of large amounts of recombinant protein complexes is an essential requirement for structural biology studies. For over two decades, prokaryotic expression systems such as E. coli have dominated the scientific literature over costly and less efficient eukaryotic cell lines. Despite the clear advantage in terms of yields and costs of expressing recombinant proteins in bacteria, the absence of specific co-factors, chaperones and post-translational modifications may cause loss of function, mis-folding and can disrupt protein-protein interactions of certain eukaryotic multi-subunit complexes, surface receptors and secreted proteins. The use of mammalian cell expression systems can address these drawbacks since they provide a eukaryotic expression environment. However, low protein yields and high costs of such methods have until recently limited their use for structural biology. Here we describe a simple and accessible method for expressing and purifying milligram quantities of protein by performing transient transfections of suspension grown HEK (Human Embryonic Kidney) 293F cells.
引言
分子细胞生物学的迅速发展和提高药物在医学上需要不断创造了一个需要进行结构生物学家看着越来越复杂的蛋白质结构。这些通常可能需要特定的翻译后修饰,分子伴侣和辅因子,以支持他们的精心折叠和酶活性。虽然目前在用细菌表达系统已获得的蛋白质数据库结构的绝大部分,原核生物无法执行大量的这些修改和缺乏许多基本的真核合作的因素。这可能是一个问题对于大型多亚基复合物,是由小信号分子,以及用于核,细胞表面和需要复杂的折叠机器的分泌蛋白活性的研究。一些E的大肠杆菌菌株已被工程化以克服这些局限性1。近年来,然而,使用米ammalian表达系统一直在增加,因为它们可靠地生产的真核蛋白质,是有问题的,否则在其他系统2来表示。今天它是可能的,通过各种范围从病毒转导到化学介导的转染技术,以获得稳定的和短暂的哺乳动物表达细胞系,物理的基因转移,如电穿孔和直接注射3。虽然所有这些方法都具有其自己的优点和缺点,仅其中的一些适合的结构研究是不是太昂贵和/或耗时的。
在这里,我们描述了用于在悬浮液中生长的哺乳动物细胞表达的蛋白质复合物的结构生物学非常简单,快速,廉价而高效的方法。该方法采用瞬时共转染人胚肾(HEK)细胞系( 如自由式HEK 293F细胞)。这些细胞已被来自HEK 293 CELL线,适合于悬浮培养物生长,达到了使用无血清培养基的高密度(如自由式293表达培养基)。然后将细胞瞬时使用的聚乙烯亚胺的支链版本(PEI),已报道的功能对于大范围的哺乳动物细胞4通过形成DNA / PEI复合物进入宿主细胞通过内吞作用5廉价的聚合物试剂进行转染。此方法是同时适合小规模(30毫升)和大规模(最多300毫升)中的实验,可以产生高水平的纯化蛋白质复合物。它是研究需要复杂的折叠机器,辅因子或不能由细菌,酵母和昆虫细胞中进行特定的翻译后修饰的蛋白是特别有用的。
在这个协议中,我们提出从Sin3A转录抑制复合物的三个蛋白中央支架的表达和纯化。这是由组蛋白的去乙酰化酶1(HDAC1)的缺陷沉默3(SDS3)抑制器和开关独立3(Sin3A)。纯化的复合物被用于高通量结晶试验。
研究方案
注:该协议是适用于任何规模的表达,因此,试剂的体积和数量应当按比例进行缩放。合适的哺乳动物表达载体必须用于本协议。在这里,我们使用的改性pcDNA 3.1表达载体便利地允许根据在克隆( 图1)中使用的限制性酶的选择的亲和标签的包含或排除。以下协议描述了一个大规模的转染。
1,大型文化/转1升转瓶
生长并根据标准方法保持HEK293F悬浮适应细胞。通常的30至100毫升的起始培养生长于250ml锥形细胞培养瓶中。
- 种子细胞以0.5×10 6个细胞/ ml至300 ml,在每1 升转瓶的终体积。
注:摇瓶最少150毫升,以容纳最多300毫升悬浮培养。对于较大规模的转染使用多个瓶子。 - 孵育24小时,在轨道摇床培养箱中,在37℃,120rpm下,和5%的CO 2,直至细胞达到1.0×10 6个细胞/ ml的密度(细胞应划分约每24小时)。
- 吸取总共300微克过滤灭菌的DNA(参见补充方法)到30的PBS中的溶液,并涡旋混合3秒。
注:使用共有1微克每百万转染细胞的DNA。如果两个或更多个质粒进行共转染减少每个的量,使得DNA的细胞的比率保持恒定。 - 补充加入1.2ml 0.5毫克/毫升过滤灭菌的PEI与PBS / DNA溶液和涡旋混合3秒。
- 孵育混合物在室温下20分钟。
- 加入该DNA / PEI混合的细胞-这应当是在1×10 6个细胞/ ml(步骤1.3)的密度。
- 以下共转染,培养的细胞在轨道摇床培养箱中进一步的48小时,在37℃,120rpm下,和5%的CO 2。
- 收获细胞内蛋白质通过在3000×g离心5分钟,离心细胞,将片状沉淀储存于-80℃。
注意:可替换地,可使用标准(非CO 2)的振荡培养箱中,如果培养上述的气氛置换为5%的CO 2和瓶盖密封。大气中会需要在每个通道(通常每2天)进行更换。
从全细胞提取2蛋白复合物的分离纯化
这个协议被优化用于使用标记标签蛋白核配合物的纯化。
- 解冻的细胞沉淀进入〜40预冷的裂解缓冲液(100mM的醋酸钾,的50mM Tris pH值7.5,5%甘油,0.3%的Triton X-100,蛋白酶抑制剂),每升培养物。
- 重悬沉淀吹打向上和向下几次(避免起泡,不要旋涡)。
- 彻底重新暂停使用玻璃匀浆细胞。超声清洗3次(15秒时,15秒关闭)。离心30000×g离心25分钟,在4℃,并保留上清液。
- 平衡1.25抗旗洗涤三次,用树脂的平衡缓冲液(100mM乙酸钾,50毫摩尔Tris pH7.5)中填充每升培养物的琼脂糖树脂的溶液中。
- 培养从步骤2.3中一个或多个的50ml离心管中的亲和树脂的全细胞提取物,并在4℃下轻轻地旋转样品为30-120分钟。
- 离心机在3000 XG为1分钟,在4℃下,弃上清。
- 用45ml预冷的缓冲液1中洗涤树脂(100mM的醋酸钾,的50mM Tris pH值7.5,5%甘油,0.3%的Triton X-100)。离心机在3000×g离心1分钟,弃上清。
- 重复步骤2.7用高盐缓冲液(300mM的醋酸钾,的50mM Tris pH值7.5,5%甘油)中,然后用低盐缓冲液(50mM醋酸钾,50毫摩尔Tris pH 7的0.5,5%甘油)和TEV裂解缓冲液(50mM醋酸钾,的50mM Tris pH值7.5,0.5 mM的TCEP)。
注:确保每次洗涤是短暂即足以充分重悬浮树脂和不再。 - 收集树脂的10微升样品,并稀释至1体积的分析2×蛋白加样缓冲液(结合蛋白对照)。不使用的还原剂,以避免从树脂释放的抗体。
- 重悬的树脂注入8-10毫升预冷TEV裂解缓冲液和转移至15ml离心管中。
- 添加〜40微克(1毫克/毫升的股票)每升原生态文化的TEV蛋白酶和移液器向上和向下几次拌匀。
- 更换管的氛围,100% 氮气 ,以防止蛋白质氧化。
- 轻轻转动在o / n 4℃。
- 离心机在3000×g离心10分钟。将上清液转移到一个超离心过滤器具有合适的分子量截断和集中下降到500微升。
- 收集浓缩的蛋白质的10微升样品,并稀释至1倍体积的2×蛋白加样缓冲液进行分析。 (TEV洗脱液控制)。
- 收集该树脂的10微升样品,并稀释成1倍体积的2×蛋白加样缓冲液进行分析。不使用的还原剂,以避免从树脂释放出大量的抗体。 (后TEV树脂控制)。
- 平衡用凝胶过滤缓冲液(50mM醋酸钾,的50mM Tris pH值7.5,0.5 mM的TCEP)的大小排阻层析柱。
- 通过0.22微米的过滤器过滤的蛋白质
- 加载样品进入柱,并收集级分。
- 运行样品从步骤2.9,2.15和2.16和从上的SDS-PAGE和考马斯亮蓝染色分析步骤2.19的凝胶过滤级分。
注:最好是从步骤2.9,2.15和2.16之前的凝胶过滤运行的SDS-PAGE样品以确认靶蛋白的表达。
结果
在这里,我们展示一个2升(8×250毫升培养)瞬时共转染和净化HDAC1,SDS3,Sin3A三元复合物。通过Sin3A的HDAC-相互作用结构域(HID)与Sin3A HDAC1和SDS3交互。典型的纯化产量可达1毫克每升培养物络合物。
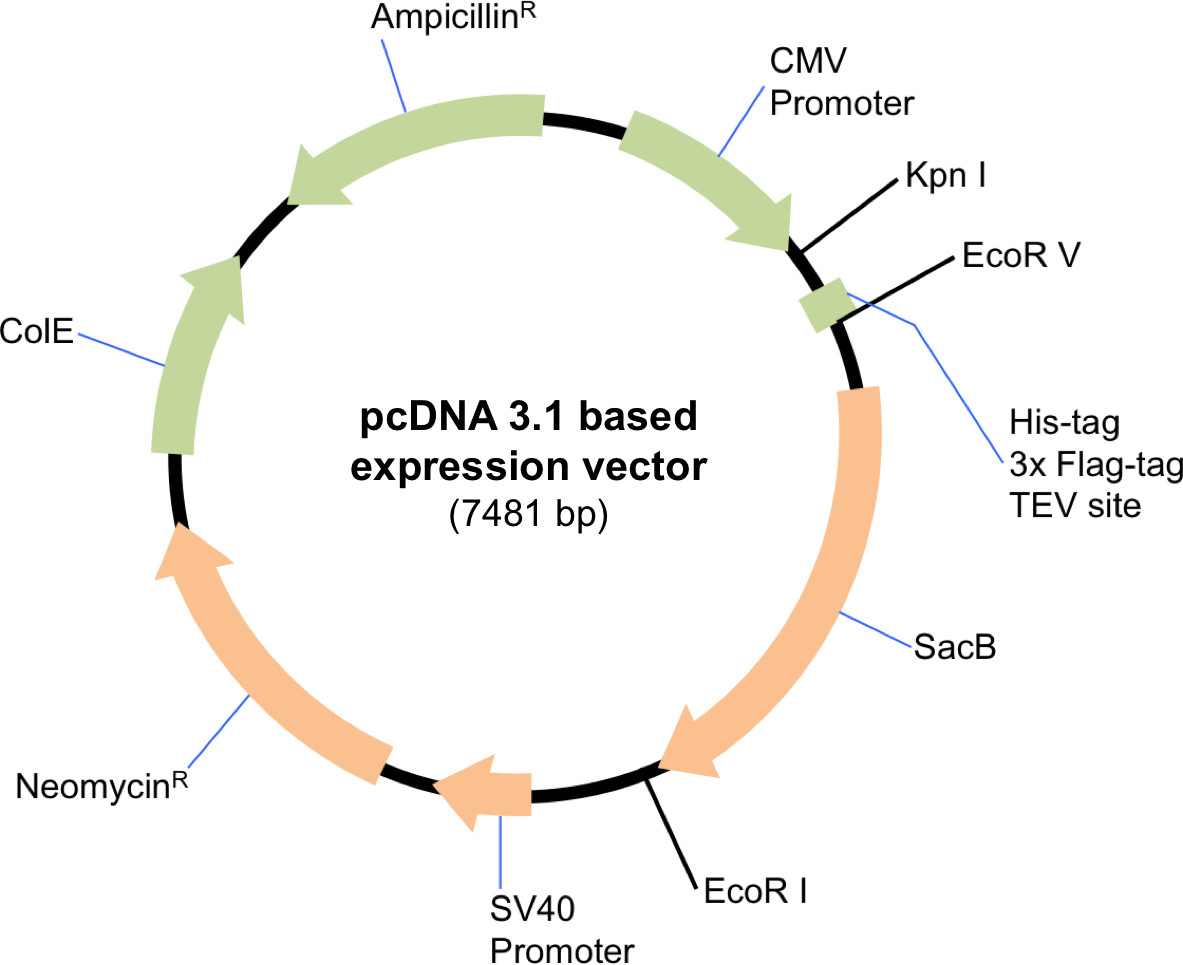
图1原理图的改性pcDNA 3.1表达载体的构建。的质粒用EcoRV消化和EcoRI消化,以包括关于Sin3A的氨基末端亲和标签和TEV切割位点。克隆HDAC1和SDS3的未标记的版本中,该载体用KpnI消化和EcoRI消化。
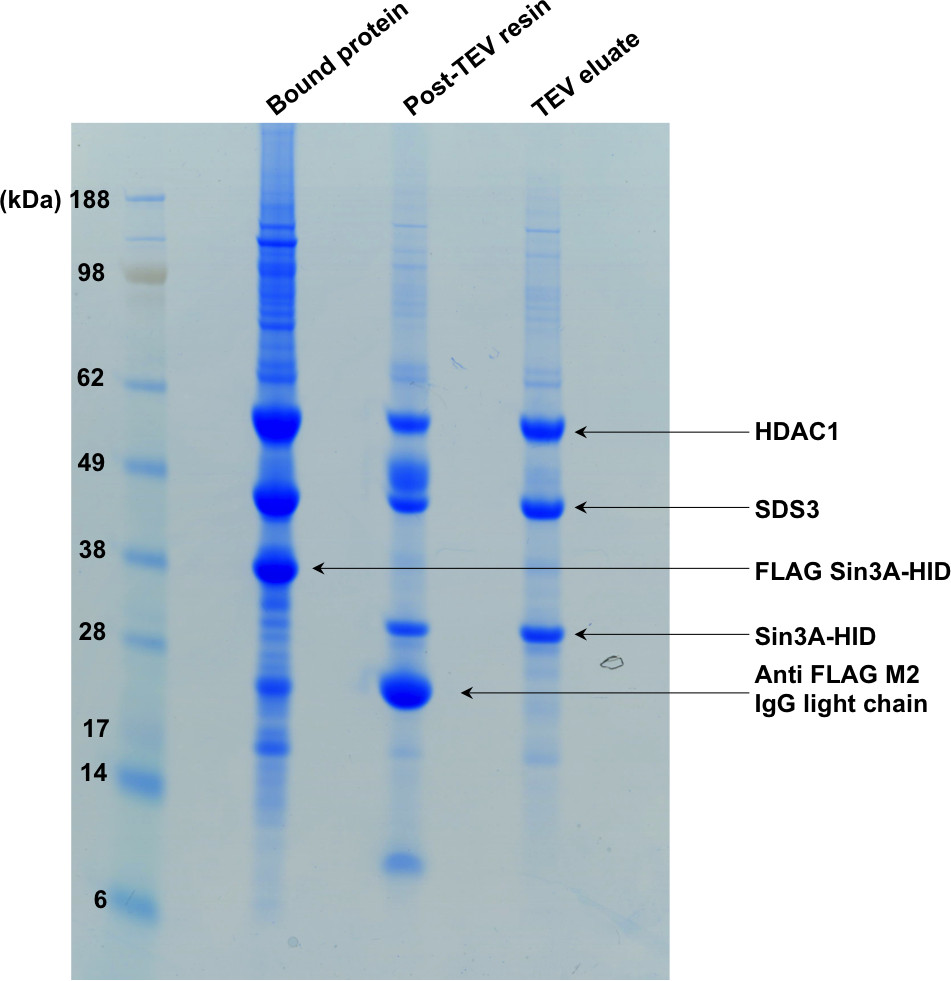
图2 SDS-PAGë表示纯化的第一步,"结合蛋白"行结合到亲和树脂的复合物。以下TEV消化,上Sin3A-HID标记本被裂解掉,复合物从树脂中洗脱所示凝胶的第二和第三通道。
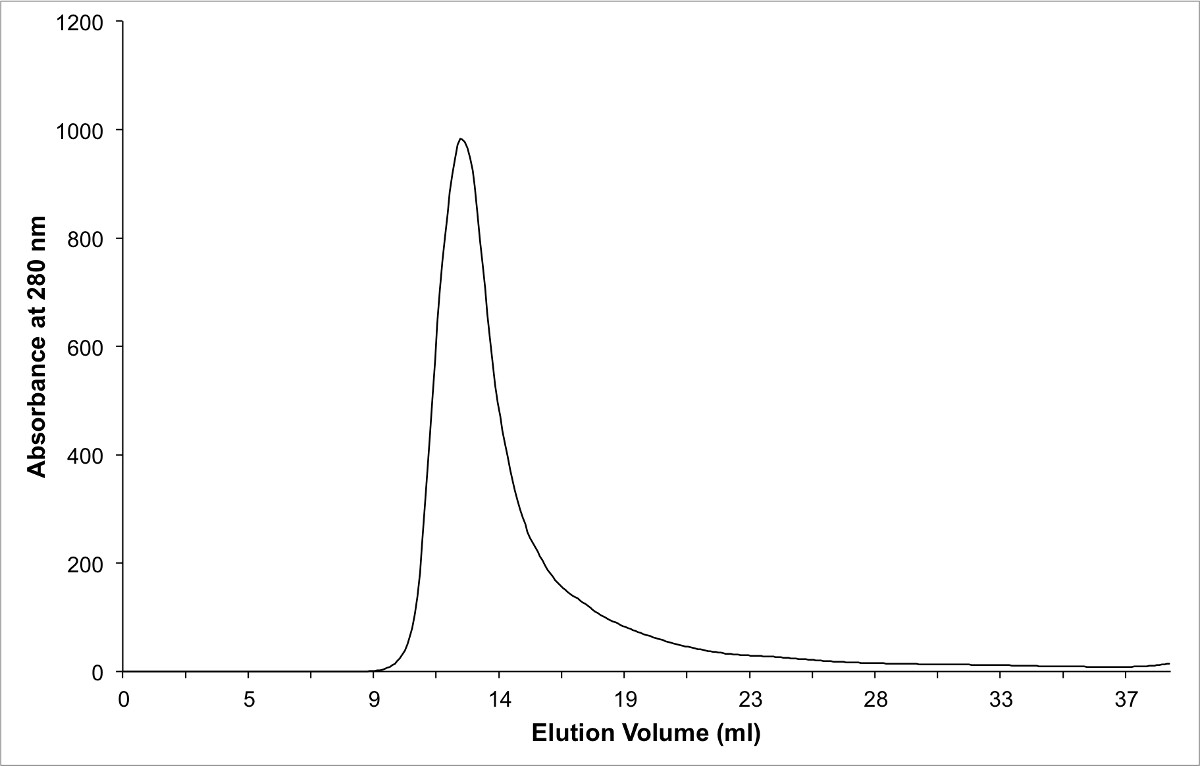
图3的色谱的蛋白质复合体的纯化使用尺寸排阻色谱法。注意,纯配合物中洗脱的空隙体积,因为它形成了一个二聚物在溶液中。
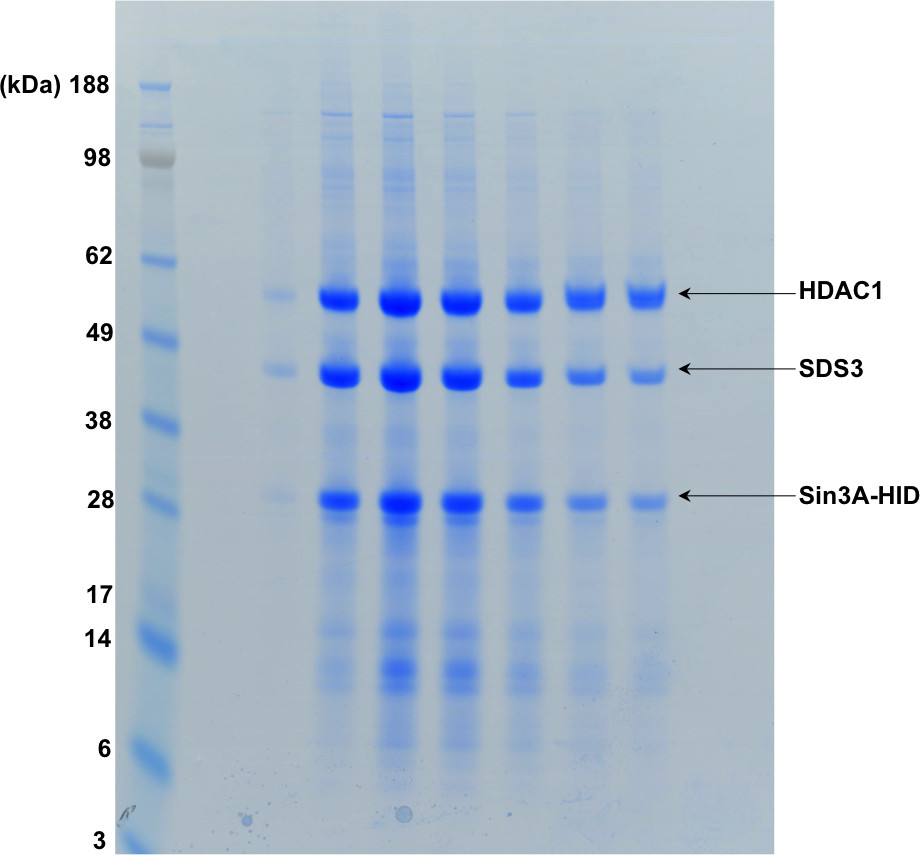
图4的SDS-PAGE显示在图3中示出的凝胶过滤的级分。
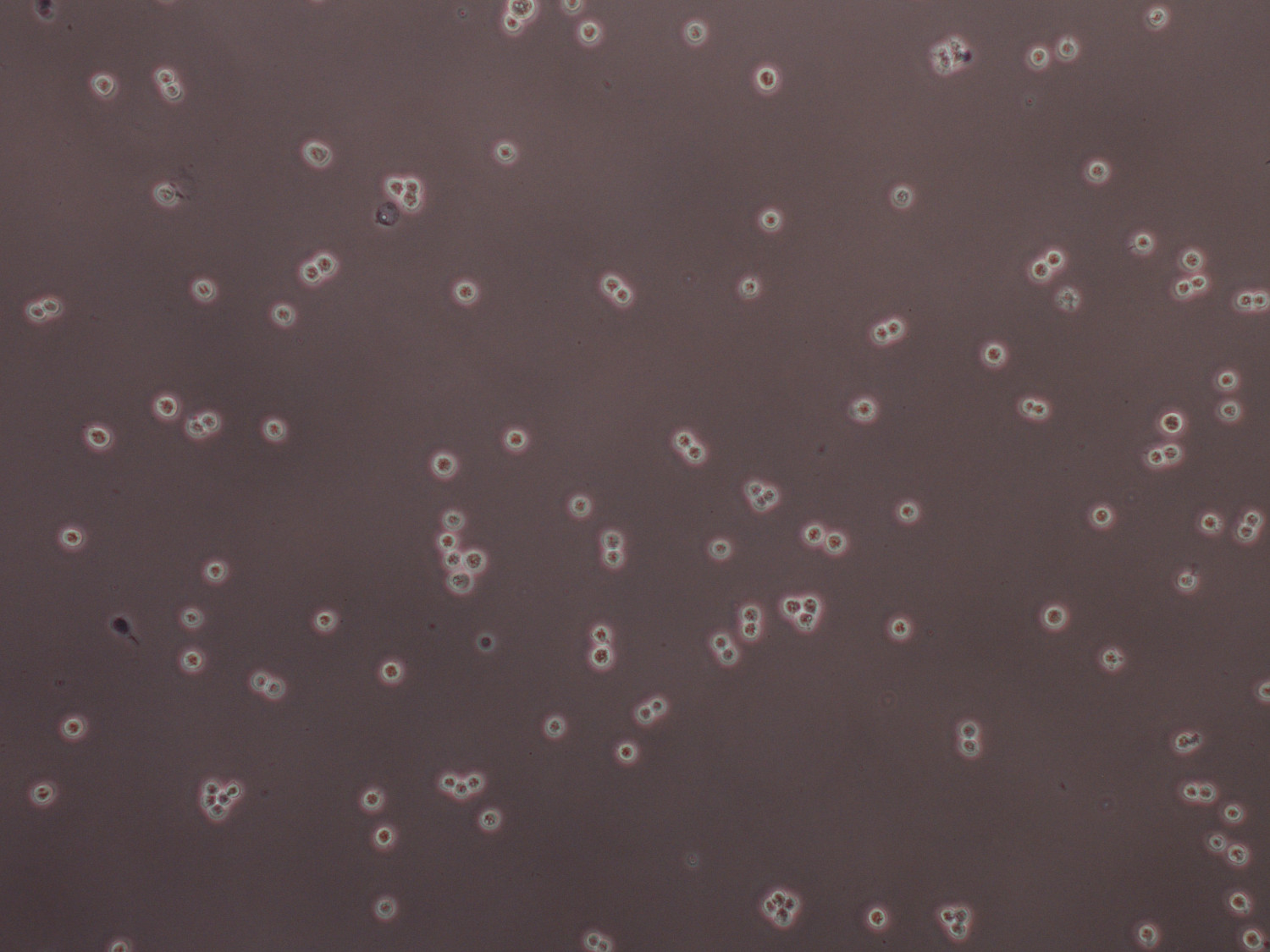
图5台盼蓝染色的HEK 293F细胞在2.3×10 6个细胞/ ml准备待转染。细胞应仅存在作为单个或分裂的细胞,而大型集群可以被打破,剧烈涡旋振荡约25秒。
| 问题 | 可能的原因 | 动作 |
| 低蛋白产量。 | 细胞数量低转。 | 确定细胞密度是约1.0×10 6之前加入转染反应混合物至培养。 |
| 细胞可能已传代次数太多。 | 使用新鲜的股价细胞后约90通年龄。 | |
| DNA可以被降解或具有高的量的杂质。 | 确保所使用的质粒DNA具有260/280比1.8和2.0之间。在琼脂糖凝胶上运行的DNA是可取的,以评估其质量。 | |
| 蛋白(S)被表达并不稳定,或溶于足够了。 | 测试小规模向上调整的转染前不同的结构。确保标签不与感兴趣的蛋白(S)的结构干扰。 | |
| 细胞看起来浑浊并有一个不寻常的颜色和/或气味。 | 细胞被感染的细菌或酵母。 | 良好的无菌技术,必须使用在任何时候。熏蒸的层流净化罩和UV消毒的细胞培养室中的情况下感染有助于含有问题。 |
| 细胞具有较低的生存能力。 | 错误的pH值在媒体上。 | 确保文化是在5-8%的CO 2增长在任何时候。 |
| 细胞被培养至密度超过3.0×10 6个细胞/ ml。 | 细胞不应该长大密度高于2.5×10 6个细胞/毫升,立即转染之前,从不高于3.0×10 6个细胞/ ml。 | |
| 亲和纯化没有工作 | 蛋白(次)不被表达。 | 见上面。 |
| 纯化条件可能是错误的。 | 调整缓冲条件( 如高盐,低盐,pH值。) |
表1故障排除。
| 系统 | 优点 | 缺点 |
| 大肠杆菌 |
|
|
| 毕赤酵母 |
|
|
| 杆状病毒表达在昆虫细胞中 |
|
|
| 生物反应器与哺乳动物系统 |
|
|
| HEK 293F悬浮细胞 |
|
|
表2的优势和主要表达系统的优缺点。
讨论
我们已经开发出一种简单和成本有效的方法(PEI成本比市售的亲脂转染试剂少得多)用于表达和纯化大量的重组蛋白,并从哺乳动物细胞多亚基复合物。最佳的转染和表达效率可如高纯度质粒DNA(二百八分之二百六十〇在1.8和2.0)中的协议部分中所述的组合使用的PEI到达。细胞必须在无血清和无抗生素的培养基中培养,因此,无菌技术要求严格的传代和转染细胞,以避免昂贵的和费时的感染。细胞生存力应为90%或更高和文化不应该发展到密度大于2.5×10 6个细胞/毫升紧接在转染前,因为这样做会降低蛋白质产率。对于一个成功的转染,文化应该只包含单个或分裂的细胞。集群可以通过活力被打破了项涡旋20到30秒( 图5)。在共转染中使用的每种质粒的比例可以由用户根据复杂的被研究的化学计量可以变化。表达效率可以针对感兴趣的蛋白进行优化,以使适当的表达时,可以建立。纯化应执行保持在所有时间该蛋白质样品冷以减少不需要的蛋白水解降解的风险。的标记和纯化缓冲器的选择是至关重要的,因为它们可能干扰结构元件或某些蛋白质的活性位点,通常导致降低的溶解度和/或酶活性的损失。小规模的转染是用于大型的蛋白质复合物的纯化测试不同的构建体是特别有用的。
今天,大量不同的替代方法是可用的重组真核蛋白质( 表2)的表达。例如,Baculovi在昆虫细胞中表达RUS被广泛使用,由于其高转染效率和其相比于其它病毒物种6缺乏细胞毒性的。然而,使病毒的方法是费时和它的不稳定性不允许病毒可以长时间保存。另一方面,酵母表达系统提供了在发酵罐中培养生长的细胞以非常高的密度的可能性,从 而导致高蛋白质产率7。但它们仍然缺乏充分各种正确折叠和与其蛋白伴侣相互作用所需的真核生物蛋白质的翻译后修饰。 HDAC3,例如,被表达,但不折叠在大肠杆菌大肠杆菌 。然而,当在293F细胞中表达,我们能够净化在复杂的活性酶,其共抑制(SMRT)和肌醇四磷酸(IP4)8,它没有在原核细胞中发现的分子。这个方法也使我们以纯化并解决晶体STructure的HDAC1与MTA1在NURD复杂的,这是同样由IP4 9活化的相互作用。理想情况下,我们总是要表示在其自然的,生理环境的真核蛋白质。用人的HEK 293-EBNA1细胞在生物反应器10-12哺乳动物表达系统已经描述和产生非常高水平的蛋白质,但这些可能是复杂的使用。
我们的方法是一种简单的和可访问的替代方法在细菌,酵母和生物反应器系统中的表达。表达的方法是快速的,并且不需要使用昂贵的设备,尤其是当该滚瓶或烧瓶中的气氛替换为5%的CO 2和标准摇动孵化器中使用。我们使用这些协议来共转多种质粒和纯化物与最多五个蛋白质随着培养的> 1 mg / L的产率。有趣的是,该系统有助于稳定性能良好配合物的鉴定。例如,前HDAC1和Sin3A的二元配合物的pression,得到蛋白质的有限产量,但除了SDS3的导致了5倍以上的量,因此可指导选择合适的构建体和稳定的复合物结晶的结构生物学家。
披露声明
The authors declare that they have no competing financial interests.
致谢
我们要感谢小雯杨博士(PROTEX克隆服务)准备用于这项工作,莱斯特核心生物技术服务大学的表达结构。这项工作是由BBSRC助学金支持,威康信托计划及高级调查员补助WT085408&WT100237和BBSRC授予RM31G0224。
材料
| Name | Company | Catalog Number | Comments |
| FreeStyle HEK 293F cells | LifeTechnologies | R790-07 | |
| FreeStyle 293 Expression Medium | LifeTechnologies | 12338-018 | |
| Anti-FLAG M2 Affinity Gel | SIGMA | A220 | |
| 250 ml Erlenmeyer Flask with Vented Cap | Corning | 431144 | |
| Roller bottles with vented caps | Corning | 01836-02 | |
| Polyethylenimine, 25 kDa, branched | Sigma-Aldrich | 408727 | Make 0.5 mg/ml stocks in H2O, adjust pH to 7.0 with dilute HCl and store at -20 - 4ºC |
| Mammalian expression vector | |||
| Dulbecco’s Phosphate Buffered Saline (DPBS) | Sigma-Aldrich | D8537 | |
| 0.22 µm Centrifugal Filter Units | Amicon | UFC30GV00 | |
| 15 ml Ultra centrifugal filters (10 kDa cut-off) | Amicon | UFC901008 | |
| Superdex 10/300 GL | GE Healthcare Life Sciences | 17-5175-01 |
参考文献
- Baneyx, F. Recombinant protein expression in Escherichia coli. Current opinion in biotechnology. 10 (5), 411-421 (1999).
- Aricescu, A. R., Owens, R. J. Expression of recombinant glycoproteins in mammalian cells: towards an integrative approach to structural biology. Current opinion in structural biology. 23 (3), 345-356 (2013).
- Kim, T. K., Eberwine, J. H. Mammalian cell transfection: the present and the future. Analytical and bioanalytical chemistry. 397 (8), 3173-3178 (2010).
- Boussif, O., Zanta, M. A., Behr, J. P. Optimized galenics improve in vitro gene transfer with cationic molecules up to 1000-fold. Gene therapy. 3 (12), 1074-1080 (1996).
- Godbey, W. T., Wu, K. K., Mikos, A. G. Poly (ethylenimine) and its role in gene delivery. Journal of Controlled Release. 60 ((2-3)), 149-160 (1999).
- Beljelarskaya, S. N. Baculovirus expression systems for production of recombinant proteins in insect and mammalian cells. Molecular Biology. 45 (1), 123-138 (2011).
- Cregg, J. M., Vedvick, T. S., Raschke, W. C. Recent advances in the expression of foreign genes in Pichia pastoris. Nature Biotechnology. 11 (8), 905-910 (1993).
- Watson, P. J., Fairall, L., Santos, G. M., Schwabe, J. W. R. Structure of HDAC3 bound to co-repressor and inositol tetraphosphate. Nature. 481 (7381), 335-340 (2013).
- Millard, C. J., Watson, P. J., et al. Class I HDACs Share a Common Mechanism of Regulation by Inositol Phosphates. Molecular Cell. 51 (1), 57-67 (2013).
- Tom, R., Bisson, L., Durocher, Y. Transfection of HEK293-EBNA1 Cells in Suspension with Linear PEI for Production of Recombinant Proteins. CSH protocols. , pdb.prot4977 (2008).
- Durocher, Y., Perret, S., Kamen, A. High-level and high-throughput recombinant protein production by transient transfection of suspension-growing human 293-EBNA1 cells. Nucleic Acids Research. 30 (2), (2002).
- Baldi, L., Muller, N., et al. Transient Gene Expression in Suspension HEK‐293 Cells: Application to Large‐Scale Protein Production. Biotechnology Progress. 21 (1), 148-153 (2005).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。