Method Article
Expression rekombinanter Proteine für Strukturbiologie in HEK 293F Suspensionszellen: eine neue und Barriere Ansatz
In diesem Artikel
Zusammenfassung
The expression of recombinant proteins by mammalian systems is becoming an attractive method for producing protein complexes for structural biology. Here we present a simple yet highly efficient expression system using suspension grown mammalian cells to purify protein complexes for structural studies.
Zusammenfassung
The expression and purification of large amounts of recombinant protein complexes is an essential requirement for structural biology studies. For over two decades, prokaryotic expression systems such as E. coli have dominated the scientific literature over costly and less efficient eukaryotic cell lines. Despite the clear advantage in terms of yields and costs of expressing recombinant proteins in bacteria, the absence of specific co-factors, chaperones and post-translational modifications may cause loss of function, mis-folding and can disrupt protein-protein interactions of certain eukaryotic multi-subunit complexes, surface receptors and secreted proteins. The use of mammalian cell expression systems can address these drawbacks since they provide a eukaryotic expression environment. However, low protein yields and high costs of such methods have until recently limited their use for structural biology. Here we describe a simple and accessible method for expressing and purifying milligram quantities of protein by performing transient transfections of suspension grown HEK (Human Embryonic Kidney) 293F cells.
Einleitung
Der rasche Fortschritt der molekularen Zellbiologie und der ständige Bedarf an verbesserten Drogen in der Medizin hat einen Bedarf an Strukturbiologen um bei zunehmend komplexer Proteinstrukturen aussehen erstellt. Diese können oft erfordern besondere post-translationale Modifikationen, molekulare Chaperone und Co-Faktoren, die ihre kunstvollen Falten und enzymatische Aktivität zu unterstützen. Während die überwiegende Mehrheit der in der Protein Data Bank wurden mit bakteriellen Expressionssystemen gewonnen worden gegenwärtigen Strukturen sind Prokaryoten nicht um eine große Anzahl dieser Modifikationen durchzuführen und es fehlt vielen wesentlichen eukaryotischen Co-Faktoren. Dies kann ein Problem für die Untersuchung von großen Multi-Untereinheiten-Komplexen, die bei kleinen Signalmolekülen sowie für nukleare, Zelloberflächen und sekretierte Proteine, die aufwendigen Faltung Maschinen erforderlich aktiviert werden. Eine Anzahl von E. coli-Stämme wurden entwickelt, um einige dieser Einschränkungen 1 überwinden. In den letzten Jahren wurde jedoch die Verwendung von mammalian Expressionssystemen ist gestiegen, weil sie zuverlässig eukaryotischen Proteinen, die sonst problematisch in anderen Systemen 2 auszudrücken produzieren. Heute ist es möglich, eine stabile und vorübergehende Expression Säugerzelllinien durch eine Vielzahl von Techniken, die aus viralen Transduktion chemisch vermittelte Transfektion Bereich zu erhalten, physikalischen Gentransfer wie Elektroporation und direkte Injektion 3. Während alle diese Verfahren haben ihre eigenen Vorteile und Nachteile, nur einige von ihnen sind für strukturelle Untersuchungen entweder zu teuer und / oder zeitaufwendig.
Hier beschreiben wir eine sehr einfache, schnelle, kostengünstige, aber hochwirksames Verfahren zur Expression von Proteinkomplexen Strukturbiologie in Suspension gezüchtet Säugerzellen. Der Ansatz nutzt transiente Co-Transfektion einer humanen embryonalen Nierenzellen (HEK)-Zelllinie (zB Freestyle HEK 293F-Zellen). Diese Zellen wurden aus der HEK 293-CE abgeleitetll Linie dazu geeignet sind, in Suspensionskulturen wachsen und erreichte hohe Dichten mit Serum-freien Medien (wie FreeStyle 293 Expression Medium). Die Zellen werden dann vorübergehend mit einer verzweigten Version von Polyethylenimin (PEI), eine preiswerte Polymer Reagenz, das berichtet wurde, dass für eine Vielzahl von Säugetierzellen durch Bildung von 4 DNA / PEI-Komplexe, die die Wirtszelle geben durch Endozytose 5 funktionieren transfiziert. Dieses Verfahren eignet sich sowohl für kleine Skala (30 ml) und große (bis zu 300 ml) Versuchen und kann hohe gereinigtes Protein-Komplexe zu erzeugen. Es ist besonders nützlich für die Untersuchung von Proteinen, die komplexe Faltung Maschinen, Co-Faktoren oder bestimmte post-translationale Modifikationen, die nicht von Bakterien, Hefe und Insektenzellen durchgeführt werden kann, erforderlich.
In diesem Protokoll zu präsentieren wir die Expression und Reinigung der drei zentralen Gerüstprotein aus der Sin3A Transkriptionsrepression komplex. Diese besteht aus HistoneDeacetylase 1 (HDAC1), Suppressor der Defekte Silencing 3 (SDS3) und Switch-unabhängige 3 (Sin3A). Das gereinigte Komplex ist für Hochdurchsatz-Kristallisationsversuche verwendet.
Protokoll
HINWEIS: Das Protokoll ist geeignet für jede Skala des Ausdrucks, also Volumen und Mengen von Reagenzien werden proportional skaliert werden. Eine geeignete Säugetierexpressionsvektor muss für dieses Protokoll verwendet werden. Hier wurde eine modifizierte pcDNA 3.1 Expressionsvektor, der bequem ermöglicht den Einschluss oder Ausschluss von einer Affinitätsmarkierung in Abhängigkeit von der Wahl der Restriktionsenzyme in dem Klonierungsvektor (Abbildung 1). Das folgende Protokoll beschreibt eine große Skala Transfektion.
1. Large Scale Kultur / Transfektion in 1 L Rollerflaschen
Entwickeln und zu pflegen HEK293F Suspension-adaptierten Zellen nach Standardprotokollen. Starterkulturen typischerweise zwischen 30 und 100 ml, werden in 250 ml konischen Zellkulturflaschen gezüchtet.
- Samenzellen bei 0,5 x 10 6 Zellen / ml in einem Endvolumen von 300 ml pro 1 Liter Rollflasche.
HINWEIS: Roller-Flaschen aufnehmen mindestens 150 ml auf maximal300 ml Suspensionskultur. Für größere Transfektionen verwenden mehrere Flaschen. - Inkubation für 24 h in einem Schüttler-Inkubator bei 37 ° C, 120 rpm und 5% CO 2, bis die Zellen eine Dichte von 1,0 x 10 6 Zellen / ml erreicht (Zellen sollte etwa alle 24 h unterteilen).
- Pipettieren insgesamt 300 ug sterilfiltriert DNA (siehe Zusatz Verfahren) in 30 ml PBS und kräftig vortexen für 3 Sekunden.
HINWEIS: Verwenden Sie insgesamt 1 ug DNA pro Million transfizierten Zellen. Wenn zwei oder mehrere Plasmide sein cotransfiziert reduzieren die Menge von jedem, so daß das Verhältnis von DNA zu Zellen konstant bleibt. - 1,2 ml von 0,5 mg / ml filtersterilisiert PEI zum PBS / DNA-Lösung und kräftig vortexen für 3 Sekunden.
- Inkubieren der Mischung bei RT für 20 min.
- Wird die DNA / PEI mischen, um die Zellen - die zu einer Dichte von 1 x 10 6 Zellen / ml (Schritt 1.3) sein sollte.
- Nach Co-Transfektion, Inkubation der Zellenin einem Orbitalschüttler Inkubator für weitere 48 h bei 37 ° C, 120 rpm und 5% CO 2.
- Ernteintrazelluläre Proteine durch Zentrifugieren Zellen bei 3000 × g für 5 min und speichert das Pellet bei -80 ° C.
HINWEIS: Alternativ können Sie ein Standard-(Nicht-CO 2) Schüttelinkubator, wenn die Atmosphäre über der Kultur wird mit 5% CO 2 ersetzt, und die Flasche Deckel verschlossen. Die Atmosphäre muss bei jedem Durchgang (in der Regel alle 2 Tage) ersetzt werden.
2. Proteinkomplex Reinigung aus Gesamtzellextrakt
Dieses Protokoll wird für die Reinigung der Kernkomplexe mit FLAG-markierten Proteinen optimiert.
- Abzutauen Zellpellet in ~ 40 ml vorgekühltes Lysepuffer (100 mM Kaliumacetat, 50 mM Tris pH 7,5, 5% Glycerin, 0,3% Triton X-100, Protease-Inhibitoren) pro Liter Kultur.
- Re-Aussetzung der Pellets durch Auf-und Abpipettieren mehrmals (Schaumbildung zu vermeiden, nicht Vortex).
- Gründlich resuspendieren Zellen mit einem Glas-Homogenisator. Beschallen für 3 Zyklen (15 Sekunden ein, 15 Sekunden aus). Zentrifugieren bei 30000 × g für 25 min bei 4 ° C und der Überstand behalten.
- Äquilibrieren 1,25 ml von Anti-Flag durch dreimaliges Waschen mit Harz Äquilibrierungspuffer (100 mM Kaliumacetat, 50 mM Tris pH 7,5) gepackt Agarose-Harz pro Liter Kultur.
- Inkubieren des gesamten Zellextrakts aus Schritt 2.3 mit dem Affinitätsharz in einem oder mehreren 50 ml-Zentrifugenröhrchen und sanft drehen die Probe für 30-120 min bei 4 ° C ist.
- Zentrifuge bei 3000 × g für 1 min bei 4 ° C, Überstand verwerfen.
- Waschen des Harzes mit 45 ml vorgekühlten Puffer 1 (100 mM Kaliumacetat, 50 mM Tris pH 7,5, 5% Glycerin, 0,3% Triton X-100). Zentrifuge bei 3000 g für 1 min und Überstand verwerfen.
- Wiederholen Sie Schritt 2.7 mittels Hochsalzpuffer (300 mM Kaliumacetat, 50 mM Tris pH 7,5, 5% Glycerin) mit Niedrigsalzpuffer (50 mM Kaliumacetat, 50 mM Tris pH 7, gefolgt.5, 5% Glycerin) und TEV Spaltungspuffer (50 mM Kaliumacetat, 50 mM Tris pH 7,5, 0,5 mM TCEP).
HINWEIS: Stellen Sie sicher, jeder Wäsche ist kurz also ausreichen, um wieder vollständig zu suspendieren das Harz und nicht mehr. - Sammeln Sie 10 ul Probe von Harz und in 1 Volumen 2x Proteinladepuffer zur Analyse (gebundene Protein-Steuerung) zu verdünnen. Verwenden Sie keine Reduktionsmittel, um zu vermeiden Loslassen der Antikörper aus dem Harz.
- Resuspendieren des Harzes in 8-10 ml vorgekühltes TEV-Spaltpuffer und in ein 15 ml Zentrifugenröhrchen.
- Hinzufügen ~ 40 ug TEV-Protease (ab Lager bei 1 mg / ml) pro Liter ursprüngliche Kultur und gut mischen durch Pipettieren von oben und unten mehrmals.
- Rohr ersetzen Atmosphäre mit 100% N 2 Gas Protein Oxidation zu verhindern.
- Sanft drehen O / N bei 4 ° C.
- Zentrifuge bei 3.000 g für 10 min. Den Überstand in ein Ultrafilterzentrifuge mit einem geeigneten Molekulargewichts-Cutoff und konzentrierenauf 500 ul.
- Sammeln einer Probe von 10 ul der konzentrierten Protein und in 1 Volumen 2x Proteinbeladungspuffer für die Analyse zu verdünnen. (TEV Eluat Kontrolle).
- Sammle eine 10 ul Probe des Harzes und in 1 Volumen 2 × Proteinbeladungspuffer für die Analyse zu verdünnen. Verwenden Sie keine Reduktionsmittel, um zu vermeiden die Freigabe großer Mengen Antikörper aus dem Harz. (Post-TEV-Harz-Steuerung).
- Äquilibrieren die Größenausschluss-Chromatographie-Säule mit Gelfiltrations-Puffer (50 mM Kaliumacetat, 50 mM Tris pH 7,5, 0,5 mM TCEP).
- Filtern des Proteins durch ein 0,22 um-Filter
- Legen Sie die Probe in die Säule und sammelt die Fraktionen.
- Führen Proben aus den Schritten 2.9, 2.15 und 2.16 und die Gelfiltration Fraktionen von Schritt 2.19 auf einem SDS-PAGE und Coomassie-Färbung für die Analyse.
HINWEIS: Es wird empfohlen, eine SDS-PAGE der Proben von den Schritten 2.9, 2.15 und 2.16 vor Gelfiltration durchgeführt, um die Expression des Zielproteins zu bestätigen.
Ergebnisse
Hier zeigen wir eine 2-L (8 x 250 ml-Kulturen) transiente Co-Transfektion und Reinigung der HDAC1, SDS3, Sin3A ternären Komplex. HDAC1 und SDS3 mit Sin3A interagieren durch die HDAC-Interaktionsdomäne (HID) von Sin3A. Eine typische Reinigungsausbeuten von bis zu 1 mg Komplex pro Liter Kultur.
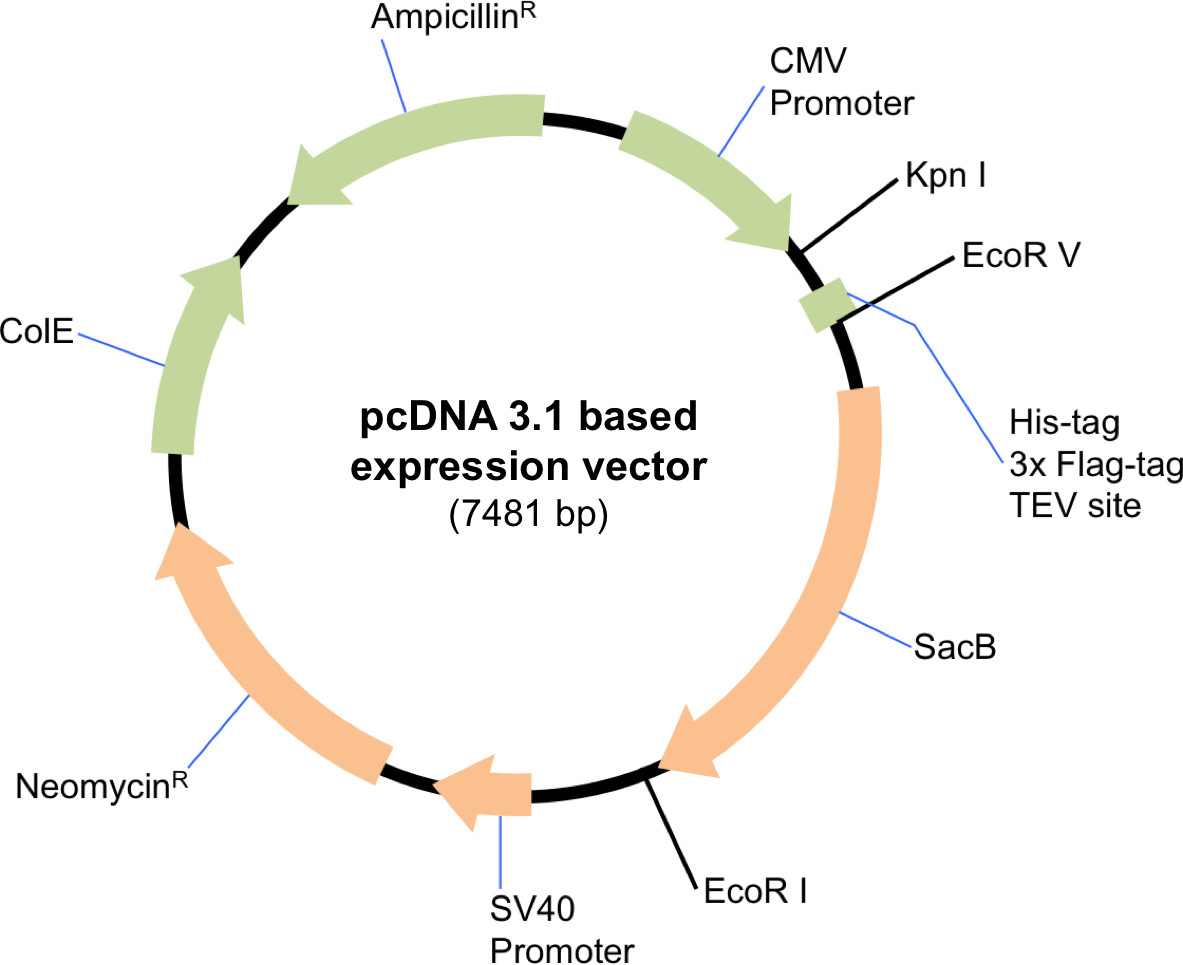
Abbildung 1 Schematische Darstellung des modifizierten pcDNA 3.1 Expressionsvektor. Das Plasmid wurde mit EcoRV und EcoRI verdaut, um die Affinität-Tags und TEV-Spaltstelle am Aminoterminus Sin3A umfassen. Ungetaggte Versionen von HDAC1 und SDS3 Klonierung wurde der Vektor mit KpnI und EcoRI verdaut.
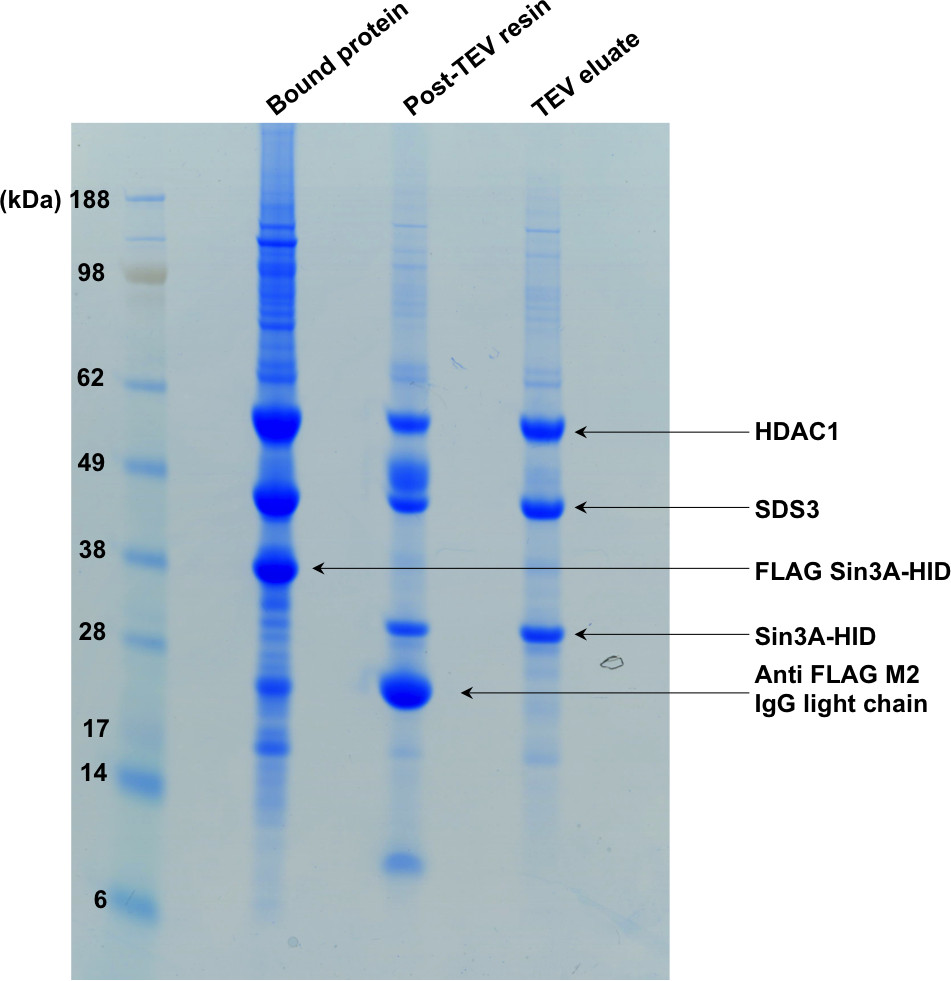
Abbildung 2. SDS-PAGE zeigt den ersten Schritt der Reinigung. Der "gebundene Protein" Spur zeigt das an das Affinitätsharz gebundenen Komplexes. Nach TEV Verdauung, ist die vorliegende Tag auf Sin3A-HID abgespalten und der Komplex wird aus dem Harz eluiert, wie in der zweiten und dritten Spuren des Gels gezeigt.
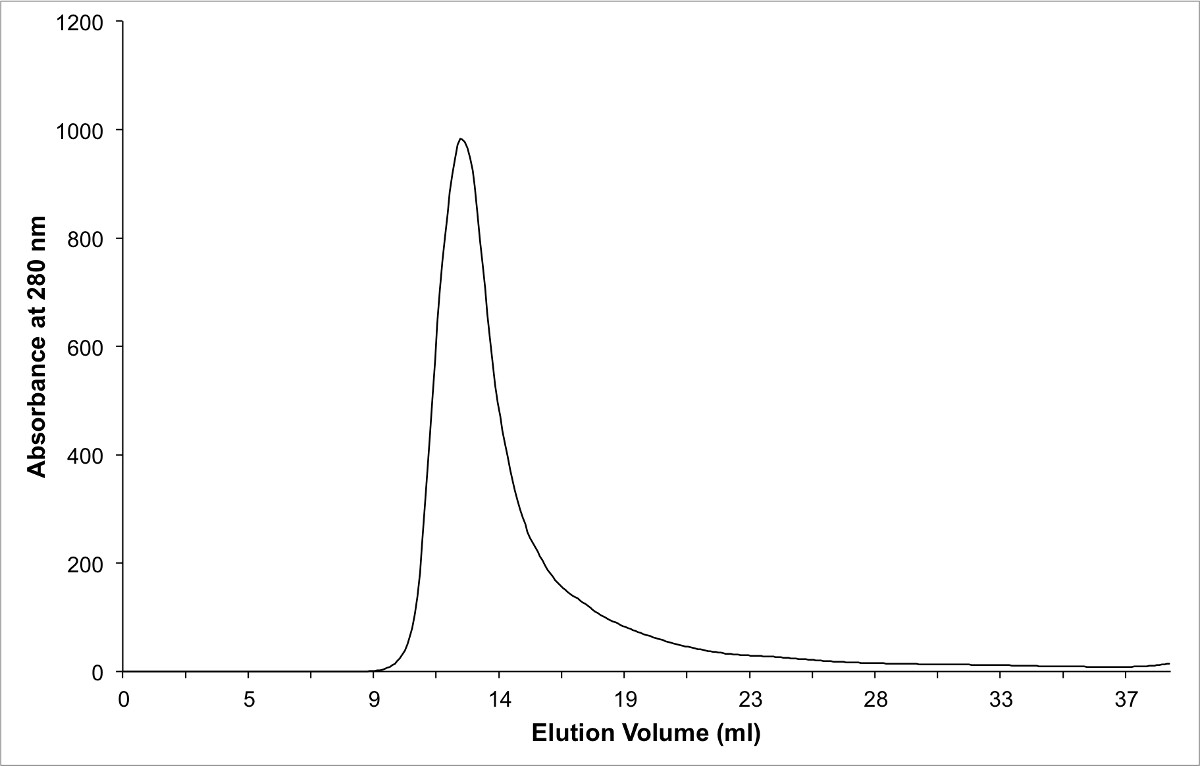
Figur 3: Chromatogramm Protein-Komplexes unter Verwendung von gereinigtem Grßenausschlußchromatographie. Beachten Sie, dass der reine Komplex in dem Leervolumen eluiert, da sie ein Dimer bildet, in Lösung.
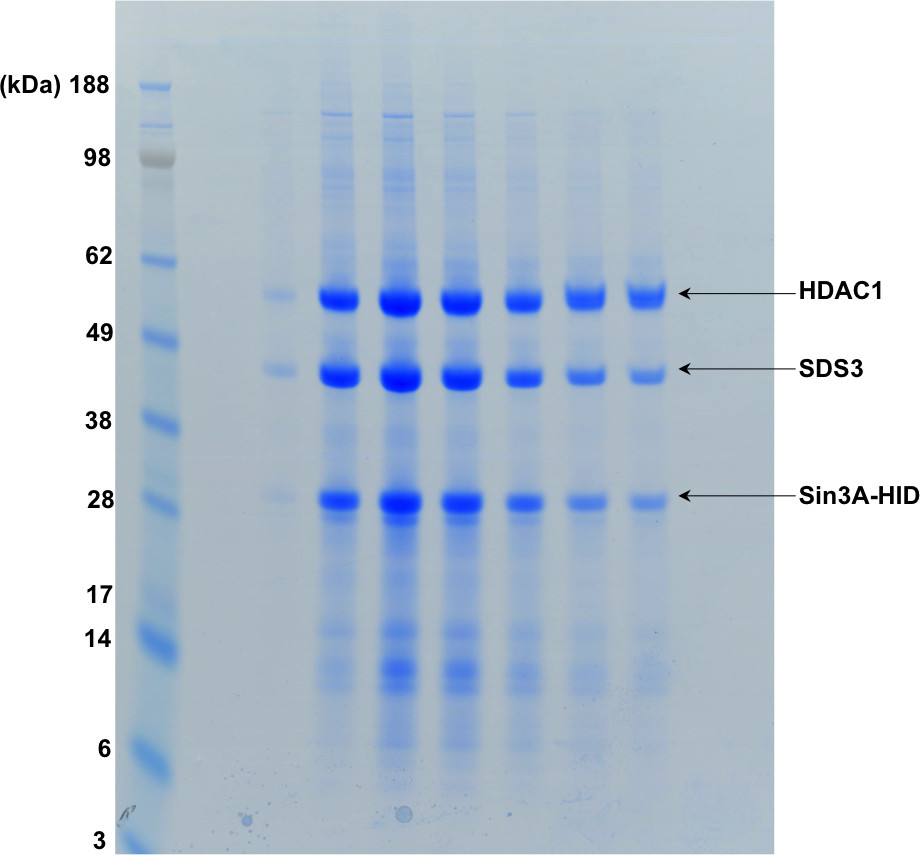
Abbildung 4. SDS-PAGE, die die Bruchteile des in 3 gezeigten Gelfiltration.
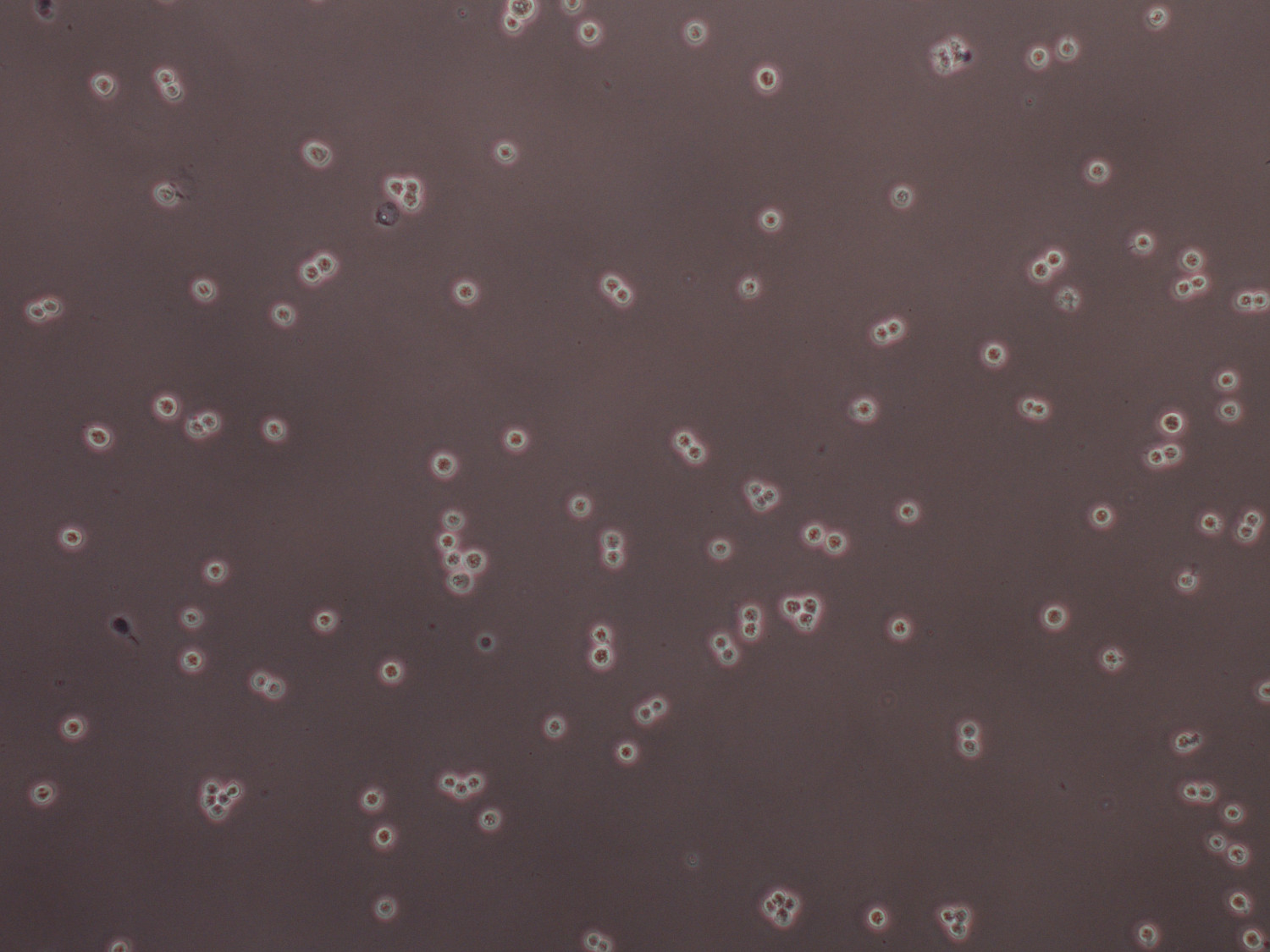
Abbildung 5. Trypanblau-gefärbten HEK 293F-Zellen in 2.3x10 6 Zellen / ml bereit, transfiziert werden. Zellen sollten nur als Einzel oder teilenden Zellen vorhanden sein, während große Cluster kann durch kräftiges Vortexen für ca. 25 Sekunden unterbrochen werden.
| Problem | Mögliche Ursachen | Aktion |
| Geringe Proteinausbeute. | Geringe Anzahl von Zellen transfiziert. | Stellen Sie sicher, Zelldichte etwa 1,0 × 10 6 vor dem Hinzufügen der Transfektion Reaktionsgemisch auf die Kultur. |
| Zellen können zu oft subkultiviert wurden. | Verwenden Sie frische Lager Zellen nach etwa 90 PassAltersgruppen. | |
| DNA verschlechtert oder eine hohe Menge an Verunreinigungen sein. | Stellen Sie sicher, die Plasmid-DNA verwendet hat eine 260/280 Verhältnis zwischen 1,8 und 2,0. Ausführen der DNA auf einem Agarose-Gel ist ratsam, seine Qualität zu beurteilen. | |
| Protein (e) exprimiert sind nicht stabil oder löslich genug. | Testen Sie verschiedene Konstrukte im kleinen Maßstab vor, um up-Skalierung der Transfektionen. Stellen Sie sicher, Tags nicht mit der Struktur der Protein (e) von Interesse stören. | |
| Zellen aussehen bewölkt und haben eine ungewöhnliche Farbe und / oder Geruch. | Zellen werden mit Bakterien oder Hefe infiziert. | Gute sterile Technik muss jederzeit verwendet werden. Räucherpatronen die Laminarströmungshauben und UV-Desinfektion des Zellkulturraum im Falle einer Infektion trägt das Problem enthalten. |
| Zellen haben eine geringe Überlebensfähigkeit. | Falscher pH-Wert in den Medien. | Stellen Sie sicher, Kulturen werden bei 5-8% CO 2 gewachsenzu allen Zeiten. |
| Zellen wurden bis zu einer Dichte von mehr als 3.0x10 6 Zellen / ml kultiviert. | Die Zellen sollten nicht bis auf Dichten von mehr als 2,5 x 10 6 Zellen / ml unmittelbar vor einer Transfektion und nicht über 3,0 x 10 6 Zellen / ml gezüchtet werden. | |
| Affinitätsreinigung hat nicht funktioniert | Protein (e) wird nicht exprimiert. | Siehe oben. |
| Reinigungsbedingungen könnte falsch sein. | Passen Pufferbedingungen (zB hohe Salz, wenig Salz, pH-Wert.) |
Tabelle 1. Fehlersuche.
| System | Vorteile | Nachteile |
| E. coli |
|
|
| P. pastoris |
|
|
| Baculovirus Expression in Insektenzellen |
|
|
| Bioreaktoren mit Säugetiersystemen |
|
|
| HEK 293F Suspensionszellen |
|
|
Tabelle 2. Vorteile und Nachteile der wichtigsten Expressionssysteme.
Diskussion
Wir haben eine einfache und kostengünstige Methode entwickelt (PEI kosten viel weniger als im Handel erhältlichen Transfektionsreagenzien lipophile) zur Expression und Reinigung von großen Mengen an rekombinanten Proteinen und Multi-Untereinheiten-Komplexen, die aus Säugetierzellen. Optimale Transfektion und Expressionseffizienz kann erreicht werden, wenn hochreine Plasmid-DNA (260/280 zwischen 1,8 und 2,0) in Kombination mit PEI wie in dem Protokoll beschrieben verwendet. Zellen müssen in serum-und antibiotikafreiem Medium kultiviert werden daher steriler Technik ist streng Passagierung und Transfektion von Zellen, um kostspielige und zeitraubende Infektionen zu vermeiden. Lebensfähigkeit der Zellen sollte 90% oder höher sein und Kulturen sollte nicht auf Dichten von mehr als 2,5 x 10 6 Zellen gezüchtet werden / ml unmittelbar vor einer Transfektion, da dies wird Proteinausbeute reduzieren. Für eine erfolgreiche Transfektion, sollte nur Kulturen enthalten einzelne oder teilenden Zellen. Cluster können durch Kraft gebrochen werdenOrganisationseinheiten Vortex 20 bis 30 sec (Abbildung 5). Das Verhältnis von jedem Plasmid in der Co-Transfektion verwendet werden, können durch den Benutzer gemäß der Stöchiometrie des Komplexes untersucht variiert werden. Expressionseffizienz für das Protein von Interesse optimiert werden, so dass ein geeignetes Expressionszeit hergestellt werden kann. Reinigung sollte durchgeführt halten die Proteinprobe Kälte zu jeder Zeit, um das Risiko von unerwünschten proteolytischen Abbau zu reduzieren. Die Auswahl des Tags und Reinigungspuffer ist kritisch, da sie strukturelle Elemente oder aktive Stellen von bestimmten Proteinen stören, was häufig zu einer reduzierten Löslichkeit und / oder Verlust der enzymatischen Aktivität. Klein Transfektionen sind besonders nützlich für das Testen verschiedener Konstrukte für die Reinigung von großen Proteinkomplexen.
Heute ist eine große Vielfalt von alternativen Methoden sind für die Expression des rekombinanten eukaryontischen Proteinen (Tabelle 2) verfügbar. Zum Beispiel Baculovirus Expression in Insektenzellen wird häufig wegen seiner hohen Transduktionseffizienz und ihre mangelnde Zytotoxizität im Vergleich zu anderen viralen Spezies 6 verwendet. Jedoch ist das Verfahren zur Herstellung des Virus zeitaufwendig und seiner Instabilität nicht den Viren für längere Zeit gelagert werden. Auf der anderen Seite bieten Hefe-Expressionssystemen die Möglichkeit wachsenden Zellen zu sehr hohen Dichten in Fermenter-Kulturen, was zu hohen Proteinausbeuten 7. Aber noch nicht über die volle Vielzahl von post-translationalen Modifikationen für eukaryontische Proteine erforderlich ist, um korrekt zu falten und die Interaktion mit den Proteinpartner. HDAC3 zum Beispiel exprimiert, aber nicht in E. falten coli. Wenn jedoch in 293F-Zellen exprimiert, waren wir in der Lage, ein aktives Enzym im Komplex mit seinem Co-Repressor (SMRT) und einem Molekül von Inositol-Tetraphosphat (IP4) 8, die in prokaryotischen Zellen gefunden wird, zu reinigen. Diese Methode hat sich uns auch die Möglichkeit zu reinigen und lösen das Kristall structure von HDAC1 Interaktion mit MTA1 im NuRD-Komplex, der in ähnlicher Weise durch IP4 9 aktiviert wird. Idealerweise würden wir immer gerne eukaryotischen Proteinen in ihrer natürlichen, physiologischen Umgebung auszudrücken. Säugetier-Expressionssysteme, die HEK 293-Zellen in Bioreaktoren EBNA1 10-12 beschrieben und ergeben sehr hohe Protein, diese können aber komplex in der Anwendung sein.
Unser Verfahren ist eine einfache und leicht zugängliche Alternative zur Expression in Bakterien, Hefe und Bioreaktorsysteme. Expressionsverfahren ist schnell und erfordert nicht die Verwendung von teuren Geräten, insbesondere wenn der Rollflasche oder Kolbenatmosphäre mit 5% CO 2 und Standard Schüttelinkubatoren verwendet werden ersetzt. Wir haben diese Protokolle verwendet, um mehrere Plasmide co-transfizieren und zu reinigen Komplexe mit bis zu fünf Proteine mit Ausbeuten von> 1 mg / l Kultur. Interessant ist, hilft das System die Identifizierung von stabilen brav Komplexe. Zum Beispiel expression des binären Komplex von HDAC1 und Sin3A gab begrenzten Proteinausbeuten, noch Zusatz von SDS3 Folge 5-fach höhere Mengen und somit führt die Strukturbiologe bei der Wahl der geeigneten Konstrukte und stabile Komplexe für die Kristallisation.
Offenlegungen
The authors declare that they have no competing financial interests.
Danksagungen
Wir möchten Dr. Xiaowen Yang (PROTEX Klonen Service) zur Herstellung der Expressionskonstrukte für diese Arbeit und der Universität von Leicester Kern Biotechnologie Services verwendet bedanken. Diese Arbeit wurde durch ein Stipendium unterstützt BBSRC, der Wellcome Trust und Senior Investigator Programme Zuschüsse WT085408 & WT100237 und BBSRC gewähren RM31G0224.
Materialien
| Name | Company | Catalog Number | Comments |
| FreeStyle HEK 293F cells | LifeTechnologies | R790-07 | |
| FreeStyle 293 Expression Medium | LifeTechnologies | 12338-018 | |
| Anti-FLAG M2 Affinity Gel | SIGMA | A220 | |
| 250 ml Erlenmeyer Flask with Vented Cap | Corning | 431144 | |
| Roller bottles with vented caps | Corning | 01836-02 | |
| Polyethylenimine, 25 kDa, branched | Sigma-Aldrich | 408727 | Make 0.5 mg/ml stocks in H2O, adjust pH to 7.0 with dilute HCl and store at -20 - 4ºC |
| Mammalian expression vector | |||
| Dulbecco’s Phosphate Buffered Saline (DPBS) | Sigma-Aldrich | D8537 | |
| 0.22 µm Centrifugal Filter Units | Amicon | UFC30GV00 | |
| 15 ml Ultra centrifugal filters (10 kDa cut-off) | Amicon | UFC901008 | |
| Superdex 10/300 GL | GE Healthcare Life Sciences | 17-5175-01 |
Referenzen
- Baneyx, F. Recombinant protein expression in Escherichia coli. Current opinion in biotechnology. 10 (5), 411-421 (1999).
- Aricescu, A. R., Owens, R. J. Expression of recombinant glycoproteins in mammalian cells: towards an integrative approach to structural biology. Current opinion in structural biology. 23 (3), 345-356 (2013).
- Kim, T. K., Eberwine, J. H. Mammalian cell transfection: the present and the future. Analytical and bioanalytical chemistry. 397 (8), 3173-3178 (2010).
- Boussif, O., Zanta, M. A., Behr, J. P. Optimized galenics improve in vitro gene transfer with cationic molecules up to 1000-fold. Gene therapy. 3 (12), 1074-1080 (1996).
- Godbey, W. T., Wu, K. K., Mikos, A. G. Poly (ethylenimine) and its role in gene delivery. Journal of Controlled Release. 60 ((2-3)), 149-160 (1999).
- Beljelarskaya, S. N. Baculovirus expression systems for production of recombinant proteins in insect and mammalian cells. Molecular Biology. 45 (1), 123-138 (2011).
- Cregg, J. M., Vedvick, T. S., Raschke, W. C. Recent advances in the expression of foreign genes in Pichia pastoris. Nature Biotechnology. 11 (8), 905-910 (1993).
- Watson, P. J., Fairall, L., Santos, G. M., Schwabe, J. W. R. Structure of HDAC3 bound to co-repressor and inositol tetraphosphate. Nature. 481 (7381), 335-340 (2013).
- Millard, C. J., Watson, P. J., et al. Class I HDACs Share a Common Mechanism of Regulation by Inositol Phosphates. Molecular Cell. 51 (1), 57-67 (2013).
- Tom, R., Bisson, L., Durocher, Y. Transfection of HEK293-EBNA1 Cells in Suspension with Linear PEI for Production of Recombinant Proteins. CSH protocols. , pdb.prot4977 (2008).
- Durocher, Y., Perret, S., Kamen, A. High-level and high-throughput recombinant protein production by transient transfection of suspension-growing human 293-EBNA1 cells. Nucleic Acids Research. 30 (2), (2002).
- Baldi, L., Muller, N., et al. Transient Gene Expression in Suspension HEK‐293 Cells: Application to Large‐Scale Protein Production. Biotechnology Progress. 21 (1), 148-153 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten